28.06.2019
Воспаление - реферат - патологическая анатомия и физиология - реферат по медицине. Общепатологическое значение
Общие закономерности течения воспалительного процесса. Реакция крови на воспаление.
Воспаление – типовой патологический процесс, сформировавшийся в эволюции как защитно-приспособительная реакция организма на воздействие патогенных факторов, направленная на локализацию, уничтожение и удаление патогенного агента, а также на устранение последствий его действия, и характеризующийся альтерацией, экссудацией и пролиферацией.
1. Альтерация - повреждение структуры клеток, тканей и органов, сопровождающееся нарушением их жизнедеятельности.
Дистрофия - расстройство обмена веществ в тканях.
Медиаторы воспаления - биологически активные вещества, высвобождающиеся в ткани при воспалении.
2. Экссудация – выпотевание белковосодержащей жидкой части крови через сосудистую стенку в воспалительную ткань.
Эмиграция - выход лейкоцитов из крови через стенку мелких сосудов в ткань или серозные полости при воспалении (путем диапедеза).
Фагоцитоз - поглощение, переваривание и обезвреживание микробов, поврежденных клеток и чужеродных частиц фагоцитами.
3. Пролиферация - новообразование клеток путём их размножения делением для восполнения поврежденной ткани, принимают участие различные тканевые элементы. Является составной частью регенерации тканей.
Сосудистые реакции при воспалении - патофизиологические изменения микроциркуляции (крово- и лимфообращения) в ткани, проявляющиеся ишемией, артериальной и венозной гиперемией, экссудацией, эмиграцией лейкоцитов, стазом.
Воспаление относится к фундаментальным патологическим процессам, которые составляют патофизиологическую основу многих заболеваний человека (например, энцефалит, миокардит, пневмония, стоматит, грипп, дифтерия и др.). Классические признаки воспаления - боль, краснота, жар, опухание и нарушенная функция ткани и органа.
Механизмы воспалительного процесса универсальны, и закономерности развития являются общими независимо от структурно-функциональных различий тканей.
Воспалительный процесс характеризуется развитием трёх типов сосудисто-тканевых реакций: альтеративно-дистрофических, сосудистых и пролиферативных.
Альтеративно-дистрофические реакции проявляются местным повреждением (альтерацией) ткани и расстройством тканевого метаболизма (дистрофией). Первичная альтерация возникает в результате прямого болезненного воздействия на клеточные структуры органа. В ответ на повреждение повышается проницаемость клеточных и субклеточных мембран. Тучные клетки выделяют медиаторы воспаления (гистамин, серотонин, гепарин и др.). Из различных клеток высвобождаются лизосомальные (гликолитические, литолитические и протеолитические) ферменты, активизирующие в ткани реакции гликолиза, липолиза и протеолиза. БАВ (медиаторы, ферменты) оказывают болезнетворное воздействие и вызывает дальнейшее разрушение (вторичную альтерацию) клеток.
Альтерация завершается некрозом воспалённой ткани с образованием некрозов, язв, ран и др. Альтеративно-дистрофические изменения проявляются значительными физико-химическими нарушениями в воспалённой ткани. Наиболее выраженные дистрофические изменения сопровождаются развитием ацидоза повреждения (Н + -гипериония), гиперосмии и гипергидратации воспалённой ткани. Воспаление формируется как саморегулирующийся процесс повреждения структуры, нарушения метаболизма и функции ткани. Вместе с тем развитие и распространение воспаления в форме местного процесса находится в зависимости от общей реактивности организма.
Экссудативное воспаление проявляется выраженными нарушениями местного кровообращения (ишемия, артериальная и венозная гиперемия, стаз) и лимфообращения явлениями экссудации (усиление фильтрации, диффузии и микровезикуляции плазмы крови через стенку микрососудов) в ткань и серозные полости с образованием инфильтратов и разных видов экссудатов, эмиграцией лейкоцитов в ткань и фагоцитозом в воспалённой ткани.
Среди защитно-приспособительных реакций важную роль играют гиперемия ткани, фагоцитоз, компенсаторная репарация и регенерация (пролиферация), имеющие большое противовоспалительное значение.
Пролиферативное воспаление характеризуется патологической репарацией и регенерацией (регенерационная гипертрофия, грануломатоз с образованием полипов, склероз и цирроз).
Лечение воспаления основано на патофизиологических принципах устранения патологических альтеративно-дистрофических, экссудативно-сосудистьгх и пролиферативных реакций путём восстановления нейрогуморальной регуляции жизнедеятельности ткани.
На ранних стадиях эволюционного развития (филогенеза) воспаление проявляется фагоцитарной реакцией (И.И. Мечников).
В раннем периоде онтогенеза или на фоне иммунобиологической недостаточности воспалительный процесс нередко принимает генерализованное распространение (сепсис).
Одним из первых и основных процессов воспаления является рефлекторное расширение мелких артерий и капилляров, вызванное раздражением нервных окончаний, заложенных в стенках сосудов, или рефлекторно через ЦНС. Вследствие расширения сосудов происходит переполнение их кровью и замедление в них тока крови, что ведет к воспалительной гиперемии. В кровеносных сосудах давление крови повышается, стенки растягиваются и становятся более проходимыми для жидкой части крови. Порозность стенок сосудов увеличивается вследствие вызванного воспалительным процессом их изменения.
Через измененные стенки сосудов в окружающую ткань проникает жидкая часть крови. Чем сильнее повреждена стенка сосуда, тем более крупные белковые частицы она пропускает. Таким образом, от степени повреждения стенки сосудов зависит большее или меньшее содержание белка в экссудате. Известно, что при быстром движении жидкости в трубке взвешенные твердые частицы находятся в середине тока жидкости, а при его замедлении они начинают оседать по стенкам сосуда. То же происходит и с кровью: при нормальном токе крови в сосудах взвешенные форменные элементы крови находятся в центре тока крови, а при замедлении кровотока лейкоциты выходят из осевого тока крови в плазматический. Происходит приклеивание лейкоцитов к эндотелию – развивается феномен краевого стояния лейкоцитов.
В крови наблюдается лейкоцитоз, увеличивается содержание белков острой фазы (СРБ, фибриноген, церулоплазмин, компоненты комплемента, глобулины и др), повышается СОЭ (из-за снижения отр. заряда эритроцитов, повышения вязкости крови и подъема температуры).
Воспаление (inflammatio, от лат. in-flammare - воспламенять) сформировавшаяся в процессе эволюции реакция организма на местное повреждение, характеризующаяся явлениями альтерации, расстройств микроциркуляции (с экссудацией и эмиграцией) и пролиферации, направленными на локализацию, уничтожение и удаление повреждающего агента, а также на восстановление (или замещение) поврежденных им тканей.
Альтерация, расстройства микроциркуляции (с экссудацией и эмиграцией) и пролиферация являются основными компонентами или внутренними признаками воспаления. Кроме того, очаг воспаления характеризуется пятью внешними (местными) проявлениями: краснотой (rubor), припухлостью (tumor), повышением температуры, или жаром (calor), болезненностью, или болью (dolor), нарушением функции functio laesa) (рис. 10-1). Эти признаки особенно хорошо определяются, когда очаг воспаления находится на наружных покровах.
Воспаление может проявляться не только местными, но и общими признаками, выраженность которых зависит от интенсивности и распространенности процесса.
Общие проявления воспаления включают лихорадку, реакции кроветворной ткани с развитием лейкоцитоза, повышенную скорость оседания эритроцитов, ускоренный обмен веществ, измененную иммунологическую реактивность, явления интоксикации организма.
Воспаление относится к числу наиболее распространенных типовых патологических процессов. Одновременно оно представляет собой важную защитно-приспособительную реакцию, эволюционно сформировавшуюся как способ сохранения целого организма ценой повреждения его части. С помощью воспаления обеспечи-
Рис. 10-1. Древние основы учения о воспалении (по Willoughby и Specter). Жар, покраснение, отек и боль приводят к нарушению функций
ваются локализация и элиминация воспалительного агента и (или) поврежденной под его воздействием ткани.
10.1. ОСНОВНЫЕ ТЕОРИИ ВОСПАЛЕНИЯ
Как патологический процесс, лежащий в основе большинства заболеваний человека, воспаление является центральной проблемой патологии на протяжении всей истории учения о болезни. Формирование представлений о сущности воспаления издавна было тесно связано с развитием взглядов на природу болезни.
На ранних этапах изучения воспаления доминировали теории Р. Вирхова (1858) и Ю. Конгейма (1885). Согласно клеточной (аттракционной, нутритивной) теории Р. Вирхова, воспаление заключается в нарушении жизнедеятельности клеточных элементов в ответ на раздражение, развитии дистрофических изменений, состоящих в появлении в клетках белковых зерен и глыбок, притяжении (аттракции) питательного (нутритивного) материала из жидкой части крови, возникновении вследствие этого мутного набухания цитоплазмы, характерного для воспаления.
 Рис. 10-2. И.И. Мечников (1845-1916). Лауреат Нобелевской премии 1908 г.
Рис. 10-2. И.И. Мечников (1845-1916). Лауреат Нобелевской премии 1908 г.
По сосудистой теории Ю. Конгейма воспаление характеризуется расстройствами кровообращения, приводящими к экссудации и эмиграции и обусловливающими последующие клеточные (дистрофические) изменения. Однако, как впоследствии было установлено, воспаление характеризуется одновременным развитием и тесной взаимосвязью сосудистых и тканевых явлений. Ю. Конгеймом впервые детально описана вся совокупность изменений сосудистого тонуса и кровотока с экссудацией и эмиграцией.
Особенно большой вклад в изучение воспаления внес И.И. Мечников (1892) (рис. 10-2). Он положил начало сравнительной патологии воспаления, теории клеточного и гуморального иммунитета, учению о фагоцитозе и сформулировал биологическую (фагоцитарную) теорию воспаления. Согласно ей, основным и центральным звеном воспалительного процесса является поглощение фагоцитами инородных частиц, в том числе бактерий.
Проанализировав воспалительную реакцию у различных видов животных, стоящих на разных ступенях эволюционного развития, И.И. Мечников показал ее усложнение в филогенезе. На ранних этапах филогенеза (у простейших одноклеточных организмов) защита от чужеродного материала осуществляется путем фагоцитоза. При этом и у простейших организмов возникают некоторые явления альтерации. У многоклеточных организмов, не имеющих сосудистой системы, воспаление проявляется скоплением вокруг места повреждения фагоцитирующих амебоидных клеток (амебоцитов). У высших беспозвоночных воспаление выражается скоплением в месте повреждения кровяных клеток - лимфогематоцитов. Несмотря на наличие у них кровеносной системы (открытого типа), сосудистые реакции, характерные для позвоночных, не возникают. Вместе с тем уже на этом этапе эволюционного развития обнаруживаются явления пролиферации. У позвоночных животных и человека воспалительная реакция значительно усложняется за счет сосудистых явлений с экссудацией и эмиграцией, участия нервной системы.
Результаты сравнительно-патологических исследований, свидетельствующие о вовлечении все более сложных защитных и
приспособительных явлений по мере эволюционирования воспалительного процесса, позволили И.И. Мечникову показать значение воспаления как защитно-приспособительной реакции всего организма. И.И. Мечников впервые установил связь воспаления с иммунитетом, в механизмах которого фагоцитоз также играет существенную роль.
В первой половине нынешнего столетия учение о воспалении стало развиваться в связи с возникновением биофизических и биохимических методов. Результаты разносторонних физико-химических исследований воспалительного очага позволили Г. Шаде (1923) выдвинуть физико-химическую, или молекулярно-патологическую, гипотезу воспаления, согласно которой ведущим в патогенезе этого процесса является местное нарушение обмена веществ, приводящее к развитию ацидоза и повышению осмотического давления в ткани, лежащих, в свою очередь, в основе расстройств кровообращения и клеточных явлений при воспалении. Однако вскоре было показано, что физико-химические изменения, характерные для очага воспаления, обнаруживаются в ходе уже развившейся воспалительной реакции и, следовательно, не могут быть пусковым механизмом сосудистых и клеточных явлений (Д.Е. Альперн, 1927). При некоторых видах воспаления (например, аллергическом) ацидоз не развивается либо выражен слабо (А.Д. Адо, 1935).
На основании результатов широких патохимических исследований В. Менкин (1938) пришел к выводу о ведущей роли биохимических сдвигов в патогенезе воспаления. Он выделил ряд специфических для воспаления веществ, опосредующих различные воспалительные феномены, - некрозин, экссудин, лейкотоксин, пирексин и др. Как установлено с тех пор, такую роль действительно выполняют физиологически активные вещества - медиаторы воспаления, многие из которых в настоящее время идентифицированы и достаточно изучены. Однако свести весь патогенез воспаления только к разрозненным эффектам отдельных медиаторов было бы неправильным.
С начала нынешнего столетия, когда было установлено участие нервной системы в патогенезе воспаления, возникли гипотезы, отдающие первостепенную роль нервному фактору - рефлекторным механизмам, нарушению трофической функции нервной системы. Так, по вазомоторной (нервно-сосудистой) теории Г. Риккера (1924) первичным в возникновении воспаления является расстройство функции сосудодвигательных нервов. В зависимости от степени
их раздражения и, следовательно, развивающейся сосудистой реакции складывается такое соотношение между тканью и кровью, которое ведет к возникновению воспалительной гиперемии и стаза и, соответственно, обусловливает интенсивность и характер нарушений обмена веществ. Однако вся совокупность воспалительных явлений не может быть объяснена только реакцией сосудов микроциркуляторного русла.
Д.Е. Альперн (1959) особое внимание уделял вопросу единства местного и общего в воспалении, роли реактивности организма в развитии этого процесса. Он подчеркивал сущность воспаления как общей реакции организма на действие вредного агента. Им обоснована нервно-рефлекторная схема патогенеза воспаления, согласно которой различные сосудисто-тканевые реакции регулируются нервной и гуморальной (главным образом гипофизарнонадпочечниковой) системами.
10.2. ЭТИОЛОГИЯ ВОСПАЛЕНИЯ
Поскольку наиболее частой причиной воспаления являются инфекционные агенты, его делят по этиологии на инфекционное (септическое) и неинфекционное (асептическое).
10.3. ЭКСПЕРИМЕНТАЛЬНОЕ ВОСПРОИЗВЕДЕНИЕ ВОСПАЛЕНИЯ
В эксперименте, как правило, используются модели асептического воспаления, вызванного химическими агентами. Традици-
онными являются раздражающие флогогены, приводящие к развитию острого гнойного воспаления: скипидар, кротоновое масло, ляпис, ксилол, формалин и т.д. Применяются и индифферентные в химическом отношении вещества, например каолин. Для воспроизведения асептического воспаления с преобладанием экссудативных явлений прибегают к декстрану. В последние годы наиболее часто из асептических агентов используется карагинан - сульфатированный гликозаминогликан, выделенный из ирландского мха Chondrus.
Для того чтобы избежать дальнейшего присутствия флогогена в очаге, применяют модели термического или лучевого (ультрафиолетовые лучи, ионизирующая радиация) воспаления.
Нередко моделируют гиперергическое воспаление по типу немедленных или замедленных аллергических реакций. Это воспаление представляет интерес в связи с бурным его течением, частыми явлениями некроза, что обусловлено повышенной реактивностью сенсибилизированного организма.
В патофизиологических исследованиях к моделям инфекционного воспаления прибегают сравнительно редко. Это связано со сложностями моделирования такого воспаления, обусловленными более глубоким взаимодействием микроорганизмов с иммунной системой в процессе его возникновения и течения. В настоящее время из инфекционных возбудителей преимущественно используются кишечная палочка, стафилококки, синегнойная палочка, поскольку именно они являются наиболее частыми причинами гнойно-воспалительных заболеваний и инфекционных осложнений у человека. Близкими к инфекционному воспалению являются такие модели, как, например, каловый перитонит.
Для изучения сосудистых явлений в очаге воспаления наиболее удобным объектом является брыжейка лягушки (опыт Ю. Конгейма), ухо кролика (метод прозрачной камеры - Е.Л. Кларк и Е.Р. Кларк), защечный мешок хомяка, раздуваемый воздухом (Г. Селье); для исследования клеточной динамики очага воспаления целесообразно использовать метод «кожного окна» (Дж. Рибак) или такие модели, как подкожныгй «воздушный мешок» (Г. Селье), перитонит, плеврит, когда можно легко собрать экссудат.
10.4. ПАТОГЕНЕЗ ВОСПАЛЕНИЯ
Любое воспаление включает 3 основных компонента:
Альтерацию - повреждение клеток и тканей;
Расстройство микроциркуляции с экссудацией и эмиграцией;
Пролиферацию - размножение клеток и восстановление целостности ткани.
Соответственно различают: альтеративное воспаление, экссудативное воспаление, пролиферативное (продуктивное) воспаление и - как его отдельный вариант - гранулематозное воспаление.
Патогенез воспаления представляет собой сложное сочетание нервных, гуморальных и эффекторных механизмов, лежащих в основе большого числа воспалительных феноменов, составляющих вышеперечисленные явления (рис. 10-3).
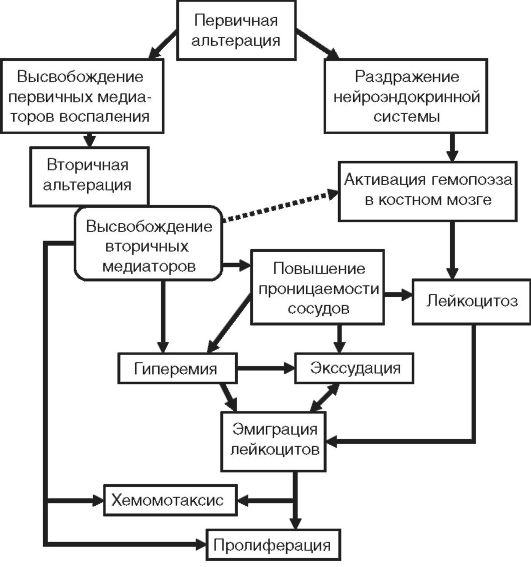 Рис. 10-3.
Общая схема патогенеза воспаления
Рис. 10-3.
Общая схема патогенеза воспаления
10.4.1. Роль повреждения ткани в развитии воспаления
Альтерация (alteratio, от лат. alterare - изменять), или дистрофия, повреждение ткани, нарушение в ней питания (трофики) и обмена веществ, ее структуры и функции. Различают первичную и вторичную альтерацию.
Первичная альтерация является результатом повреждающего воздействия самого воспалительного агента, поэтому ее выраженность при прочих равных условиях (реактивность организма, локализация) зависит от свойств флогогена. Строго говоря, первичная альтерация не является компонентом воспаления, так как воспаление есть реакция на повреждение, вызванное флогогеном, т.е. на первичную альтерацию. В то же время практически первичные и вторичные альтеративные явления трудно отделимы друг от друга.
Вторичная альтерация является следствием воздействия на соединительную ткань, микрососуды и кровь высвободившихся внеклеточно лизосомальных ферментов и активных метаболитов кислорода. Их источником служат активированные иммигрировавшие и циркулирующие фагоциты, отчасти - резидентные клетки. При воспалении у животных с предварительно вызванной лейкопенией альтерация выражена слабо. Определенную роль в альтерации может играть также литический комплекс С5b-С9, образующийся при активации комплемента плазмы и тканевой жидкости.
Вторичная альтерация не зависит от воспалительного агента, для ее развития необязательно дальнейшее присутствие флогогена в очаге. Она является реакцией организма на уже вызванное вредным началом повреждение. Это целесообразный и необходимый компонент воспаления как защитно-приспособительной реакции, направленный на скорейшее отграничение (локализацию) флогогена и (или) поврежденной под его воздействием ткани от остального организма. Ценой повреждения достигаются и другие важные защитные явления: более выраженный микробицидный и литический эффект лизосомальных ферментов и активных метаболитов кислорода, поскольку он осуществляется не только в фагоцитах, но и внеклеточно; вовлечение других медиаторов воспаления и клеток, усиленная экссудация, эмиграция и фагоцитоз. В результате воспалительный процесс завершается быстрее. Однако альтерация целесообразна лишь в известных пределах. Так, например, при дисбалансе в системе лизосомальные протеиназы -
их ингибиторы возникают избыточные проявления альтерации с преобладанием некроза.
Альтеративные явления при воспалении включают тканевой распад и усиленный обмен веществ («пожар обмена»), приводящие к ряду физико-химических изменений в воспаленной ткани: накоплению кислых продуктов (ацидоз, или Н+-гипериония), увеличению осмотического давления (осмотическая гипертензия, или гиперосмия), повышению коллоидно-осмотического, или онкотического, давления (гиперонкия).
В зависимости от силы повреждающего агента, интенсивности и локализации воспаления морфологические проявления альтерации широко варьируют: от едва заметных структурно-функциональных изменений до полной деструкции (некробиоз) и гибели (некроз) тканей и клеток. Обнаруживаются мутное набухание цитоплазмы клеток, явления белковой, жировой и других видов их дистрофии. Резко повышается проницаемость мембран клеток и клеточных органелл. Изменяются и субклеточные структуры - митохондрии, лизосомы, рибосомы, эндоплазматическая сеть. Митохондрии набухают или сморщиваются, кристы их разрушаются. Повышение проницаемости и повреждение мембран лизосом сопровождаются выходом разнообразных ферментов, играющих роль в разрушении субклеточных структур. Изменяются форма и величина цистерн эндоплазматического ретикулума, в цитоплазме появляются везикулы, концентрические структуры и др. Отмечаются краевое расположение хроматина, повреждение мембраны ядра. В строме наблюдаются мукоидное и фибриноидное набухание вплоть до некроза, растворение коллагеновых и эластических волокон.
Повышение обмена веществ при воспалении происходит преимущественно за счет углеводов. Первоначально усиливается как их окисление, так и гликолиз. В основе этого явления лежит активация соответствующих тканевых ферментов. Заметно увеличивается потребление кислорода воспаленной тканью. По мере накопления в очаге лейкоцитов, лизосомальные ферменты которых расщепляют углеводы анаэробным путем, а также повреждения и снижения количества митохондрий в ходе альтерации, реакции окисления заметно ослабевают, а гликолиза - нарастают. Соответственно расщепление углеводов не всегда доходит до конечных продуктов - углекислого газа и воды. Дыхательный коэффициент снижается. В ткани накапливаются недоокисленные продукты углеводного обмена - молочная и трикарбоновые кислоты.
Кроме того, вследствие нарушения обмена жиров, белков и распада нуклеиновых кислот в очаге нарастает содержание жирных кислот, кетоновых тел, полипептидов, аминокислот, нуклеотидов (АТФ, адениловая кислота), нуклеозидов (аденозин). В результате развивается ацидоз. Первоначально он компенсируется тканевыми буферными системами и ускоренным крово- и лимфотоком. По мере истощения буферных систем и замедления крово- и лимфотока ацидоз нарастает и становится некомпенсированным. Если в норме концентрация водородных ионов в ткани составляет 0,5?10 -7 , т.е. рН равен 7,34, то при воспалении может быть, соответственно, 25?10 -7 и 5,6 и ниже. Чем острее протекает воспалительный процесс, тем более выражен ацидоз. Так, при остром гнойном воспалении рН составляет 6,5-5,39, а при хроническом - 7,1-6,6. Ацидоз принимает участие в повышении проницаемости сосудов. Он создает благоприятные условия для реализации разрушительных эффектов лизосомальных ферментов, в частности гликозидаз, расщепляющих углеводные компоненты матрикса соединительной ткани.
Наряду с Н+-гиперионией в очаге нарастает содержание и других ионов - ионов калия, натрия, кальция. Это обусловлено разрушением клеток и усиленной диссоциацией в кислой среде солей. Вследствие опережающего повышения уровня внеклеточного калия нарушается соотношение ионов калия и кальция (дизиония). Изменения в гомеостазе ионов Са 2 + могут лежать в основе гибели клеток в очаге воспаления. Са 2 + является одним из вторичных мессенджеров между мембраной и клеточными ферментными системами, а также генным аппаратом. Повышение уровня внутриклеточного Са 2 + приводит к абсорбции его митохондриальными мембранами и последующим блокированием дыхательной цепи электронов. Повышенное внутриклеточное содержание Са 2 + активирует нелизосомальные протеазы, приводя к лизису цитоскелета, деградации энзимов, мембрано-ассоциированных белков (ионных каналов, переносчиков, рецепторов, молекул адгезии). Отмечено, что хотя снижение внеклеточного Са 2 + важно для выживания клеток, это может быть препятствием к их новому росту. В очаге воспаления нарастает молекулярная концентрация, поскольку в процессе тканевого распада и усиленного обмена веществ происходит расщепление крупных молекул до множества мелких. Вследствие повышения ионной и молекулярной концентрации развивается гиперосмия. Так, если в норме депрессия межклеточной жидкости
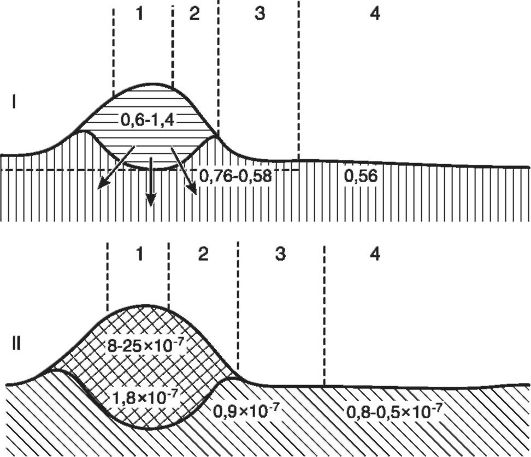 Рис. 10-4.
Схематическое
изображение разреза через воспалительный отек кожи: I - изменения
осмотического давления (А°С) в разных зонах очага воспаления: 1 - центр
воспаления, 2 - зона полнокровия, 3 - зона явного отека, 4 - зона
латентного отека; II - изменения концентрации ионов водорода: 1 - центр
гнойного воспаления, 2 - зона воспалительного инфильтрата, 3 - зона
периферического отека, 4 - зона перехода к нормальному состоянию (по
Шаде)
Рис. 10-4.
Схематическое
изображение разреза через воспалительный отек кожи: I - изменения
осмотического давления (А°С) в разных зонах очага воспаления: 1 - центр
воспаления, 2 - зона полнокровия, 3 - зона явного отека, 4 - зона
латентного отека; II - изменения концентрации ионов водорода: 1 - центр
гнойного воспаления, 2 - зона воспалительного инфильтрата, 3 - зона
периферического отека, 4 - зона перехода к нормальному состоянию (по
Шаде)
составляет 0,62°, т.е. осмотическое давление равно 8 атм, то при гнойном воспалении - соответственно 0,80° и 19 атм (рис. 10-4).
В результате физико-химических изменений воспаленной ткани, расщепления белков до полипептидов и аминокислот с увеличением концентрации последних происходит увеличение дисперсности коллоидов, их способности притягивать и задерживать воду. Развивается гиперонкия. Изменения осмотического и онкотического давления являются важным фактором экссудации и, соответственно, воспалительного отека.
10.4.2. Медиаторы воспаления
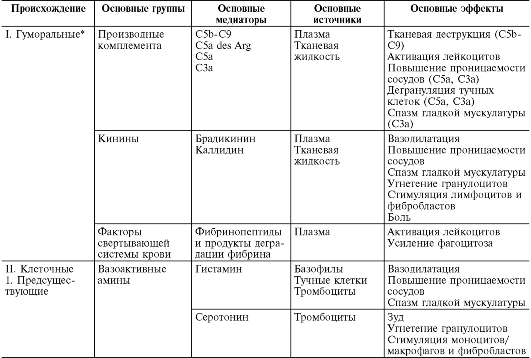
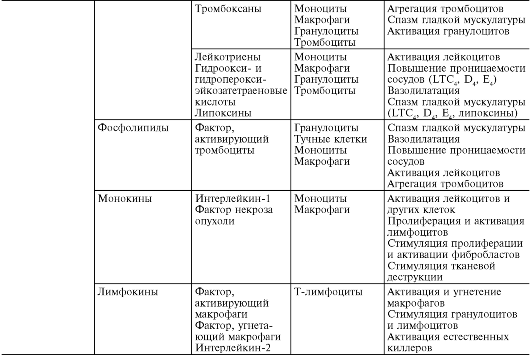
В ходе первичной и вторичной альтерации высвобождаются большие количества разнообразных медиаторов и модуляторов воспаления (табл. 10-1).
Таблица 10-1. Медиаторы воспаления
 *Все предсуществующие.
*Все предсуществующие.
Под медиаторами (посредниками) воспаления понимают биологически активные вещества, реализующие возникновение и поддержку различных воспалительных явлений, например повышение сосудистой проницаемости, эмиграцию и т.д. При нормальной жизнедеятельности эти же вещества в физиологических концентрациях ответственны за регуляцию функций клеток или тканей. При воспалении, высвобождаясь в больших количествах, они приобретают новое качество - медиаторов воспаления. Практически все медиаторы являются и модуляторами воспаления, т.е. способны усиливать или ослаблять выраженность воспалительных явлений. Соответственно эффект медиатора может быть добавочным (аддитивным), потенцирующим (синергистическим) и ослабляющим (антагонистическим), а взаимодействие медиаторов возможно на уровне их синтеза, секреции или эффектов. Медиаторное звено является основным в патогенезе воспаления. Оно координирует взаимодействие множества клеток - эффекторов воспаления, смену клеточных фаз в очаге воспаления.
Медиаторы воспаления по происхождению делятся на гуморальные (образующиеся в жидких средах - плазме крови и тканевой жидкости) и клеточные. Все гуморальные медиаторы являются предсуществующими, т.е. имеются в виде предшественников до активации последних; к ним относятся производные комплемента, кинины и факторы свертывающей системы крови. Среди клеточных медиаторов выделяют предсуществующие (депонированные в клетках в неактивном состоянии) - вазоактивные амины, лизосомальные ферменты, нейропептиды, и вновь образующиеся (т.е. продуцируемые клетками при стимуляции) - эйкозаноиды, цитокины, лимфокины, активные метаболиты кислорода.
Основными источниками клеточных медиаторов являются:
1. Нейтрофилы, которые выделяют катионные белки, стимулируют высвобождение биогенных аминов из тромбоцитов и тучных клеток, содержат ингибитор высвобождения гистамина и гистаминазу. Протеазы нейтрофилов участвуют в образовании кининов и активных фрагментов комплемента (С3а, С3Ь). Нейтрофилы образуют простагландин (PG) E 2 и другие эйкозаноиды. Ферменты нейтрофилов активируют как свертывание крови, так и фибринолиз.
2. Макрофаги выделяют ангиотензин-конвертазу, которая инактивирует брадикинин, превращает ангиотензин-I в ангиотензин-П. Они синтезируют PGE 2 , а также тромбоксаны и лей-
котриены (LT). Поскольку PGE 2 препятствует высвобождению клеточных медиаторов воспаления и подавляет агрегацию тромбоцитов, макрофаги, помимо провоспалительной, обладают и противовоспалительной функцией. Макрофаги синтезируют различные компоненты комплемента, обладают свертывающей и фибринолитической активностью.
3. Эозинофилы служат отрицательными модуляторами воспаления. Они содержат гистаминазу, кининазу, ферменты, расщепляющие лейкотриены С и D (лизофосфалипазу, арилсульфатазу В, фосфолипазу D), главный щелочной белок, осуществляющий цитотоксическую функцию и нейтрализующий гепарин. Таким образом, ферменты эозинофилов нейтрализуют продукты тучных клеток, способствуют уничтожению клеточных остатков. Эозинофилы фагоцитируют секретируемые тучными клетками гранулы и подавляют высвобождение гистамина. Особый интерес представляет присутствие в эозинофилах лизофосфолипазы. Ее субстратом являются частично деградированные фосфолипиды, содержащиеся в мембранах погибших клеток. Высвобождая из фосфолипидов свободные жирные кислоты, лизофосфолипаза способствует образованию арахидоновой кислоты.
4. Тучные клетки и базофилы выделяют гистамин и серотонин, гепарин, факторы хемотаксиса нейтрофилов и эозинофилов, фактор активации тромбоцитов, протеолитические ферменты, они продуцируют пероксидазу, супероксид и пероксид водорода, а также протеазу, превращающую кининоген в кинин.
5. Тромбоциты секретируют факторы роста и свертывания, вазоактивные амины и липиды, нейтральные и кислые гидролазы.
Производные комплемента (рис. 10-5) являются наиболее важными из гуморальных медиаторов воспаления. Среди почти 20 различных белков, образующихся при активации комплемента, непосредственное отношение к воспалению имеют его фрагменты С5а, С3а, С3Ь и комплекс С5Ь-С9:
С5а и С3а являются медиаторами острого воспаления и анафилатоксинами (т.е. либераторами гистамина из тучных клеток), таким образом, они повышают проницаемость капилляров как прямо, так и опосредованно через гистамин (рис. 10-6);
С5а des Arg и С3а образуются из С5а в плазме и тканевой жидкости под влиянием карбоксипептидазы N и повышают проницаемость посткапиллярных венул. Эффект С5а des Arg
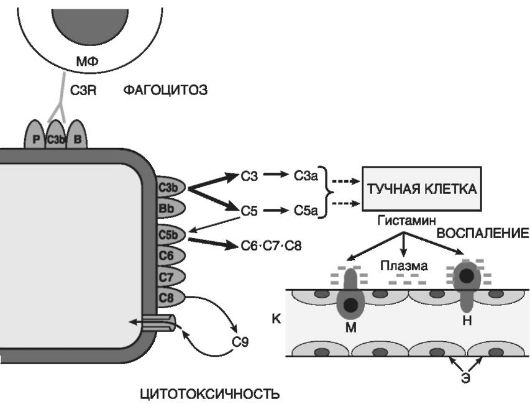 Рис.
10-5. Компоненты системы комплемента: C3b, C5b - фрагменты С3 и С5,
связанные с мембраной; С3а и С5а - пептиды, отщепившиеся,
соответственно, от С3 и С5; С6-С8 - компоненты комплекса, атакующего
мембраны; С9 - белок, полимеризующийся в мембране; Bb - фрагмент белка
В, связанный с мембраной; стрелки - каскадно-усиливающиеся компоненты
реакции; МФ - макрофаг; C3R - рецептор к C3b компоненту комплемента; К -
капилляр; Э - эндотелиальная выстилка капилляра; Н и М - диапедез
нейтрофила и моноцита
Рис.
10-5. Компоненты системы комплемента: C3b, C5b - фрагменты С3 и С5,
связанные с мембраной; С3а и С5а - пептиды, отщепившиеся,
соответственно, от С3 и С5; С6-С8 - компоненты комплекса, атакующего
мембраны; С9 - белок, полимеризующийся в мембране; Bb - фрагмент белка
В, связанный с мембраной; стрелки - каскадно-усиливающиеся компоненты
реакции; МФ - макрофаг; C3R - рецептор к C3b компоненту комплемента; К -
капилляр; Э - эндотелиальная выстилка капилляра; Н и М - диапедез
нейтрофила и моноцита
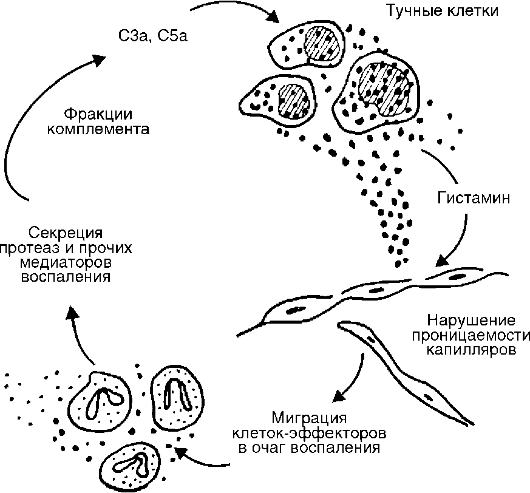 Рис. 10-6. Связь комплемента с тучными клетками в очаге острого воспаления
Рис. 10-6. Связь комплемента с тучными клетками в очаге острого воспаления
не связан с гистамином, но является нейтрофилзависимым, т.е. осуществляется за счет факторов проницаемости, высвобождаемых из полиморфно-ядерных гранулоцитов, - лизосомальных ферментов и неферментных катионных белков, активных метаболитов кислорода. Кроме того, С5а и С5а des Arg привлекают нейтрофилы. В отличие от них С3а практически не обладает хемотаксическими свойствами;
С3Ь опсонизирует патогенный агент и, соответственно, способствует иммунной адгезии и фагоцитозу;
Комплекс С5Ь-С9 ответствен за лизис микроорганизмов и патологически измененных клеток.
Источником комплемента служат плазма крови и в меньшей мере тканевая жидкость. Усиленное поступление плазменного комплемента в ткань является одним из важных назначений экссудации. Активные компоненты комплемента высвобождают не только гистамин, но и интерлейкин (IL) 1, простагландины, лейкотриены, фактор, активирующий тромбоциты, и синергистически взаимодействуют с простагландинами и веществом Р.
Кинины - вазоактивные пептиды, образующиеся из кининогенов (а 2 -глобулинов) под влиянием калликреинов в плазме (брадикинин) и в тканевой жидкости (каллидин). Пусковым фактором активации калликреин-кининовой системы является активация при повреждении ткани фактора Хагемана (XII), превращающего прекалликреины в калликреины. Фактор XII присутствует в крови и имеет сродство к отрицательно заряженным поверхностям. В жидкой фазе крови он спонтанно диссоциирует на два фрагмента: ХПа - ферментативно активный фрагмент и ХПб. ХIIa адсорбируется на поверхности чужеродного агента (флогогена), где стабилизируется. Он обладает протеолитической активностью, субстратом которой являются сам фактор ХП и другой белок - прекаллекреин. Далее прекалликреин под действием ХПа превращается в протеазу калликреин. Калликреин резко усиливает образование ХНа из фактора ХП и одновременно действует на новый субстрат - так называемый высокомолекулярный кининоген (ВМК). Под действием калликреина из ВМК образуется брадикинин, являющийся одним из главных медиаторов воспаления. Брадикинин действует на эндотелий сосудов, вызывая «размыкание» краев клеток сосудистого эндотелия и открывая тем самым путь плазме крови в очаг воспаления. Таким образом, данная система обнаруживает чужеродное тело по его отрицательно заряженной
поверхности. Поверхности же собственных клеток устроены так, что они не адсорбируют ХПа, не стабилизируют его и не индуцируют тем самым дальнейшую цепь событий. Это самый простой и примитивный способ отличать «свое» от «несвоего».
Кинины опосредуют расширение артериол и повышают проницаемость венул путем контракции эндотелиальных клеток. Они сокращают гладкую мускулатуру вен и повышают внутрикапиллярное и венозное давление, угнетают эмиграцию нейтрофилов, модулируют распределение макрофагов, стимулируют миграцию и митогенез Т-лимфоцитов и секрецию лимфокинов. Кроме того, они усиливают пролиферацию фибробластов и синтез коллагена и, следовательно, имеют значение в репаративных явлениях при хроническом воспалении. Одним из важнейших эффектов кининов является присущая им способность раздражать окончания чувствительных нервов, обусловливая возникновение воспалительной боли. Кинины усиливают высвобождение гистамина из тучных клеток, синтез простагландинов многими типами клеток, поэтому некоторые из их основных эффектов - вазодилатация, сокращение гладкой мускулатуры, боль - связывают с высвобождением других медиаторов, особенно простагландинов.
Активация фактора Хагемана запускает не только процесс кининообразования, но и свертывания крови и фибринолиза. При этом образуются такие медиаторы, как фибринопептиды и продукты деградации фибрина, которые являются мощными хематтрактантами.
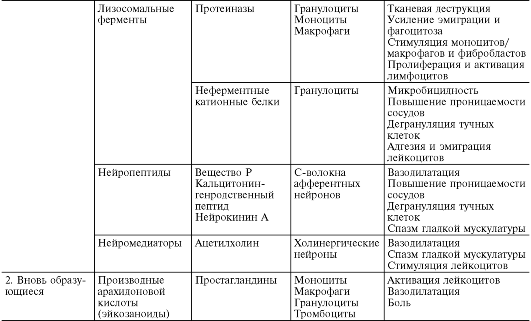
Эйкозаноиды (рис. 10-7) являются важным медиаторным звеном воспалительной реакции, о чем свидетельствуют их продолжительная продукция в очаге и тесная связь с ключевым событием воспаления - лейкоцитарной инфильтрацией, а также мощный противовоспалительный эффект ингибиторов их синтеза. В очаге воспаления основными продуцентами эйкозаноидов являются моноциты и макрофаги, хотя они образуются почти всеми типами ядерных клеток при стимуляции последних. Преобладающими эйкозаноидами в очаге воспаления оказываются простагландины (PGE 2), лейкотриены (LTB4) и 5-гидропероксиэйкозатетраеновая кислота (5-HPETE). Образуются также, хотя и в меньшем количестве, тромбоксан A 1 (TхA 2), PGF 2a , PGD 2 , простациклин (PGI 2), LTC 4 , LTD 4 , LTE 4 , другие HPETE. Главным эффектом эйкозаноидов является их влияние на лейкоциты; как мощные хематтрактанты они играют важную роль в механизмах самоподдержания лейкоцитарной инфильтрации.
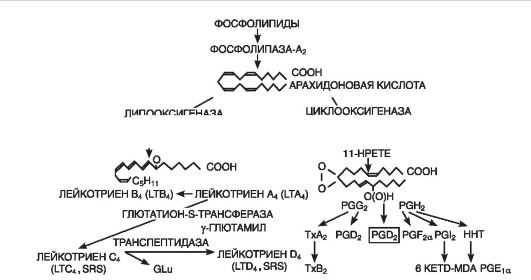
Рис. 10-7. Образование лейкотриенов и простагландинов из мембраны клетки (по D. Gemsa et al., 1981): Тх - тромбоксан; PG (prostaglandin) - простагландин; LT (leukotrien) - лейкотриен; HPETE (hydroxyperoxy-eicosatetranoic acid) - гидропероксиэйкозатетраеновая кислота
Простагландины сами не повышают сосудистую проницаемость, но, будучи сильными вазодилататорами, усиливают гиперемию и, следовательно, экссудацию. Простагландины и лейкотриены имеют значение в генезе воспалительной боли. При этом PGE 2 , не обладая прямой болевой активностью, повышает чувствительность рецепторов афферентных болевых нервных окончаний к брадикинину и гистамину. PGE 2 является сильным жароповышающим агентом и участвует в развитии лихорадки. Простагландины играют ключевую роль в модуляции воспалительного процесса, регулируя экссудацию, эмиграцию и дегрануляцию лейкоцитов, а также фагоцитоз. Так, например, PGE потенцируют развитие отека, вызванного гистамином или брадикинином, а PGF 1a , напротив, ослабляют. Аналогичным образом PGE и PGF 1a действуют на эмиграцию лейкоцитов.
Лейкотриены (синтезируются во всех клетках крови, кроме эритроцитов, а также в адвентиции сосудов, тучных клетках, легких) способствуют сокращению гладкой мускулатуры желудочнокишечного тракта, оказывают сосудосуживающее действие (в том числе коронарных артерий). LTC 4 , LTD 4 , LTE 4 повышают проницаемость сосудов путем прямой контракции эндотелиальных клеток, а LTB 4 - как нейтрофилзависимый медиатор. Лейкотриены при-
водят к спазму гладкой мускулатуры бронхов (эффект бронхоспазма в отличие от вызванного гистамином развивается медленнее, но является более продолжительным), развитию отека, привлечению эозинофилов, повышению секреции слизи и нарушению ее транспорта. Органом-мишенью для лейкотриенов является сердце. Выделяясь в избытке, они ингибируют (на 60%) сократимость сердечной мышцы, уменьшая коронарный кровоток и усиливая воспалительную реакцию. Лейкотриены широко взаимодействуют с другими медиаторами воспаления. Они усиливают бронхоспастическое действие гистамина, ацетилхолина, простагландинов и тромбоксанов, стимулируют высвобождение простагландинов и тромбоксанов.
Тромбоксаны (образуются в ткани мозга, селезенки, легких и в тромбоцитах, клетках воспалительной гранулемы) вызывают адгезию и агрегацию тромбоцитов, способствуют развитию тромбоза при ишемической болезни сердца, оказывают вазоспастическое действие.
Модуляторная функция эйкозаноидов осуществляется через изменения соотношения циклических нуклеотидов в клетках.
Биогенные амины - гистамин и серотонин считаются основными медиаторами первоначальных микроциркуляторных нарушений в очаге острого воспаления и немедленной фазы повышения проницаемости сосудов.
Незначительное количество нейромедиатора серотонина содержится в тучных и энтерохромаффинных клетках, но главным его источником являются тромбоциты. Эффекты серотонина неоднозначны и меняются в зависимости от количества. В обычных физиологических условиях серотонин является вазоконстриктором, вызывает пролонгированный спазм сосудов, повышает их тонус. При воспалении количество серотонина резко возрастает. В высоких концентрациях серотонин является вазодилататором, расширяет сосуды, повышает проницаемость, причем в 100 раз более эффективно по сравнению с гистамином. Серотонин способен вызывать непосредственную контракцию эндотелиальных клеток венул и является также медиатором боли. Кроме того, серотонин стимулирует моноциты в очаге воспаления.
Гистамин действует двояко в отношении сосудов и клеток. Через Н 1 -рецепторы он расширяет артериолы и угнетает эмиграцию и дегрануляцию лейкоцитов, а через H 1 -рецепторы суживает венулы, повышая таким образом внутрикапиллярное давление, и сти-
мулирует эмиграцию и дегрануляцию лейкоцитов. При обычном течении воспаления гистамин действует преимущественно через Н 1 -рецепторы на нейтрофилах, ограничивая их функциональную активность, и через Н 1 -рецепторы на моноцитах, стимулируя их. Таким образом, наряду с провоспалительными сосудистыми эффектами он оказывает противовоспалительное действие. Обладая способностью к регуляции пролиферации, дифференцировки и функциональной активности фибробластов, гистамин участвует в процессах репарации. Модуляторные эффекты гистамина также опосредуются циклическими нуклеотидами.
Что касается взаимодействий биогенных аминов в очаге воспаления, то известно, что гистамин через H 1 -рецепторы может запускать или усиливать синтез простагландинов, а через Н 2 -рецепторы - угнетать. Взаимодействуя как между собой, так и с брадикинином, нуклеотидами и нуклеозидами, веществом Р, биогенные амины повышают проницаемость сосудов. Сосудорасширяющее действие гистамина усиливается в комплексе с ацетилхолином, серотонином, брадикинином.
Лизосомальные ферменты высвобождаются в очаге воспаления из гранулоцитов и моноцитов-макрофагов в ходе их хемотаксической стимуляции, миграции, фагоцитоза, повреждения, гибели. В гранулах нейтрофилов содержатся протеиназы - эластаза, катепсин G и коллагеназы, которые обеспечивают противомикробную защиту, лизируя убитые микроорганизмы. Они обладают медиаторным и модуляторным эффектами в отношении сосудистой проницаемости, эмиграции, фагоцитоза.
Повышение проницаемости сосудов под влиянием лизосомальных ферментов происходит за счет лизиса субэндотелиального матрикса, истончения и фрагментации эндотелиальных клеток и сопровождается геморрагией и тромбозом. Образуя или расщепляя важнейшие хемотаксины, лизосомальные ферменты модулируют лейкоцитарную инфильтрацию. В зависимости от концентрации они могут и сами усиливать или угнетать миграцию нейтрофилов. Нейтральные протеиназы способны модулировать фагоцитоз. Например, эластаза образует опсонин С3Ь, необходимый для адгезии частиц к поверхности нейтрофила. Следовательно, нейтрофил сам обеспечивает себе механизм усиления фагоцитоза. Как катепсин G, так и эластаза повышают сродство Fc-рецептора мембраны нейтрофила к комплексам иммуноглобулинов и, соответственно, усиливают эффективность поглощения частиц.
Благодаря способности лизосомальных ферментов активировать системы комплемента, калликреин-кининовую, свертывания и фибринолиза, высвобождать цитокины и лимфокины, воспаление развертывается и самоподдерживается в течение длительного времени.
Неферментные кат ионные белки, содержащиеся в азурофильных и в специфических гранулах нейтрофилов, обладают таким важным свойством, как высокая микробицидность. В этом отношении они находятся в синергистическом взаимодействии с системой миелопероксидаза - перекись водорода. Катионные белки сорбируются на отрицательно заряженной мембране бактериальной клетки путем электростатического взаимодействия, нарушая проницаемость и структуру ее оболочки. Затем наступает гибель микроорганизма с последующим эффективным лизисом его лизосомальными протеиназами. Кроме того, высвободившиеся катионные белки опосредуют повышение проницаемости сосудов (способствуя дегрануляции тучных клеток и высвобождению гистамина), а также адгезию и эмиграцию лейкоцитов.
Цитокины при воспалении продуцируются главным образом стимулированными моноцитами и макрофагами (монокины), а также нейтрофилами, лимфоцитами, эндотелиальными и другими клетками. Цитокины повышают сосудистую проницаемость (нейтрофилзависимым путем), адгезию и эмиграцию лейкоцитов. Наряду с провоспалительными свойствами цитокины важны и для непосредственной защиты организма, поскольку стимулируют нейтрофилы и моноциты к умерщвлению, поглощению и перевариванию внедрившихся микроорганизмов, а также усиливают фагоцитоз путем опсонизации патогенного агента. Стимулируя раневое очищение, пролиферацию и дифференцировку клеток, цитокины усиливают репаративные процессы. Наряду с этим они могут опосредовать тканевую деструкцию (деградацию хрящевого матрикса и резорбцию кости) и, таким образом, играть роль в патогенезе заболеваний соединительной ткани, в частности ревматоидного артрита. Действие цитокинов вызывает также ряд метаболических эффектов, лежащих в основе общих проявлений воспаления - лихорадки, сонливости, анорексии, изменения обмена веществ, стимуляции гепатоцитов к усиленному синтезу белков острой фазы, активации системы крови и т.д. Цитокины взаимодействуют между собой, с простагландинами, нейропептидами и другими медиаторами.
К медиаторам воспаления (цитокинам) относится также ряд лимфокинов - полипептидов, продуцируемых стимулированными лимфоцитами. Лимфокины координируют взаимодействие нейтрофилов, макрофагов и лимфоцитов, регулируя воспалительную реакцию в целом.
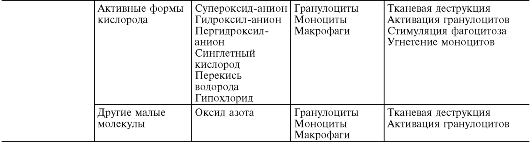
Активные метаболиты кислорода, прежде всего свободные радикалы - супероксидный анион-радикал (О* -) , гидроксильный радикал (НО*), гидроперекисный радикал (НО*,), вследствие наличия на их внешней орбите одного или нескольких непарных электронов обладают повышенной реактивностью с другими молекулами и, следовательно, значительным деструктивным потенциалом, который имеет значение в патогенезе воспаления (рис. 10-8).
Источником активных форм кислорода - кислородных радикалов, перекиси водорода (Н 1 О 1), синглетного кислорода (1 О 1), гипохлорита (HOCl) и др. - служат: респираторный взрыв фагоцитов при их стимуляции, каскад арахидоновой кислоты в процессе образования эйкозаноидов, ферментные процессы в эндоплазматическом ретикулуме и пероксисомах, митохондриях, цитозоле, а также самоокисление малых молекул, таких как гидрохиноны, лейкофлавины, катехоламины и др.
Радикалы кислорода повышают бактерицидную способность фагоцитов, а также имеют медиаторную и модуляторную функ-
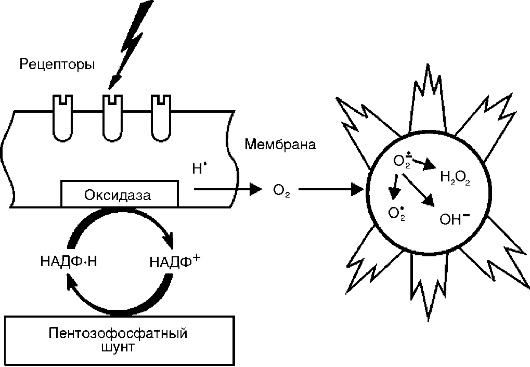 Рис. 10-8. Индукция активных форм кислорода при активации оксидазной системы клеточной мембраны
Рис. 10-8. Индукция активных форм кислорода при активации оксидазной системы клеточной мембраны
ции. Будучи медиаторами воспаления, активные метаболиты кислорода вызывают перекисное окисление липидов, повреждение белков, углеводов, нуклеиновых кислот, что повышает проницаемость сосудов (вследствие повреждения эндотелиальных клеток) и способствует стимуляции фагоцитов. Как модуляторы, они могут усиливать воспалительные явления (высвобождая ферменты и взаимодействуя с ними при повреждении ткани) или оказывать противовоспалительный эффект (инактивация лизосомальных гидролаз и других медиаторов воспаления). Большое значение имеют активные метаболиты кислорода в поддержании хронического воспаления.
К медиаторам и модуляторам воспаления относят также нейропептиды - вещества, высвобождаемые С-волокнами в результате активации воспалительным агентом полимодальных ноцицепторов, играющих важную роль в возникновении аксон-рефлексов в конечных разветвлениях первичных афферентных (чувствительных) нейронов. Наиболее изученными являются вещество Р, кальцитонин-генсвязанный пептид, нейрокинин А. Нейропептиды повышают проницаемость сосудов, и эта их способность во многом опосредована медиаторами, происходящими из тучных клеток. Между немиелиновыми нервами и тучными клетками имеются мембранные контакты, которые обеспечивают сообщение центральной нервной системы с очагом воспаления. Нейропептиды синергистически взаимодействуют в повышении проницаемости сосудов как между собой, так и с гистамином, брадикинином, С5а, фактором, активирующим тромбоциты, лейкотриеном В 4 ; антагонистически - с АТФ и аденозином. Они оказывают также потенцирующее воздействие на привлечение и цитотоксическую функцию нейтрофилов, усиливают адгезию нейтрофилов к эндотелию венул. Кроме того, нейропептиды повышают чувствительность ноцицепторов к действию различных медиаторов, в частности простагландина E 1 и простациклина, участвуя таким образом в формировании боли при воспалении.
Кроме вышеперечисленных веществ, к медиаторам воспаления относятся также ацетилхолин и катехоламины, высвобождающиеся при возбуждении холин- и адренергических структур. Ацетилхолин вызывает расширение сосудов и играет роль в аксон-рефлекторном механизме артериальной гиперемии при воспалении. Норадреналин и адреналин тормозят рост сосудистой проницаемости, выступая главным образом как модуляторы воспаления.
10.4.3. Расстройства кровообращения и микроциркуляции в воспаленной ткани
Расстройства микроциркуляции. Сосудистые явления развиваются вслед за воздействием воспалительного агента, поскольку первоначальные из них являются по своей природе рефлекторными. Они хорошо прослеживаются под микроскопом в классическом опыте Ю. Конгейма на брыжейке лягушки и включают ряд стадий:
1. Кратковременный спазм артериол, сопровождающийся побледнением ткани. Является результатом рефлекторного возбуждения вазоконстрикторов от воздействия воспалительного агента. Длится от нескольких десятков секунд до нескольких минут, так что его не всегда удается отметить.
2. Артериальная гиперемия, обусловленная расширением артериол, механизм которой, с одной стороны, связан аксонрефлекторным возбуждением вазодилататоров, а с другой - с непосредственными сосудорасширяющими эффектами медиаторов воспаления: нейропептидов, ацетилхолина, гистамина, брадикинина, простагландинов и др. Артериальная гиперемия лежит в основе двух основных внешних местных признаков воспаления - покраснения и повышения температуры ткани. Кроме того, в воссоздании жара имеет значение повышенная теплопродукция в очаге из-за усиленного обмена веществ.
3. Венозная гиперемия. Она может развиться уже через несколько минут после воздействия флогогена и характеризуется значительной продолжительностью - сопровождает весь ход воспалительного процесса. Одновременно, поскольку при ее участии осуществляются основные воспалительные явления, она считается истинной воспалительной гиперемией.
В механизме венозной гиперемии различают 3 группы факторов: а) нарушения реологических свойств крови и ее циркуляции. Сюда относятся повышение вязкости крови вследствие ее сгущения, обусловленного экссудацией, потери альбуминов, увеличения содержания глобулинов, изменения коллоидного состояния белков; усиление сопротивления кровотоку в результате краевого стояния лейкоцитов, набухания и агрегации эритроцитов; тромбообразование вследствие активации свертывающей системы крови; нарушение характера кровотока - замедление тока крови в осевой зоне, уменьшение краевой плазматической зоны;
б) изменения сосудистой стенки, которые включают потерю сосудистого тонуса вследствие паралича нервно-мышечного аппарата сосудов; снижение эластичности сосудистой стенки; набухание эндотелия и повышение его адгезивности, в результате чего просвет сосудов сужается, создаются условия для прилипания лейкоцитов к эндотелию;
в) тканевые изменения, состоящие в сдавлении венул и лимфатических сосудов отечной, инфильтрированной тканью; снижении упругости соединительной ткани. Многие из перечисленных факторов являются и причинами, и одновременно следствиями развивающейся венозной гиперемии.
Воспалительная гиперемия отличается от других видов гиперемии (вызываемой, например, механическим фактором) значительным ослаблением или даже извращением реакции сосудов воспаленной ткани на действие сосудосуживающих агентов (адреналин, кофеин) и на раздражение симпатических нервов. Это явление может быть связано с «десенсибилизацией» сосудов, т.е. сниженной или качественно измененной их чувствительностью к действию вазоконстрикторных стимулов, что обусловлено блокадой рецепторов. Другие отличия воспалительной гиперемии связаны с более выраженным кровенаполнением воспаленного участка органа или ткани, расширением и увеличением количества функционирующих капилляров, интенсивностью микроциркуляции, отставанием линейной скорости кровотока и др., что позволяет рассматривать воспалительную гиперемию как специальный вид нарушений микроциркуляции.
4. Стаз. Он может развиться в некоторых разветвлениях сосудов воспаленной ткани. Распространенный стаз характерен для острого, быстро развивающегося, например гиперергического, воспаления. Как правило, нарушение кровотока при воспалительном стазе является преходящим, однако при возникновении повреждений сосудистой стенки и тромбов во многих микрососудах стаз становится необратимым.
10.4.4. Экссудация и экссудаты
Расстройства микроциркуляции при воспалении сопровождаются явлениями экссудации и эмиграции.
Экссудация (exsudatio, от лат. exsudare - потеть) - выпотевание белоксодержащей жидкой части крови через сосудистую стенку
в воспаленную ткань. Соответственно жидкость, выходящая при воспалении из сосудов в ткань, называется экссудатом. Термины «экссудат» и «экссудация» употребляются только по отношению к воспалению. Они призваны подчеркнуть отличие воспалительной жидкости (и механизма ее образования) от межклеточной жидкости и транссудата - невоспалительного выпота, выходящего при других, невоспалительных, отеках. Если транссудат содержит до 2% белка, то экссудат - более 3 (до 8%).
Механизм экссудации включает 3 основных фактора:
1) повышение проницаемости сосудов (венул и капилляров) в результате воздействия медиаторов воспаления и в ряде случаев самого воспалительного агента;
2) увеличение кровяного (фильтрационного) давления в сосудах очага воспаления вследствие гиперемии;
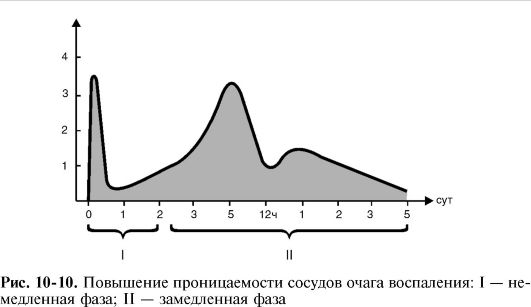
3) возрастание осмотического и онкотического давления в воспаленной ткани в результате альтерации и начавшейся экссудации и, возможно, снижение онкотического давления крови из-за потери белков при обильной экссудации (рис. 10-9, 10-10).
Ведущим фактором экссудации является повышение проницаемости сосудов, которое, как правило, имеет две фазы - немедленную и замедленную.
 Рис. 10-9. Выход синьки Эванса из сосуда брыжейки лягушки при воспалении, х
35 (по А.М. Чернуху)
Рис. 10-9. Выход синьки Эванса из сосуда брыжейки лягушки при воспалении, х
35 (по А.М. Чернуху)
 Немедленная фаза
возникает
вслед за действием воспалительного агента, достигает максимума на
протяжении нескольких минут и завершается в среднем в течение 15-30 мин,
когда проницаемость может возвращаться к норме (в том случае, если сам
флогоген не оказывает прямого повреждающего влияния на сосуды).
Преходящее повышение проницаемости сосудов в немедленной фазе
обусловлено главным образом контрактильными явлениями со стороны
эндотелия венул. В результате взаимодействия медиаторов со
специфическими рецепторами на мембранах эндотелиальных клеток происходит
сокращение актиновых и миозиновых микрофиламентов цитоплазмы клеток, и
эндотелиоциты округляются; две соседние клетки отодвигаются друг от
друга, и между ними появляется межэндотелиальная щель, через которую и
осуществляется экссудация.
Немедленная фаза
возникает
вслед за действием воспалительного агента, достигает максимума на
протяжении нескольких минут и завершается в среднем в течение 15-30 мин,
когда проницаемость может возвращаться к норме (в том случае, если сам
флогоген не оказывает прямого повреждающего влияния на сосуды).
Преходящее повышение проницаемости сосудов в немедленной фазе
обусловлено главным образом контрактильными явлениями со стороны
эндотелия венул. В результате взаимодействия медиаторов со
специфическими рецепторами на мембранах эндотелиальных клеток происходит
сокращение актиновых и миозиновых микрофиламентов цитоплазмы клеток, и
эндотелиоциты округляются; две соседние клетки отодвигаются друг от
друга, и между ними появляется межэндотелиальная щель, через которую и
осуществляется экссудация.
Замедленная фаза развивается постепенно, достигает максимума через 4-6 ч и длится иногда до 100 ч в зависимости от вида и интенсивности воспаления. Следовательно, экссудативная фаза воспаления начинается немедленно после воздействия флогогена и продолжается более 4 суток.
Стойкое увеличение проницаемости сосудов в замедленной фазе связано с повреждением сосудистой стенки венул и капилляров лейкоцитарными факторами - лизосомальными ферментами и активными метаболитами кислорода.
По отношению к сосудистой проницаемости медиаторы воспаления делятся на:
1) прямодействующие, влияющие непосредственно на эндотелиальные клетки и вызывающие их контракцию, - гистамин, серотонин, брадикинин, С5а, С3а, LTC 4 и LTD 4 ;
2) нейтрофилзависимые, эффект которых опосредуется лейкоцитарными факторами. Такие медиаторы не способны повышать проницаемость сосудов у лейкопенических животных. Это компонент комплемента С5а des Arg, LTB 4 , интерлейкины, в частности IL-1, отчасти фактор, активирующий тромбоциты.
Выход жидкой части крови из сосуда и задержка ее в ткани объясняется: повышенной проницаемостью сосудов, увеличенным фильтрационным давлением крови, осмотическим и онкотическим давлением ткани, фильтрацией и диффузией через микропоры в самих эндотелиальных клетках (трансцеллюлярные каналы) пассивным путем; активным путем - с помощью так называемого микровезикулярного транспорта, который заключается в микропиноцитозе эндотелиальными клетками плазмы крови, ее транспорте в виде микропузырьков (микровезикул) по направлению к базальной мембране и последующем выбросе (экструзии) в ткань.
При воспалении проницаемость сосудов повышена в большей степени, чем при любом из невоспалительных отеков, в связи с чем количество белка в экссудате превышает таковое в транссудате. Подобное отличие обусловлено разницей в количествах и наборе высвобождаемых биологически активных веществ. Например, лейкоцитарные факторы, повреждающие сосудистую стенку, играют важную роль в патогенезе экссудации и менее значимую - при невоспалительных отеках.
Степенью повышения проницаемости сосудов определяется и белковый состав экссудата. При сравнительно небольшом увеличении проницаемости могут выйти только мелкодисперсные альбумины, по мере дальнейшего повышения - глобулины и, наконец, фибриноген.
В зависимости от качественного состава различают следующие виды экссудатов: серозный, фибринозный, гнойный, гнилостный, геморрагический, смешанные (рис. 10-11, см. цв. вклейку).
Серозный экссудат характеризуется умеренным содержанием белка (3-5%), в основном мелкодисперсного (альбумин), и небольшим количеством полиморфно-ядерных лейкоцитов, вследствие чего имеет невысокую удельную плотность (1015-1020) и является
достаточно прозрачным. По составу наиболее близок к транссудату. Характерен для воспаления серозных оболочек (серозный перитонит, плеврит, перикардит, артрит и др.), реже встречается при воспалении в паренхиматозных органах. Экссудат при серозном воспалении слизистых оболочек характеризуется большой примесью слизи. Такое воспаление называется катаральным (от греч. katarrheo - стекаться, течь вниз; катаральный ринит, гастрит, энтероколит и др.). Чаще всего серозный экссудат наблюдается при ожоговом, вирусном, аллергическом воспалении.
Фибринозный экссудат отличается высоким содержанием фибриногена, что является результатом значительного повышения проницаемости сосудов. При контакте с поврежденными тканями фибриноген превращается в фибрин и выпадает в виде ворсинчатых масс (на серозных оболочках) или пленки (на слизистых), вследствие чего экссудат уплотняется. Если фибринозная пленка расположена рыхло, поверхностно, легко отделяется без нарушения целостности слизистой, такое воспаление называется крупозным. Оно наблюдается в желудке, кишечнике, трахее, бронхах. В том случае, когда пленка плотно спаяна с подлежащей тканью и ее удаление обнажает язвенную поверхность, речь идет о дифтеритическом воспалении. Оно характерно для миндалин, полости рта, пищевода. Такое различие обусловлено характером эпителия слизистой оболочки и глубиной повреждения. Фибринозные пленки могут самопроизвольно отторгаться благодаря аутолизу, развертывающемуся вокруг очага, и демаркационному воспалению и выходить наружу; подвергаться ферментативному расплавлению или организации, т.е. прорастанию соединительной тканью с образованием соединительнотканных сращений, или спаек. Фибринозный экссудат может формироваться при дифтерии, дизентерии, туберкулезе.
Гнойный экссудат характеризуется наличием большого количества полиморфно-ядерных лейкоцитов, главным образом погибших и разрушенных (гнойные тельца), ферментов, продуктов аутолиза тканей, альбуминов, глобулинов, иногда нитей фибрина, особенно нуклеиновых кислот, обусловливающих высокую вязкость гноя. Вследствие этого гнойный экссудат является достаточно мутным, с зеленоватым оттенком. Он характерен для воспалительных процессов, вызванных кокковой инфекцией, патогенными грибками или химическими флогогенами, такими как скипидар, отравляющие вещества.
Гнилостный (ихорозный) экссудат отличается наличием продуктов гнилостного разложения тканей, вследствие чего имеет грязнозеленую окраску и дурной запах. Образуется в случае присоединения патогенных анаэробов.
Геморрагический экссудат характеризуется большим содержанием эритроцитов, что придает ему розовый или красный цвет. Характерен для туберкулезных поражений (туберкулезный плеврит), чумы, сибирской язвы, черной оспы, токсического гриппа, аллергического воспаления, т.е. для воздействия высоковирулентных агентов, бурно протекающего воспаления, сопровождающегося значительным повышением проницаемости и даже разрушением сосудов. Геморрагический характер может принять любой вид воспаления - серозный, фибринозный, гнойный.
Смешанные экссудаты наблюдаются при воспалении, протекающем на фоне ослабленных защитных сил организма и присоединения вследствие этого вторичной инфекции. Различают серозно-фибринозный, серозно-гнойный, серозно-геморрагический, гнойно-фибринозный экссудаты.
Биологическое значение экссудации двояко. Она выполняет важную защитную роль: обеспечивает поставку в ткань плазменных медиаторов - активных компонентов комплемента, кининов, факторов свертывающей системы, ферментов плазмы, биологически активных веществ, высвобождаемых активированными клетками крови. Совместно с тканевыми медиаторами они участвуют в умерщвлении и лизисе микроорганизмов, привлечении лейкоцитов крови, опсонизации патогенного агента, стимуляции фагоцитоза, раневом очищении, репаративных явлениях. С экссудатом из тока крови в очаг выходят продукты обмена, токсины, т.е. очаг воспаления выполняет дренажную элиминативную функцию. С другой стороны, вследствие свертывания лимфы в очаге, выпадения фибрина, усугубления венозного застоя и тромбирования венозных и лимфатических сосудов экссудат участвует в задержке в очаге микробов, токсинов, продуктов обмена.
Будучи компонентом патологического процесса, экссудация может приводить к осложнениям - поступлению экссудата в полости тела с развитием плеврита, перикардита, перитонита; сдавлению близлежащих органов; гноеобразованию с развитием абсцесса, эмпиемы, флегмоны, пиемии. Образование спаек может вызвать смещение и нарушение функций органов. Большое значение имеет локализация воспалительного процесса. Так, например,
образование на слизистой оболочке гортани при дифтерии фибринозного экссудата может привести к асфиксии.
Скопление в ткани экссудата обусловливает такой внешний местный признак воспаления, как припухлость. Кроме того, наряду с действием брадикинина, гистамина, простагландинов, нейропептидов давление экссудата на окончания чувствительных нервов имеет некоторое значение в возникновении воспалительной боли.
10.4.5. Выход лейкоцитов в воспаленную ткань (эмиграция лейкоцитов)
Эмиграция (emigratio, от лат. emigrare - выселяться, переселяться) - выход лейкоцитов из сосудов в ткань. Осуществляется путем диапедеза главным образом через стенку венул. Эмиграция лейкоцитов в очаг является ключевым событием патогенеза воспаления. Лейкоциты служат основными эффекторами воспаления. Внеклеточные бактерицидный и литический эффекты лейкоцитарных продуктов и фагоцитоз играют решающую роль в борьбе с флогогеном. Одновременно, оказывая влияние на клетки, сосуды и кровь, компоненты лейкоцитов выступают как важные медиаторы и модуляторы воспаления, в том числе повреждения собственных тканей. Осуществляя раневое очищение, фагоциты создают предпосылки для репаративных явлений, где они стимулируют пролиферацию, дифференцировку и функциональную активность фибробластов и других клеток. Механизм эмиграции (по И.И. Мечникову) состоит в явлении хемотаксиса.
Пусковым моментом активации лейкоцитов является воздействие на рецепторы (часто специфические) клеточных мембран разнообразных хемотаксических агентов (хематтрактантов), высвобождаемых микроорганизмами или фагоцитами, а также образующихся в ткани в результате действия воспалительного агента или под влиянием самих фагоцитов. Наиболее важными хематтрактантами являются: фрагменты комплемента, фибринопептиды и продукты деградации фибрина, калликреин, проактиватор плазминогена, фрагменты коллагена, фибронектин, метаболиты арахидоновой кислоты, цитокины, лимфокины, бактериальные пептиды, продукты распада гранулоцитов.
В результате связывания хематтрактантов с рецепторами и активации ферментов плазматической мембраны в фагоците развивается респираторный взрыв - резкое повышение потребле-
ния кислорода и образование активных его метаболитов. Этот процесс не имеет отношения к обеспечению фагоцита энергией. Он направлен на дополнительное вооружение фагоцита высокореактивными токсическими веществами для более эффективного уничтожения микроорганизмов. Наряду с дыхательным взрывом в фагоците происходят другие изменения: повышенная выработка особых мембранных гликопротеинов, определяющих адгезивность фагоцита; понижение поверхностного натяжения мембраны и изменение коллоидного состояния участков цитоплазмы (обратимый переход из геля в золь), что необходимо для образования псевдоподий; активация актиновых и миозиновых микрофиламентов, являющаяся основой миграции; усиленная секреция и выделение веществ, облегчающих прикрепление лейкоцита к эндотелию (лактоферрин, катионные белки, фибронектин, интерлейкины).
Лейкоциты выходят из осевого тока крови в плазматический. Этому способствуют нарушение реологических свойств крови, замедление кровотока, изменение его характера, в частности уменьшение краевой плазматической зоны (рис. 10-12).
Вследствие возрастания адгезивных свойств лейкоцитов и эндотелиальных клеток происходит приклеивание лейкоцитов к
 Рис. 10-12.
Схема
кровотока в норме и при воспалении: 1 - нормальная циркуляция: осевой
ток, краевая плазматическая зона с отдельными лейкоцитами; 2 -
замедление кровотока: видны эритроциты, краевое стояние лейкоцитов и
тромбоцитов; 3 - сильный застой крови: краевое стояние лейкоцитов и
тромбоцитов, уменьшение краевой плазматической зоны (по Д.Е. Альперну)
Рис. 10-12.
Схема
кровотока в норме и при воспалении: 1 - нормальная циркуляция: осевой
ток, краевая плазматическая зона с отдельными лейкоцитами; 2 -
замедление кровотока: видны эритроциты, краевое стояние лейкоцитов и
тромбоцитов; 3 - сильный застой крови: краевое стояние лейкоцитов и
тромбоцитов, уменьшение краевой плазматической зоны (по Д.Е. Альперну)
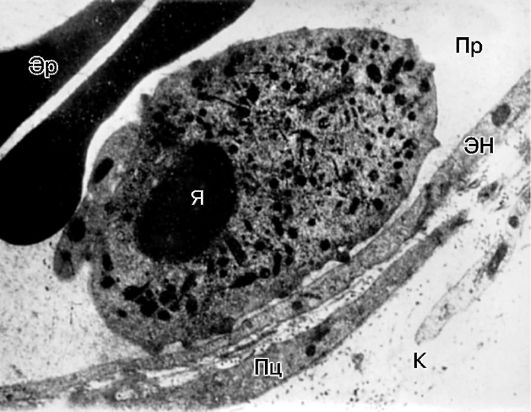 Рис. 10-13.
Краевое
стояние лейкоцита в венуле брыжейки крысы при воспалении: Пр - просвет
сосуда; ЭН - эндотелиальная клетка; Пц - перицит; К - коллагеновые
волокна; Я - ядро; Эр - эритроциты. Электронная микроскопия, х10 000 (по
А.М. Чернуху)
Рис. 10-13.
Краевое
стояние лейкоцита в венуле брыжейки крысы при воспалении: Пр - просвет
сосуда; ЭН - эндотелиальная клетка; Пц - перицит; К - коллагеновые
волокна; Я - ядро; Эр - эритроциты. Электронная микроскопия, х10 000 (по
А.М. Чернуху)
эндотелию - развивается феномен краевого стояния лейкоцитов
(рис. 10-13).
Повышение адгезивности эндотелия может быть обусловлено: усиленной продукцией им адгезивных гликопротеинов (лектинов) и других веществ, которые включаются в состав фибриновой пленки, в норме покрывающей эндотелий со стороны просвета сосуда, фиксацией на эндотелиальных клетках хематтрактантов, впоследствии взаимодействующих со специфическими рецепторами на лейкоцитах, усилением экспрессии на эндотелиоцитах рецепторов к иммуноглобулину G и фрагменту комплемента С3Ь, что способствует фиксации иммунных комплексов, а через них - лейкоцитов, несущих рецепторы к иммуноглобулину (Ig) G и С3Ь.
Прилипание лейкоцитов к эндотелию опосредовано следующими факторами:
Лейкоциты в фазе инициации воспаления активируются и образуют агрегаты; в результате активации лейкоцита его отрицательный заряд снижается, что уменьшает силы взаимного отталкивания между ним и отрицательно заряженным эндотелием;
Между лейкоцитами и эндотелием образуются кальциевые мостики (Са 2 + и другие двухвалентные ионы играют ключевую роль в прилипании лейкоцитов);
В ходе активации в лейкоцитах усиливается синтез специфических гранул, некоторые компоненты которых, например лактоферрин, усиливают адгезивные свойства клеток;
На мембране лейкоцитов возрастает экспрессия адгезивных гликопротеинов классов Мас-1 и LAF-1.
Первоначальный контакт лейкоцитов с эндотелием является весьма непрочным, и под влиянием кровотока они могут перекатываться по поверхности фибриновой пленки, однако контакт быстро стабилизируется, поскольку лейкоциты выделяют в зону слипания протеазы, обнажающие лектиноподобные участки мембраны эндотелиоцитов и придающие им повышенную адгезивность. Прямое отношение к прилипанию фагоцитов к эндотелию имеет выделяемый ими фибронектин. Занявшие краевое положение лейкоциты выпускают псевдоподии, которые проникают в межэндотелиальные щели и таким образом «переливаются» через эндотелиальный слой (рис. 10-14). Эмиграции способствуют повышение сосудистой проницаемости и усиление тока жидкости из сосуда в ткань, существенно облегчающие прохождение сосудистой стенки для лейкоцита.
Оказавшись между эндотелиальным слоем и базальной мембраной, лейкоцит выделяет лизосомальные протеиназы, растворяющие ее, а также катионные белки, изменяющие коллоидное состояние базальной мембраны (обратимый переход из геля в золь), что обеспечивает повышенную проходимость ее для лейкоцита. Иммигрировавшие лейкоциты отделяются от наружной поверхности сосудистой стенки и амебоидными движениями направляются к центру очага воспаления (рис. 10-15), что определяется градиентом концентрации хемотаксических веществ в очаге. Некоторую роль могут играть электрокинетические явления, обусловленные разностью потенциалов между отрицательно заряженным лейкоцитом и положительным зарядом ткани, характеризующейся Н+- гиперионией.
Первоначально среди лейкоцитов экссудата в очаге острого воспаления преобладают гранулоциты, в основном нейтрофилы, а затем - моноциты/макрофаги. Позже в очаге накапливаются лимфоциты.
Поскольку замедление кровотока в отдельных разветвлениях микроциркуляторного русла и краевое стояние лейкоцитов могут
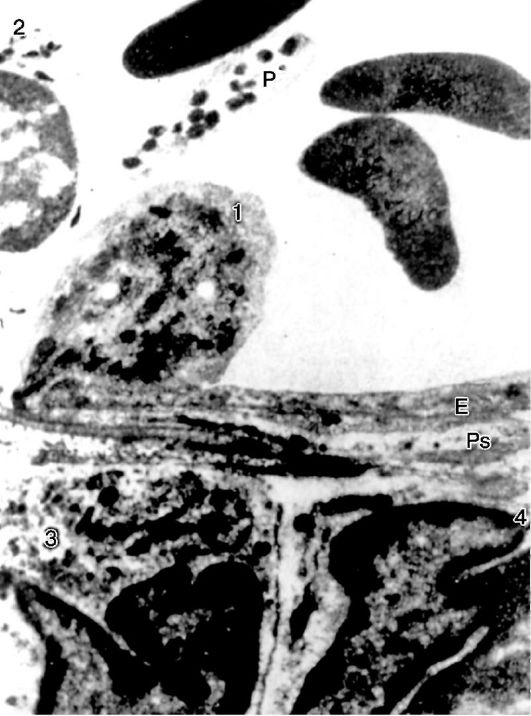 Рис.
10-14. Эмиграция нейтрофила: 1 - эмигрирующий нейтрофил; Е -
эндотелиальная клетка; Ps - длинный псевдоподий, расположенный
параллельно эндотелию; 2 - нейтрофил в просвете сосуда; 3, 4 -
эмигрировавшие нейтрофилы; Р - тромбоцит. х15 500 (по Марчези)
Рис.
10-14. Эмиграция нейтрофила: 1 - эмигрирующий нейтрофил; Е -
эндотелиальная клетка; Ps - длинный псевдоподий, расположенный
параллельно эндотелию; 2 - нейтрофил в просвете сосуда; 3, 4 -
эмигрировавшие нейтрофилы; Р - тромбоцит. х15 500 (по Марчези)
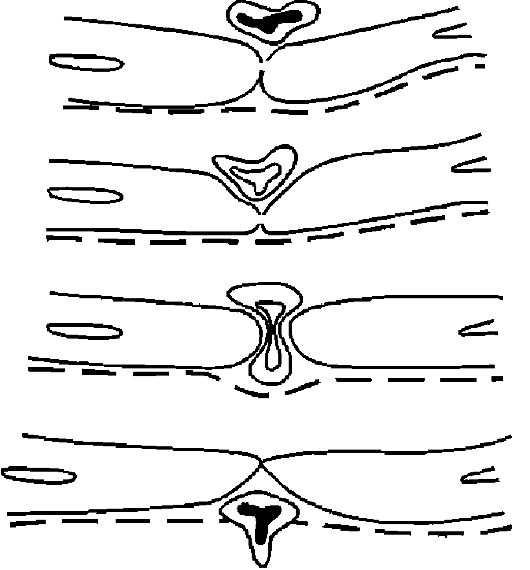 Рис. 10-15. Схема эмиграции лейкоцитов (по Марчези)
Рис. 10-15. Схема эмиграции лейкоцитов (по Марчези)
развиваться весьма быстро, а мигрирующему нейтрофилу достаточно 3-12 мин, чтобы пройти эндотелий, появление гранулоцитов в очаге может наблюдаться уже к 10-й мин от начала воспаления. Скорость аккумуляции нейтрофилов в очаге является наивысшей в первые 2 ч, постепенно снижаясь в последующие. Количество их достигает максимума через 4-6 ч. В этот период лейкоциты очага представлены нейтрофилами более чем на 90%. Гранулоциты фагоцитируют бактерии или иные инородные тела и частицы отмирающих клеточных элементов, параллельно осуществляя внеклеточную поставку ферментов, катионных белков, активных метаболитов кислорода. Одновременно происходит массивное разрушение нейтрофилов, останки которых являются важным стимулом расширения инфильтрации - как нейтрофильной, так и моноцитарной. Как и в норме, большинство гранулоцитов, вышедших в ткань, никогда не возвращается в кровоток.
Моноциты обычно преобладают в очаге острого воспаления спустя 16-24 ч и достигают пика, как правило, на третьи сутки. Однако миграция моноцитов из крови в ткань начинается одновременно с миграцией нейтрофилов. Предполагается, что вначале меньшая, чем у нейтрофилов, скорость аккумуляции моноцитов связана с торможением хемотаксиса этих клеток под влиянием продуктов жизнедеятельности нейтрофилов в течение определенного времени, необходимого для полной выраженности нейтрофильной реакции и предупреждения ее моноцитарного контроля. В очаге воспаления наблюдаются постепенное превращение иммигрировавших моноцитов в макрофаги и созревание последних, в процессе которого объем цитоплазмы и органелл в ней увеличивается. В частности, повышается количество митохондрий и лизосом, что имеет существенное значение для полноценного выполнения макрофагами их функций в очаге. Возрастает активность пиноцитоза, в цитоплазме увеличивается количество фаголизосом, повышается число филоподий. Моноциты/макрофаги также являются источником медиаторов воспаления (ферментов, метаболитов кислорода, цитокинов), фагоцитируют бактерии, но имеют преимущественное значение в фагоцитозе останков погибших клеток, в частности нейтрофилов. Поэтому понятна зависимость аккумуляции моноцитов от предыдущего выхода нейтрофилов. Так, у кроликов с нейтропенией моноциты не появляются в очаге воспаления в течение 16 ч, в то время как в естественных условиях воспаления они обнаруживаются уже через 4 ч, а введение в очаг
воспаления лейкопеническим животным нейтрофилов восстанавливает обычную аккумуляцию мононуклеаров. Известно хемотаксическое действие лизатов нейтрофилов на моноциты, обусловленное отчасти катионными белками их лизосомальных гранул.
С другой стороны, аккумуляция нейтрофилов во многом зависит от моноцитов. Особенно это касается той части нейтрофильной инфильтрации, которая связана с усиленным кроветворением, поскольку последнее инициируется моноцитарно-макрофагальными гемопоэтическими факторами, в частности IL-1, различными типами так называемых колониестимулирующих факторов - веществ преимущественно белковой природы, ответственных за пролиферацию и дифференцировку в костном мозгу кроветворных клеток. В настоящее время выделен ряд хемотаксических пептидов из моноцитов человека для нейтрофилов, которым может принадлежать роль в механизме саморегуляции лейкоцитарной реакции очага воспаления. Однако вопрос о механизмах смены клеточных фаз в очаге воспаления, перехода от развертывания воспалительной реакции к ее разрешению относится к наименее изученным в проблеме воспаления.
Клеточный состав экссудата в большой мере зависит от характера и течения воспалительного процесса, в свою очередь определяемых воспалительным агентом и состоянием реактивности организма. Так, экссудат особенно богат нейтрофилами, если воспаление вызвано гноеродными микробами; при аллергическом воспалении в очаге содержится много эозинофилов. Хронические воспалительные процессы характеризуются незначительным содержанием нейтрофилов, преобладанием моноцитов и лимфоцитов.
Иммигрировавшие лейкоциты совместно с пролиферирующими клетками местного происхождения образуют воспалительный инфильтрат. При этом экссудат с содержащимися в нем клетками пропитывает ткань, распределяясь между элементами воспалительного участка и делая его напряженным и плотным. Инфильтрат наряду с экссудатом обусловливает припухлость и имеет значение в возникновении воспалительной боли.
10.4.6. Восстановительные процессы в воспаленной ткани
Под воспалительной пролиферацией (proliferat e, от лат. proles - потомство, ferre - создавать) понимают размножение местных кле-
точных элементов в очаге воспаления. Пролиферация развивается с самого начала воспаления наряду с явлениями альтерации и экссудации, но становится преобладающей в более поздний период процесса, по мере стихания экссудативно-инфильтративных явлений. Первоначально она в большей мере выражена на периферии очага. Важнейшим условием прогрессирования пролиферации является эффективность очищения очага воспаления от микроорганизмов или другого вредного агента, продуктов альтерации тканей, погибших лейкоцитов (раневое очищение). Ведущая роль в этом отводится макрофагам - гематогенного (моноциты) и тканевого (гистиоциты) происхождения.
Раневое очищение происходит главным образом путем внеклеточной деградации поврежденной ткани и фагоцитоза. Оно осуществляется под регуляторным влиянием цитокинов с помощью таких ферментов, как протеогликаназа, коллагеназа, желатиназа. Активация этих ферментов может происходить под воздействием активатора плазминогена, высвобождаемого при участии цитокинов из мезенхимальных клеток. Простагландины, высвобождаясь вместе с ферментами, могут, со своей стороны, индуцировать протеиназы и вносить свой вклад в процессы деградации.
Фагоцитоз был открыт и понят как важнейший элемент воспаления и естественного иммунитета И.И. Мечниковым в 1882 г.
И.И. Мечников выделил 4 фазы фагоцитоза:
1) фаза приближения: выход лейкоцита из сосуда и приближение к объекту фагоцитоза под действием хематтрактантов;
2) фаза прилипания (контактная);
3) фаза погружения: обволакивание и погружение объекта внутрь фагоцита; образуется особая вакуоль, где скапливаются лизосомы;
4) фаза переваривания, результатом которой могут быть 2 варианта исхода: а) адекватное дозированное освобождение лизосомальных ферментов, разрушающее только флогоген (сам фагоцит остается интактным); б) чрезмерное выделение лизосомальных ферментов, что ведет к разрушению объекта фагоцитоза и самого фагоцита.
Фагоциты, взаимодействуя с бактериями, активируются, их мембрана становится «липкой», так как количество различных рецепторов на ней резко увеличивается, как увеличивается и «ощупывающая» подвижность цитоплазмы этих клеток. Одновременно в цитоплазме накапливаются пероксисомы и гранулы, наполнен-
ные мощными протеазами. Когда такая клетка встречается с микроорганизмом, бактерия «прилипает» к поверхности фагоцита, обволакивается его псевдоподиями и оказывается внутри клетки, где и разрушается. Макрофаги начинают выделять в среду фактор некроза опухолей (TNF), интерферон γ (IFN-γ) и IL-8, который играет в воспалении особую роль - он вызывает появление в эндотелиоцитах рецепторов, реагирующих с моноцитами и нейтрофилами с высоким сродством, так что эти клетки останавливаются в капиллярах, расположенных в районе воспаления. IL-8 наиболее эффективен в создании градиента для хемотаксиса фагоцитирующих клеток. Фагоциты имеют рецепторы к IL-8, которые «чувствуют» разницу в его концентрации со стороны, обращенной к его источнику, и с противоположной стороны, и направляют свое движение по оси максимального отличия. Таким образом, фагоцитирующие клетки накапливаются в очаге воспаления, активно поглощают и разрушают (внутриклеточно) бактерии и обломки клеток и выделяют ферменты, разрушающие межклеточное вещество соединительной ткани. При нагноении кожный покров, окружающий очаг воспаления (нарыв), истончается и прорывается: флогогены, обломки клеток и накопившиеся фагоциты выбрасываются из организма. Пораженный участок ткани постепенно восстанавливается. Удаляя останки лейкоцитов и разрушенных тканей, макрофаги устраняют важнейший источник собственной хемотаксической стимуляции и подавляют дальнейшее развитие местной лейкоцитарной реакции. По мере очищения очага воспаления количество макрофагов убывает из-за снижения их поступления из крови. Из очага они уносятся восстанавливающимся током лимфы в регионарные лимфоузлы, где погибают. Лимфоциты частью погибают, частью превращаются в плазматические клетки, продуцирующие антитела, и затем постепенно элиминируются.
Пролиферация осуществляется главным образом за счет мезенхимальных элементов стромы, а также элементов паренхимы органов. В ней участвуют камбиальные, адвентициальные, эндотелиальные клетки. В результате дифференцировки стволовых клеток соединительной ткани - полибластов - в очаге появляются эпителиоидные клетки, фибробласты и фиброциты. Основными клеточными элементами, ответственными за репаративные процессы в очаге воспаления, являются фибробласты. Они продуцируют основное межклеточное вещество - гликозаминогликаны, а также синтезируют и секретируют волокнистые структуры - коллаген,
эластин, ретикулин. В свою очередь, коллаген является главным компонентом рубцовой ткани.
Регуляция пролиферации. Процесс пролиферации находится под сложным гуморальным контролем. Решающее значение здесь имеют опять-таки макрофаги. Они являются основным источником фактора роста фибробластов - термолабильного белка, стимулирующего пролиферацию фибробластов и синтез коллагена. Макрофаги также усиливают привлечение фибробластов в очаг воспаления, секретируя IL-1 и фибронектин. Макрофаги стимулируют пролиферацию эндотелиальных и гладкомышечных клеток сосудистой стенки, базальной мембраны и, таким образом, образование микрососудов. Угнетение или стимуляция системы мононуклеарных фагоцитов соответственно ослабляет или усиливает развитие грануляционной ткани в очаге гнойного воспаления.
В свою очередь, макрофаги опосредуют регуляторное влияние на фибробласты и пролиферацию Т-лимфоцитов. Последние же активируются протеиназами, образующимися в очаге воспаления в результате распада ткани. Протеиназы могут оказывать непосредственное влияние как на макрофаги, так и на фибробласты. Макрофаги и лимфоциты могут высвобождать моно- и лимфокины, не только стимулирующие, но и угнетающие фибробласты, выступая в качестве истинных регуляторов их функций.
Фибробласты зависят также от тромбоцитарного фактора роста, являющегося термостабильным белком с высоким содержанием цистеина и молекулярной массой 30 000Д. В качестве других факторов роста для фибробластов называют соматотропин, соматомедины, инсулиноподобные пептиды, инсулин, глюкагон.
Важную роль в пролиферативных явлениях играют кейлоны - термолабильные гликопротеины с молекулярной массой 40 000Д, способные ингибировать клеточное деление путем инактивации ферментов, участвующих в редупликации ДНК. Одним из основных источников кейлонов являются сегментоядерные нейтрофилы. По мере снижения количества нейтрофилов в очаге воспаления уменьшается содержание кейлонов, что приводит к ускорению деления клеток. По другим предположениям, при воспалении сегментоядерные нейтрофилы практически не вырабатывают кейлоны и усиленно продуцируют антикейлоны (стимуляторы деления); соответственно деление клеток ускоряется, пролиферация усиливается.
Другие клетки и медиаторы могут модулировать репаративный процесс, воздействуя на функции фибробластов, макрофа-
гов и лимфоцитов. Существенное значение в регуляции репаративных явлений, по Д.Н. Маянскому, имеют также реципрокные взаимоотношения в системе коллаген - коллагеназа, стромальнопаренхиматозные взаимодействия.
Пролиферация сменяется регенерацией. Последняя не входит в комплекс собственно воспалительных явлений, однако непременно следует им и трудно от них отделима. Она состоит в разрастании соединительной ткани, новообразовании кровеносных сосудов, в меньшей степени - в размножении специфических элементов ткани. При незначительном повреждении ткани происходит относительно полная ее регенерация. При образовании дефекта он заполняется вначале грануляционной тканью - молодой, богатой сосудами, которая впоследствии замещается соединительной тканью с образованием рубца.
10.5. ХРОНИЧЕСКОЕ ВОСПАЛЕНИЕ
Бывают случаи, когда в воспалительных инфильтратах с самого начала скапливаются не полиморфно-ядерные лейкоциты, а моноциты, лимфоциты и их производные. Формирование такого скопления мононуклеарных клеток, получившего название «гранулема», является предпосылкой к долгому течению воспаления. Хроническое воспаление служит иллюстрацией справедливости высказывания И.И. Мечникова: «воспаление - реакция защитная по своей биологической сути, но, к сожалению, для организма не всегда достигающая совершенства».
В отличие от острого воспаления хроническое воспаление начинается не с нарушений микроциркуляции и описанных ранее событий в сосудистом русле, а со скопления критического числа раздраженных (активированных) макрофагов в одном месте.
Стойкое раздражение макрофагов можно вызвать разными способами.
Ряд микробов поглощается макрофагами, но, оказавшись в их фагосомах, не погибает и получает возможность длительно персистировать и размножаться внутри клетки (это возбудители туберкулеза, проказы, листериоза, токсоплазмоза и многие другие). Макрофаги, содержащие микробы, переходят в активное состояние и начинают секретировать медиаторы воспаления.
Макрофаги могут поглощать неинфекционные частицы, которые клетка не в состоянии расщепить или выбросить в среду (сложные полисахаридные комплексы - коррагенан из морских водорослей, декстран, зимозан из пекарских дрожжей). После внутривенного введения мышам гранул зимозана они захватываются макрофагами-резидентами (клетками Купфера) печени и макрофагами интерстиция легкого и активируют их. Через 2-3 суток вокруг таких макрофагов, как вокруг эпицентров, начинают скапливаться попавшие с кровью моноциты и формируется то, что принято называть гранулемой, или мононуклеарным инфильтратом. Привлечение новых моноцитов/макрофагов в зону локализации активированных макрофагов связано с веществами, вызывающими хемотаксис. Они выделяются активными макрофагами в готовом виде (LTC 4 , LTD 4 , PGE 2) либо в виде предшественников: С2, С4, С5, С6 компоненты комплемента, которые превращаются в СЗа, С5а, С567-фракции с высокой хемотаксической активностью под действием протеаз, секретируемых теми же макрофагами.
Лизосомальные ферменты, секретируемые макрофагами, как коллагеназа, расщепляют коллаген. Продукты частичной деградации коллагена обладают мощной способностью притягивать свежие моноциты в очаг воспаления.
Активированные макрофаги секретируют биоокислители, которые запускают перекисное окисление липидов в мембранах других клеток в зоне инфильтрации. Однако простое повышение хемотаксинов в каком-то участке ткани еще не означало бы притока туда новых клеток-эффекторов воспаления из крови. Нужно, чтобы наряду с формированием градиента этих веществ произошло повышение проницаемости микрососудов, из которых мононуклеарные лейкоциты могли бы поступать в зону локализации раздраженных макрофагов. Активированные макрофаги повышают проницаемость микрососудов, продуцируя LTC 4 , LTD 4 , фактор агрегации тромбоцитов, О 2 *- , коллагеназу и активатор плазминогена, разрыхляющие капилляросоединительнотканный барьер. Они либо разуплотняют базальную мембрану капилляров, либо сокращают эндотелиальные клетки и обнажают межэндотелиальные щели, либо действуют тем и другим способом. В результате облегчается выход лейкоцитов из крови и их передвижение в область высокой концентрации хемотаксинов, где они присоединяются к другим клеткам инфильтрата. Моноциты, придя в инфильтрат, выделяют
фибронектин. Благодаря этому они прочно связываются с матриксом соединительной ткани, прежде всего с коллагеновыми волокнами. Они как бы «становятся на якорь». В английской литературе такое обездвиживание клеток даже получило название «заякоривание» (от англ. anchor - якорь). Это очень важный момент, ибо «на ходу» фагоциты «не успевают решить тех проблем», которые возникают перед ними в очаге воспаления.
Фагоцитоз протекает наиболее эффективно лишь после того, как моноциты закрепляются и распластываются на структурах соединительной ткани. Таким образом, активные макрофаги не только запускают, но и детерминируют весь процесс хронического воспаления. Однако в реальных условиях макрофаги работают не в изоляции, а в комплексе с другими типами клеток, входящих в состав воспалительного инфильтрата (гранулемы) (рис. 10-16, см. цв. вклейку).
Лучше всего изучена функциональная кооперация между макрофагами и лимфоцитами:
1. Прежде всего эти клетки вступают в тесное взаимодействие в специфическом иммунном ответе, развивающемся при инфекционном воспалении. Макрофаги поглощают и частично разрушают микробные антигены в своих фаголизосомах. В модифицированном виде эти антигены вновь всплывают на цитоплазматическую мембрану макрофага, где они вступают в комплексную связь с особыми белками. Только в таком сочетании антиген распознается Т-лимфоцитами. Это взаимодействие макрофага и Т-лимфоцитов в очаге хронического воспаления можно назвать антигензависимым. Оно проявляет себя наиболее зримо при тех формах хронического воспаления, которые возникают при микробном заражении и протекают с явлениями гиперчувствительности замедленного типа (ГЗТ).
2. Наряду с этим макрофаги связаны с лимфоцитами не только через антигены, но и через свои секреты. Макрофаги выделяют вещества (например, IL-1), усиливающие рост лимфоцитов и повышающие их активность.
3. В то же время активно пролиферирующие лимфоциты выделяют лимфокины, которые активируют макрофаги и резко усиливают их эффекторные функции в очаге хронического воспаления:
Фактор торможения миграции макрофагов повышает адгезивность мембран макрофагов и дает им возможность прочно за-
цепиться за субстрат. Тот же фактор растормаживает секрецию макрофагами медиаторов воспаления;
Фактор, усиливающий агрегацию макрофагов, их пролиферацию, слияние макрофагов друг с другом с образованием гигантских многоядерных клеток, столь характерных для очагов хронического воспаления. В частности, таких клеток особенно много в туберкулезных инфильтратах в легких;
Пути запуска и развития острого и хронического воспаления принципиально отличаются:
1. При остром воспалении процесс запускается «от сосудов», тогда как при хроническом воспалении - с территории соединительной ткани, где находятся активные макрофаги.
2. Ведущей клеткой острого воспаления - эффектором - является нейтрофил, а хронического воспаления - активный макрофаг. Все другие клетки мезенхимы (тучные, лимфоциты, эозинофилы) тоже вносят свой вклад в реализацию процесса, модулируя реактивность нейтрофилов и макрофагов.
3. Острое воспаление заканчивается быстро, в считанные дни, если не возникнет осложнений в виде гнойной полости (абсцесса).
4. Хроническое воспаление не может закончиться быстро по следующим причинам:
Во-первых, макрофаги в очаге воспаления имеют длительный жизненный цикл, который исчисляется неделями, месяцами и даже годами. Вначале, на этапе зарождения, в гранулему приходят свежие моноциты с кровью, лимфоциты - с кровью и лимфой. Они еще не обладают достаточно высокой микробицидной активностью. Затем гранулема постепенно зреет, и в ней накапливаются дифференцированные макрофаги, активно поглощающие микробы. Наконец, на заключительном этапе, в застарелой гранулеме число активно фагоцитирующих клеток уменьшается, но зато возрастает процент относительно
Инертных в смысле фагоцитоза эпителиоидных и гигантских многоядерных клеток; во-вторых, любая гранулема - это не «застывшее» образование. В нее постоянно следуют потоком все новые и новые моноциты с кровью из костного мозга. Если в гранулеме много активированных макрофагов, приток будет превышать отток клеток из гранулемы. Дело в том, что раздраженные макрофаги усиленно вырабатывают особые гемопоэтины. Они стимулируют образование фагоцитов в костном мозгу. К их числу относится колониестимулирующий фактор Меткалфа. Поэтому пока раздраженные макрофаги «работают», баланс будет смещен в сторону притока клеток в инфильтрат, и его рассасывание невозможно. Если макрофаги выделяют много биоокислителей в среду своего обитания, они могут не только санировать очаг, но и повредить собственные клетки организма. При гиперпродукции Н 2 О 2 и О 2 *- эти факторы могут ускользать из фагосом в цитозоль макрофага и вести к его гибели. В целях предупреждения такой ситуации в макрофагах имеется система аварийной нейтрализации избытка биоокислителей. В нее входят ферменты: каталаза, глутатионпероксидаза и глутатионредуктаза. В частности, под действием глутатионредуктазы осуществляется нейтрализация перекиси водорода в реакции 2 ГН + Н 2 О 2 - Г-Г + 2Н 2 О, где Г - глутатион. Фермент супероксиддисмутаза нейтрализует супероксидный анион-радикал (О 2 *-) в реакции О 2 *- + О 2 *- + 2Н+ - Н 2 О 2 + О 2 . Когда системы антиоксидантной защиты не срабатывают, это ведет к персистенции воспаления.
Хроническое воспаление может продолжаться в течение всей жизни. Периодически оно обостряется, когда в очаг поступают нейтрофилы и свежие макрофаги с высокой провоспалительной активностью. В очаге мононуклеарной инфильтрации идет деструкция соединительной ткани. В ответ на это происходит разрастание волокнистых структур. В конечном счете может развиться склероз с частичным или полным выключением специализированных функций органа. Этому способствует накопление в гранулеме особого класса макрофагов, секретирующих фибробластстимулирующие факторы. С такой ситуацией врачам приходится встречаться при циррозах печени после вирусных гепатитов, хронических пневмониях, хронических гломерулонефритах и других хронически протекающих воспалительных заболеваниях.
10.6. ОБЩИЕ ПРОЯВЛЕНИЯ ВОСПАЛЕНИЯ
Общие проявления воспаления обусловлены влияниями из очага процесса, главным образом медиаторами воспаления.
Лихорадка является результатом воздействия эндогенных пирогенов, в частности IL-1, высвобождаемых активированными лейкоцитами очага воспаления и периферической крови, на центр терморегуляции.
Ускоренный обмен веществ является следствием усиленной секреции катаболических гормонов, в частности под влиянием монокинов, а также может быть вторичным по отношению к лихорадке. При этом в крови отмечается повышенное содержание глюкозы, глобулинов, остаточного азота.
Повышение СОЭ отражает абсолютное или относительное преобладание в плазме глобулинов над альбуминами, что происходит вследствие усиленной продукции гепатоцитами под воздействием монокинов «белков острой фазы» или же опережающей потери альбуминов при экссудации. Преобладание в плазме крупнодисперсных белков уменьшает отрицательный заряд эритроцитов и, соответственно, их взаимное отталкивание. Это повышает агглютинацию эритроцитов и, следовательно, их оседание.
Изменения иммунных свойств организма, проявляющиеся, в частности, повышенной устойчивостью к повторному воздействию флогогена, особенно инфекционного, обусловлены формированием в ходе воспаления клеточного и гуморального иммунитета. В этом большую роль играют лимфоидные клетки очага воспаления, например В-лимфоциты, превращающиеся в плазматические клетки - продуценты антител. Воспаление формирует иммунологическую реактивность организма («иммунитет через болезнь»).
Реакции системы крови при воспалении включают эмиграцию лейкоцитов в очаг и ряд изменений со стороны кроветворной ткани и периферической крови:
1) первоначальное преходящее снижение числа циркулирующих лейкоцитов в крови (транзиторная лейкопения), обусловленное их маргинацией и эмиграцией;
2) уменьшение количества зрелых и незрелых гранулоцитов и моноцитов в костном мозге в результате усиленного их вымывания в кровь, которое обеспечивается рефлекторным и, возможно, гуморальным ускорением кровотока в костном мозгу. Когда количество лейкоцитов в крови, поступивших из костного мозга,
превышает число эмигрировавших в очаг воспаления, развивается лейкоцитоз;
3) последующее восстановление числа незрелых и зрелых гранулоцитов и моноцитов в костном мозгу, свидетельствующее об активации кроветворения;
4) увеличение (против исходного) общего количества миелокариоцитов и клеток отдельных ростков кроветворения в костном мозгу, что указывает на развитие его гиперплазии. Все это обеспечивает развитие и продолжительное поддержание лейкоцитарной инфильтрации очага воспаления.
Активация кроветворения при воспалении обусловлена усиленной выработкой стимулированными лейкоцитами очага воспаления и крови гемопоэтических веществ - колониестимулирующих факторов, интерлейкинов и др., которые являются инициирующим звеном механизма самоподдержания лейкоцитарной инфильтрации очага воспаления. В саморегуляции инфильтрации существенное значение имеют лизосомальные ферменты, активные формы кислорода, эйкозаноиды.
Для острого воспаления характерен нейтрофильный лейкоцитоз со сдвигом влево (увеличение количества более молодых, палочкоядерных и юных нейтрофилов в результате вовлечения костно-мозгового резерва и активации кроветворения), а также моноцитоз, для хронического воспаления - моноцит арный лейкоцитоз и лимфоцитоз.
В возникновении общих явлений при воспалении имеют значение гуморальные и рефлекторные влияния из очага. Об этом свидетельствует, например, усиление рефлекса Гольца у лягушки (урежение сердечных сокращений при легком поколачивании по животу) при воспалении органов брюшной полости.
10.7. РОЛЬ РЕАКТИВНОСТИ В ВОСПАЛЕНИИ
Возникновение, развитие, течение и исход воспаления зависят от реактивности организма, которая, в свою очередь, прежде всего определяется функциональным состоянием высших регуляторных систем - нервной, эндокринной, иммунной.
Роль нервной системы. Участие нервной системы в патогенезе воспаления стало очевидным благодаря исследованиям И.И. Мечникова по сравнительной патологии воспаления, показавшим, что чем сложнее организм, чем более дифференцирована его нервная
система, тем ярче и полнее выражена воспалительная реакция. В дальнейшем была установлена существенная роль рефлекторных механизмов в возникновении и развитии воспаления. Предварительная анестезия ткани на месте приложения флогогена отодвигает и ослабляет воспалительную реакцию. Повреждение и перерыв афферентной части рефлекторной дуги в ходе воспаления ослабляют его дальнейшее развитие. Как указывалось, кратковременная ишемия и артериальная гиперемия в очаге воспаления имеют рефлекторную природу. О роли рефлекторных реакций свидетельствуют и данные клинических наблюдений о том, что воспаление может спонтанно развиваться на симметричных участках тела.
На значение высших отделов центральной нервной системы указывают задержка развития и ослабление воспаления на фоне наркоза или в период зимней спячки. Известна возможность воспроизведения условно-рефлекторного воспаления и лейкоцитоза на действие лишь условного раздражителя (почесывание или нагревание кожи живота) после выработки условного рефлекса с применением флогогена (внутрибрюшинное введение убитых стафилококков) как безусловного раздражителя.
О роли нижележащих отделов центральной нервной системы свидетельствуют данные о развитии обширных воспалительных процессов в коже и слизистых оболочках при хроническом повреждении таламической области. Считается, что это связано с нарушением нервной трофики тканей и, таким образом, уменьшением их устойчивости к вредным агентам.
Вегетативная нервная система оказывает значительное влияние на развитие воспаления. На десимпатизированном ухе кролика воспаление протекает более бурно, но и заканчивается быстрее. Напротив, раздражение симпатических нервов тормозит развитие воспаления. Ацетилхолин вызывает расширение сосудов и способствует развитию артериальной гиперемии, усиливает эмиграцию. Норадреналин обусловливает кратковременную ишемию, угнетает рост проницаемости сосудов и эмиграцию. Таким образом, парасимпатическая нервная система оказывает провоспалительное действие, а симпатическая - противовоспалительное.
Роль эндокринной системы. По отношению к воспалению гормоны можно разделить на про- и противовоспалительные. К первым относятся соматотропин, минералокортикоиды, тиреоидные гормоны, инсулин, ко вторым - кортикотропин, глюкокортикоиды, половые гормоны.
Роль иммунной системы. В иммунизированном организме в результате повышенной устойчивости к вредному агенту воспаление характеризуется уменьшенной интенсивностью и заканчивается быстрее. При сниженной иммунологической реактивности (иммунологическая недостаточность - наследственные и приобретенные иммунодефициты) наблюдается вялое затяжное, зачастую рецидивирующее и повторное воспаление. При повышенной иммунологической реактивности (аллергия) воспаление протекает более бурно, с преобладанием альтеративных явлений, вплоть до некроза.
Эффекторы нервной, эндокринной и иммунной систем - нейромедиаторы, нейропептиды, гормоны и лимфокины осуществляют как прямое регулирующее влияние на ткань, сосуды и кровь, гемо- и лимфопоэз, так и опосредованное другими медиаторами воспаления, высвобождение которых они модулируют через специфические рецепторы клеточных мембран и изменения концентраций циклических нуклеотидов в клетках.
В зависимости от реактивности организма воспаление может быть нормергическим, гиперергическим и гипергическим.
Нормергическое воспаление - обычно протекающее, воспаление в нормальном организме.
Гиперергическое воспаление - бурно протекающее, воспаление в сенсибилизированном организме. Классическими примерами являются феномен Артюса, реакция Пирке и др. Характеризуется преобладанием явлений альтерации.
Гипергическое воспаление - слабовыраженное или вялотекущее воспаление. Первое наблюдается при повышенной устойчивости к раздражителю, например в иммунизированном организме, и характеризуется уменьшенной интенсивностью и более быстрым завершением (положительная гипергия). Второе - при пониженной общей и иммунологической реактивности (иммунодефициты, голодание, опухоли, сахарный диабет и др.) и отличается слабой динамикой, затяжным течением, задержкой элиминации флогогена и поврежденной им ткани, разрешения реакции (отрицательная гипергия).
Значение реактивности в патогенезе воспаления позволило рассматривать его как общую реакцию организма на местное повреждение.
10.8. ВИДЫ ВОСПАЛЕНИЯ
По характеру сосудисто-тканевой реакции различают альтеративное, экссудативно-инфильтративное и пролиферативное воспаление.
Вид воспаления зависит от реактивности организма, локализации процесса, вида, силы и продолжительности действия флогогена.
Альтеративное воспаление характеризуется особой выраженностью явлений дистрофии (вплоть до некробиоза и некроза) и, таким образом, преобладанием их над экссудативно-инфильтративными и пролиферативными. Чаще всего альтеративное воспаление развивается в паренхиматозных органах и тканях (миокард, печень, почки, скелетные мышцы) при инфекциях и интоксикациях, поэтому называется еще паренхиматозным. При выраженных некробиотических изменениях альтеративное воспаление называется некротическим, например иммунокомплексное аллергическое воспаление (экспериментальный феномен Артюса и артюсоподобные реакции у человека).
Экссудативно-инфильтративное воспаление характеризуется преобладанием циркуляторных расстройств с экссудацией и эмиграцией над альтерацией и пролиферацией. В зависимости от характера экссудата оно может быть серозным, фибринозным, гнойным, гнилостным, геморрагическим и смешанным.
10.9. ТЕЧЕНИЕ ВОСПАЛЕНИЯ
Течение воспаления определяется реактивностью организма, видом, силой и продолжительностью действия флогогена. Различают острое, подострое и хроническое воспаление.
Острое воспаление характеризуется достаточно выраженной интенсивностью и сравнительно небольшой продолжительно-
Хроническое воспаление отличается слабой интенсивностью и большой продолжительностью - от нескольких месяцев до многих лет и десятилетий. По характеру сосудисто-тканевой реакции чаще всего является пролиферативным. Ведущую роль в его патогенезе играют моноциты-макрофаги и лимфоциты. Хроническое воспаление может быть первичным и вторичным (вследствие перехода острого воспаления в хроническое). Развитие первично хронического воспаления в первую очередь определяется свойствами флогогена (туберкулез, сифилис и т.д.), вторично хронического - особенностями реактивности организма.
Подострое воспаление занимает промежуточное положение. Его клиническая продолжительность - ориентировочно 3-6 недель.
Острое воспаление может приобретать затяжное течение, т.е. становиться подострым или вторично хроническим. Возможно волнообразное течение хронического воспаления, когда периоды стихания процесса чередуются с обострениями. При этом в период обострения усиливаются и становятся преобладающими экссудативные явления с инфильтрацией полиморфно-ядерными лейкоцитами и даже альтеративные. В дальнейшем на первый план снова выходят пролиферативные явления.
В целом принципиальных различий в общих механизмах острого и затяжного воспаления не имеется (воспаление - типовой процесс). Разница состоит в том, что при затяжном процессе изза измененной реактивности организма нарушается единство повреждения и защиты, и воспалительный процесс приобретает характер отрицательно гипоергического, пролиферативного.
10.10. ИСХОДЫ ВОСПАЛЕНИЯ
Исход воспаления зависит от его вида и течения, локализации и распространенности. Возможны следующие исходы воспаления:
1. Практически полное восстановление структуры и функции (возврат к нормальному состоянию - restitutio ad integrum). Наблюдается при незначительном повреждении, когда происходит восстановление специфических элементов ткани.
2. Образование рубца (возврат к нормальному состоянию с неполным восстановлением). Наблюдается при значительном дефекте на месте воспаления и замещении его соединительной тканью. Рубец может не отразиться на функциях или же привести к нарушениям функций в результате: а) деформации органа или ткани (например, рубцовые изменения клапанов сердца); б) смещения органов (например, легких в результате образования спаек в грудной полости в исходе плеврита).
3. Гибель органа и всего организма - при некротическом воспалении.
4. Гибель организма при определенной локализации воспаления - например, от удушья вследствие образования дифтеритических пленок на слизистой оболочке гортани. Угрожающей является локализация воспаления в жизненно важных органах.
5. Развитие осложнений воспалительного процесса: а) поступление экссудата в полости тела с развитием, например, перитонита при воспалительных процессах в органах брюшной полости; б) образование гноя с развитием абсцесса, флегмоны, эмпиемы, пиемии; в) склероз или цирроз органа в результате диффузного разрастания соединительной ткани при пролиферативном воспалении.
6. Переход острого воспаления в хроническое.
В клиническом исходе воспаления большое значение имеет основное заболевание, если возникновение очага (очагов) воспаления связано с ним.
10.11. ЗНАЧЕНИЕ ВОСПАЛЕНИЯ ДЛЯ ОРГАНИЗМА
В общебиологическом отношении воспаление является важной защитно-приспособительной реакцией, сформировавшейся в процессе эволюции как способ сохранения целого организма ценой повреждения его части. Это способ аварийной защиты организма, применяемый в том случае, когда организм не смог справиться с вредным агентом путем его физиологической элиминации и возникло повреждение. Воспаление является своеобразным биологическим и механическим барьером, при помощи которого обеспечиваются локализация и элиминация флогогена и (или) поврежденной им ткани и ее восстановление или же возмещение тканевого дефекта. Свойства биологического барьера достигаются
путем адгезии, умерщвления и лизиса бактерий, деградации поврежденной ткани. Функция механического барьера осуществляется за счет выпадения фибрина, свертывания лимфы в очаге, блокады кровеносных и лимфатических сосудов, размножения соединительнотканных клеток на границе поврежденной и нормальной ткани (демаркация). Все это препятствует всасыванию и распространению микробов, токсинов, продуктов нарушенного обмена и распада.
Воспалительный очаг выполняет не только барьерную, но и дренажную функцию: с экссудатом из крови в очаг выходят продукты нарушенного обмена, токсины. Как уже указывалось, воспаление влияет на формирование иммунитета.
Вместе с тем целесообразность воспаления как защитноприспособительной реакции является безусловной лишь в эволюционно-биологическом отношении. И как местный процесс при определенной локализации и распространенности воспаление может сопровождаться общими патологическими проявлениями (интоксикация, изменение реактивности и др.) и даже при обычном течении наносить вред организму. Кроме того, в связи с измененной реактивностью на практике часто встречаются необычные по течению формы и осложнения воспаления.
Фагоцитоз.
Фагоцитоз - заключается в поглощении и переваривании бакте-рий, продуктов повреждения и распада клеток. Фагоцитарную актив-ность проявляют прежде всего нейтрофильные лейкоциты и макрофа-ги. Выделяют 4 стадии фагоцитоза: 1-ая стадия - приближение фа-гоцита к инородному предмету, 2-ая стадия - прилипание фагоцита к объекту. Ему предшествует покрытие фагоцита иммуноглобулинами М и J и фрагментами комплемента (опсонизация). 3-я стадия - пог-лощение объекта путем инвагинации фагоцита и образование вакуоли - фагосомы. Перед образованием фагосомы в фагоците активиру-ется оксидаза, что обеспечивает синтез перекиси водорода. Пере-кись водорода под влиянием пероксидаз образует активные молекулы кислорода, который путем перекисного окисления разрушает мембра-ны клеток. Разрущению мембран способствует также лизосомальные ферменты и бактерицидные белки, выделяющиеся при дегрануляции лейкоцитов. Это происходит в 4-ую стадию - внутриклеточного рас-щепления и переваривания фагоцитированных микробов и остатков поврежденных клеток. При этом гибнут и сами фагоциты. Продукты их разрушения стимулируют процессы пролиферации.
Пролиферация.
Элементы пролиферации имеют место с самого начала воспале-ния, но она становится преобладающей по мере стихания экссуда-ции. На стадии пролиферации постепенно прекращаются разрушительные процессы и сменяются созидательными. Идёт активное погашение воспалительного процесса. В этом отношении активную роль играет белок α 2 -макроглобулин. Он широкого спектра действия, в частности ингибирует кинины. В инактивации клеток воспаления кроме местных факторов большое значение имеют общие факторы, например эндокринные. Кортизол тормозит синтез вазоактивных веществ, вызывает эозинофилопению, лимфопению и базофилопению. Затем идёт замещение дефекта здоровой тканью. Это осуществляется путём размножения оставшихся живых клеток (клетки резиденты), а также новых клеток из соседних зон (клетки эмигранты). Размножаются стволовые клетки сосудистой ткани-полибласты и лимфоидные клетки, возникают новые капилляры. Образуется грануляционная ткань. Стимуляторами роста являются: тромбоцитозный фактор роста фибробластов (тромбоциты); подобные факторы образуются в лимфоцитах и моноцитах. В некоторых органах образуются вещества стимулирующие пролиферацию. Например, в гипофизе фактор роста фибробластов, в печени соматомедин, который тоже стимулирует пролиферацию. Имеются и ингибиторы пролиферации - кейлоны, гормон кортизон.
В конце воспаления при его завершении решающюю роль играют две клетки фибробласт и эндотелиоцит. Идёт заселение зоны воспаления фибробластами и неоангиогенез. Фибробласты синтезируют коллаген. Эндотелиоциты способствуют образованию сосудов.
При небольшом повреждении тканей, при ранах, заживающих первичным натяжением, воспалительный процесс заканчивается полным восстановлением. При гибели большого количества клеток дефект замещается соединительной тканью с образованием рубца. Может быть избыточное образование рубцовой ткани.
Патогенез клинических признаков воспаления.
Покраснение обусловлено развитием артериальной гиперемии, увеличением притока крови с повышенным содержанием кислорода, увеличением количества функционирующих капилляров.
"Припухлость" объясняется артериальной и венозной гипереми-ей, экссудацией, эмиграцией лейкоцитов.
Жар обусловлен усилением обмена веществ на ранних стадиях воспаления, притоком крови с более высокой температурой, разоб-щения процессов биологического окисления и фосфорилирования.
Лихорадка развивается под влиянием поступающих из очага вос-паления пирогенных факторов, таких как липополисахариды, катион-ные белки, интерлейкин-1 и др.
Боль вызывается раздражением рецепторов в очаге воспаления медиаторами, особенно серотонином, кининами, простагландинами, сдвигом реакции среды в кислую сторону, возникновением дизионии, повышением осмотического давления и механическим растяжением или сдавлением тканей.
Нарушение функции воспаленного органа связано с расстройством его нейроэндокринной регуляции, развитием боли, структурными на-рушениями.
Лейкоцитоз обусловлен активацией лейкопоэза и перераспреде-лением лейкоцитов в кровеносном русле. К числу основных причин его развития относятся: стимуляция симпато-адреналовой системы, воздействие некоторых бактериальных токсинов, продуктов тканево-го распада, а также ряда медиаторов воспаления (интерлейкин-1).
Изменение белкового "профиля" крови выражается в том, что при остром процессе в крови накапливаются так называемые "белки острой фазы" воспаления - С-реактивный белок и др. Для хроничес-кого течения воспаления характерно увеличение в крови содержания альфа- и особенно гамма-глобулинов.
Увеличение СОЭ происходит из-за снижения отрицательного заряда эритроцитов, агломерации эритро-цитов, изменения белкового спектра крови, в частности повышения содержания фибриногена, подъема температуры.
Иммунитет и воспаление.
Изменения в иммунной системе при воспалении выражаются в на-растании титра антител, появлении сенсибилизированных лимфоцитов в крови. В становлении иммунитета при воспалении следует отме-тить такие неспецифические факторы как фагоцитоз и комплемент. Место фагоцитоза, осуществляемого ПЯЛ и моноцитарным фагоцитом (макрофагом), в системе иммунитета определяется тем, что несмот-ря на неспецифичность самого акта фагоцитоза, макрофаги принима-ют участие в переработке их в иммуногенную форму. Система комп-лемента участвует в специфических реакциях, присоединяя свои компоненты к молекулам антител, что обеспечивает лизис антиген-ных субстанций, против которых выработаны антитела, она активи-рует иммунные комплексы. Таким образом, включение иммунного от-вета при воспалении обеспечивается двумя клеточными системами неспецифической защиты - системой ПЯЛ и макрофагов, а также плазм. системой - системой комплемента.
Взаимосвязь местных и общих изменений при воспалении.
В очаге воспаления возникают сложные процессы, которые не могут протекать автономно. Они являются сигналом для включения в воспалительную реакцию различных систем организма. Материальный субстрат этих сигналов - накопление и циркуляция в крови БАВ, компонентов комплемента, интерферона и др. Из факторов, обуслов-ливающих взаимосвязь местных и общих изменений при воспалении, большое значение имеют так называемые реактанты острой фазы. Эти вещества неспецифичны для воспаления. Они появляются через 4-6 часов после разноообразных повреждений, в том числе после пов-реждения при воспалении. Наибольшее значение из них имеют: С-ре-активный белок, интерлейкин-1, Т-кининоген, трансферин, апофер-ритин и др. Большинство реактантов острой фазы синтезируются макрофагами, гепатоцитами. Интерлейкин-1 влияет на функцию кле-ток воспалительного очага, в том числе лимфоцитов, активирует ПЯЛ, стимулирует синтез простагландинов и простациклинов в эндо-телиоцитах, способствует гемостатической реакции в очаге повреж-дения. Концентрация С-реактивного белка увеличивается при воспа-лении в 100-1000 раз. Этот белок активирует цитолитическую ак-тивность Т-лимфоцитов киллеров, ингибирует агрегацию тромбоци-тов.
Т-кининоген является предшественником кининов и ингибитором протеиназ. Воспаление индуцирует синтез в печени апоферритина, который стимулирует выработку ПЯЛ. Реактанты острой фазы опреде-ляют неспецифический ответ организма, создающий условия для раз-вития местной воспалительной реакции. Вместе с тем они стимули-руют включение в процесс других систем организма, способствуя взаимодействию местного и общего при воспалении.
Величина, распространенность очага воспаления, а также осо-бенности повреждающего агента оказывают выраженное влияние на взваимосвязь местных и общих изменений при воспалении. Начиная с некоторых критических размеров этого очага, развитие воспаления сочетается с рядом нарушений гомеостаза, вызванных как продукта-ми повреждения тканей и медиаторами, так и стрессом (болевым, эмоциональным).
Воспаление и реактивность организма.
Возникновение, развитие, течение и исход воспаления зависят от реактивности организма. Реактивность зависит прежде всего от состояния высших регуляторных систем: нервной, эндокринной, им-мунной.
Применение анестезирующих веществ, способных выключать ре-цепторные образования, заметно ослабляет течение воспалительного процесса. Создание в ЦНС стойкого очага возбуждения резко ослаб-ляет течение и интенсивность воспаления. Глубокий наркоз заметно ослабляет образование инфильтратов. Значительное влияние на раз-витие воспаления оказывает эндокринная система. По отношению к воспалению гормоны можно разделить на про- и противовоспалитель-ные. К первым относятся соматотропин, минералокортикоиды,тире-оидные гормоны, инсулин, ко вторым - кортикотропин, глюкокорти-коиды. Противовоспалительные гормоны: 1. Умень-шают проницаемость сосудов. 2. Стабилизируют лизосомальные мемб-раны. 3. Усиливают действие катехоламинов. 4. Ослабляют синтез и
действие БАВ (гистамина, серотонина). 5. Уменьшают эмиграцию
лейкоцитов, ослабляют фагоцитоз.
Развитие воспаления существенно зависит от возраста. У ново-рожденных детей экссудативный компонент воспаления почти не вы-ражен, так как сосудистые реакции несовершенны. Несовершенны они потому, что недостаточно сформированы как периферические нервные окончания симпатических и блуждающего нервов, так и их центры. Симпатическая нервная система сохраняет свое доминирующее влия-ние на сосудистый тонус после рождения, приводя к спазму сосу-дов. Воспаление в период новорожденности принимает альтеративный характер. Пролиферативный компонент воспаления запаздывает. Чаще всего в этом возрасте возникает воспаление кожи, так как эпидер-мальный слой очень слабо развит.
Кожа и слизистые оболочки детей грудного возраста не способ-ны обеспечить антимикробную защиту. Фагоцитарная активность лей-коцитов очень низкая. Причем фагоциты в состоянии поглотить мик-робы, но не могут их лизировать, т.к. активность гидролитических ферментов низка (не завершенный фагоцитоз). Фагосомы таких лей-коцитов превращаются в "хранилища" жизнеспособных микробов, вы-зывая генерализацию инфекции.
У детей, начиная с 5-месячного возраста чаще возникают вос-паления тонкого и толстого кишечника (энтериты, колиты).
В старческом возрасте чаще возникают воспалительные процессы ЖКТ, т.к. снижается кислотность желудочного сока, который явля-ется защитным фактором при попадании в желудок бактерий. В ре-зультате угнетения деятельности ресничек эпителия дыхательных путей часто возникают пневмонии.
Виды воспаления.
В зависимости от характера доминирующего местного процесса (альтерация, экссудация, пролиферация) различают 3 вида воспале-ния. При альтеративном воспалении преобладают повреждение, дист-рофия, некроз. Оно наблюдается чаще всего в паренхиматозных ор-ганах при инфекционных заболеваниях, протекающих с выраженной интоксикацией (творожистый распад легких при туберкулезе).
Экссудативное воспаление характеризуется выраженным наруше-нием кровообращения с явлениями экссудации и эмиграции лейкоци-
тов. По характеру экссудата различают серозное, гнойное, гемор-рагическое, фибринозное, гнилостное, смешанное воспаление.
Пролиферативное или продуктивное воспаление характеризуется тем, что при нем доминирует размножение клеток гематогенного и гистиогенного происхождения. В воспаленной зоне возникают кле-точные инфильтраты. При воспалении клетки претерпевают трансфор-мацию и дифференцировку, в результате чего образуется молодая соединительная ткань. Она проходит все стадии созревания, в ре-зультате чего орган или часть его пронизывается соединительно-тканными тяжами.
По характеру течения воспаление может быть острым, подострым и хроническим. Острое воспаление длится от нескольких дней до нескольких недель. Для него характерны: выраженная интенсивность воспалительной реакции и преобладание либо альтеративных, либо сосудисто-экссудативных явлений. Роль основных эффекторов в его патогенезе играют ПЯЛ. Хроническое воспаление - это вялый, дли-тельно текущий процесс. В нем преобладают дистрофические и про-лиферативные явления. Основная роль при хроническом воспалении принадлежит макрофагам и лимфоцитам. Подострое воспаление зани-мает промежуточное положение.
Исходы воспаления.
1. Полное восстановление поврежденного органа. Это имеет мес-то в том случае, если ни действие флогогенного фактора, ни раз-витие воспалительного процесса не приводит к гибели существенно-го количества ткани. 2. Если в результате действия флогогенного фактора или в результате вторичной альтерации происходит потеря существенного количества ткани, то дефект ткани ликвидируется путем формирования рубца или диффузного прорастания соединитель-ной ткани. Наличие рубца иногда не вызывает существенного нару-шения функции органа, но в некоторых случаях может привести к серъезным последствиям. Например, рубцевание в стенке пищевода (после его ожога) может вызвать сужение пищевода, что вызовет затруднение питания организма. 3. Воспаление может быть губи-тельным для организма. Это бывает обусловлено тем, что в случае обширной альтерации может погибнуть ткань жизненно важного орга-на, или в результате экссудации сдавливаются такие органы как
мозг, сердце, легкие, что может настолько нарушить их функцию,
что это станет несовместимо с жизнью.
Хроническое воспаление (Адо 1994г. стр. 171-173).
Хроническое воспаление начинается со скопления большого чис-
ла раздраженных (активированных) макрофагов в одном месте. Стой-кое раздражение макрофагов вызывается разными способами: 1. Де-фект макрофагов. В этом случае макрофаги поглощают чужеродный фактор, но не могут его уничтожить. Возникает незавершенный фа-гоцитоз. Поэтому макрофаги постоянно находятсяя в активном сос-тоянии. 2. Ряд микроорганизмов поглощается макрофагами, но в си-лу своих особенностей, в фагосомах не погибает и получает воз-можность долго жить и размножаться. К таким формам относятся возбудители туберкулеза, проказы, токсоплазмоза и многих других инфекционных заболеваний. 3. Макрофаги не могут поглотить чуже-родный агент. Они окружают его, возбуждаются и начинают привле-кать новые макрофаги, формируя грануляционную ткань.
Привлечение новых макрофагов, моноцитов, лимфоцитов в зону локализации активированных макрофагов связано с веществами, вы-зывающими положительный хемотаксис. Эти вещества выделяются са-мими раздраженными макрофагами. К ним относятся лейкотриены С и Д, простагландины группы Е 2 . Притоку макрофагов в очаг воспале-ния способствует повышение проницаемости сосудов. Повышают про-ницаемость микрососудов лейкотриены, ФАТ, коллагеназа. Эти ве-щества либо разуплотняют базальную мембрану капилляров, либо сокращают эндотелиальные клетки и расширяют межэндотелиальные щели. Таким образом, в очаге хронического воспаления скапливают-ся мононуклеарные клетки - моноциты, макрофаги, лимфоциты. Скоп-ление таких клеток получило название "гранулемы".
Активированные макрофаги секретируют биоокислители, которые запускают перекисное окисление липидов в мембранах клеток зоны инфильтрации. Макрофаги секретируют также лизосомальные фермен-ты. Моноциты секретируют свои биологически активные вещества, в частности фибронектин. Благодаря фибронектину моноциты прочно связываются с гранулемой, обездвиживаются.
Лимфоциты выделяют различные лимфокины, в том числе и такие, которые активируют макрофаги и резко усиливают их эффекторные
функции в очаге хронического воспаления. Макрофаги,в свою оче-редь, выделяют интерлейкин-1, усиливающие рост лимфоцитов и по-вышающие их активность.
Таким образом, хроническое воспаление существенно отличается от острого. Острое воспаление начинается с альтерации и наруше-ния микроциркуляции, хроническое с активации макрофагов. Ведущей клеткой острого воспаления является нейтрофил, хронического - активный макрофаг. Острое воспаление заканчивается быстро, хро-ническое течет длительно, иногда в течении всей жизни. Хроничес-кое воспаление течет длительно потому, что макрофаги в очаге воспаления имеют длительный жизненный цикл. Им нужно много вре-мени для перехода в раздраженное состояние, кроме того, в грану-лему постоянно поступают новые клетки, которые также медленно переходят в активное состояние. Обострение при хроническом вос-палении связано с притоком в очаг воспаления свежих макрофагов с высокой провоспалительной активностью. Хроническое воспаление часто завершается склерозом с частичным или полным выключением функций органа.
Биологическое значение воспаления.
Как и всякий патологический процесс, воспаление по своей сущности процесс противоречивый. В нем сочетаются и мобилизация защитных сил организма, и явления повреждения. Организм защища-ется от воздействия чуждых и вредных ему факторов путем отграни-чения воспалительного очага от всего организма. Такое действие предотвращает распространение и генерализацию воспалительного процесса, сосредотачивая борьбу с вредным агентом в одном месте. Воспалительный очаг фиксирует все, что находится в нем, поглоща-ет токсичные вещества, циркулирующие в крови. Это объясняется тем, что вокруг очага формируется своеобразный барьер с односто-ронней проницаемостью. Вначале он создается за счет закупорки отодящих сосудов и за счет блокады внесосудистого тканевого транспорта. Далее этот барьер окончательно оформляется за счет разм. соединительно-тканных клеток между нормальной и пораженной тканью. В очаге воспаления создаются неблагоприятные условия для жизни микроорганизмов. В этом отношении главную роль играют фагоциты и специфические антитела, ферменты. Положительная сторона воспаления особенно проявляется в стадии пролиферации и регене-рации. Воспаление - один из способов формирования иммунитета. Вторая противоположная сторона воспаления всегда несет в себе элементы разрушения. Борьба с повреждающим агентом в зоне воспа-ления неизбежно сочетается с гибелью собственных клеток. В неко-торых случаях начинает преобладать альтерация, что ведет к ги-бели ткани или органа. Экссудация может привести к нарушению пи-тания ткани, ферментативному расплавлению ее, гипоксии и общей интоксикации. Резорбция из воспалительного очага различных ток-сич. веществ вызывает явления интоксикации. Перенос лейкоцитами фагоцитированных бактерий при незавершенном фагоцитозе может вызвать развитие очагов воспаления в других участках тела.
Принципы патогенетической терапии при воспалении:
I. Воздействие на повреждающий фактор с целью предупреждения или прекращения первичной альтерации (антибиотики, иммунные сы-
воротки и др.)
II Провоспалительная терапия.
1. Местное стимулирующее действие на очаг воспаления (го-рячие ванны, грелки и др.)
2. Общее воздействие на организм (вакцинотерапия, лакто-терапия, аутогемотерапия).
III. Противоспалительная терапия:
1. Применение препаратов, препятствующих образованию и высвобождению медиаторов проницаемости:
а) блокада выброса лизосомальных ферментов, стабилизация лизосомальных мембран.
б) Подавление гликолиза, как источника энергии для осво-бождения факторов проницаемости.
2. Применение антагонистов и ингибиторов БАВ.
а) Ингибиторы кининов.
б) Ингибиторы простагландинов.
в) Антипротеазные препараты.
3. Местное применение сосудосуживающих препаратов.
4. Местные воздействия на многие звенья воспалительного процесса (холод).
5. Общее воздействие на организм (рациональное питание, здоровый образ жизни).
Что такое воспаление?
 Каждый живой организм снабжен системой защиты от различных напастей. По сути даже слеза - это тоже защитная реакция организма на инородное тело, в том числе и слезы «душевные». Это все, конечно, не диковинка и о защитных функциях организма известно всем. А есть такая защитная функция, как воспаление, которое чаще всего относится к причинам заболевания. Это толкование не совсем верно, поскольку воспаление возникает не просто так, а по какой-то причине.
Каждый живой организм снабжен системой защиты от различных напастей. По сути даже слеза - это тоже защитная реакция организма на инородное тело, в том числе и слезы «душевные». Это все, конечно, не диковинка и о защитных функциях организма известно всем. А есть такая защитная функция, как воспаление, которое чаще всего относится к причинам заболевания. Это толкование не совсем верно, поскольку воспаление возникает не просто так, а по какой-то причине. Следовательно, воспаление - это реакция организма на повреждение клеток, тканей, костей, а также, это реакция на сбои работы в каких-либо органах. Первым признаком воспалительного процесса в организме, является повышение температуры тела. Конечно же, высокая температура может возникнуть и по причине повышения сахара в крови, поэтому, что бы диагноз был более точный, необходимо сдать общий анализ крови, который покажет даже минимальный воспалительный процесс.
Любое воспаление - это физиологическая реакция, которая должна спровоцировать вас к немедленным действиям. Основными причинами воспалений, являются следующие:
Физические - возникают в результате травм, радиоактивного излучения, поражения током, термические поражения.
. Химические - ожоги кислотами и щелочами, минеральными и органическими веществами.
. Биологические - вирусные заболевания, бактерии, грибки и подобные поражения кожных и слизистых оболочек.
Впервые описание воспалительных процессов были обнаружены еще в древние времена. Одним из первых, кто описал внешние признаки воспаления, был древнеримский писатель Авл Корнелий. Его список симптомов воспаления выглядел так: rubor (покраснение), tumor (опухоль, припухлость), calor (жар, температура), dolor (боль). Позже этот список дополнил Клавдий Гален такой приметой, как нарушение функций - functio laesa. Эта запись датируется 130 - 200 годом нашей эры.
Медицинская трактовка воспалительного процесса выглядит таким образом: покраснение, отечность, повышений температуры тела, болевые ощущения, сбои в работе некоторых органов, упадок сил. Каждый из этих симптомов связан между собой. Пораженная область провоцирует расширение сосудов, в результате чего усиливается кровоснабжение. После этого кровоток замедляется и возникает покраснение, повышается температура. Далее, возникает проницаемость сосудов и капилляров, что ведет к выходу лейкоцитов из плазмы крови в область повреждения - местный отек, который оказывает давление на нервные клетки и возникает боль. Таким образом, происходит нарушение функций в организме. А это становится хорошим плацдармом для образования свободных радикалов.
Еще воспаления дифференцируются по типам и формам. Воспаление бывает острым, подострым и хроническим. Разница между ними состоит в скорости развития и длительности процесса. Так, первое длится до 2-х месяцев, второе - до 6-ти месяцев, последнее - длиться более шести месяцев. Всякий воспалительный процесс проходит несколько стадий. А именно: альтерация - травмирование клеток, тканей. Экссудация - выхождение клеток крови и жидкого вещества из сосудов к тканям. Пролиферация - размножение клеток, что вызывает разрастание ткани и последующее рубцевание.
Исходя из этого, различают такие виды воспалений:
. Альтернативное - воспаление, которое характеризуется дистрофическими и некротическими изменениями клеток и ткани в таких органах, как сердце, печень, почки и ткани головного мозга. В этом случае процесс экссудации и пролиферации проявляется слабо. Таким способом воспаление происходит при дизентерии, брюшном тифе и прочие подобные заболевания. . Экссудативное воспаление - воспаление, при котором реакции сосудов микроциркуляторного русла с образованием экссудата доминируют над альтернативными и пролиферативными компонентами. Экссудат - это белесая жидкость, которая состоит из белков и клеток гематогенной и гистогенной природы. Образуется она в месте воспаления. В связи с этим, данная жидкость может содержать бактерии, которые провоцируют инфекционное заболевание. Поэтому экссудативную жидкость считаю биологическим материалом для лабораторных исследований. Процесс экссудации - проникновение жидкости в ткани органов, является физиологическим и выполняет защитные функции.
. Экссудативное воспаление - воспаление, при котором реакции сосудов микроциркуляторного русла с образованием экссудата доминируют над альтернативными и пролиферативными компонентами. Экссудат - это белесая жидкость, которая состоит из белков и клеток гематогенной и гистогенной природы. Образуется она в месте воспаления. В связи с этим, данная жидкость может содержать бактерии, которые провоцируют инфекционное заболевание. Поэтому экссудативную жидкость считаю биологическим материалом для лабораторных исследований. Процесс экссудации - проникновение жидкости в ткани органов, является физиологическим и выполняет защитные функции.
. Пролиферация - это финишная , которая состоит в образовании новых клеток и восстановлении тканей. В процессе пролиферации образуются клетки нескольких типов - комбиальные клетки соединительной ткани, В и Т-лимфоциты, моноциты и клетки местной ткани, где был очаг поражения и источник воспаления. Все это дает начало образованию макрофагов, которые являются источниками «рождения» эпителия. В процессе восстановления кожных покровов после воспалительного процесса, могут возникнуть неровности, шероховатости, значительные рубцы. Причиной такого финиша может быть разрастание волокнистой ткани. Предпосылками к этому являются фибробласты - клетки продуцирующие коллаген в избыточном количестве. Пролиферативное воспаление подразделяется на такие виды: гранулематозное, межуточное и воспаление, в процессе которого образуются полипы и остроконечные кондиломы.
Любое воспаление поддается регулированию. Наиболее распространенные способы «приструнить» воспаление, являются гормональные, иммунные и нервные факторы. Среди гормонов есть такие, которые усиливают воспаление, а есть такие, которые гасят его. К «усилителям» воспаления относятся минералокортикоиды, гипофизарный тиреостимулин, альдостерон, соматотропный гормон гипофиза. К «Тормозителям» относятся глюкокортикоиды и адренокортикотропный гормон гипофиза. Терапевтическими свойствами этих гормонов уже давно успешно восстанавливают различные воспаления. С их помощью блокируются сосудистые и клеточные феномены воспаления. Они являются ингибиторами процесса подвижности лейкоцитов, усиливают образование лимфоцитов.
В вопросе различных воспалительных процессах, огромную роль играет иммунитет. То, насколько он силен, зависит длительность воспалительного процесса, а также возникновение осложнений, связанных с воспалением. Наиболее сильно, воспаление протекает в условии антигенной стимуляции. Это говорит об иммунном или аллергическом воспалении.
Независимо от того как долго и в какой форме протекает воспаление, оно нуждается в обязательном диагностировании и прогнозировании. И чем раньше будет поставлен правильный диагноз, тем эффективней будет лечение. Так, например, острое воспаление возникает для нейтрализации агента, который спровоцировал воспалительную реакцию.
Восстановление поврежденных тканей происходит несколькими разными способами. Если острое воспаление не имеет осложнений, то поврежденная ткань восстанавливается путем разжижения и выведения экссудата и клеточного детрита с помощью макрофагов и лимфатической системы. Ежели воспаление сопровождается некрозом тканей, то реабилитация повреждения происходит путем образования рубца. В случаях, когда острое воспаление не нейтрализуется иммунной системой, возникает хроническое воспаление. В этом случае восстановление, чаще всего, завершается рубцеванием ткани.
Современная медицина двояко относится к воспалениям. С одной стороны это физиологическая реакция, указывающая на неполадки и сбои в работе организма либо сигнализирует о наличии местной травме. Исходя из этого, воспалительный процесс помогает нейтрализовать дальнейшее развитие инфекции. С другой стороны, воспаление - это заболевание, которое нарушает работу всего организма, заставляет его работать в аварийном режиме. При слабом иммунитете, незначительное воспаление может спровоцировать токсикацию организма и возникновение сложных заболеваний затяжного характера. Кроме этого, воспаление может быть смертельным.


