23.09.2018
Основные свойства гидроксид железа 3. Восстановительные свойства
Так как Fe2+ легко окисляются до Fe+3:
Fe+2 – 1e = Fe+3
Так, свежеполученный зеленоватый осадок Fe(OH)2 на воздухе очень быстро изменяет окраску – буреет. Изменение окраски объясняется окислением Fe(OH)2 в Fe(OH)3 кислородом воздуха:
4Fe+2(OH)2 + O2 + 2H2O = 4Fe+3(OH)3.
Восстановительные свойства проявляют и соли двухвалентного железа, особенно при действии окислителей в кислотной среде. Например, сульфат железа (II) восстанавливает перманганат калия в сернокислотной среде до сульфата марганца (II):
Существует множество других способов остановить или замедлить ржавчину. Один из способов защиты поверхности железа состоит в том, чтобы покрыть его металлом, который не корродирует, например, хром. Они были покрыты слоем хрома для защиты поверхности железа от контакта с воздухом.

Спросите учащихся, почему они считают, что это особенно важно для кранов в ванных комнатах и бассейнах, которые должны быть защищены от ржавчины. Это потому, что они во влажной, влажной среде, а вода делает железо более подверженным ржавчине. Цинк также реагирует с кислородом с образованием оксида цинка.
10Fe+2SO4 + 2KMn+7O4 + 8H2SO4 = 5Fe+32(SO4)3 + 2Mn+2SO4 + K2SO4 + 8H2O.
Качественная реакция на катион железа (II).
Реактивом для определения катиона железа Fe2+ является гексациано (III) феррат калия (красная кровяная соль) K3:
3FeSO4 + 2K3 = Fe32¯ + 3K2SO4.
При взаимодействии ионов 3- с катионами железа Fe2+ образуется темно-синий осадок – турнбулева синь:
3Fe2+ +23- = Fe32¯
Цинк находится в другой группе, чтобы гладить на Периодической таблице. Это говорит о том, что он не реагирует так же, как железо с кислородом. Оксид цинка не является пористым оксидом, но образует плотный защитный слой, который не может быть проникнут кислородом или водой. Железо может быть покрыто тонким слоем цинка в процессе, называемом гальванизацией. Слой цинка быстро реагирует с кислородом, превращаясь в оксид цинка. Этот слой защищает цинк под ним от дальнейшего окисления. Он также защищает железо под цинком от контакта с кислородом.
Соединения железа (III)
Оксид железа (III) Fe2O3 – порошок бурого цвета, не растворяется в воде. Оксид железа (III) получают:
А) разложением гидроксида железа (III):
2Fe(OH)3 = Fe2O3 + 3H2O
Б) окислением пирита (FeS2):
4Fe+2S2-1 + 11O20 = 2Fe2+3O3 + 8S+4O2-2.
Fe+2 – 1e ® Fe+3
На следующей диаграмме показан сегмент оцинкованной стали с царапиной в защитном покрытии. Как вы думаете, что произойдет с сталью, которая подвергается воздействию воздуха царапинами в покрытии? Открытая сталь будет ржаветь с течением времени. 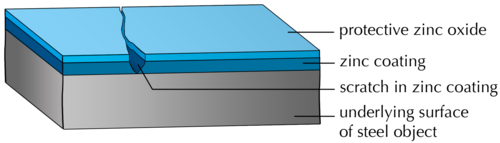
Железо, оцинкованное, используется для различных целей. Скорее всего, вы видели, что он используется в качестве оцинкованных кровельных панелей или других оцинкованных строительных материалов, таких как винты, гвозди, трубы или полы.
2S-1 – 10e ® 2S+4
O20 + 4e ® 2O-2 11e
Оксид железа (III) проявляет амфотерные свойства:
А) взаимодействует с твердыми щелочами NaOH и KOH и с карбонатами натрия и калия при высокой температуре:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O,
Fe2O3 + 2OH- = 2FeO2- + H2O,
Fe2O3 + Na2CO3 = 2NaFeO2 + CO2.
Феррит натрия
Гидроксид железа (III) получают из солей железа (III) при взаимодействии их со щелочами:
Формирование ржавчины и способы ее предотвращения. 



В этой главе мы узнали, как образуются оксиды металлов. Мы видели две демонстрации реакций, в которых металлы образовывались как продукты. Наконец, мы узнали о металлическом оксиде из нашего повседневного опыта, а также о способах предотвращения образования ржавчины, особенно тех, которые используются в зданиях и промышленности.
FeCl3 + 3NaOH = Fe(OH)3¯ + 3NaCl,
Fe3+ + 3OH- = Fe(OH)3¯.
Гидроксид железа (III) является более слабым основанием, чем Fe(OH)2, и проявляет амфотерные свойства (с преобладанием основных). При взаимодействии с разбавленными кислотами Fe(OH)3 легко образует соответствующие соли:
Fe(OH)3 + 3HCl « FeCl3 + H2O
2Fe(OH)3 + 3H2SO4 « Fe2(SO4)3 + 6H2O
Fe(OH)3 + 3H+ « Fe3+ + 3H2O
Реакции с концентрированными растворами щелочей протекают лишь при длительном нагревании. При этом получаются устойчивые гидрокомплексы с координационным числом 4 или 6:
Вырезанные кусочки яблока становятся коричневыми, так как соединения железа в яблочной мякоти реагируют с кислородом в воздухе! Реакции помогает фермент в яблоке, поэтому капающий лимонный сок на кусочки разрушает фермент и предотвращает его превращение в коричневый цвет.
Почему яблоки становятся коричневыми?
- Когда металл реагирует с кислородом, образуется оксид металла.
- Общее уравнение для этой реакции: металлический кислород → оксид металла.
- Некоторые металлы будут реагировать с кислородом при сжигании.
- Эти реакции называются реакциями горения.
Fe(OH)3 + NaOH = Na,
Fe(OH)3 + OH- = -,
Fe(OH)3 + 3NaOH = Na3,
Fe(OH)3 + 3OH- = 3-.
Соединения со степенью окисления железа +3 проявляют окислительные свойства, так как под действием восстановителей Fe+3 превращается в Fe+2:
Fe+3 + 1e = Fe+2.
Так, например, хлорид железа (III) окисляет йодид калия до свободного йода:
2Fe+3Cl3 + 2KI = 2Fe+2Cl2 + 2KCl + I20
Качественные реакции на катион железа (III)
Заполните таблицу, предоставив отсутствующие уравнения для реакции между цинком и кислородом. Окись кальция реагирует с водой с образованием гидроксида кальция. Известняк и его изделия имеют много применений, в том числе для цемента, раствора и бетона.
При интенсивном нагревании карбонат кальция разрушается. Эта реакция называется термическим разложением. Вот уравнения для термического разложения карбоната кальция. Двуокись кальция карбонат кальция. Другие карбонаты металлов разлагаются одинаково, в том числе.
Карбонат карбоната карбоната натрия карбонат. . Например, здесь приведены уравнения для термического разложения карбоната меди. Двуокись углерода карбоновой кислоты. Металлы высоко в реакционной серии имеют карбонаты, которые нуждаются в большой энергии для разложения разложения: если вещество разлагается, оно распадается на более простые соединения или элементы. их. Действительно, не все карбонаты металлов группы 1 разлагаются при температурах, достигаемых горелкой Бунзена.
А) Реактивом для обнаружения катиона Fe3+ является гексациано (II) феррат калия (желтая кровяная соль) K2.
При взаимодействии ионов 4- с ионами Fe3+ образуется темно-синий осадок – берлинская лазурь :
4FeCl3 + 3K4 « Fe43¯ +12KCl,
4Fe3+ + 34- = Fe43¯.
Б) Катионы Fe3+ легко обнаруживаются с помощью роданида аммония (NH4CNS). В результате взаимодействия ионов CNS-1 с катионами железа (III) Fe3+ образуется малодиссоциирующий роданид железа (III) кроваво-красного цвета:
Металлы, низко расположенные в ряду реакционной способности, такие как медь, имеют карбонаты, которые легко разлагаются. Вот почему карбонат меди часто используется в школе для проявления термического разложения. Он легко разлагается и его изменение цвета, от зеленого медного карбоната до черного оксида меди, легко увидеть.
Железосодержащая родниковая вода Кенигсбруннен. Желудочная вода епископства Св. Иоанна. Осаждение гидроксида железа из раствора сульфата аммония с частичным окислением до гидроксида железа кислородом воздуха. Кроме того, гидроксид железа относится к группе гидроксидов железа, но он очень неустойчив и быстро окисляется до гидроксида оксида железа в присутствии кислорода.
FeCl3 + 3NH4CNS « Fe(CNS)3 + 3NH4Cl,
Fe3+ + 3CNS1- « Fe(CNS)3.
Применение и биологическая роль железа и его соединений.
Важнейшие сплавы железа – чугуны и стали – являются основными конструкционными материалами практически во всех отраслях современного производства.
Хлорид железа (III) FeCl3 применяется для очистки воды. В органическом синтезе FeCl3 применяется как катализатор. Нитрат железа Fe(NO3)3 · 9H2O используют при окраске тканей.
Гидроксид железа получают осаждением раствора хлорида железа щелочами, предпочтительно с избытком аммиака. При замораживании он кристаллизуется, а также под очень длительным хранением под водой и легко превращается в водорастворимые соединения. Противоядие арсеници, используемое при отравлении мышьяком, также содержит гидроксид железа в качестве активного ингредиента.
Другим, ранее официальным гидроксидом железа является железное волокно. Гидрат оксида железа образуется, когда железо начинает ржаветь на влажном угле или в воздухе, содержащем диоксид серы. Именно из-за присутствия небольших количеств углекислоты железо окисляется, в то время как в каждом случае чистая вода или сухой воздух не вызывает никакой реакции. Гидроксид железа темно-коричневый, нерастворим в воде, легко растворим в кислотах и разлагается при нагревании в воде и оксиде железа. Он легко переносит свой кислород в окисляемые тела и превращается в оксид железа, который энергично поглощает кислород из воздуха.
Железо является одним из важнейших микроэлементов в организме человека и животных (в организме взрослого человека содержится в виде соединений около 4 г Fe). Оно входит в состав гемоглобина, миоглобина, различных ферментов и других сложных железобелковых комплексов, которые находятся в печени и селезенке. Железо стимулирует функцию кроветворных органов.
Поэтому он действует как гниющий агент и разрушает вращающиеся вещества, содержащиеся в жидкостях. На древесину можно также нападать, например, на ржавые гвозди. Гидроксид железа поглощает энергичные газы и, следовательно, благоприятно воздействует на почву; в сочетании с волокнистыми волокнами и некоторыми красителями, служит пятном при окрашивании.
Материалы, составляющие сплавы Зама. Цинк - голубоватый белый металл, который не может быть изменен в воздухе, который можно отполировать. Неизменный в холодном воздухе на сухом воздухе влажный воздух покрыт легким слоем гидрокарбоната, что делает его темнее и защищает его от более глубокого окисления. Общий цинк легко прикрепляется из-за примесей, которые он содержит, из разбавленных кислот, с образованием соли водорода и цинка. из благородных металлов, таких как медь, свинец, серебро и т.д. на них воздействуют горячие растворы щелочных гидроксидов путем обеспечения оцинкованного растворимого и водорода.
Список использованной литературы:
1. «Химия. Пособие репетитор». Ростов-на-Дону. «Феникс». 1997 год.
2. «Справочник для поступающих в вузы». Москва. «Высшая школа», 1995 год.
3. Э.Т. Оганесян. «Руководство по химии поступающим в вузы». Москва. 1994 год.
Неорганическое соединение гидроксид железа 3 имеет химическую формулу Fe(OH)2. Оно принадлежит к ряду амфотерных в которых преобладают свойства, характерные для оснований. На вид это вещество представляет собой кристаллы белого цвета, которые при длительном пребывании на открытом воздухе постепенно темнеют. Имеются варианты кристаллов зеленоватого оттенка. В повседневной жизни вещество может наблюдать каждый в виде зеленоватого налета на металлических поверхностях, что свидетельствует о начала процесса ржавления - гидроксид железа 3 выступает в качестве одной из промежуточных стадий этого процесса.
Это белый порошок, используемый во имя белого или белого снега цинка, не является токсичным и не черным в контакте с сероводородом. Кристаллическое разнообразие фосфоресцирует до света или в присутствии радиоактивных веществ. Соли цинка бесцветные или белые.
Их растворы обеспечивают щелочью осадок белого гидроксида, растворимый в избытке реагента. Сульфид аммония образует белый сульфидный осадок. Цинковые угли - неприятный запах жидкости, волдыри; обычно легко воспламеняются на воздухе и могут обрабатываться только в потоке инертного газа, таком как азот. Они получают путем взаимодействия цинка, чистого или сплава с алкилиодидом.
В природе соединение находят в виде амакинита. Этот кристаллический минерал, кроме собственно железа, содержит в себе еще примеси магния и марганца, все эти вещества придают амакиниту разные оттенки - от желто-зеленого до бледно- зеленого, в зависимости от процентного содержания того или иного элемента. Твердость минерала составляет 3,5-4 единицы по шкале Мооса, а плотность равна примерно 3 г/см³.
Иолоид алкилозина, который образуется в качестве промежуточного продукта, разлагает при повышении температуры в цинк в процессе образования йодида цинка. Кажется, что цинк в Китае известен с древних времен. В Европе цинковые сплавы с медью использовались в первом тысячелетии до нашей эры. При извлечении металла используются две группы минералов. Поскольку минералы цинка обычно связаны с минералами свинца, предварительное обогащение минерала должно выполняться магнитным разделением и флотацией. Чтобы облегчить отделение полезных частей от стерильных, добавьте разбавленное серное масло или серную кислоту, добавив поверхностно минерал, вызывает выброс газа, который способствует флотации.
К физическим свойствам вещества следует также отнести его крайне слабую растворимость. В том случае, когда гидроксид железа 3 подвергается нагреванию, он разлагается.
Это вещество очень активно и взаимодействует со многими другими веществами и соединениями. Так, например, обладая свойствами основания, оно вступает в с различными кислотами. В частности, серная кислота, гидроксид железа 3 в ходе реакции ведут к получению (III). Так как эта реакция может происходить путем обычного прокаливания на открытом воздухе, такой недорогой сульфата используется как в лабораторных, так и в промышленных условиях.
В зависимости от стран и состава минералов соблюдаются два разных процесса экстракции. Последующая фаза приводит к образованию металла для восстановления оксида углерода. Операция должна проводиться при более высокой температуре, чем температура кипения цинка, чтобы отделить металл от примесей путем дистилляции. Часть цинка, которая была бы потеряна для пара-побегов, восстанавливается при остановке. Полученный таким образом металл содержит в качестве основных примесей кадмий, свинец, медь, железо.
Очищенный раствор подвергают электролизу нерастворимым свинцовым анодом и катодом, состоящим из алюминиевого листа. Затем электролитический цинк отделяют от алюминиевой подложки и сливают в реверберирующей печи. Насекомое его неизменяемости к цинковому воздуху используется в листах или листах для покрытия крыш, в состоянии листов или листов оно также используется в графике и сухих батареях. Различные предметы, которые затем покрываются гальванопластикой специальным сплавом, который придает им вид бронзового искусства.
В ходе реакции с ее результатом является образование хлорида железа (II).
В некоторых случаях гидроксид железа 3 может проявлять и кислотные свойства. Так, например, при взаимодействии с сильно концентрированным (концентрация должна быть не менее 50%) раствором гидроксида натрия получается тетрагидроксоферрат (II) натрия, выпадающий в виде осадка. Правда, для течения такой реакции необходимо обеспечить довольно сложные условия: реакция должна происходить в условиях кипения раствора в азотной атмосферной среде.
Цинк обладает эффективным защитным действием на железо и сталь, подвергшиеся воздействию в определенных средах, таких как вода, водяной пар, вещества органические, бензольные или хлорированные растворители. Эта защита обеспечивается различными процессами.
Лозинко входит в состав многочисленных медных сплавов: латуни, специальной латуни. Цинк является основным компонентом сплавов Зама. Исследования немецкого химика Фридриха Вёрлера позволили измерить его относительную плотность, подчеркнув особую легкость металла. Процесс Холла-Йёруля по-прежнему остается основным методом используется для производства алюминия, хотя новые методы все еще изучаются. Металл, контактирующий с воздухом, быстро покрывается прозрачной и высокостойкой оксидной вуалью, которая защищает поверхность от воздействия агрессивных веществ и глубокого окисления.
Как уже говорилось, при нагревании вещество разлагается. Результатом этого разложения выступает (II), а, кроме того, в виде примесей получаются металлическое железо и его производные: оксид дижелеза (III), химическая формула которого Fe3O4.
Как произвести гидроксид железа 3, получение которого связано с его способностью вступать в реакции с кислотами? До того как приступить к проведению опыта, следует обязательно напомнить о правилах безопасности при проведении таких опытов. Эти правила применимы для всех случаев обращения с кислотно-щелочными растворами. Главное здесь - обеспечить надежную защиту и избегать попадания капель растворов на слизистые оболочки и кожу.
Итак, получить гидроксид можно в ходе проведения реакции, в которой взаимодействуют хлорид железа (III) и KOH - калия гидроксид. Данный метод - самый распространенный для образования нерастворимых оснований. При взаимодействии этих веществ протекает обычная реакция обмена, в результате которой получается осадок бурого цвета. Этот осадок и есть искомое вещество.
Применение гидроксида железа в промышленном производстве довольно широко. Наиболее распространенным является его использование в качестве активного вещества в аккумуляторах железо-никелевого типа. Кроме того, соединение используется в металлургии для получения различных металлосплавов, а также в гальваническом призводстве, авомобилестроении.


