02.02.2018
Феррум 3 о 4 степень окисления. Большая энциклопедия нефти и газа


В земной коре железо распространено достаточно широко на его долю приходится около 4,1 % массы земной коры (4- е место среди всех элементов, 2- е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало в кислых и средних породах. Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe 2 O 3 ; содержит до 70 % Fe), магнитный железняк (магнетит, FeFe 2 O 4, Fe 3 O 4 ; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH 2 O) гематит магнетит лимонит гётит

Сидерит FeCO 3 содержит примерно 35 % железа. Обладает желтовато - белым (с серым или коричневым оттенком в случае загрязнения) цветом. Сидерит Миспикель FeAsS содержит 34,3 % железа. Миспикель Лёллингит FeAs 2 содержит 27,2 % железа Лёллингит ильменит FeTiO 3 ильменит магномагнетит (Fe, Mg) фиброферрит FeSO 4 (OH)·4,5H 2 O ярозит KFe 3 (SO 4) 2 (OH) 6 ярозит


Основные степени окисления железа +2 и +3. При хранении на воздухе при температуре до 200 °C железо постепенно покрывается плотной плёнкой оксида, препятствующего дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины, который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближённо её химическую формулу можно записать как Fe 2 O 3 ·xH 2 O. оксида ржавчины

С кислородом железо реагирует при нагревании. При сгорании железа на воздухе образуется оксид Fe 3 O 4, при сгорании в чистом кислороде оксид Fe 2 O 3. Если кислород или воздух пропускать через расплавленное железо, то образуется оксид FeO. При нагревании порошка серы и железа образуется сульфид, приближённую формулу которого можно записать как FeS. кислородомFe 3 O 4Fe 2 O 3 FeO серы


13.ЭЛЕМЕНТЫ ПОДГРУППЫ ХРОМА.
Атомный номер Название Электронная
конфигурацияρ
г/см 3tпл.
0 Ctкип.
0 CЭО Атомный
радиус,
нмСтепень
окисления26 Железо Fe 3d64s2 7,87 1535 2750 1,64 0,128 +2,+3 27 Кобальт Co 3d74s2 8,9 1495 2870 1,7 0,125 +2,+3 28 Никель Ni 3d8 4s2 8,9 1453 2732 1,75 0,124 +1,+2,+3,+4 Получение
металлов подгруппы железаВосстановлением из оксидов углём или оксидом углерода (II)
FeO + C Fe + CO
Fe 2 O 3 + 3CO 2Fe + 3CO 2
NiO + C Ni + CO
Co 2 O 3 + 3C 2Co + 3COFe
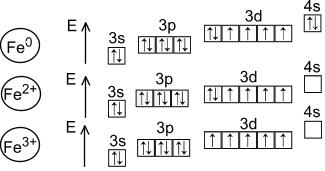
d- элемент VIII группы; порядковый номер – 26; атомная масса – 56; (26p; 30 n), 26eМеталл средней активности, восстановитель.
Основные степени окисления - +2, +3
Железо и его соединения
На воздухе железо легко окисляется в присутствии влаги (ржавление):
4Fe + 3O 2 + 6H 2 O 4Fe(OH) 3
Накалённая железная проволока горит в кислороде, образуя окалину - оксид железа (II,III):
3Fe + 2O 2 Fe 3 O 4
При высокой температуре (700–900 0 C) железо реагирует с парами воды:
3Fe + 4H 2 O Fe 3 O 4 + 4H 2
Железо реагирует с неметаллами при нагревании:2Fe + 3Br 2 2FeBr 3
Fe + S FeS
Железо легко растворяется в соляной и разбавленной серной кислотах:Fe + 2HCl FeCl 2 + H 2
Fe + H 2 SO 4 (разб.) FeSO 4 + H 2В концентрированных кислотах–окислителях железо растворяется только при нагревании
2Fe + 6H 2 SO 4 (конц.) Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O
Fe + 6HNO 3 (конц.) Fe(NO 3) 3 + 3NO 2 + 3H 2 O(на холоде концентрированные азотная и серная кислоты пассивируют железо).
Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.Fe + CuSO 4 FeSO 4 + Cu
Соединения двухвалентного железа
Гидроксид железа (II)
Образуется при действии растворов щелочей на соли железа (II) без доступа воздуха:
FeCl + 2KOH 2KCl + Fе(OH) 2
Fe(OH) 2 - слабое основание, растворимо в сильных кислотах:
Fe(OH) 2 + H 2 SO 4 FeSO 4 + 2H 2 O
При прокаливании Fe(OH)2 без доступа воздуха образуется оксид железа (II) FeO:
Fe(OH) 2 FeO + H 2 O
В присутствии кислорода воздуха белый осадок Fe(OH) 2 , окисляясь, буреет – образуя гидроксид железа (III) Fe(OH) 3:
4Fe(OH) 2 + O 2 + 2H 2 O 4Fe(OH) 3
Соединения железа (II) обладают восстановительными свойствами, они легко превращаются в соединения железа (III) под действием окислителей:
10FeSO 4 + 2KMnO 4 + 8H 2 SO 4 5Fe 2 (SO 4) 3 + K 2 SO 4 + 2MnSO 4 + 8H 2 O
6FeSO 4 + 2HNO 3 + 3H 2 SO 4 3Fe 2 (SO 4) 3 + 2NO + 4H 2 OСоединения железа склонны к комплексообразованию (координационное число=6):
FeCl 2 + 6NH 3 Cl 2
Качественная реакция на Fe 2+
Fe(CN)2 + 4KCN K4(жёлтая кровяная соль)При действии гексацианоферрата (III) калия K 2 (красной кровяной соли) на растворы солей двухвалентного железа образуется синий осадок (турнбулева синь):
3FeSO 4 + 2K 3 Fe 3 + 3K 2 SO 4
Соединения трёхвалентного железа
Оксид железа (III)
Образуется при сжигании сульфидов железа, например, при обжиге пирита:
4FeS 2 + 11O 2 2Fe 2 O 3 + 8SO 2
или при прокаливании солей железа:
2FeSO 4 Fe 2 O 3 + SO 2 + SO 3
Fe 2 O 3 - основной оксид, в незначительной степени проявляющий амфотерные свойства
Fe 2 O 3 + 6HCl 2FeCl 3 + 3H 2 O
Fe 2 O 3 + 2NaOH + 3H 2 O 2Na
Гидроксид железа (III)
Образуется при действии растворов щелочей на соли трёхвалентного железа: выпадает в виде красно–бурого осадка
Fe(NO 3) 3 + 3KOH Fe(OH) 3 + 3KNO 3
Fe(OH) 3 – более слабое основание, чем гидроксид железа (II).
Это объясняется тем, что у Fe 2+ меньше заряд иона и больше его радиус, чем у Fe 3+ , а поэтому, Fe 2+ слабее удерживает гидроксид-ионы, т.е. Fe(OH) 2 более легко диссоциирует.
В связи с этим соли железа (II) гидролизуются незначительно, а соли железа (III) - очень сильно. Гидролизом объясняется и цвет растворов солей Fe(III): несмотря на то, что ион Fe3+ почти бесцветен, содержащие его растворы окрашены в жёлто-бурый цвет, что объясняется присутствием гидроксоионов железа или молекул Fe(OH)3, которые образуются благодаря гидролизу:Fe 3+ + H 2 O 2 + + H +
2 + + H 2 O + + H +
+ + H2O Fe(OH) 3 + H +При нагревании окраска темнеет, а при прибавлении кислот становится более светлой вследствие подавления гидролиза. Fe(OH)3 обладает слабо выраженной амфотерностью: он растворяется в разбавленных кислотах и в концентрированных растворах щелочей:
Fe(OH) 3 + 3HCl FeCl 3 + 3H 2 O
Fe(OH) 3 + NaOH Na
Соединения железа (III) - слабые окислители, реагируют с сильными восстановителями:
2FeCl 3 + H2S S + 2FeCl 2 + 2HCl
Качественные реакции на Fe3+
17. d -элементы.Железо, общая характеристика, свойства. Оксиды и гидроксиды, КО и ОВ характеристика, биороль, способность к комплексообразованию.
1.Общая характеристика.
Железо - d-элемент побочной подгруппы восьмой группы четвёртого периода ПСХЭ с атомным номером 26.
Один из самых распространённых в земной коре металлов (второе место после алюминия).
Простое веществожелезо - ковкийметаллсеребристо-белого цветас высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажностина воздухе.
4Fe + 3O2 + 6H2O = 4Fe(OH)3
В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
3Fe + 2O2 = FeO + Fe2O3
3Fe + 4H2O = FeO*Fe2O3
FeO*Fe2O3 = Fe3O4 (железная окалина)
Собственно, железом обычно называют его сплавы с малым содержанием примесей (до 0,8 %), которые сохраняют мягкость и пластичность чистого металла. Но на практике чаще применяются сплавы железа с углеродом: сталь(до 2,14 вес. % углерода) и чугун(более 2,14 вес. % углерода), а также нержавеющая(легированная) сталь с добавками легирующих металлов (хром,марганец, никельи др.). Совокупность специфических свойств железа и его сплавов делают его «металлом № 1» по важности для человека.
В природе железо редко встречается в чистом виде, чаще всего оно встречается в составе железо-никелевых метеоритов. Распространённость железа в земной коре - 4,65 % (4-е место после O, Si, Al). Считается также, что железо составляет бо́льшую часть земного ядра.
2.Свойства
1.Физ.св-ва. Железо - типичный металл, в свободном состоянии - серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси (в частности - углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами. Часто выделяют так называемую «триаду железа» - группу трёх металлов (железо Fe,кобальт Co, никель Ni), обладающих схожими физическими свойствами, атомными радиусами и значениями электроотрицательности.
2.Хим.св-ва.
|
Степень окисления |
Оксид |
Гидроксид |
Характер |
Примечания |
|
Слабоосновный | ||||
|
Очень слабое основание, иногда - амфотерный | ||||
|
Не получен |
|
Кислотный |
Сильный окислитель |
Для железа характерны степени окисления железа - +2 и +3.
Степени окисления +2 соответствует чёрный оксид FeO и зелёный гидроксид Fe(OH) 2 . Они имеют основный характер. В солях Fe(+2) присутствует в виде катиона. Fe(+2) - слабый восстановитель.
Степени окисления +3 соответствуют красно-коричневый оксид Fe 2 O 3 и коричневый гидроксид Fe(OH) 3 . Они носят амфотерный характер, хотя и кислотные, и основные свойства у них выражены слабо. Так, ионы Fe 3+ нацело гидролизуются даже в кислой среде. Fe(OH) 3 растворяется (и то не полностью), только в концентрированных щелочах. Fe 2 O 3 реагирует со щелочами только при сплавлении, давая ферриты (формальные соли кислоты несуществующей в свободном виде кислоты HFeO 2):
Железо (+3) чаще всего проявляет слабые окислительные свойства.
Степени окисления +2 и +3 легко переходят между собой при изменении окислительно-восстановительных условий.
Кроме того, существует оксид Fe 3 O 4 , формальная степень окисления железа в котором +8/3. Однако этот оксид можно также рассматривать как феррит железа (II) Fe +2 (Fe +3 O 2) 2 .
Также существует степень окисления +6. Соответствующего оксида и гидроксида в свободном виде не существует, но получены соли - ферраты (например, K 2 FeO 4). Железо (+6) находится в них в виде аниона. Ферраты являются сильными окислителями.
Чистое металлическое железо устойчиво в воде и в разбавленных растворах щелочей . Железо не растворяется в холодных концентрированных серной и азотной кислотах из-за пассивации поверхности металла прочной оксидной плёнкой. Горячая концентрированная серная кислота, являясь более сильным окислителем, взаимодействует с железом.
С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо реагирует с образованием солей железа(II):
При взаимодействии железа с приблизительно 70%-й серной кислотой при нагревании реакция протекает с образованием сульфата железа(III) :
3.Оксиды и гидроксиды, КО и ОВ хар-ка…
Соединения железа (II)
Оксид железа(II) FeO обладает основными свойствами, ему отвечает основание Fe(OH) 2 . Соли железа (II) обладают светло-зелёным цветом. При их хранении, особенно во влажном воздухе, они коричневеют за счёт окисления до железа (III). Такой же процесс протекает при хранении водных растворов солей железа(II):
Из солей железа(II) в водных растворах устойчива соль Мора - двойной сульфат аммония и железа(II) (NH 4) 2 Fe(SO 4) 2 ·6Н 2 O.
Реактивом на ионы Fe 2+ в растворе может служить гексацианоферрат(III) калия K 3 (красная кровяная соль). При взаимодействии ионов Fe 2+ и 3− выпадает осадоктурнбулевой сини :
Для количественного определения железа (II) в растворе используют фенантролин , образующий с железом (II) красный комплекс FePhen 3 в широком диапазоне рН (4-9)
Соединения железа (III)
Оксид железа(III) Fe 2 O 3 слабо амфотерен , ему отвечает ещё более слабое, чем Fe(OH) 2 , основание Fe(OH) 3 , которое реагирует с кислотами:
Соли Fe 3+ склонны к образованию кристаллогидратов. В них ион Fe 3+ как правило окружен шестью молекулами воды. Такие соли имеют розовый или фиолетовый цвет.Ион Fe 3+ полностью гидролизуется даже в кислой среде. При рН>4 этот ион практчиески полностью осаждается в виде Fe(OH) 3:
При частичном гидролизе иона Fe 3+ образуются многоядерные оксо- и гидроксокатионы, из-за чего растворы приобретают коричневый цвет.Основные свойства гидроксида железа(III) Fe(OH) 3 выражены очень слабо. Он способен реагировать только с концентрированными растворами щелочей:
Образующиеся при этом гидроксокомплексы железа(III) устойчивы только в сильно щелочных растворах. При разбавлении растворов водой они разрушаются, причём в осадок выпадает Fe(OH) 3 .
При сплавлении со щелочами и оксидами других металлов Fe 2 O 3 образует разнообразные ферриты :
Соединения железа(III) в растворах восстанавливаются металлическим железом:
Железо(III) способно образовывать двойные сульфаты с однозарядными катионами типа квасцов , например, KFe(SO 4) 2 - железокалиевые квасцы, (NH 4)Fe(SO 4) 2 - железоаммонийные квасцы и т. д.
Для качественного обнаружения в растворе соединений железа(III) используют качественную реакцию ионов Fe 3+ с тиоцианат-ионами SCN − . При взаимодействии ионов Fe 3+ с анионами SCN − образуется смесь ярко-красных роданидных комплексов железа 2+ , + , Fe(SCN) 3 , - . Состав смеси (а значит, и интенсивность её окраски) зависит от различных факторов, поэтому для точного качественного определения железа этот метод неприменим.
Другим качественным реактивом на ионы Fe 3+ служит гексацианоферрат(II) калия K 4 (жёлтая кровяная соль). При взаимодействии ионов Fe 3+ и 4− выпадает ярко-синий осадок берлинской лазури :
Соединения железа (VI)
Ферраты - соли не существующей в свободном виде железной кислоты H 2 FeO 4 . Это соединения фиолетового цвета, по окислительным свойствам напоминающие перманганаты, а по растворимости - сульфаты. Получают ферраты при действии газообразного хлора или озона на взвесь Fe(OH) 3 в щелочи , например, феррат(VI) калия K 2 FeO 4 . Ферраты окрашены в фиолетовый цвет.
Ферраты также можно получить электролизом 30%-ного раствора щелочи на железном аноде:
Ферраты - сильные окислители. В кислой среде разлагаются с выделением кислорода:
Окислительные свойства ферратов используют для обеззараживания воды .
4.Биороль
1)В живых организмах железо является важным микроэлементом, катализирующим процессы обмена кислородом (дыхания).
2)Обычно железо входит в ферменты в виде комплекса.В частности, этот комплекс присутствует в гемоглобине - важнейшем белке, обеспечивающем транспорт кислорода с кровью ко всем органам человека и животных. И именно он окрашивает кровь в характерный красный цвет.
4)Избыточная доза железа (200 мг и выше) может оказывать токсическое действие. Передозировка железа угнетает антиоксидантную систему организма, поэтому употреблять препараты железа здоровым людям не рекомендуется.
Cтраница 3
На рис. V.8 приведена корреляционная схема, которая дает представление об интервалах изомерных сдвигов 57Fe для соединений железа. Степень окисления железа может меняться от 0 до 6, и охарактеризовать ее по изомерному сдвигу 57Fe не так просто.
Восстановительная атмосфера вызывает понижение степени окисления железа в шлаке, между тем как при окислительной атмосфере под действием больших температур пламени продолжается распад более высоких окислов железа. Повышение степени окисления железа в шлаке воздействием окислительной атмосферы возможно только при температуре пламени ниже 1 200 С и большой поверхности шлака.
Довольно резко в породах изменяется содержание А12Оз, щелочей. Постоянным сохраняется степень окисления железа.
| Зависимость вязкости от температуры. |
Образец С со степенью окисления 13 % не имеет пластической области, и шлак ведет себя, как стекло. С повышением степени окисления железа до 30 или 56 % в кривых вязкости образцов В и А появляется изгиб, свидетельствующий о том, что шлак в месте изгиба переходит в пластическое состояние.
Но степень окисления серы, входящей в состав этих ионов, различна. В первом случае степень окисления железа совпадает с зарядом простого иона Fe2 и с валентностью железа. Таким образом, валентностью данного элемента в комплексном соединении называют всю сумму связей, которой обладает в данном соединении центральный атом - комплексообразователь.
Тенденция к комплексообразованию подтверждается и существованием типичных двойных солей типа шенитов и квасцов. В этом соединении степень окисления железа 2 стабилизируется, в то время как сульфат FeSO4 в водном растворе склонен к окислению кислородом воздуха. Никель подобных соединений не образует, поскольку степень окисления 3 для этого элемента настолько малохарактерна, что даже не стабилизируется в двойных солях.
Это увеличение степени окисления железа в шлаке продолжается до температуры около 1 200 С. При дальнейшем повышении температуры шлака степень окисления железа значительно падает.
Как указано, центральный атом железа лежит в плоскости 16-членного пор-фирипового кольца, причем он связан с атомами азота пиррольных колец четырьмя из шести имеющихся валентностей, а поэтому для завершения октаэдрического комплекса остаются две валентности; эти валентности находятся выше и ниже плоскости чертежа показанной модели. Кроме того, нужно учитывать также степень окисления железа; когда железо находится в закисном состоянии, как показано на рисунке, то протопорфирин носит название тема или, более четко, феррогема. Если гем находится в свободном состоянии в растворе и не связан с белком, то предполагается, что две молекулы воды находятся в координационной связи с пятым и шестым положениями валентности железа. Джордж обозначает этот феррогем следующим образом: H2O - Fep-H. При окислении он переходит в Н О Fep НаО с одним положительным зарядом. Этот ферригем может координировать хлор-ион с переходом в H2O - Fep-Cl и в этом случае называется гемином; при координированном гидроксилыюм ионе ферригем обозначается как гематин Н2О - Рер-ОН, хотя эти термины иногда употребляются и менее специфически, лишь для обозначения наличия окисного железа. Возможна координация и других молекул, причем в первую очередь играет роль координация с перекисью водорода. Феррогем легко координирует азотистые основания, например пиридин, образуя гемохромогеиы В-Рбр - В. Такое же соединение с ферригемом B-Fep-B называется парагема-тином.
Посредством магнитного метода установлено наличие и дана количественная оценка валентных связей между соседними положительными ионами. Так, в Fe203 на носителе А1203 степень окисления железа равна трем, но одновременно соседние атомы железа образуют между собою ковалентную связь.
Посредством магнитного, метода установлено наличие и дана количественная оценка валентных связей между соседними положительными ионами. Так, в Fe2O3 на носителе А12О3 степень окисления железа равна трем, но одновременно соседние атомы железа образуют между собою ковалентную связь.
Если рассмотреть гидроксиды Fe (OH) 2 и Fe (OH) 3, то с позиции схемы Косселя кислотные свойства второго гидроксида должны быть выражены сильнее, чем первого. Это следует из того, что чем выше степень окисления железа (даже если принять, что радиусы ионов Fe2 и Fe3 одинаковы), тем выше отталкивание протона и тем сильнее выражены кислотные свойства соответствующего гидроксида. Если учесть, что радиус иона Fe3 несколько меньше, чем иона Fe2, то большее отталкивание протона в соединении Fe (OH) 3 по сравнению с Fe (OH) 2 становится еще очевиднее.
Часть окислов железа восстанавливается до металлического железа, другая часть - до [ закись-окиси ]; кроме того, на них выделяется углерод. Количество кислорода, еще содержащегося в руде, характеризует степень окисления железа.
Если после предварительных испытаний остается сомнение, присутствует ли ион железа, можно проделать поверочные реакции. Но следует помнить, что при этом испытании уже нельзя установить первоначальную степень окисления железа в анализируемой пробе.
Лишь в присутствии сильных окислителей удается получить довольно непрочные производные железной кислоты H2FeO4 со степенью окисления железа 6, однако соответствующий оксид выделить не удалось. Если RuO4 - малоустойчивое вещество, которое получают косвенным путем, то OsO4 - соединение вполне устойчивое, образующееся при окислении металла на воздухе.