31.07.2019
Клетки воспаления. Большая энциклопедия нефти и газа
Важнейшим процессом воспаления является эмиграция лейкоцитов из сосудов в поврежденную флогогеном ткань для осуществления лейкоцитами защитной функции. Однако, лейкоциты появляются в очаге воспаления и осуществляют вторичную альтерацию, т.е. выполняют также регуляторную функцию.
Эмиграция лейкоцитов осуществляется следующим образом: лейкоциты выходят из осевого тока сначала на границу плазматического слоя, а затем начинают прилипать к эндотелиальным клеткам сосуда. Важная роль в адгезии (лат. adhaesio - прилипание) лейкоцитов отводится эндотелиально-лейкоцитарным адгезионным молекулам селектинам и интегринам . Под влиянием цитокинов IL-1,8, ФАТ, TNF-α, компонентов комплемента происходят конформационные изменения мембран лейкоцитов и эндотелия, экспресссируются молекулы адгезии.
Стадии эмиграции:
· I стадия – обратимая адгезия, роллинг или скольжение лейкоцитов;
· II стадия – необратимая адгезия к эндотелию и последующая трансэндотелиальная миграция;
· III стадия – хемотаксис – направленное движение в очаге воспаления.
Адгезия лейкоцитов к эндотелию сосуда происходит по принципу механизму лиганд-рецептор. Стимулирующими факторами для адгезии лейкоцитов являются медиаторы воспаления: эйкозаноиды, биогенные амины, интерлейкин-1, интерлейкин-8, ФАТ, TNF-α, компоненты комплемента.
Фаза Роллинга (скольжения лейкоцитов) обеспечивается молекулами - селектинами Существует 3 подгруппы селектинов:
- L-селектины (LAM-1) синтезируются лейкоцитами,
- P-селектин - гликопротеиновый лиганд (GMP-140)
- Е-селектин (ELAM-1) синтезируется эндотелиоцитами
Рис. 6. Экспрессия молекул адгезии на эндотелии
Фаза плотной адгезии - более поздняя стадия взаимодействия лейкоцитов и эндотелия сосудов обеспечивается молекулой ICAM-1 (intercellular adhesion molecule –1 или межклеточная адгезионная молекула-1) (Рис.6) и VCAM-1 (vessel cellular adhesion molecule-1 или молекула адгезии сосудистого эндотелия первого типа) (Рис 7).
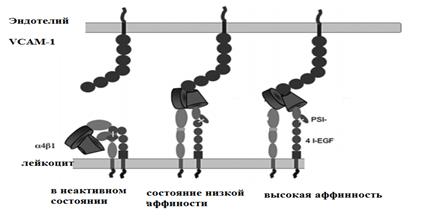
Рис. 7. Варианты различной аффинности молекул клеточной адгезии
Трансэндотелиальная миграция лейкоцитов в ткань является ключевым элементом врожденного и адаптивного иммунитетов. Этот процесс имеет два возможных пути реализации. Преодоление базальной мембраны сосудистой стенки возможно через межэндотелиальный контакт (парацеллюлярная миграция). Все гранулоциты, имеющие сегментированное ядро, могут проходить между эндотелиальными клетками через межэндотелиальные контакты, поскольку сегментированные ядра нейтрофилов могут проходить через узкие щели. В трансэндотелиальной миграции лейкоцитов важна роль молекулы PECAM (platelet/endothelial cell adhesion molecule).
Образование сцепления между молекулами PECAM на лейкоците и эндотелии является самым уязвимым этапом во всем процессе трансмиграции лейкоцитов. PECAM-зависимый механизм трансмиграциипредставляет собой следующий процесс: по мере того как лейкоциты продвигаются к базальной мембране клетки, они образуют псевдоподии в области межэндотелиальных контактов. В конце процесса соединения лейкоцита с эндотелием в субэндотелиальный слой перемещается вся клетка.
Мононуклеарные клетки, такие как моноциты и лимфоциты также способны проходить между эндотелиальными клетками при значительной активации эндотелия и изменении его формы.
Движение лейкоцита к очагу воспаления .
Процесс направленного движения лейкоцитов микрофагов, макрофагов) в очаг воспаления, называется хемотаксисом, а вещества, вызывающие это направленное движение клеток называются хемоаттрактантами и подразделяются на экзогенные и эндогенные. К экзогенным хемоаттрактантам относят продукты жизнедеятельности или структурные элементы микроорганизмов, а также другие чужеродные вещества.
Основная роль в стимуляции хемотаксиса лейкоцитов принадлежит эндогенным хемоаттрактантам, которые бывают неспецифическими и специфическими. В качестве неспецифических хемоаттрактантов выступают большинство биологически активных веществ, а также продукты повреждения клеток и медиаторы воспаления (гистамин, серотонин, АТФ, ДНК, продукты деградации фибрина (ПДФ), продукты деградации коллагена, фибронектин, тромбин). Некоторые вещества имеют принципиальное значение для хемотаксиса, а нарушение их образования существенно влияет на выход лейкоцитов из сосудов. Эти вещества получили название специфических хемоаттрактантов. К ним относятся: лейкотриен В4 и комплемент (С5а, С3а) (они определяют хемотаксис нейтрофилов, эозинофилов и моноцитов); фактор активации тромбоцитов (влияет на хемотаксис нейтрофилов и эозинофилов)
Специфичность LtB 4 , ФАТ, компонентов комплемента C5a и С3а достаточно условна, т.к. эти вещества имеют много других эффектов, из которых стимуляция хемотаксиса – одна из важнейших. При воспалении они образуются в большом количестве и привлекают в очаг воспаления преимущественно нейтрофильные гранулоциты.
Особая роль в механизмах хемотаксиса принадлежит хемокинам, цитокинам, регулирующим хемотаксис. Среди них особенно активным хемоаттрактантным эффектом обладает интерлейкин-8 (IL-8). Его могут продуцировать большинство клеток в ответ на воздействие эндотоксином, TNF-α, и IL-1. Кроме того, к хемокинам относят нейтрофил-активирующий пептид эпителиальных клеток (ENA-78), нейтрофил активирующий пептид-2 (NAP-2) и воспалительный белок макрофагов α и β (MIP-1), воспалительный белок макрофагов -2 α и β (MIP-2), белок хемотаксиса моноцитов (MCP-1, 2 и 3), эотаксин.
Хемокины отвечают за более регуляцию выхода из сосудов различных лейкоцитов, что способствует правильной последовательности эмиграции лейкоцитов. Регуляция последовательности выхода лейкоцитов из сосудов имеет важное биологическое значение. Первой линией защиты при любом воспалении выступают нейтрофильные лейкоциты, которые относятся к неспецифическому иммунитету. При невозможности быстрого уничтожения антигена происходит активное подключение специфического иммунитета, и в очаг воспаления выходят сначала антиген-презентирующие клетки (моноциты крови), а затем лимфоциты и эозинофилы.
Органы и ткани также имеют свою популяцию резидуальных макрофагов, которые играют ключевую роль в инициации локального воспалительного ответа. Во время рекрутирования нейтрофилов популяция резидуальных макрофагов уменьшается. Это явление получило название реакции исчезновения макрофагов. Как и нейтрофилы, моноциты крови также мигрируют в очаг воспаления и в течение некоторого времени превращаются в макрофаги, однако их максимальное количество в ткани наблюдается несколько позже, чем нейтрофилов.
Нейтрофилы обладают мощными гистотоксическими свойствами. Поэтому по мере процесса рекрутирования других лейкоцитов нейтрофилы должны погибнуть путем апоптоза или некроза. Кроме того, часть нейтрофилов способна покинуть очаг воспаления через лимфатическую дренажную систему и попадать обратно в кровоток.
ФАГОЦИТОЗ
Илья Ильич Мечников описал фагоцитоз в 1883 году как общебиологическое явление в жизнедеятельности одноклеточных и многоклеточных организмов, состоящее в поглощении клетками других клеток.
Фагоцито́з - это процесс захвата клеткой частиц путем рецепторного эндоцитоза. Максимальная активность фагоцитов наблюдается в отношении частиц диаметром более 1 мкм. Однако, возможен фагоцитоз и более мелких частиц, диаметром до 100 нм. Фагоцитоз в очаге воспаления осуществляетсямакрофагами, которые представляют собой «профессиональных» фагоцитов. Фагоцитоз протекает в несколько стадий: 1 – приближение (хемотаксис), 2- прилипание к объекту фагоцитоза (аттракция, адгезия), 3 – погружение объекта фагоцитоза (рецепторный эндцитоз), 4 – умерщвление (киллинг), 5 – внутриклеточное переваривание.
3.6.1. прилипание лейкоцита к объекту фагоцитоза – это рецептор-опосредованный процесс. На мембране лейкоцитов можно обнаружить рецепторы ко многим антигенам микроорганизмов, которые относятся к рецепторам «первичного иммунитета». Однако, такой механизм связывания лейкоцита с антигеном ограничен и не позволяет осуществить полноценный иммунный ответ. Поэтому, в большинстве случаев прилипание лейкоцита к объекту фагоцитоза осуществляется с помощью универсальных «посредников», в качестве которых выступают иммуноглобулины (преимущественно IgG) и система комплемента (C3b). Процесс связывания объекта фагоцитоза с такими белками для последующего фагоцитоза называется опсонизацией , а сами белки, выполняющие эту функцию – опсонинами . После опсонизации объекта фагоцитоза лейкоцит взаимодействует не с антигеном микроорганизма, а иммуноглобулином через соответствующий рецептор к Fc-фрагменту иммуноглобулина или через рецептор к С3b. Наиболее активны как опсонины иммуноглобулины G1 и G3, в меньшей степени Μ и Ε. Они распознаются Fсγ- или иными Fc-pецепторами. Фактор комплемента С3b и его нестабильная форма iC3b также участвуют в опсонизации через рецепторы CR1-CR3 как при прямой активации объектами фагоцитоза, так и при активации иммуноглобулинами и иммунными комплексами. Опсонизация в несколько раз увеличивает активность прилипания. С-реактивный белок также является ко-опсонином, так как связывает С-белок пневмококков и других микробов и опосредует прикрепление к ним факторов комплемента и фагоцитов.
Иногда опсонизация может оказывать отрицательное воздействие. Некоторые микроорганизмы (например, золотистый стафилококк) и вирусы (например, вирус герпеса) в процессе эволюции выработали способности, позволяющие ускользать от опсонизации с помощью белков-аналогов Fсγ-рецепторов. Они блокируют антитела-опсонины и не дают фагоцитам прилипать к обладающему ими объекту. Патогены, обладающие способностью связываться с антителами не только по Fab, но и по Fc-фрагменту, способны провоцировать образование крупных комплексов, содержащих несколько молекул иммуноглобулина и микробных тел (вирусных частиц).
Исходно в организме имеется недостаточное количество иммуноглобулинов, способных связаться с конкретным антигеном микроорганизма, поэтому максимальная активность фагоцитоза невозможна без образования достаточного количества специфических к данному антигену иммуноглобулинов. После распознавания антигена и выработки антиген-специфичных иммуноглобулинов процесс опсонизации усиливается, чем достигается уничтожение микроорганизма, в том числе с помощью фагоцитоза.
3.6.2.Стадия погружения объекта фагоцитоза завершается образованием фагосомы. Этот процесс энергозависимый и связан с работой сократительных белков фагоцита, которая происходит после взаимодействия опсонизированного микроорганизма с соответствующими рецепторами на мембране фагоцита. В результате погружения, объект оказывается в цитоплазме фагоцита, полностью окруженный фагосомой, созданной путем инвагинации и замыкания участка клеточной мембраны.
3.6.3.Стадия переваривания происходит при участии микрофиламентов цитоскелета и белков-фагозогенов. Фагосома сливается с лизосомами и специфическими гранулами фагоцита (внутренняя дегрануляция), формируя фаголизосому, где и происходит завершающая стадия фагоцитоза. Все эти процессы инициированы входом ионов кальция в клетку и активацией протеинкиназы С.
Разрушение (киллинг) объектов фагоцитоза происходит с помощью разнообразных механизмов. Они подразделяются на кислород-зависимые и кислород-независимые:
Кислород-зависимый киллинг состоит в разрушении содержимого фагосомы компонентами, образующимися в реакции галогенизации и перекисного окисления, а именно гипохлоритом, перекисью водорода, синглетным кислородом, гидроксильными радикалами и другими активными формами кислорода.
К кислороднезависимым механизмам относится воздействие таких веществ, как лизоцим, эластаза, коллагеназа, катепсины, лактоферрин, катионные белки (дефенсины, протегрины).
После гибели микроорганизма происходит окончательное переваривание его структур ферментами фагоцита. Фагоцитоз, который завершился уничтожением микроорганизма и перевариванием объекта фагоцитоза называется завершенным.
3.6.3.3. Незавершенный фагоцитоз .
1.Блокада фагосомо-лизосомального слияния, обнаруженная у вирусов (например, вирус гриппа), бактерий (микобактерии) и простейших (токсоплазмы).
2.Резистентность к лизосомальным ферментам (гонококки и стафилококки).
3.Способность патогенных микроорганизмов быстро покидать фагосомы после поглощения и длительно пребывать в цитоплазме (риккетсии).
4.Способность вырабатывать каталазу, разрушающую перекись водорода (стафилококк, аспергиллы), что блокирует разрушение микроорганизмов и антиген-представляющую функцию фагоцита.
ПРОЛИФЕРАЦИЯ
Под пролиферацией в контексте воспаления понимается п роцесс восстановления структуры поврежденной ткани, возникающий через несколько часов после повреждения. Цель пролиферации может быть достигнута только при условии, что дальнейшего повреждения тканей не происходит, в противном случае новые клетки будут разрушаться под действием повреждающих факторов. В процессе пролиферации выделяют 3 этапа:
· очищение ткани от поврежденных клеточных элементов, микроорганизмов и других чужеродных элементов
· стимуляция роста сосудов в поврежденной ткани
· восстановление целостности ткани.
Процесс пролиферации и восстановления поврежденной ткани становится значимым лишь к моменту, когда основные процессы первичного и вторичного повреждения завершатся. Главным условием успешного хода репаративного процесса при воспалении служит затухание острых альтеративных и экссудативных изменений. Это достижимо лишь при условии полного устранения (элиминации) флогогенного агента. Если флогогенный агент полностью не устранен, воспаление может стать хроническим. Второе условие перехода к репаративным процессам требует действия противовоспалительных медиаторов.
Очищение ткани от поврежденных клеток и микроорганизмов осуществляют нейтрофильные лейкоциты и макрофаги, которые являются основными клетками острого воспаления. Нейтрофильные лейкоциты окружают очаг воспаления, создавая барьер между зоной повреждения и здоровой тканью. Схожую функцию выполняют венозный стаз, препятствуя распространению флогогена по сосудам.
Ангиогенез – восстановление сосудистой сети в поврежденной ткани происходит под влиянием факторов роста. К ним относят фактор роста фибробластов (FGF), фактор роста из тромбоцитов (PDGF), сосудистый эндотелиальный фактор роста (VEGF), трансформирующий фактор роста (TGF α и β), эпидермальный фактор роста (EGF)). Под их влиянием происходит деление эндотелиальных клеток, часть из которых происходит непосредственно из очага воспаления, а часть приходит в виде предшественниц эндотелиоцитов из костного мозга, и формирование трубки будущего капилляра (ангиогенез). Эндотелиальные клетки в новообразованных капиллярах функционально несостоятельны, и эти сосуды отличаются высокой проницаемостью. Затем эндотелиальные клетки «созревают», происходит формирование базальной мембраны, и вновь образованные сосуды приобретают свойства нормальных капилляров.
Регенерация - это замена утраченных клеток клетками того же типа. Если полное количественное восстановление паренхиматозных клеток невозможно, например, при потере клеточных элементов, неспособных к делению, то происходит восполнение дефекта паренхимы соединительной тканью. Формируется молодая, богатая регенерирующими, высокопроницаемыми сосудами грануляционная ткань, затем соединительная ткань и рубец. При репаративных процессах в очаге воспаления регенерация клеток и рост соединительной ткани достигаются через усиление пролиферации. Стимуляторами пролиферации также выступают факторы роста. Ведущие факторы роста для различных клеток могут различаться. Так, если для эндотелиоцитов основным можно назвать сосудистый эндотелиальный фактор роста (VEGF), то для фибробластов – фактор роста фибробластов (FGF), а для эпителиальных клеток – эпидермальный фактор роста (EGF).
Исходы острого воспаления
Исходы острого воспаления зависят от этиологического фактора, вызывающего первичное повреждение, а также от реактивности организма, которая определяет степень вторичного повреждения и степень регенерации.
Благоприятный исход воспаления - полное восстановление структуры и функции происходит при воспалении в хорошо регенерирующих тканях при условии сравнительно небольшого объема поврежденной ткани за счет роста соединительной ткани и паренхимы, которые идут одновременно с ростом сосудов. По своей пролиферативной активности ткани делятся на 3 типа: с высокой пролиферативной активностью (костный мозг, эпителий кожи и слизистых); с возможной пролиферативной активностью в условиях повреждения (гепатоциты); непролиферирующие ткани (нервная, мышечная).
Процессы пролиферации имеют не только механизмы стимулирующей, но и тормозной регуляции, что также очень важно. Так, фибробласты, участвующие в регенерации ткани, постепенно утрачивают свою пролиферативную активность, что предотвращает их чрезмерную пролиферацию. При этом происходит угнетение экспрессии факторов роста и рецепторов к ним. Важным объектом в механизме регуляции пролиферативной активности клеток являются коннексины, молекулы, которые образуют не только межклеточные контакты, но и формируют каналы, через которые проникают ионы кальция, цАМФ, влияющие на пролиферативную активность клеток. Угнетение пролиферативной активности клеток достигается с помощью так называемого феномена «контактного торможения», когда при достижении определенной плотности клеточных контактов начинается торможение пролиферативной активности на уровне регуляции генома клетки.
Относительно благоприятный исход воспаления – Неполное восстановление структуры (рубец) возникает в любой ткани при выраженной гибели клеток, либо при любом повреждении тканей с возможной пролиферативной активностью или непролиферирующих тканей (рубцы на коже при механической травме или ожоге, постинфарктный кардиосклероз). При увеличении пролиферативной активности фибробластов и недостаточной тормозной регуляции возможна их избыточная пролиферация, что проявляется в виде гипертрофических и келоидных рубцов. Появление таких рубцов отчасти имеет генетическую предрасположенность, связанную с некоторыми генами по системе HLA (HLA BW16, HLA BW21). Доказано, что фибробласты в гипертрофических и келоидных рубцах более активны, вырабатывают больше коллагена, фибронектина и протеогликанов, а также имеют нарушенную чувствительность к механизмам регуляции.
Формирование дефекта ткани – еще один вариант относительно благоприятного исхода воспаления. При недостаточной активности пролиферативных процессов на фоне хронической гипоксии ткани, например, при патологии микрососудов при диабетической микроангиопатии или при хронической венозной недостаточности, процессы пролиферации могут существенно запаздывать. А несоответствие между естественной убылью клеток и их восстановлением может привести к образованию дефекта ткани (язве).
Неблагоприятные исходы воспаления :
Гибель органа или ткани возникает при чрезвычайно сильном первичном повреждении и при нарушении реактивности организма, например, на фоне нарушения кровообращения (гангрена).
Генерализация воспаления (сепсис) связана с поступлением в кровь большого количества цитокинов (ИЛ-1b, ИЛ-6, ФНО-a) и развитием «синдрома системного воспалительного ответа». Генерализация инфекции за пределы очага воспаления осуществляется через лимфатические и кровеносные сосуды.
Хроническое воспаление лежит в основе множества распространенных болезней: от ревматоидного артрита и туберкулёза до пневмокониозов и атеросклероза. Главной причиной перехода острого воспаления в хроническое является длительное перманентное повреждение ткани инфекционными или неинфекционными факторами. Хроническое инфекционное воспаление возникает в двух случаях: 1 – при развитии иммунодефицита, когда иммунная система организма не справляется с инфекцией; 2 – при заболевании, вызванном специфической инфекцией и исходной несостоятельностью иммунитета против возбудителя (микоплазмы, спирохеты, хламидии, простейшие и др.). Хроническое неинфекционное воспаление развивается также по двум причинам: 1 – при длительном действии на ткань чужеродных эндо- или экзогенных повреждающих факторов (компоненты пыли, инородное тело в ткани); 2 – при развитии аутоиммунного процесса, когда происходит постоянное повреждение ткани аутоантителами или сенсибилизированными лимфоцитами.
Механизмы хронического воспаления отличаются от механизмов острого воспаления, равно как различается их клеточный состав. Если при остром воспалении главными эффекторными клетками являются нейтрофильные гранулоциты, то при хроническом воспалении это моноциты/макрофаги и лимфоциты. Особенностьхронического воспаления заключается вмононуклеарной инфильтрации пораженных тканей лимфоцитами и макрофагами. Часто возникает накопление и длительное активное функционирование макрофагов в очагах воспаления. Этому способствуют факторы, ингибирующие миграцию макрофагов - окисленные липиды, а также пептиды, выделяемые Т-лимфоцитами (MIF).
Для хронического воспаления, связанного с действием инфекции характерен механизм гиперергической реакции замедленного типа (ГЗТ). Цитокины, выделяемые при макрофагально-лимфоцитарной инфильтрации, взаимно активируют лимфоциты и макрофаги, создавая порочный круг, поддерживающий существование воспаления, в особенности моноцитарный хемотаксический белок -1 (MCP-1) и макрофагальный воспалительный протеин-бета (MIP-1β).
Ангиогенез в зоне хронического воспаления:Хроническое воспаление сопровождается высокой пролиферативной активностью компонентов сосудистой стенки и ростом сосудов (ангиогенезом) за счет таких факторов роста как фактор роста фибробластов (α- FGF и β-FGF). Трансформирующего фактора роста (TGF-β), который имеет проангиогенный характер действия, стимулирует дифференцировку гладкомышечных клеток и формирование базальной мембраны сосудов.
Системные ответы при остром воспалении
Системные ответы организма на острое воспаление называют реакцией острой фазы воспаления . Воспаление, как правило, сопровождается не только местными, но и системными реакциями. Системные реакции организма на воспаление преимущественно связаны с выделением в кровь цитокинов. Основными цитокинами, которые вызывают системную реакцию являются интерлейкин-1 β (Il-1b), интерлейкин-6(Il-6), а также фактор некроза опухоли альфа (TNF-a).
· Острое воспалениевызывает снижение аппетита, плохое самочувствие, сонливость, снижение толерантности к физической и умственной нагрузке. Цитокины (в первую очередь TNF-a и IL-1) воздействуют на зоны гипоталамуса и другие структуры ЦНС, отвечающих за сон, вызывая их стимуляцию. Поэтому при остром воспалении больные, как правило, испытывают общую сонливость и недомогание, которые нередко называют признаками «интоксикации». Часть цитокинов, например IL-1, вырабатывается микроглией под действием провоспалительных стимулов. Влияние цитокинов на центр терморегуляции в гипоталамусе приводит к развитию лихорадки. Цитокины также изменяют функциональную активность ядер гипоталамуса, влияя на образование нейромедиаторов.
· В результате активации гипоталамо-гипофизарно-надпочечниковой системы, повышается уровень катехоламинов и глюкокортикоидов.
· Костномозговой ответ на острое воспаление заключается активации лейкопоэза, что приводит к увеличению числа лейкоцитов в крови (лейкоцитоз) и, в меньшей степени, усиливается продукция тромбоцитов. На фоне таких изменений со стороны лейкоцитов и тромбоцитов происходит некоторое угнетение эритропоэза, что сопровождается анемией.
· Белковосинтетическая функция печени: цитокины, в первую очередь интерлейкин-6, увеличивают образование в печени белков острой фазы. «Белки острой фазы» - общее название белков, образующихся в печени при воспалении, которые обладают защитной функцией. Они принимают участие в антимикробной, антиоксидантной, антитоксической защите и являются частью системы гемостаза.
· ЖКТ: уменьшение секреции желудочного сока, тормозится моторика желудочно-кишечного тракта.
Cтраница 1
Воспалительный очаг, возникающий в роговице, вызывает раздражение нервных окончаний, что влечет за собой типичную ответную реакцию: светобоязнь, слезотечение, блефароспазм, чувство инородного тела под веком. Сочетание этих субъективных признаков принято называть роговичным синдромом. При наличии такого синдрома следует тщательно осматривать роговицу. Воспалительный инфильтрат в роговице сопровождается покраснением глаза. При этом в процесс бывают вовлечены глубокие сосуды перилимбальной области. Кровенаполнение и расширение этих сосудов обусловливает ярко-фиолетовое окрашивание в форме венчика, окружающего роговицу. Такая локальная гиперемия глаза носит название п е р и-корнеальной инъекции.
Дифференциация свежего воспалительного очага и старого рубцового помутнения очень важна при диагностике и выборе метода лечения. Особенно важно об этом помнить при рецидивирующих заболеваниях, чтобы отличить старый очаг от нового, конъюнктивит на глазу с бельмом от кератита, иридоциклит при наличии рубцов роговицы от кератоирита.
Источником передних остеопериоститов бывают воспалительные очаги в соседних с орбитой тканях век, периорбиталь-ной области, слезных органов, кожи лица, но чаще всего они исходят из придаточных пазух носа при эмпиемах последних, из кариозных зубов, а у детей в возрасте до 3 месяцев - из их зачатков. Воспалительный процесс распространяется из первичного очага по продолжению или по венозным сосудам при тромбофлебитах. При общих инфекциях воспалительный процесс в костных стенках орбиты может возникнуть гематогенно-метастатическим путем.
Локализация коллоидальных красок в воспалительных очагах побудила использовать радиоактивные производные этих красок для обнаружения внутренних абсцессов. Для этой цели был синтезирован дибромтрипан. У кроликов вызывались поражения инъекцией вирулентных стафилококков около агаровой массы, желатинизиро-ванной в подкожной ткани.
Выписка реконвалесцентов возможна после клинического выздоровления и исчезновения воспалительного очага в легких. После выписки из стационара с целью профилактики остаточных явлений и возможности рецидива необходима диспансеризация в течение 1 - 2 лет.
Очевидно, приходится признать, что между активностью воспалительного очага в глазу и общим иммунобиологическим состоянием больного существует некоторое взаимодействие. И если возможность бурной вспышки туберкулезного процесса в глазу в сильной степени зависит от общего иммунобиологического состояния организма, то и сам воспалительный глазной очаг, со своей стороны, способен в какой-то мере влиять на общую чувствительность. Подобный вопрос уже неоднократно ставился, но до сих пор не получил еще достаточно убедительного разрешения. Во всяком случае, мало убедительными представляются соображения Лелейна (Lohlein, 1950) о том, что размеры глазного воспалительного очага являются слишком незначительными, чтобы он мог оказывать сколько-нибудь заметное влияние на состояние иммунитета всего организма. Как известно, реакция организма на воспалительный, в том числе и туберкулезный, очаг определяется отнюдь не размерами этого последнего, но количеством и вирулентностью содержащихся в нем патогенных микроорганизмов. И если какие-либо островоспалительные заболевания роговой оболочки или других бедных сосудами тканей глаза действительно не дают обычно выраженных общих реакций, то зависит это не столько от малых размеров глазного очага, сколько от его изолированности от общей системы кровообращения. При увеальной локализации глазного очага условия для активного взаимодействия между воспалительным процессом в глазу и общим иммунобиологическим состоянием больного являются, конечно, несравненно более благоприятными. Наглядным подтверждением этого могут служить многочисленные клинические наблюдения, показывающие постепенное уменьшение интенсивности реакции на внутри-кожное введение туберкулина по мере успокоения островоспалительного глазного процесса у больных с передними и с задними увеитами туберкулезной этиологии. Особенно интересно наблюдать в динамике параллельный спад интенсивности глазного процесса в задних отделах увеального тракта, где затихание хориоидального воспаления сразу же сказывается уменьшением набухлости окружающей сетчатки и соответствующим повышением остроты зрения и постепенным уменьшением размеров и интенсивности гиперемии и папулы, возникающих на месте внутрикожного введения туберкулина.
Как известно, ускоренный и усиленный выход трипанового синего в пределах воспалительного очага в ткани обусловлен нарушением проницаемости кровеносных сосудов. Поскольку, судя по использованному тесту, проницаемость после введения ацетоксана менее нарушена, следует заключить, что ацетоксан оказывает известное нормализующее влияние на проницаемость, предотвращая ее нарушения в очаге воспаления.
Современные представления не исключают возможности включения процессов пролиферации и дифференцировки лимфоцитов непосредственно в воспалительном очаге. Во всяком случае, все необходимые популяции клеток здесь присутствуют: Т - хелперы, В-клетки и макрофаги в качестве антигенпре-зентируюших.
Клинические наблюдения могут нередко представить нам столь же несомненные доказательства явного влияния активно развивающегося туберкулезного воспалительного очага в уве-альном тракте больного глаза на общее иммунобиологическое состояние больного.
Конечно, сам по себе положительный результат внутрикож-ной туберкулиновой пробы Манту у больного с воспалительным очагом в увеальном тракте глаза не может рассматриваться как доказательство туберкулезной природы глазного процесса. Однако если гари этом дело касается человека, у которого даже самое тщательное и всестороннее обследование не позволило обнаружить никаких других активных воспалительных очагов в организме, кроаде только одного бурно развивающегося воспалительного очага в глазу, то к положительным результатам пробы Манту приходится отнестись уже с известным вниманием. В этом отношении следует упомянуть и о некоторых статистических данных.
Все приведенные соображения касаются, конечно, только тех случаев, когда в глазу имеется активный воспалительный очаг. Если же там сохранились лишь рубцовые остатки давно отзвучавшего воспаления, то ни рентгенограмма, ни кожные туберкулиновые пробы уже не смогут помочь нам разгадать этиологию того процесса, который оставил после себя все эти изменения.
Материалом для исследования служат гной из свищей и язвенных поражений, соскобы с краев язв, пунктаты закрытых воспалительных очагов, биоптаты пораженных тканей.
При своевременно начатом лечении улучшение наступает через 2 - 3 дня: снижается температура, уменьшаются симптомы интоксикации, подвергаются обратному развитию воспалительные очаги. Однако в большинстве случаев одной антибактериальной терапии недостаточно и поэтому следует проводит патогенетическое лечение: специфический гамма-глобулин, кортико-стероиды (по 70 - 100 мг в сутки) перорально в течение 5 - 6 дней.
Лечение герпетических кератитов комплексное: использование противовирусных средств, иммунотерапия, методы, стимулирующие регенерацию и трофику роговицы, физическое воздействие на воспалительный очаг в роговице и хирургическое лечение.
Вдыхание хлора вызывает резкий кашель и удушье, воспаление слизистых оболочек дыхательных путей, отек легких, а в дальнейшем образование в легких воспалительных очагов.
Как известно, острое воспаление характеризуется определенной последовательностью сосудистых изменений, проявляющихся развитием спазма сосудов, артериальной, венозной гиперемии и стаза.
Спазм сосудов - реакция кратковременная. Спазм может длиться от нескольких секунд (при легком повреждении ткани) до нескольких минут (при тяжелом повреждении). Такая реакция сосудов в очаге воспаления не является строго обязательной и не проявляется в ряде случаев при повреждении паренхиматозных органов. Возникновение спазма сосудов в зоне воспаления обусловлено сокращением гладкомышечных элементов сосудов в ответ на их повреждение, а также возбуждением вазоконстрикторов под влиянием сильного, быстродействующего альтерирующего фактора. Кратковременность этой стадии определяется быстрой инактивацией вазоконстрикторных медиаторов - норадреналина, адреналина под влиянием моноаминоксидазы. Возможно, что в механизмах спазма сосудов в зоне воспаления принимает участие серотонин, освобождающийся в большом количестве при повреждении тканей из тромбоцитов и лаброцитов. Внешним проявлением спазма сосудов является побледнение участка ткани, где развивается воспалительный процесс.
Стадия артериальной гиперемии характеризуется умеренным расширением мелких артерий, артериол, капилляров, венул, а также функционированием резервных капилляров (феномен новообразования капилляров). Расширение сосудов вызывает увеличение кровенаполнения ткани, усиление лимфообразования и лимфооттока. Приток крови может несколько превышать ее отток, что способствует возрастанию гидродинамического давления в сосудах, увеличению линейной и объемной скорости движения крови, снижению артериовенозной разницы по кислороду. На этой стадии формируются такие внешние признаки воспаления, как покраснение и повышение температуры. Усиление оксигенации ткани активирует обмен веществ в клетках, способствует появлению активных форм кислорода, которые, с одной стороны, могут оказывать повреждающее действие на интактные клетки и соединительную ткань, а с другой - становятся факторами защиты организма от инфекционных патогенных агентов, а в дальнейшем оказывают стимулирующее влияние на процессы пролиферации в зоне воспаления. По мере развития артериальной гиперемии к очагу воспаления усиливается приток гуморальных факторов защиты - комплемента, пропердина, фибронектина, интерферона, церулоплазмина и др. Интенсивный кровоток обеспечивает вымывание токсических продуктов обмена, факторов патогенности, продуцируемых микроорганизмами, биологически активных веществ. В ряде случаев, при снижении реактивности организма, за счет интенсивного кровотока могут произойти диссеминация инфекции и развитие септического состояния. Артериальная гиперемия может продолжаться в течение нескольких часов и суток, она наиболее выражена по периферии зоны альтерации. В основе развития артериальной гиперемии лежат несколько механизмов :
1. Нейрогенный - за счет активации аксонрефлекса, усиления холинергических и гистаминергических нервных влияний на сосудистую стенку, а также повреждения сенсорных пептидергических нервных волокон, участвующих в ноцицепции и выделении сенсорных нейропептидов - субстанции Р, пептида гена, родственного кальцитонину, пептида протеинового гена. Указанные нейропептиды обладают выраженным сосудорасширяющим действием.
2. Нейропаралитический - за счет пареза симпатических вазоконстрикторов и снижения чувствительности адренорецепторов сосудов.
3. Миопаралитический - за счет снижения базального тонуса сосудов под влиянием умеренных концентраций вазоактивных соединений (гистамин, кинины, лейкотриены и др.), а также за счет Н+- и К+-гиперионии. По мере нарастания воспалительного процесса артериальная гиперемия сменяется венозной.
Венозная гиперемия характеризуется дальнейшим расширением сосудов, снижением скорости кровотока, полнокровием ткани, феноменом краевого стояния лейкоцитов и их эмиграцией, нарушением реологических свойств крови, усилением процессов экссудации.
Факторы, влияющие на переход артериальной гиперемии в венозную, можно разделить на две группы: внутрисосудистые и внесосудистые .
К внутрисосудистым факторам, вызывающим развитие венозной гиперемии, относятся набухание эндотелиальных клеток, краевое стояние лейкоцитов, активация системы гемостаза, сладжирование эритроцитов, сгущение крови, повышение ее вязкости, образование микротромбов.
Из внесосудистых факторов наибольшее значение имеют отек ткани и сдавление венул, мелких вен, лимфатических сосудов экссудатом. Усиливают венозную гиперемию избыточное накопление в очаге воспаления медиаторов с сосудорасширяющим действием, ферментов лизосом и ионов водорода, а также нарушение околокапиллярного соединительнотканного скелета и десмосом в зоне первичной и вторичной альтерации.
Внешними проявлениями венозной гиперемии являются отек ткани, цианоз, снижение обменных процессов и как следствие - снижение температуры в очаге воспаления. Усиление гипоксии и ацидоза стимулирует развитие соединительнотканных элементов по периферии очага воспаления и тем самым обеспечивает формирование барьера, отделяющего воспалительный очаг от здоровой ткани. В образовании барьера принимают участие также нейтрофилы и мононуклеары.
Ограничение кровотока в участке венозной гиперемии и образование барьеров способствуют уменьшению резорбции из очага воспаления продуктов распада, токсических факторов, а также снижают риск распространения инфекционных агентов. Однако при развитии воспаления в паренхиматозных органах длительная венозная гиперемия может привести к снижению их специализированных функций и развитию склерозирования клеток .
Исходом венозной гиперемии является стаз - полная остановка кровотока в сосудах. Распространенный стаз характерен для острого, быстроразвивающегося воспаления (гиперергического). Продолжительность и исход стаза могут быть различны. Стаз может длиться от нескольких часов до нескольких дней; он может быть обратимым и необратимым .
Механизмы эмиграции лейкоцитов. Роль лейкоцитов в очаге воспаления
Как уже было отмечено, важнейшим признаком венозной гиперемии является эмиграция лейкоцитов из сосудов в воспаленную ткань. Последовательность выхода лейкоцитов получила название закона Мечникова, согласно которому спустя несколько часов (1, 5-2 часа) с момента действия альтерирующего фактора интенсивно эмигрируют нейтрофилы и другие сегментоядерные лейкоциты, а затем моноциты и лимфоциты.
Процессу эмиграции предшествует нарушение осевого тока движения крови внутри сосуда. В условиях замедления кровотока эритроциты, объединяясь в «монетные столбики», занимают центральную часть сосуда, а лейкоциты, имеющие более низкую удельную массу, выходят из осевого тока сначала на границу плазматического слоя, а затем начинают прилипать к эндотелиальным клеткам сосуда. Важная роль в адгезии (лат. adhaesio -прилипание) лейкоцитов отводится так называемым эндотелиально-лейкоцитарным адгезивным молекулам (ЭЛАМ), которые экспрессируются на поверхности лейкоцитов, эндотелиальных клеток и макромолекулах межклеточного матрикса в очаге воспаления . Активаторами экспрессии ЭЛАМ на лейкоцитах и эндотелиальных клетках в зоне воспаления являются биологически активные вещества - цитокины, такие как ИЛ-1, ИЛ-8, ЛТ В4, ФАТ, ФНО-a, a-интерферон, фракции комплемента С5а и Bb, хемотаксические факторы, липополисахариды бактерий и др. Под влиянием указанных медиаторов в лейкоцитах и клетках эндотелия сосудов происходят конформационные изменения мембраны, освобождаются и экспресссируются молекулы адгезии. Большинство цитокинов в одинаковой степени влияет на адгезивность лейкоцитов и эндотелия, однако отмечается и избирательное действие медиаторов на различные клетки. Так, ЛТ В4 индуцирует появление молекул адгезии на нейтрофилах, ИЛ-1 - на эндотелии сосудов, компоненты комплемента - на моноцитах и гранулоцитах.
В настоящее время известно несколько классов молекул клеточной адгезии:
1. Селектины - лектиновые молекулы клеточной адгезии, опосредующие самую раннюю стадию взаимодействия лейкоцитов и сосудистой стенки. Селектины экспрессируются рано и не обеспечивают прочного прикрепления лейкоцитов к эндотелию сосудов. Выделяют три вида селектинов: L-селектины синтезируются всеми лейкоцитами,
Е-селектины синтезируются эндотелиоцитами. Указанные селектины обеспечивают феномен краевого стояния лейкоцитов. Источником
P-селектинов являются тромбоциты и эндотелий сосудов, помимо участия в процессах маргинации лейкоцитов, они способствуют адгезии тромбоцитов.
2. Интегрины - это гетеродимерные белки, экспрессируемые различными лейкоцитами и клетками гемопоэтического ряда. Эндотелий экспрессирует лишь некоторые интегрины. В настоящее время идентифицировано пять видов интегринов. Наиболее важными для миграционного и фагоцитарного процесса являются три гетеродимера. Указанные интегрины ответственны за поздние стадии взаимодействия лейкоцитов, тромбоцитов и эндотелия сосудов.
3. Адгезивные молекулы суперсемейства иммуноглобулинов (ICAM) - трансмембранные протеины с пятью внеклеточными доменами, экспрессируемые преимущественно эндотелием. Некоторые из этих молекул синтезируются неактивированными клетками и определяют интенсивность физиологической миграции лейкоцитов. В зоне воспаления под влиянием ИЛ-1, ФНО, гамма-интерферона активируются синтез и экспрессия молекул ICAM, что обеспечивает отсроченную фазу адгезии и эмиграции лейкоцитов. В группу белков, подобных иммуноглобулинам, включены лимфоцитарные рецепторы - СD2, СD58 (LFA-3). Они экспрессируются на Т-лимфоцитах и антигенпредставляющих клетках, участвуют в презентации антигена и контакте цитотоксических лимфоцитов с клетками-мишенями.
4. Адрессины - белки эндотелиальных клеток венул лимфоидных органов. Имеют большое значение в миграции лимфоцитов в очаги хронического и аутоиммунного воспаления. При остром воспалении адрессины менее значимы.
5. Хрящевые соединительные белки. Экспрессируются всеми видами лейкоцитов, распознают гиалуроновую кислоту, что обеспечивает перемещение лейкоцитов в основном веществе соединительной ткани .
При недостаточном образовании селектинов и интегринов или выработке антител к мембранным рецепторам снижаются адгезивные свойства лейкоцитов, нарушается их способность к эмиграции, накоплению в очаге воспаления и фагоцитозу, что может способствовать частым гнойным инфекциям и развитию сепсиса.
Важная роль в процессах адгезии и эмиграции принадлежит устранению отрицательного заряда эндотелиальных клеток и лейкоцитов за счет накопления в очаге воспаления одновалентных и двухвалентных ионов (Н, К, Са, Mn, Mg) , а также катионных белков, выделяемых лейкоцитами. Факторами инициации адгезии лейкоцитов к стенке сосуда являются комплемент (С5а), лейкотриены, фибронектин, иммуноглобулины (Fc-фрагмент IgG), гистамин.
После адгезии происходят перемещение лейкоцита по поверхности эндотелиоцита к межэндотелиальной щели, которая в очаге воспаления значительно расширена, а затем и образование ложноножки и передвижение лейкоцита через межэндотелиальную щель в подэндотелиальное пространство и базальную мембрану сосуда. Таким образом лейкоциты оказываются за пределами сосуда.
В большинстве случаев острого воспаления внутрисосудистые перемещения лейкоцитов и их эмиграция занимают несколько часов. Как правило, первыми в очаг воспаления выходят нейтрофилы, они обнаруживаются в воспаленной ткани уже через 6-24 часа. Несколько позднее эмигрируют моноциты и лимфоциты (24-48 часов). Такая асинхронность эмиграции клеток обусловлена неодновременным появлением молекул адгезии и хемотаксических факторов, специфичных для разных лейкоцитов.
Нужно отметить, что временные интервалы эмиграции лейкоцитов и последовательность их выхода весьма относительны и определяются типом сосуда, видом воспаления и стадией воспаления.
Так, в зоне воспалительного процесса, инициируемого возбудителями туберкулеза, листериоза, хламидиоза, токсоплазмоза, вирусной инфекцией, первоначально в очаге воспаления доминируют мононуклеары, при аллергических реакциях - эозинофилы.
Направленное движение лейкоцитов обеспечивается хемоаттрактантами, концентрация которых по мере развития вторичной альтерации в очаге воспаления нарастает, а также наличием рецепторов к различным хемоаттрактантам на поверхности лейкоцитов.
При взаимодействии рецепторов и хемоаттрактантов возникает гиперполяризация мембраны лейкоцита, увеличивается ее проницаемость для ионов Са, инициируется синтез функционально активных фосфолипидов и циклических нуклеотидов, растет число внутриклеточных органелл, функционирование которых обеспечивает перемещение лейкоцита и секрецию содержимого гранул. Помимо ориентированного движения лейкоцитов, хемоаттрактанты индуцируют адгезию лейкоцитов к эндотелию, способствуют краевому стоянию лейкоцитов и их агрегации в просвете микрососудов. Хемотаксис опосредуется различными группами веществ:
1. Цитотаксигенами, которые, не являясь хемоаттрактантами, генерируют факторы хемотаксиса.
2. Цитотаксинами, которые оказывают прямое воздействие на лейкоциты. Некоторые цитотаксины специфичны для нейтрофилов (например, экстракт культуры Е.coli) , а другие цитотаксины индуцируют миграцию гранулоцитов и моноцитов .
Хемоаттрактанты могут иметь эндогенное и экзогенное происхождение. Экзогенными хемоаттрактантами являются пептиды бактерий, особенно содержащие N-формиловые группы. Свойствами эндогенных хемоаттрактантов обладают компоненты комплемента, иммуноглобулины, иммунные комплексы, лимфокины и монокины, кинины, лейкотриен В4, продукты липоксигеназного пути превращения арахидоновой кислоты, фактор, активирующий тромбоциты, фактор Хагемана, лизосомальные ферменты и другие.
Роль лейкоцитов в очаге воспаления
Эмигрировавшие в зону воспаления нейтрофилы являются активными фагоцитами, которые очищают зону воспаления от инфекционных возбудителей. Адгезия нейтрофилов к объекту фагоцитоза ускоряется благодаря опсонинам - активным белковым молекулам, прикрепляющимся к объекту и облегчающим распознавание объекта фагоцитирующими клетками. Одновременно с процессами направленного движения лейкоцитов и фагоцитозом в них происходит респираторный взрыв - резкое увеличение потребления кислорода для образования бактерицидных свободных кислородных радикалов (синглетный кислород, гидроксильный радикал, перекись водорода, супероксидный анион). Образование активных форм кислорода происходит с участием ферментов миелопероксидазы, супероксиддисмутазы и каталазы. Освобождающиеся в очаге воспаления активные формы кислорода являются высокотоксичными факторами для бактерий, грибов, микоплазм, вирусов, хламидий и других возбудителей, они нарушают структуру и функции мембран микробных клеток, ограничивают их жизнедеятельность или вызывают гибель микроорганизмов. Помимо антимикробной активности, усиление свободнорадикальных процессов вызывает повреждение интактных паренхиматозных клеток, эндотелиальных клеток сосудов и элементов соединительной ткани в очаге воспаления, что способствует дальнейшей альтерации ткани.
Кроме вновь синтезирующихся факторов оксидантной системы, в гранулах нейтрофилов содержатся лизоцим, лактоферрин, катионные белки, щелочная и кислая фосфатазы, рибонуклеаза, дезоксирибонуклеаза, гиалуронидаза, b-глюкуронидаза, эластаза, коллагеназа, ФАТ, кинины, лейкоцитарный пироген, хемотаксические факторы.
Таким образом, накопление нейтрофилов в очаге воспаления и освобождение ими указанных биологически активных веществ вызывают гибель или ограничение жизнедеятельности микроорганизмов, разрушение и лизис омертвевших тканей, очищение зоны повреждения . За счет нейтрофилов вокруг очага воспаления формируется нейтрофильный защитный барьер, который отграничивает зону повреждения (совместно с моноцитарным и фибробластическим) от здоровой ткани и препятствует распространению инфекции и токсических повреждающих факторов.
Высокоактивные медиаторы нейтрофилов участвуют в развитии вторичной альтерации, стимулируют выход биологически активных веществ из других клеток, способствуют расширению сосудов, увеличению их проницаемости, экссудации плазмы и эмиграции лейкоцитов. Поступая в системный кровоток, они вызывают проявление некоторых системных эффектов воспалительного процесса.
Эмигрировавшие в зону воспаления эозинофилы также обладают способностью фагоцитировать бактерии, грибы, иммунные комплексы. Они содержат примерно такой же набор ферментов, как и нейтрофилы (кроме лизоцима). Однако в фагоцитозе участвует меньший процент эозинофилов, и он протекает менее интенсивно, чем у нейтрофилов.
Основными факторами, стимулирующими процесс дегрануляции эозинофилов, являются иммуноглобулины, иммунные комплексы, комплемент. Продукты секреции эозинофилов ингибируют выделение лаброцитами гистамина и участвуют в его инактивации за счет гистаминазы, эозинофильный катионный протеин связывает и нейтрализует гепарин, высокие концентрации арилсульфатазы инактивируют хемотаксические белки и медленно реагирующую субстанцию анафилаксии, фосфолипазы В и D инактивируют тромбоцитактивирующий фактор. Под влиянием эндотоксинов и в процессе фагоцитоза эозинофилы продуцируют и выделяют эндогенный пироген, обеспечивающий развитие лихорадочной реакции, сопровождающей воспалительный процесс.
Медиаторы эозинофилов, так же как и нейтрофилов, могут участвовать в реакциях повреждения ткани и распространении вторичной альтерации.
Базофильные лейкоциты, как и другие гранулоциты, обладают способностью к фагоцитозу, но их фагоцитарная активность довольно низка. В зоне инфекционного и аллергического воспаления возникает реакция дегрануляции базофилов с выделением медиаторов воспаления - гистамина, гепарина, фактора активации тромбоцитов, лейкотриенов, калликреина, эозинофильного хемотаксического фактора, ферментов.
Вслед за гранулоцитами в очаге воспаления накапливаются мононуклеары. Моноциты, эмигрировавшие в ткани, превращаются в тканевые макрофаги. В зоне воспаления происходит накопление макрофагов за счет эмиграции моноцитов из кровеносного русла, а также за счет мобилизации тканевых макрофагов. Макрофаги обеспечивают фагоцитоз не только инфекционных возбудителей воспалительного процесса, но и клеточный детрит, тем самым очищая зону альтерации и подготавливая ее к последующей регенерации и репарации. Мононуклеарные фагоциты участвуют в обеспечении неспецифической защиты организма посредством фагоцитоза, секреции гуморальных факторов, таких как лизоцим, a-интерферон, ФНО, компоненты комплемента. В очаге воспаления макрофаги приобретают более выраженные антимикробные свойства благодаря фагоцитозу антимикробных компонентов, продуцируемых нейтрофилами (миелопероксидазы и катионных белков). Таким образом, макрофаги приобретают способность галоидировать белки. Микробицидная функция макрофагов реализуется через продукты «респираторного взрыва», секреции монокинов, лизосомальных ферментов. Окислительные реакции сопровождаются накоплением в очаге воспаления высокотоксичных продуктов ПОЛ, вызывающим дальнейшую деструкцию клеток, сосудов и элементов соединительной ткани.
При наличии этиологического агента в виде бактериального возбудителя моноциты/макрофаги являются антигенпрезентирующими клетками, обеспечивающими запуск иммунного ответа организма. В процессе представления антигена активированные макрофаги секретируют и освобождают такие цитокины, как ФНО, интерлейкины (ИЛ-1, ИЛ-3, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-12, ИЛ-15), компоненты комплемента, хемотаксические факторы . Выделение зрелых форм интерлейкинов из клеток начинается уже через 2 часа после антигенной стимуляции и продолжается в течение 24-48 часов. Моноциты/макрофаги в зоне воспаления являются источником лизосомальных протеаз - коллагеназы, эластазы, ангиотензин конвертазы, активатора плазминогена; адгезивных веществ - фибронектина, тромбоспондина, протеогликанов; факторов роста - колониестимулирующих факторов, фактора роста фибробластов; эндогенных пирогенов.
Под действием пусковых медиаторов макрофагов в очаге воспаления происходит активация различных типов лейкоцитов, клеток соединительной ткани, эндотелия сосудов, паренхиматозных клеток, что приводит к синтезу и секреции биологически активных соединений, оказывающих повреждающие, защитные и системные эффекты.
Интенсивная эмиграция лимфоцитов в зону воспаления в большинстве случаев осуществляется после эмиграции нейтрофилов и моноцитов. Стимулированные лимфоциты выделяют биологически активные вещества - лимфокины, обеспечивающие развитие иммунного ответа, аллергических реакций, процессов пролиферации и репарации.
Все лейкоциты в зоне воспаления довольно быстро подвергаются жировой дегенерации, превращаются в гнойные тельца и удаляются вместе с гноем. В очаге воспаления возможны два пути гибели лейкоцитов.
Первый - грубое повреждение мембраны, нарушение целостности клетки и ее некроз, что возможно в очаге первичной и вторичной альтерации под влиянием самого повреждающего агента и различных цитотоксических медиаторов воспаления.
Второй - более мягкий, запрограммированный путь клеточной гибели, или апоптоз. При апоптозе наблюдаются уменьшение ядра лейкоцита, конденсация ядерного хроматина, фрагментация ДНК, подавление транскрипции, снижение синтеза рибосомной РНК и белков. Стареющие нейтрофилы теряют способность секретировать лизосомальные ферменты, и это исключает дальнейшее повреждение ткани. Макрофаги активно фагоцитируют апоптозные нейтрофилы. Поглощение апоптозных нейтрофилов обеспечивается взаимодействием тромбоспондина, секретируемого макрофагом и рецепторами нейтрофила . Путем апоптоза могут удаляться из очага воспаления не только нейтрофилы, но и эозинофилы и лимфоциты.
Макрофаги . Установлено, что активированные макрофаги синтезируют особое вещество, получившее название интерлейкин-1 (ИЛ-1). Оно выделяется макрофагами в среду и распространяется по всему организму, где оно находит свои мишени, которыми являются миоциты, синовиоциты, гепатоциты, костные клетки, лимфоциты, нейроциты. По-видимому, на мембранах этих клеток имеются специфические рецепторы, благодаря которым ИЛ-1 действует именно на них, а не на другие клетки. Действие это стимулирующее и более всего изучено применительно к гепатоцитам и лимфоцитам. Действие ИЛ-1 универсально, т.е. срабатывает при любом инфекционном (воспалительном) заболевании, причем в самом начале, и таким образом дает сигнал указанным органам включиться в воспалительный (инфекционный) процесс. Есть основание предполагать, что характерные для ранних этапов заболевания симптомы (головная боль, боль в мышцах и суставах, сонливость, лихорадка, лейкоцитоз и увеличение содержания белков, в том числе иммуноглобулинов) объясняется именно действием ИЛ-1 (рис. 12.3).
Роль макрофагов не ограничивается секрецией ИЛ-1. В этих клетках синтезируется еще целый ряд биологически активных веществ, каждое из которых делает свой вклад в воспаление. К ним относятся: эстеразы, протеазы и антипротеазы; лизосомальные гидролазы - коллагеназа, аластаза, лизоцим, α-макроглобулин; монокины - ИЛ-1, колониестимулирующий фактор, фактор, стимулирующий рост фибробластов; антиинфекционные агенты - интерферон, трансферрин, транскобаламин; компоненты комплемента: С1, С2, СЗ, С4, С5, С6; дериваты арахидоновой кислоты: простагландин Е2, тромбоксан А2, лейкотриены. Не следует забывать также важнейшую функцию макрофагов - фагоцитоз.
Тучные клетки . Роль этих клеток в воспалении заключается в том, что они при повреждении выбрасывают содержащиеся в их гранулах гистамин и гепарин. А так как эти клетки в большом количестве располагаются по краям сосудов, то и действие указанных веществ проявится прежде всего на сосудах (гиперемия).
Макрофаги и лаброциты находятся в тканях постоянно (клетки-резиденты). Другие клетки воспаления проникают в зону воспаления со стороны (клетки-эмигранты). К ним относятся полиморфно-ядерные нейтрофилы, эозинофилы и лимфоциты.
Нейтрофилы. Главная функция этих клеток - фагоцитоз. Они выселяются из костного мозга в кровь, эмигрируют из сосудов и в больших количествах скапливаются в воспаленной ткани. И активное их размножение, и миграция, и фагоцитоз подвержены регулирующему влиянию биологически активных веществ (тканевых, системных, организменных). Действие их проявляется, однако, только тогда, когда на клетках имеются рецепторы, специфически реагирующие с медиатором воспаления: гистамином, адреналином, глюкокортикоидами, гамма-глобулинами и т.д.
В цитоплазме нейтрофилов имеется два типа гранул: первичные азурофильные (более крупные) - обычные лизосомы, вторичные, или специфические гранулы мельче, а главное, они содержат другой набор ферментных и неферментных веществ. В первичных гранулах содержатся кислые гидролазы, а кроме того, лизоцим, миелопероксидаза и катионные белки. Вторичные гранулы специфические; содержат щелочную фосфатазу, лактоферрин и лизоцим. Все это важно для понимания участия нейтрофилов в воспалении (см. ниже).
Тромбоциты . Роль тромбоцитов (кровяных пластинок) в воспалении состоит главным образом в том, что они имеют ближайшее отношение к микроциркуляции. Наверное, это самые постоянные и самые универсальные участники воспаления. В них содержатся вещества, влияющие на проницаемость сосудов, на их сократимость, на рост и размножение клеток, а главное - на свертываемость крови.
Лимфоциты. Эти клетки играют роль при любом воспалении, но особенно при иммунном.
Фибробласты . Действие фибробластов проявляется в последней стадии процесса, когда в очаге воспаления увеличивается число этих клеток, оживляется синтез в них коллагена и гликозамингликанов.
Характеристика расстройств микроциркуляции в очаге воспаления, причины их возникновения. Экссудация, механизмы развития. Ее роль при воспалении. Классификация воспаления по виду экссудата.


