02.02.2018
Ferrum 3 o 4 κατάσταση οξείδωσης. Μεγάλη εγκυκλοπαίδεια πετρελαίου και φυσικού αερίου


ΣΤΟ φλοιός της γηςΟ σίδηρος είναι ευρέως διαδεδομένος· αντιπροσωπεύει περίπου το 4,1% της μάζας του φλοιού της γης (4η θέση μεταξύ όλων των στοιχείων, 2η μεταξύ των μετάλλων). Στον μανδύα και στον φλοιό της γης, ο σίδηρος συγκεντρώνεται κυρίως σε πυριτικά άλατα, ενώ η περιεκτικότητά του είναι σημαντική σε βασικά και υπερβασικά πετρώματα και χαμηλή σε όξινα και ενδιάμεσα πετρώματα. Είναι γνωστός ένας μεγάλος αριθμός μεταλλευμάτων και ορυκτών που περιέχουν σίδηρο. Μεγαλύτερης πρακτικής σημασίας είναι το κόκκινο σιδηρομετάλλευμα (αιματίτης, Fe 2 O 3, περιέχει έως και 70% Fe), το μαγνητικό σιδηρομετάλλευμα (μαγνητίτης, FeFe 2 O 4, Fe 3 O 4, περιέχει 72,4% Fe), το καφέ σιδηρομετάλλευμα ή λιμονίτης (γκαιθίτης και υδρογοηθίτης, αντίστοιχα FeOOH και FeOOH nH 2 O) μαγνητίτης αιματίτης λιμονίτης γαιθίτης

Ο Siderite FeCO 3 περιέχει περίπου 35% σίδηρο. Έχει κιτρινωπό λευκό (με γκρι ή καφέ απόχρωση σε περίπτωση μόλυνσης). Το Siderite Mispikel FeAsS περιέχει 34,3% σίδηρο. Το Mispikel Löllingite FeAs 2 περιέχει 27,2% σίδηρο Löllingite ιλμενίτης FeTiO 3 ιλμενίτης μαγνητίτης (Fe, Mg) ινοφερρίτης FeSO 4 (OH) 4,5H 2 O γιαροσίτης KFe 3 (SO 4) 2 (OH) 6 ιαροσίτης


Οι κύριες καταστάσεις οξείδωσης του σιδήρου είναι +2 και +3. Όταν αποθηκεύεται στον αέρα σε θερμοκρασίες έως 200 °C, ο σίδηρος καλύπτεται σταδιακά με ένα πυκνό φιλμ οξειδίου, το οποίο εμποδίζει την περαιτέρω οξείδωση του μετάλλου. Στον υγρό αέρα, ο σίδηρος καλύπτεται με ένα χαλαρό στρώμα σκουριάς, το οποίο δεν εμποδίζει την πρόσβαση οξυγόνου και υγρασίας στο μέταλλο και την καταστροφή του. Η σκουριά δεν έχει μόνιμη χημική σύνθεση, κατά προσέγγιση χημική φόρμουλαμπορεί να γραφεί ως Fe 2 O 3 xH 2 O. οξείδιο σκουριάς

Ο σίδηρος αντιδρά με το οξυγόνο όταν θερμαίνεται. Όταν ο σίδηρος καίγεται στον αέρα, σχηματίζεται οξείδιο Fe 3 O 4, όταν καίγεται σε καθαρό οξυγόνο, σχηματίζεται οξείδιο Fe 2 O 3. Εάν το οξυγόνο ή ο αέρας διοχετεύεται μέσω τετηγμένου σιδήρου, σχηματίζεται οξείδιο FeO. Όταν θερμαίνονται το θείο και η σκόνη σιδήρου, σχηματίζεται θειούχο, ο κατά προσέγγιση τύπος του οποίου μπορεί να γραφτεί ως FeS. oxygenFe 3 O 4Fe 2 O 3 FeO θείο


13. ΣΤΟΙΧΕΙΑ ΥΠΟΟΜΑΔΑΣ ΧΡΩΜΙΟΥ.
ατομικός αριθμός Ονομα Ηλεκτρονικός
διαμόρφωσηρ
g/cm 3tpl.
0Cβράζει
0CΕΟ Ατομικός
ακτίνα κύκλου,
nmΒαθμός
οξείδωση26 Σίδηρος Fe 3d64s2 7,87 1535 2750 1,64 0,128 +2,+3 27 Cobalt Co 3d74s2 8,9 1495 2870 1,7 0,125 +2,+3 28 Νικέλιο Νι 3d8 4s2 8,9 1453 2732 1,75 0,124 +1,+2,+3,+4 Παραλαβή
μέταλλα υποομάδας σιδήρουΑνάκτηση από οξείδια με άνθρακα ή μονοξείδιο του άνθρακα (II)
FeO + C Fe + CO
Fe 2 O 3 + 3CO 2Fe + 3CO 2
NiO + C Ni + CO
Co 2 O 3 + 3C 2Co + 3COFe
δ- στοιχείο της ομάδας VIII. αύξων αριθμός - 26; ατομική μάζα- 56; (26p; 30n), 26eΜέταλλο μέτριας δραστικότητας, αναγωγικός παράγοντας.
Κύριες καταστάσεις οξείδωσης - +2, +3
Ο σίδηρος και οι ενώσεις του
Στον αέρα, ο σίδηρος οξειδώνεται εύκολα παρουσία υγρασίας (σκουριάς):
4Fe + 3O 2 + 6H 2 O 4Fe(OH) 3
Ένα θερμαινόμενο σύρμα σιδήρου καίγεται σε οξυγόνο, σχηματίζοντας άλατα - οξείδιο σιδήρου (II, III):
3Fe + 2O 2 Fe 3 O 4
Στο υψηλή θερμοκρασία(700–900 0 C) ο σίδηρος αντιδρά με τους υδρατμούς:
3Fe + 4H 2 O Fe 3 O 4 + 4H 2
Ο σίδηρος αντιδρά με τα μη μέταλλα όταν θερμαίνεται:2Fe + 3Br 2 2FeBr 3
Fe + S FeS
Ο σίδηρος διαλύεται εύκολα σε υδροχλωρικά και αραιά θειικά οξέα:Fe + 2HCl FeCl 2 + H 2
Fe + H 2 SO 4 (razb.) FeSO 4 + H 2Στα πυκνά οξειδωτικά οξέα, ο σίδηρος διαλύεται μόνο όταν θερμαίνεται.
2Fe + 6H 2 SO 4 (συμπ.) Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O
Fe + 6HNO 3 (συμπ.) Fe(NO 3) 3 + 3NO 2 + 3H 2 O(στο κρύο, τα συμπυκνωμένα νιτρικά και θειικά οξέα παθητικοποιούν τον σίδηρο).
Ο σίδηρος μετατοπίζει τα μέταλλα στα δεξιά του στη σειρά των τάσεων από τα διαλύματα των αλάτων τους.Fe + CuSO 4 FeSO 4 + Cu
Σιδήρου ενώσεις
Υδροξείδιο σιδήρου (II).
Σχηματίζεται από τη δράση αλκαλικών διαλυμάτων σε άλατα σιδήρου (II) χωρίς πρόσβαση αέρα:
FeCl + 2KOH 2KCl + Fe(OH) 2
Το Fe (OH) 2 είναι μια ασθενής βάση, διαλυτή σε ισχυρά οξέα:
Fe(OH) 2 + H 2 SO 4 FeSO 4 + 2H 2 O
Όταν το Fe (OH) 2 πυρώνεται χωρίς πρόσβαση αέρα, σχηματίζεται οξείδιο του σιδήρου (II) FeO:
Fe(OH) 2 FeO + H 2 O
Παρουσία ατμοσφαιρικού οξυγόνου, ένα λευκό ίζημα Fe (OH) 2, που οξειδώνεται, γίνεται καφέ - σχηματίζοντας υδροξείδιο σιδήρου (III) Fe (OH) 3:
4Fe(OH) 2 + O 2 + 2H 2 O 4Fe(OH) 3
Οι ενώσεις σιδήρου(II) έχουν αποκαταστατικές ιδιότητες, μετατρέπονται εύκολα σε ενώσεις σιδήρου (III) υπό τη δράση οξειδωτικών παραγόντων:
10FeSO 4 + 2KMnO 4 + 8H 2 SO 4 5Fe 2 (SO 4) 3 + K 2 SO 4 + 2MnSO 4 + 8H 2 O
6FeSO 4 + 2HNO 3 + 3H 2 SO 4 3Fe 2 (SO 4) 3 + 2NO + 4H 2 OΟι ενώσεις σιδήρου είναι επιρρεπείς σε σχηματισμό συμπλόκων (αριθμός συντονισμού = 6):
FeCl 2 + 6NH 3 Cl 2
Ποιοτική αντίδραση για Fe 2+
Fe(CN)2 + 4KCN K4 (κίτρινο άλας αίματος)Κάτω από τη δράση του εξακυανοφερρικού καλίου (III) K 2 (ερυθρό άλας αίματος) σε διαλύματα αλάτων σιδήρου, σχηματίζεται ένα μπλε ίζημα (μπλε του Turnbull):
3FeSO 4 + 2K 3 Fe 3 + 3K 2 SO 4
Ενώσεις σιδήρου
Οξείδιο σιδήρου (III).
Σχηματίζεται κατά την καύση θειούχων σιδήρου, για παράδειγμα, κατά την ψήσιμο πυρίτη:
4FeS 2 + 11O 2 2Fe 2 O 3 + 8SO 2
ή κατά την πύρωση αλάτων σιδήρου:
2FeSO 4 Fe 2 O 3 + SO 2 + SO 3
Fe 2 O 3 - βασικό οξείδιο, σε ασήμαντο βαθμόαμφοτερικός
Fe 2 O 3 + 6HCl 2FeCl 3 + 3H 2 O
Fe 2 O 3 + 2NaOH + 3H 2 O 2Na
Υδροξείδιο σιδήρου (III).
Σχηματίζεται από τη δράση αλκαλικών διαλυμάτων σε άλατα σιδήρου σιδήρου: καθιζάνει ως κόκκινο-καφέ ίζημα.
Fe(NO 3) 3 + 3KOH Fe(OH) 3 + 3KNO 3
Το Fe (OH) 3 είναι ασθενέστερη βάση από το υδροξείδιο του σιδήρου (II).
Αυτό εξηγείται από το γεγονός ότι το Fe 2+ έχει μικρότερο φορτίο ιόντων και μεγαλύτερη ακτίνα από το Fe 3+, και ως εκ τούτου, το Fe 2+ διατηρεί τα ιόντα υδροξειδίου πιο αδύναμα, δηλ. Το Fe(OH) 2 διασπάται πιο εύκολα.
Από αυτή την άποψη, τα άλατα σιδήρου (II) υδρολύονται ελαφρά και τα άλατα σιδήρου (III) υδρολύονται πολύ έντονα. Το χρώμα των διαλυμάτων των αλάτων Fe(III) εξηγείται επίσης με υδρόλυση: παρά το γεγονός ότι το ιόν Fe3+ είναι σχεδόν άχρωμο, τα διαλύματα που το περιέχουν είναι χρωματισμένα κιτρινοκαφέ, γεγονός που εξηγείται από την παρουσία υδροξοϊόντων σιδήρου ή Fe(OH )3 μόρια, που σχηματίζονται λόγω υδρόλυσης:Fe 3+ + H 2 O 2 + + H +
2 + + H 2 O + + H +
+ + H2O Fe(OH) 3 + H +Όταν θερμαίνεται, το χρώμα σκουραίνει και όταν προστίθενται οξέα, γίνεται πιο ανοιχτόχρωμο λόγω της καταστολής της υδρόλυσης. Το Fe (OH) 3 έχει ασθενώς έντονη αμφοτερικότητα: διαλύεται σε αραιά οξέα και σε πυκνά αλκαλικά διαλύματα:
Fe(OH) 3 + 3HCl FeCl 3 + 3H 2 O
Fe(OH) 3 + NaOH Na
Οι ενώσεις σιδήρου (III) είναι ασθενείς οξειδωτικοί παράγοντες, αντιδρούν με ισχυρούς αναγωγικούς παράγοντες:
2FeCl 3 + H2S S + 2FeCl 2 + 2HCl
Ποιοτικές αντιδράσειςσε Fe3+
17. ρε - στοιχεία Σίδηρος, γενικά χαρακτηριστικά, ιδιότητες. Οξείδια και υδροξείδια, χαρακτηριστικά CO και OM, βιομόρια, ικανότητα σχηματισμού συμπλόκου.
1. Γενικά χαρακτηριστικά.
Σίδερο - d-στοιχείο της δευτερεύουσας υποομάδας της όγδοης ομάδας της τέταρτης περιόδου του PSCE με ατομικό αριθμό 26.
Ένα από τα πιο κοινά μέταλλα στον φλοιό της γης (δεύτερη θέση μετά το αλουμίνιο).
Μια απλή ουσία σίδηρος είναι ένα εύπλαστο ασημί-λευκό μέταλλο με υψηλή χημική αντιδραστικότητα: σίδηρος γρήγορα διαβρώνεταισε υψηλές θερμοκρασίες ή υψηλή υγρασία στον αέρα.
4Fe + 3O2 + 6H2O = 4Fe(OH)3
Σε καθαρό οξυγόνο, ο σίδηρος καίγεται και σε λεπτή διασπορά, αναφλέγεται αυθόρμητα στον αέρα.
3Fe + 2O2 = FeO + Fe2O3
3Fe + 4H2O = FeO*Fe2O3
FeO*Fe2O3 = Fe3O4 (ζυγαριά σιδήρου)
Στην πραγματικότητα, ο σίδηρος ονομάζονται συνήθως κράματά του με χαμηλή περιεκτικότητα σε ακαθαρσίες (έως 0,8%), τα οποία διατηρούν την απαλότητα και την ολκιμότητα του καθαρού μετάλλου. Στην πράξη, όμως, χρησιμοποιούνται συχνότερα κράματα σιδήρου με άνθρακα: χάλυβας (έως 2,14% κατά βάρος άνθρακα) και χυτοσίδηρος (περισσότερο από 2,14% κατά βάρος άνθρακα), καθώς και ανοξείδωτος (κραματοποιημένος) χάλυβας με προσθήκη κραμάτων μέταλλα (χρώμιο, μαγγάνιο, νικέλιο κ.λπ.). Ο συνδυασμός των ειδικών ιδιοτήτων του σιδήρου και των κραμάτων του τον καθιστούν «μέταλλο Νο 1» σε σημασία για τον άνθρωπο.
Στη φύση, ο σίδηρος βρίσκεται σπάνια στην καθαρή του μορφή, τις περισσότερες φορές εμφανίζεται ως μέρος των μετεωριτών σιδήρου-νικελίου. Η επικράτηση του σιδήρου στον φλοιό της γης είναι 4,65% (4η θέση μετά τα O, Si, Al). Πιστεύεται επίσης ότι ο σίδηρος αποτελεί το μεγαλύτερο μέρος του πυρήνα της γης.
2.Ιδιότητες
1.Φυσική Αγ.Ο σίδηρος είναι ένα τυπικό μέταλλο, σε ελεύθερη κατάσταση έχει ασημί-λευκό χρώμα με γκριζωπή απόχρωση. Το καθαρό μέταλλο είναι όλκιμο, διάφορες ακαθαρσίες (ιδιαίτερα ο άνθρακας) αυξάνουν τη σκληρότητα και την ευθραυστότητά του. Έχει έντονες μαγνητικές ιδιότητες. Συχνά διακρίνεται η λεγόμενη «τριάδα σιδήρου» - μια ομάδα τριών μετάλλων (σίδηρος Fe, κοβάλτιο Co, νικέλιο Ni) που έχουν παρόμοιες φυσικές ιδιότητες, ατομικές ακτίνες και τιμές ηλεκτραρνητικότητας.
2.Chemical St. Islands.
|
Κατάσταση οξείδωσης |
Οξείδιο |
Υδροξείδιο |
Χαρακτήρας |
Σημειώσεις |
|
Αδύναμα βασικά | ||||
|
Πολύ αδύναμη βάση, μερικές φορές αμφοτερική | ||||
|
Δεν ελήφθη |
|
Οξύ |
Ισχυρός οξειδωτικός παράγοντας |
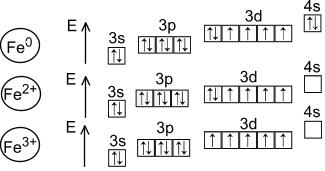
Για το σίδηρο, οι καταστάσεις οξείδωσης του σιδήρου είναι χαρακτηριστικές - +2 και +3.
Η κατάσταση οξείδωσης +2 αντιστοιχεί σε μαύρο οξείδιο FeO και πράσινο υδροξείδιο Fe(OH) 2 . Είναι βασικά. Στα άλατα, ο Fe(+2) υπάρχει ως κατιόν. Ο Fe(+2) είναι ένας ασθενής αναγωγικός παράγοντας.
+3 καταστάσεις οξείδωσης αντιστοιχούν σε κόκκινο-καφέ οξείδιο Fe 2 O 3 και καφέ υδροξείδιο Fe(OH) 3. Είναι αμφοτερικής φύσης, αν και οι όξινες και βασικές τους ιδιότητες εκφράζονται ασθενώς. Έτσι, τα ιόντα Fe 3+ είναι εντελώς υδρολυμένοακόμα και σε όξινο περιβάλλον. Το Fe (OH) 3 διαλύεται (και ακόμη και τότε όχι εντελώς), μόνο σε συμπυκνωμένα αλκάλια. Το Fe 2 O 3 αντιδρά με τα αλκάλια μόνο όταν συντήκεται, δίνοντας φερρίτες(επίσημα άλατα ενός οξέος που δεν υπάρχει στην ελεύθερη μορφή του οξέος HFeO 2):
Ο σίδηρος (+3) παρουσιάζει τις περισσότερες φορές ασθενείς οξειδωτικές ιδιότητες.
Οι καταστάσεις οξείδωσης +2 και +3 μεταβάλλονται εύκολα μεταξύ τους όταν αλλάζουν οι συνθήκες οξειδοαναγωγής.
Επιπλέον, υπάρχει οξείδιο Fe 3 O 4, η επίσημη κατάσταση οξείδωσης του σιδήρου στην οποία είναι +8/3. Ωστόσο, αυτό το οξείδιο μπορεί επίσης να θεωρηθεί ως φερρίτης σιδήρου (II) Fe +2 (Fe +3 O 2) 2 .
Υπάρχει επίσης μια κατάσταση οξείδωσης +6. Το αντίστοιχο οξείδιο και υδροξείδιο δεν υπάρχουν σε ελεύθερη μορφή, αλλά έχουν ληφθεί άλατα - φερρικά (π.χ. K 2 FeO 4). Ο σίδηρος (+6) βρίσκεται σε αυτά με τη μορφή ανιόντος. Τα Ferrates είναι ισχυροί οξειδωτικοί παράγοντες.
Ο καθαρός μεταλλικός σίδηρος είναι σταθερός στο νερό και σε αραιά διαλύματα. αλκάλια. Ο σίδηρος δεν διαλύεται σε ψυχρά συμπυκνωμένα θειικά και νιτρικά οξέα λόγω της παθητικοποίησης της μεταλλικής επιφάνειας με ένα ισχυρό φιλμ οξειδίου. Το θερμό συμπυκνωμένο θειικό οξύ, ως ισχυρότερο οξειδωτικό μέσο, αλληλεπιδρά με τον σίδηρο.
ΑΠΟ υδροχλωρικόςκαι αραιωμένο (περίπου 20%) θειικός οξέαΟ σίδηρος αντιδρά για να σχηματίσει άλατα σιδήρου (II):
Όταν ο σίδηρος αντιδρά με περίπου 70% θειικό οξύ όταν θερμαίνεται, η αντίδραση προχωρά με το σχηματισμό θειικός σίδηρος (III).:
3. Οξείδια και υδροξείδια, CO και OM char-ka ...
Ενώσεις σιδήρου(II).
Το οξείδιο του σιδήρου (II) FeO έχει βασικές ιδιότητες, αντιστοιχεί στη βάση Fe (OH) 2. Τα άλατα του σιδήρου (II) έχουν ανοιχτό πράσινο χρώμα. Όταν αποθηκεύονται, ειδικά σε υγρό αέρα, γίνονται καφέ λόγω της οξείδωσης σε σίδηρο (III). Η ίδια διαδικασία συμβαίνει κατά την αποθήκευση υδατικών διαλυμάτων αλάτων σιδήρου(II):
Από άλατα σιδήρου(II) σε υδατικά διαλύματα, σταθερά αλάτι μόρα- διπλό θειικό αμμώνιο και σίδηρο (II) (NH 4) 2 Fe (SO 4) 2 6H 2 O.
Το αντιδραστήριο για ιόντα Fe 2+ σε διάλυμα μπορεί να είναι εξακυανοφερρικό κάλιο (III) K 3 (κόκκινο άλας αίματος). Όταν τα ιόντα Fe 2+ και 3− αλληλεπιδρούν, δημιουργείται ίζημα μπλε τουρμπουλ:
Για τον ποσοτικό προσδιορισμό του σιδήρου (II) σε διάλυμα, χρησιμοποιήστε φαινανθρολίνη, το οποίο σχηματίζει ένα κόκκινο σύμπλεγμα FePhen 3 με σίδηρο (II) σε μεγάλο εύρος pH (4-9)
Ενώσεις σιδήρου (III).
Οξείδιο σιδήρου (III) Fe 2 O 3 ασθενώς αμφοτερένιο, αντιστοιχεί σε ακόμη ασθενέστερη από Fe (OH) 2, βάση Fe (OH) 3, η οποία αντιδρά με οξέα:
Τα άλατα Fe 3+ τείνουν να σχηματίζουν κρυσταλλικούς υδρίτες. Σε αυτά, το ιόν Fe 3+ συνήθως περιβάλλεται από έξι μόρια νερού. Τέτοια άλατα έχουν ροζ ή μοβ χρώμα Το ιόν Fe 3+ υδρολύεται πλήρως ακόμη και σε όξινο περιβάλλον. Σε pH>4, αυτό το ιόν καταβυθίζεται σχεδόν πλήρως με τη μορφή Fe (OH) 3:
Με τη μερική υδρόλυση του ιόντος Fe 3+, σχηματίζονται πολυπυρηνικές οξο- και υδροξοκίες, λόγω των οποίων τα διαλύματα γίνονται καφέ.Οι κύριες ιδιότητες του υδροξειδίου του σιδήρου (III) Fe (ΟΗ) 3 εκφράζονται πολύ ασθενώς. Είναι σε θέση να αντιδράσει μόνο με συμπυκνωμένα αλκαλικά διαλύματα:
Τα προκύπτοντα υδροξοσύμπλεγμα σιδήρου (III) είναι σταθερά μόνο σε έντονα αλκαλικά διαλύματα. Όταν τα διαλύματα αραιώνονται με νερό, καταστρέφονται και καθιζάνει Fe (OH) 3.
Όταν συντήκεται με αλκάλια και οξείδια άλλων μετάλλων, το Fe 2 O 3 σχηματίζει μια ποικιλία φερρίτες:
Οι ενώσεις σιδήρου (III) σε διαλύματα ανάγεται με μεταλλικό σίδηρο:
Ο σίδηρος (III) είναι ικανός να σχηματίζει διπλά θειικά άλατα με μονοφόρτιση κατιόντατύπος στυπτηρία, για παράδειγμα, KFe (SO 4) 2 - στυπτηρία σιδήρου καλίου, (NH 4) Fe (SO 4) 2 - στυπτηρία σιδήρου αμμωνίου, κ.λπ.
Για την ποιοτική ανίχνευση των ενώσεων σιδήρου (III) σε ένα διάλυμα, χρησιμοποιείται μια ποιοτική αντίδραση ιόντων Fe 3+ με θειοκυανικά ιόντα SCN − . Όταν τα ιόντα Fe 3+ αλληλεπιδρούν με τα ανιόντα SCN −, σχηματίζεται ένα μείγμα συμπλεγμάτων θειοκυανικού σιδήρου με έντονο κόκκινο χρώμα 2+ , + , Fe(SCN) 3 , -. Η σύνθεση του μείγματος (και επομένως η ένταση του χρώματός του) εξαρτάται από διάφορους παράγοντες, επομένως αυτή η μέθοδος δεν είναι εφαρμόσιμη για τον ακριβή ποιοτικό προσδιορισμό του σιδήρου.
Ένα άλλο αντιδραστήριο υψηλής ποιότητας για ιόντα Fe 3+ είναι εξακυανοφερρικό κάλιο (II)Κ 4 (κίτρινο άλας αίματος). Όταν τα ιόντα Fe 3+ και 4− αλληλεπιδρούν, σχηματίζεται ένα έντονο μπλε ίζημα κυανούν χρώμα:
Ενώσεις σιδήρου(VI).
φερράτες- άλατα του οξέος σιδήρου H 2 FeO 4 που δεν υπάρχουν σε ελεύθερη μορφή. Πρόκειται για ενώσεις με ιώδες χρώμα, που θυμίζουν υπερμαγγανικά άλατα σε οξειδωτικές ιδιότητες και θειικά άλατα σε διαλυτότητα. Τα Ferrates λαμβάνονται με τη δράση αερίων χλώριοή όζοσε ένα εναιώρημα Fe (OH) 3 σε αλκάλιο , για παράδειγμα, φερτικό κάλιο (VI) K 2 FeO 4 . Τα Ferrates έχουν μοβ χρώμα.
Μπορούν επίσης να ληφθούν Ferrates ηλεκτρόλυση 30% αλκαλικό διάλυμα σε άνοδο σιδήρου:
Τα Ferrates είναι ισχυροί οξειδωτικοί παράγοντες. Σε όξινο περιβάλλον, αποσυντίθενται με την απελευθέρωση οξυγόνου:
Χρησιμοποιούνται οι οξειδωτικές ιδιότητες των φερρατικών απολύμανση νερού.
4.Biorol
1) Στους ζωντανούς οργανισμούς, ο σίδηρος είναι ένα σημαντικό ιχνοστοιχείο που καταλύει τις διαδικασίες ανταλλαγής οξυγόνου (αναπνοή).
2) Ο σίδηρος περιλαμβάνεται συνήθως στα ένζυμα με τη μορφή συμπλόκου.Πιο συγκεκριμένα, αυτό το σύμπλοκο υπάρχει στην αιμοσφαιρίνη, την πιο σημαντική πρωτεΐνη που παρέχει μεταφορά οξυγόνου με το αίμα σε όλα τα όργανα του ανθρώπου και των ζώων. Και είναι αυτός που βάφει το αίμα σε ένα χαρακτηριστικό κόκκινο χρώμα.
4) Μια υπερβολική δόση σιδήρου (200 mg και άνω) μπορεί να έχει τοξική δράση. Η υπερβολική δόση σιδήρου καταστέλλει το αντιοξειδωτικό σύστημα του σώματος, γι' αυτό χρησιμοποιήστε συμπληρώματα σιδήρου υγιείς ανθρώπουςΔεν συνιστάται.
Σελίδα 3
Στο σχ. Το V.8 δείχνει ένα σχήμα συσχέτισης που δίνει μια ιδέα για τα διαστήματα των ισομερών μετατοπίσεων 57Fe για ενώσεις σιδήρου. Η κατάσταση οξείδωσης του σιδήρου μπορεί να κυμαίνεται από 0 έως 6, και δεν είναι τόσο εύκολο να χαρακτηριστεί από την ισομερή μετατόπιση 57Fe.
Μια αναγωγική ατμόσφαιρα προκαλεί μείωση του βαθμού οξείδωσης του σιδήρου στη σκωρία, ενώ σε μια οξειδωτική ατμόσφαιρα, υπό την επίδραση υψηλών θερμοκρασιών φλόγας, συνεχίζεται η αποσύνθεση υψηλότερων οξειδίων του σιδήρου. Η αύξηση του βαθμού οξείδωσης του σιδήρου στη σκωρία από τη δράση μιας οξειδωτικής ατμόσφαιρας είναι δυνατή μόνο σε θερμοκρασία φλόγας κάτω από 1200 C και σε μεγάλη επιφάνεια σκωρίας.
Η περιεκτικότητα σε Al2O3 και αλκάλια αλλάζει αρκετά απότομα στα πετρώματα. Η κατάσταση οξείδωσης του σιδήρου παραμένει σταθερή.
| Εξάρτηση ιξώδους από τη θερμοκρασία. |
Το δείγμα C με κατάσταση οξείδωσης 13% δεν έχει πλαστική περιοχή και η σκωρία συμπεριφέρεται σαν γυαλί. Με αύξηση του βαθμού οξείδωσης του σιδήρου στο 30 ή 56%, εμφανίζεται μια κάμψη στις καμπύλες ιξώδους των δειγμάτων Β και Α, υποδεικνύοντας ότι η σκωρία στη θέση της κάμψης περνά σε πλαστική κατάσταση.
Αλλά ο βαθμός οξείδωσης του θείου, που αποτελεί μέρος αυτών των ιόντων, είναι διαφορετικός. Στην πρώτη περίπτωση, η κατάσταση οξείδωσης του σιδήρου συμπίπτει με το φορτίο ενός απλού ιόντος Fe2 και με το σθένος του σιδήρου. Έτσι, το σθένος ενός δεδομένου στοιχείου σε μια σύνθετη ένωση ονομάζεται η συνολική ποσότητα δεσμών που έχει το κεντρικό άτομο, ο παράγοντας συμπλοκοποίησης, σε αυτήν την ένωση.
Η τάση σχηματισμού συμπλόκου επιβεβαιώνεται και από την ύπαρξη τυπικών διπλών αλάτων όπως οι σενίτες και οι στυπτηρίες. Σε αυτή την ένωση, η κατάσταση οξείδωσης του σιδήρου 2 σταθεροποιείται, ενώ το θειικό FeSO4 εισέρχεται υδατικό διάλυμαεπιρρεπείς σε οξείδωση από το ατμοσφαιρικό οξυγόνο. Το νικέλιο δεν σχηματίζει τέτοιες ενώσεις, καθώς η κατάσταση οξείδωσης 3 για αυτό το στοιχείο είναι τόσο αχαρακτηριστική που δεν σταθεροποιείται καν σε διπλά άλατα.
Αυτή η αύξηση του βαθμού οξείδωσης του σιδήρου στη σκωρία συνεχίζεται μέχρι τη θερμοκρασία περίπου 1.200 C. Με περαιτέρω αύξηση της θερμοκρασίας της σκωρίας, ο βαθμός οξείδωσης του σιδήρου πέφτει σημαντικά.
Όπως υποδεικνύεται, το κεντρικό άτομο σιδήρου βρίσκεται στο επίπεδο του 16-μελούς δακτυλίου από πορφύριο και συνδέεται με τα άτομα αζώτου των δακτυλίων πυρρολίου με τέσσερα από τα έξι διαθέσιμα σθένη, και επομένως απομένουν δύο σθένη για να ολοκληρωθεί το οκταεδρικό σύμπλεγμα. Αυτά τα σθένη είναι πάνω και κάτω από το επίπεδο σχεδίασης του μοντέλου που φαίνεται. Επιπλέον, πρέπει επίσης να λαμβάνεται υπόψη ο βαθμός οξείδωσης του σιδήρου. όταν ο σίδηρος βρίσκεται σε σιδηρούχα κατάσταση, όπως φαίνεται στο σχήμα, η πρωτοπορφυρίνη ονομάζεται θέμα ή, πιο καθαρά, ferrogem. Εάν η αίμη βρίσκεται σε ελεύθερη κατάσταση σε διάλυμα και δεν είναι συνδεδεμένη με την πρωτεΐνη, τότε υποτίθεται ότι δύο μόρια νερού βρίσκονται σε συντονισμό με την πέμπτη και έκτη θέση του σθένους του σιδήρου. Ο George ορίζει αυτό το ferrogem ως εξής: H2O - Fep-H. Όταν οξειδώνεται, μετατρέπεται σε H O Fep NaO με ένα θετικό φορτίο. Αυτή η φερριέμη μπορεί να συντονίσει το ιόν χλωρίου με τη μετάβαση σε H2O - Fep-Cl και σε αυτή την περίπτωση ονομάζεται αιμίνη. με ένα συντονισμένο ιόν υδροξυλίου, το ferrigem ορίζεται ως αιματίνη H2O - Pep-OH, αν και αυτοί οι όροι χρησιμοποιούνται μερικές φορές λιγότερο συγκεκριμένα, μόνο για να υποδείξουν την παρουσία οξειδίου του σιδήρου. Ο συντονισμός άλλων μορίων είναι επίσης δυνατός και ο συντονισμός με το υπεροξείδιο του υδρογόνου παίζει πρωτίστως ρόλο. Το Ferrohem συντονίζει εύκολα αζωτούχες βάσεις, όπως η πυριδίνη, σχηματίζοντας αιμοχρωματικά B-Fp-B. Η ίδια ένωση με τη φερριέμη B-Fep-B ονομάζεται παρααιματίνη.
Με τη μαγνητική μέθοδο, διαπιστώθηκε η παρουσία και η ποσοτική εκτίμηση δεσμών σθένους μεταξύ γειτονικών θετικών ιόντων. Έτσι, στο Fe203 σε ένα στήριγμα A1203, η κατάσταση οξείδωσης του σιδήρου είναι τρεις, αλλά ταυτόχρονα, τα γειτονικά άτομα σιδήρου σχηματίζουν έναν ομοιοπολικό δεσμό μεταξύ τους.
Μέσω της μαγνητικής μεθόδου, διαπιστώθηκε η παρουσία και η ποσοτική εκτίμηση των δεσμών σθένους μεταξύ γειτονικών θετικών ιόντων. Έτσι, στο Fe2O3 σε έναν φορέα A12O3, η κατάσταση οξείδωσης του σιδήρου είναι τρεις, αλλά ταυτόχρονα, τα γειτονικά άτομα σιδήρου σχηματίζουν έναν ομοιοπολικό δεσμό μεταξύ τους.
Εάν θεωρήσουμε τα υδροξείδια Fe (OH) 2 και Fe (OH) 3, τότε από την άποψη του σχήματος Kossel, οι όξινες ιδιότητες του δεύτερου υδροξειδίου θα πρέπει να είναι πιο έντονες από το πρώτο. Αυτό προκύπτει από το γεγονός ότι όσο υψηλότερος είναι ο βαθμός οξείδωσης του σιδήρου (ακόμα και αν υποθέσουμε ότι οι ακτίνες των ιόντων Fe2 και Fe3 είναι ίδιες), τόσο μεγαλύτερη είναι η απώθηση του πρωτονίου και τόσο πιο έντονες οι όξινες ιδιότητες των αντίστοιχων υδροξείδιο. Αν λάβουμε υπόψη ότι η ακτίνα του ιόντος Fe3 είναι κάπως μικρότερη από αυτή του ιόντος Fe2, τότε η μεγαλύτερη απώθηση του πρωτονίου στην ένωση Fe (OH) 3 σε σύγκριση με το Fe (OH) 2 γίνεται ακόμη πιο εμφανής.
Μέρος των οξειδίων του σιδήρου ανάγεται σε μεταλλικό σίδηρο, το άλλο μέρος σε [οξείδιο του αζώτου]. επιπλέον, απελευθερώνεται άνθρακας πάνω τους. Η ποσότητα οξυγόνου που εξακολουθεί να περιέχεται στο μετάλλευμα χαρακτηρίζει τον βαθμό οξείδωσης του σιδήρου.
Εάν, μετά από προκαταρκτικές δοκιμές, εξακολουθεί να υπάρχει αμφιβολία εάν υπάρχει ιόν σιδήρου, μπορούν να πραγματοποιηθούν αντιδράσεις επαλήθευσης. Αλλά πρέπει να θυμόμαστε ότι με αυτή τη δοκιμή δεν είναι πλέον δυνατό να καθοριστεί ο αρχικός βαθμός οξείδωσης του σιδήρου στο αναλυόμενο δείγμα.
Μόνο με την παρουσία ισχυρών οξειδωτικών παραγόντων, είναι δυνατό να ληφθούν μάλλον εύθραυστα παράγωγα του οξέος σιδήρου H2FeO4 με κατάσταση οξείδωσης σιδήρου 6, ωστόσο, δεν ήταν δυνατό να απομονωθεί το αντίστοιχο οξείδιο. Εάν το RuO4 είναι μια χαμηλής σταθερότητας ουσία που λαμβάνεται έμμεσα, τότε το OsO4 είναι μια εντελώς σταθερή ένωση που σχηματίζεται κατά την οξείδωση ενός μετάλλου στον αέρα.