11.04.2018
Химические свойства простых веществ: металлов и неметаллов
В периодической системе железо находится в четвертом периоде, в побочной подгруппе VIII группы.
Порядковый номер - 26, электронная формула 1s 2 2s 2 2p 6 3d 6 4s 2 .
Валентные электроны у атома железа находятся на последнем электронном слое (4s 2) и предпоследнем (3d 6). В химических реакциях железо может отдавать эти электроны и проявлять степени окисления +2, +3 и, иногда, +6.
Железо является вторым по распространенности металлом в природе (после алюминия). Наиболее важные природные соединения: Fe2O3x3H2O - бурый железняк;Fe2O3 - красный железняк;Fe3O4(FeO Fe2O3) - магнитный железняк;FeS2 - железный колчедан (пирит). Соединения железа входят в состав живых организмов.
Железо - серебристо серый металл, обладает большой ковкостью, пластичностью и сильными магнитными свойствами. Плотность железа - 7,87 г/см3, температура плавления 1539С.
Получение железа
В промышленности железо получают восстановлением его из железных руд углеродом (коксом) и оксидом углерода (II) в доменных печах.
Химизм доменного процесса следующий:
C + O 2 = CO 2 ,
3Fe 2 O 3 + CO = 2Fe 3 O 4 + CO 2 ,
Fe 3 O 4 + CO = 3FeO + CO 2 ,
FeO + CO = Fe + CO 2 .
В реакциях железо является восстановителем . Однако при обычной температуре оно не взаимодействует даже с самыми активными окислителями (галогенами, кислородом, серой), но при нагревании становится активным и реагирует с ними:
2Fe + 3Cl 2 = 2FeCl 3 Хлорид железа (III)
3Fe + 2O 2 = Fe 3 O 4 (FeO x Fe 2 O 3) Оксид железа (II,III)
Fe + S = FeS Сульфид железа (II)
При очень высокой температуре железо реагирует с углеродом, кремнием и фосфором:
3Fe + C = Fe 3 C Карбид железа (цементит)
3Fe + Si = Fe 3 Si Силицид железа
3Fe + 2P = Fe 3 P 2 Фосфид железа (II)
Во влажном воздухе железо быстро окисляется (коррозирует):
4Fe + 3O 2 + 6H 2 O = 4Fe(OH) 3 ,
Железо находится в середине электрохимического ряда напряжений металлов, поэтому является металлом средней активности . Восстановительная способность у железа меньше, чем у щелочных, щелочноземельных металлов и у алюминия. Только при высокой температуре раскаленное железо реагирует с водой:
3Fe + 4H 2 O = Fe 3 O 4 + 4H 2
Железо реагирует с разбавленными серной и соляной кислотами, вытесняя из кислот водород:
Fe + 2HCl = FeCl 2 + H 2
Fe + H 2 SO 4 = FeSO 4 + H 2
При обычной температуре железо не взаимодействует с концентрированной серной кислотой, так как пассивируется ею . При нагревании концентрированная H 2 SO 4 окисляет железо до сульфита железа (III):
2Fe + 6H 2 SO 4 = Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O.
Разбавленная азотная кислота окисляет железо до нитрата железа (III):
Fe + 4HNO 3 = Fe(NO 3) 3 + NO + 2H 2 O.
Концентрированная азотная кислота пассивирует железо.
Из растворов солей железо вытесняет металлы, которые расположены правее его в электрохимическом ряду напряжений:
Fe + CuSO 4 = FeSO 4 + Cu
Оксид железа (II) FeO - основной оксид, легко реагирует с кислотами, при этом образуются соли железа(II):
FeO + 2HCl = FeCl 2 + H 2 O
FeO + 2H + = Fe 2+ + H 2 O
Гидроксид железа (II) Fe(OH) 2 - порошок белого цвета, не растворяется в воде. Получают его из солей железа (II) при взаимодействии их со щелочами:
FeSO 4 + 2NaOH = Fe(OH) 2 + Na 2 SO 4 ,
Fe(OH) 2 проявляет свойства основания, легко реагирует с кислотами:
Fe(OH) 2 + 2HCl = FeCl 2 + 2H 2 O,
Fe(OH)2 + 2H+ = Fe2+ + 2H2O.
При нагревании гидроксид железа (II) разлагается:
Fe(OH) 2 = FeO + H 2 O.
Соединения со степенью окисления железа +2 проявляют восстановительные свойства, так как Fe 2+ легко окисляются до Fe +3: Fe +2 - 1e = Fe +3
Так, свежеполученный зеленоватый осадок Fe(OH) 2 на воздухе очень быстро изменяет окраску - буреет. Изменение окраски объясняется окислением Fe(OH) 2 в Fe(OH) 3 кислородом воздуха:
4Fe(OH) 2 + O 2 + 2H 2 O = 4Fe(OH) 3 .
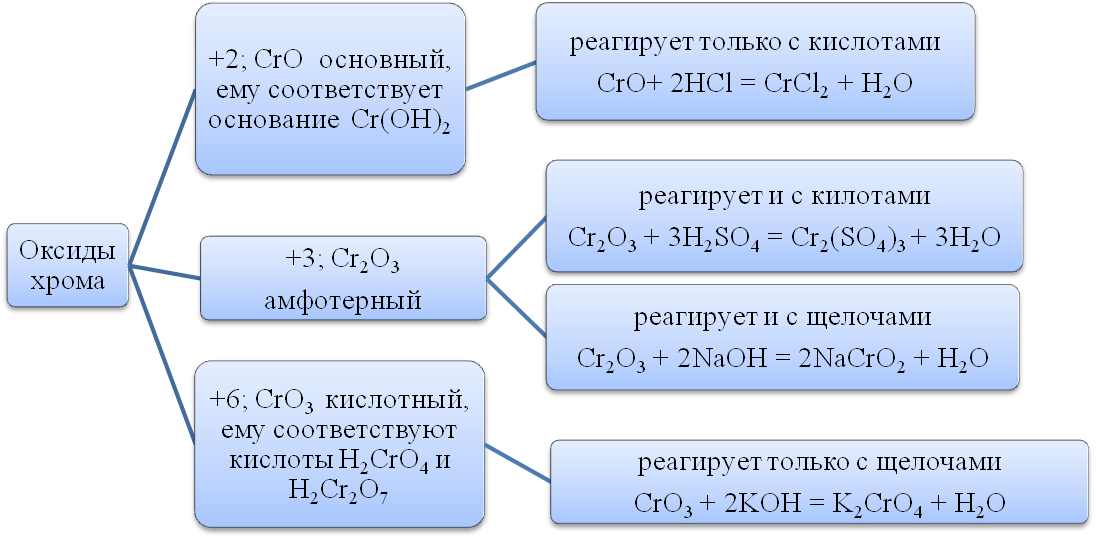
Оксид железа (III) Fe 2 O 3 - порошок бурого цвета, не растворяется в воде.
Оксид железа (III) получают разложением гидроксида железа (III):
2Fe(OH) 3 = Fe 2 O 3 + 3H2O
Оксид железа (III) проявляет амфотерные свойства:
взаимодействует с кислотами и твердыми щелочами NaOH и KOH , а также с карбонатами натрия и калия при высокой температуре:
Fe 2 O 3 + 2NaOH = 2NaFeO 2 + H 2 O,
Fe 2 O 3 + 2OH - = 2FeO 2- + H2O,
Fe 2 O 3 + Na 2 CO 3 = 2NaFeO 2 + CO 2 .
Феррит натрия
Гидроксид железа (III) получают из солей железа (III) при взаимодействии их со щелочами:
FeCl 3 + 3NaOH = Fe(OH) 3 + 3NaCl,
Гидроксид железа (III) является более слабым основанием, чем Fe(OH) 2 , и проявляет амфотерные свойства (с преобладанием основных). При взаимодействии с разбавленными кислотами Fe(OH) 3 легко образует соответствующие соли:
Fe(OH) 3 + 3HCl = FeCl 3 + H 2 O
2Fe(OH) 3 + 3H 2 SO 4 = Fe 2 (SO 4) 3 + 6H 2 O
Реакции с концентрированными растворами щелочей протекают лишь при длительном нагревании.:
Fe(ОН) 3 + КОН = К
Соединения со степенью окисления железа +3 проявляют окислительные свойства , так как под действием восстановителей Fe+3 превращается в Fe+2: Fe +3 + 1e = Fe +2.
Так, например, хлорид железа (III) окисляет йодид калия до свободного йода:
2FeCl 3 + 2KI = 2FeCl 2 + 2KCl + I 2 0
Хром .
 Хром
находится в побочной подгруппе VI группы
Периодической системы. Строение
электронной оболочки хрома: Cr 3d 5 4s 1 .
Степени окисления от +1 до +6, но наиболее
устойчивые +2, +3, +6.
Хром
находится в побочной подгруппе VI группы
Периодической системы. Строение
электронной оболочки хрома: Cr 3d 5 4s 1 .
Степени окисления от +1 до +6, но наиболее
устойчивые +2, +3, +6.
Массовая доля хрома в земной коре составляет 0,02%. Важнейшими минералами, входящими в состав хромовых руд, являются хромит, или хромистый железняк, и его разновидности, в которых железо частично заменено на магний, а хром - на алюминий.
Хром - серебристо серый металл. Чистый хром достаточно пластичный, а технический самый твердый из всех металлов.
Хром химически малоактивен . В обычных условиях он реагирует только с фтором (из неметаллов), образуя смесь фторидов. При высоких температурах (выше 600°C) взаимодействует с кислородом, галогенами, азотом, кремнием, бором, серой, фосфором:
4Cr + 3O 2 = 2Cr 2 O 3
2Cr + 3Cl 2 = 2CrCl 3
2Cr + N 2 = 2CrN
2Cr + 3S = Cr 2 S 3
В азотной и концентрированной серной кислотах он пассивирует, покрываясь защитной оксидной пленкой. В хлороводородной и разбавленной серной кислотах растворяется, при этом, если кислота полностью освобождена от растворенного кислорода, получаются соли хрома(II), а если реакция протекает на воздухе - соли хрома (III): Cr + 2HCl = CrCl 2 + H 2 ; 2Cr + 6HCl + O 2 = 2CrCl 3 + 2H 2 O + H 2
1. Неметаллические свойства простых веществ усиливаются в ряду
1) азот → фосфор → мышьяк 2) фтор → хлор → бром
3) селен → сера → кислород 4) фосфор → кремний → алюминий
2. И натрий, и медь при комнатной температуре реагируют с
1) гидроксидом натрия 2) водой 3) водородом 4) азотной кислотой
3. И железо, и цинк при комнатной температуре реагируют с
1) гидроксидом магния 2) оксидом углерода(II) 3) cульфатом меди(II) 4) водой
4. Железо реагирует с каждым из двух веществ 1) O2и NaCl 2) KOH и H2S 3)HCl и S 4)Na2S и K2O
5. Алюминий не реагирует с раствором
1) серной кислоты 2) сульфата магния 3) гидроксида натрия 4) нитрата меди(II)
6. Разбавленная серная кислота взаимодействует с 1) Zn 2) Ag 3) NaNO3 4) SO2
7. Какой из указанных металлов вступает в реакцию с соляной кислотой?
1) серебро 2) золото 3) алюминий 4) медь
8. И с цинком, и с медью реагирует
1) хлор 2) оксид углерода(II) 3) гидроксид натрия 4) соляная кислота
9. Алюминий не реагирует с
1) водой 2) гидроксидом калия 3) соляной кислотой 4) хлоридом натрия
10. В реакцию с железом может вступать каждое из двух веществ:
1) CuSO 4 и O 2 2) S и NaOH (p-p) 3) MgCl 2 и H 2 O 4) Na 2 SO 4 и Hg(NO 3) 2
11. В реакцию с водой при комнатной температуре вступает каждый из двух металлов:
1) Zn и Cu 2) К и Ca 3) Zn и K 4) Ca и Ag
12. С раствором серной кислоты реагирует каждый из двух металлов:
1) Zn и Hg 2) Ag и Mg 3) Zn и Mg 4) Cu и Hg
13. С литием реагирует 1) азот 2) оксид натрия 3) кальций 4) фосфат кальция
14. Алюминий реагирует с
1)магнием 2) оксидом углерода(II) 3)гидроксидом железа(II) 4)нитратом серебра (р-р)
15. И цинк, и кальций при комнатной температуре реагируют с
1) водой 2) бромом 3) гидроксидом натрия 4) кремниевой кислотой
16. Железо вытесняет металл из раствора
1) хлорида алюминия 2) сульфата цинка 3) нитрата меди(II) 4) силиката калия
17. Цинк при комнатной температуре вступает в реакцию с каждым из двух веществ:
1) соляная кислота и нитрат серебра 2) вода и гидроксид натрия
3) оксид серы(VI) и оксид алюминия 4) сульфат меди(II) и вода
18. Реакция возможна между 1) Fe и S 2) Р и H2 3) Cl2 и O2 4) Fe и K
19. Образование меди происходит в результате реакции
1) водорода с оксидом меди(II) 2) водорода с хлоридом меди(II)
3) серебра с хлоридом меди(II) 4)кислорода с сульфидом меди(II)
20. Раствор соляной кислоты не вступает в реакцию с
1) серебром 2) оксидом меди(II) 3) гидроксидом меди(II) 4) карбонатом меди(II)
21. С магнием не реагирует 1) хлор 2) оксид кальция 3) соляная кислота 4) сульфат меди(II) (р-р)
22. С медью не реагирует 1) хлор 2) кислород 3) серная кислота (конц.) 4) хлорид железа(II) (р-р)
23. С магнием реагирует 1) медь 2) оксид кальция 3) гидроксид натрия 4) азотная кислота
24. С раствором щёлочи взаимодействует 1) железо 2) цинк 3) медь 4) магний
25. Алюминий не реагирует с
1) серной кислотой 2) гидроксидом натрия 3) хлоридом меди(II) 4) гидроксидом цинка
26. С железом реагирует раствор 1) Na2S 2) BaCl2 3) K2CO3 4) AgNO3
27. Магний реагирует с
1) оксидом натрия 2) сульфатом лития 3) хлоридом цинка(р-р) 4) гидроксидом калия(р-р)
28. С раствором сульфата меди(II) не реагирует 1) цинк 2) серебро 3) железо 4) олово
29 Цинк реагирует с
1) оксидом алюминия 2) соляной кислотой 3) гидроксидом железа(III) 4) сульфидом железа(II)
30 . И литий, и цинк при комнатной температуре реагируют с
31. Практически осуществима реакция между раствором хлорида цинка и
1) железом 2) медью 3) свинцом 4) алюминием
32. C раствором нитрата меди(II) может взаимодействовать
1) цинк 2) гидроксид железа(III) 3) оксид кремния(IV) 4) углерод
33. При нагревании возможна реакция между
1) железом и серой 2)азотом и водой 3) медью и оксидом серы(IV) 4)фосфором и оксидом цинка
34. Алюминий взаимодействует с каждым из двух веществ
1) K 2 O и K 2 SO 4 2) S и LiCl 3) Cl 2 и H 2 SO 4 4) H 2 O и Cu(OH) 2
35. И литий, и железо при комнатной температуре реагируют с
1) гидроксидом натрия 2) водой 3) серой 4) соляной кислотой
36. И с магнием, и с алюминием реагирует
1) хлорид натрия 2) оксид бария 3) гидроксид калия 4) серная кислота
37. Железо реагирует с 1) бромом 2) оксидом натрия 3) хлоридом кальция 4) гидроксидом натрия
38. Щёлочь и водород образуется при взаимодействии воды с
1) кремнием 2) калием 3) цинком 4) алюминием
39. Калий взаимодействует с каждым из двух веществ
1) H 2 О и S 2) O 2 и Ba 3) Cu и N 2 4) HCl и NaOH
40. Железо не реагирует с раствором
1) хлороводородной кислоты 2) серной кислоты 3) хлорида бария 4) нитрата серебра
41. Магний при обычных условиях вступает в реакцию с каждым из двух веществ:
1) вода и соляная кислота 2) вода и гидроксид натрия
3) соляная кислота и гидроксид натрия 4) соляная кислота и раствор сульфата меди(II)
42. Железо вытесняет металл из раствора 1) Zn(NO3)2 2) CuSO4 3) AlCl3 4) Ва(OH)2
43. Водород из раствора фосфорной кислоты может вытеснить
1) железо 2) медь 3) золото 4) серебро
44. Калий взаимодействует с каждым из двух веществ:1)Ca и O 2 2) Cu и N 2 3 HCl и S 4)H 2 O и NaOH
45. Для восстановления металлов из их оксидов используют 1) CO 2 2) CO 3) SO 3 4) NO
46. Алюминий взаимодействует с каждым из двух веществ:
1) Cl 2 и H 2 SO 4 2) S и NaCl 3) H 2 O и Cu(OH) 2 4) K 2 O и Na 2 SO 4
47. Какой из указанных металлов вытесняет водород из раствора соляной кислоты?
1) ртуть 2) медь 3) железо 4) серебро
48. В реакцию с разбавленной серной кислотой вступает 1) медь 2) золото 3) цинк 4) серебро
49. И хлор, и кислород при нагревании реагируют с
1) соляной кислотой 2) гидроксидом натрия 3) водой 4) железом
50. Железо при обычных условиях вступает в реакцию с каждым из двух веществ
1) оксидом серы(VI) и кислородом 2) водородом и углеродом
3) кислородом и хлором 4) водой и железом
51. 52. Фтор в реакциях 1) проявляет свойства только восстановителя
2) проявляет свойства только окислителя
3) может проявлять свойства и окислителя, и восстановителя
4) не проявляет окислительно-восстановительных свойств
51. И магний, и натрий при комнатной температуре энергично реагируют с
1) водой 2) соляной кислотой 3) гидроксидом бария 4) карбонатом кальция
52. В реакцию замещения с нитратом свинца вступает
1) водород 2) железо 3) медь 4) серебро
53. Азот реагирует с 1) водой 2) соляной кислотой 3) кислородом 4) фосфором
54. Медь реагирует с раствором 1) AgNO3 2) FeSO4 3) Al2(SO4)3 4) NaOH
55. При комнатной температуре с водой реагирует каждый из двух металлов:
1) Ba и Fe 2) Ag и Al 3) Na и Ba 4) Pb и K
56. Цинк реагирует с 1) хлоридом натрия 2) хлоридом меди(II)
3) оксидом кремния(IV) 4) оксидом фосфора(V)
57. Цинк вытесняет металл из раствора
1) нитрата калия 2) нитрата кальция 3) сульфата меди(II) 4) сульфата магния
58. С кислородом без нагревания вступает в реакцию 1) натрий 2) азот 3) серебро 4) хлор
59. И кальций, и белый фосфор при комнатной температуре реагируют с
1) соляной кислотой 2) гидроксидом калия 3) кислородом 4) Водой
60. В реакцию с соляной кислотой вступает каждый из двух металлов:
1) Ca и Ag 2) Hg и Na 3) Cu и Zn 4) Mg и Zn
61. С каким из перечисленных веществ кислород реагирует при обычных условиях?
1) азотом) натрием 3) оксидом алюминия 4) оксидом углерода(IV)
62. С кислородом реагирует 1) медь 2) оксид углерода(IV) 3) гидроксид натрия 4)серная кислота
63. С углеродом реагирует 1) водород 2) гидроксид магния 3) хлорид кальция 4) фосфорная кислота
64. Водород реагирует с 1) медью 2)оксидом меди(II) 3) гидроксидом меди(II) 4)сульфатом меди(II)
65. Сера является восстановителем в реакции с1) магнием 2) кислородом 3) водородом 4) железом
66. В реакцию с соляной кислотой вступает каждый из двух металлов:
1) Zn и Cu 2) Ag и Mg 3) Zn и Mg 4) Cu и Ag
67. С водородом реагирует 1) хлор 2) медь 3) гидроксид калия 4) соляная кислота
68. С водородом без нагревания вступает в реакцию 1) фтор 2) азот 3) сера 4) железо
69. С разбавленной серной кислотой реагирует 1) кислород 2) железо 3) углерод 4) кремний
70. Не реагируют друг с другом
1) хлор и водород 2) кислород и кальций
o 3) азот и вода 4) железо и сера
71. С растворами гидроксида натрия и соляной кислоты взаимодействует 1) Ag 2) Mg 3) Fe 4) Al
72. Фосфор реагирует с 1) NaCl 2) O 2 3) KBr 4) Н 2
73 . Бром вытесняет другой галоген из раствора
1) хлорида натрия 2) иодида калия 3) фторида натрия 4) Фтороводорода
74. И магний, и сера реагируют с
1) щелочами 2) разбавленной серной кислотой 3) азотом 4) кислородом
75. Водород вступает в реакцию с 1) CuO 2) NaOH 3) NH 3 4) K 2 O
76. И кислород, и водород вступают в реакцию с 1) FeO 2) CuO 3) NH 3 4) H 2 S
77. И железо, и фосфор реагируют с 1) водородом 2) хлором 3) щелочами 4) соляной кислотой
78. С углеродом взаимодействует 1)оксид железа(III) 2)гидроксид натрия 3 соляная кислота 4)медь
79. С раствором бромида бария реагирует 1) ZnCl 2 2) KI 3) FeO 4) Cl 2
80. Водород не реагирует с 1) оксидом меди(II) 2) хлором 3) гидроксидом натрия 4) кислородом
81. Водород при нагревании вступает в химическую реакцию с
1) водой 2) оксидом меди (II) 3) хлоридом натрия 4) аммиаком
82. Водород из растворов кислот можно вытеснить
1) платиной 2) медью 3) магнием 4) серебром
83. Раствор гидроксида калия способен растворять 1) медь 2) магний 3) углерод 4) алюминий
84. В реакцию с водой при комнатной температуре вступает каждое из двух веществ:
1) магний и сера 2) алюминий и фосфор 3) натрий и кальций 4) кислород и углерод
85. С раствором сульфата меди(II) реагирует 1) серебро 2) ртуть 3) сера 4) магний
86. С разбавленной серной кислотой не реагирует
1) железо 2) цинк 3) медь 4) магний
87. Сера реагирует с каждым из двух веществ:
1) азот и цинк 2) кислород и оксид магния 3) гидроксид натрия и аммиак 4) водород и ртуть
88. Кислород реагирует с 1) NaOH 2) SO 2 3) FeCl 3 4) CO 2
89. Кислород реагирует с каждым из двух веществ:
1) CO и Mg 2) CO 2 и Mg 3) MgO и C 4) SiO 2 и P
90. И с магнием, и с водородом реагирует
1) хлор 2) оксид фосфора(V) 3) гидроксид кальция 4) сероводородная кислота
91. С водородом реагирует
1) аммиак 2) гидроксид натрия 3) сера 4) фосфорная кислота
92. Азот при небольшом нагревании может вступать в химическую реакцию с
1) серой 2) магнием 3) углеродом 4) железом
93. Хлор реагирует с 1) N 2 2) KF 3) NaI 4) O 2
94. С углеродом не реагирует
1) натрий 2) водород 3) оксид углерода(II) 4) серная кислота (конц.)
95. Водород образуется при взаимодействии раствора серной кислоты и
1) оксида натрия 2) карбоната натрия 3) меди 4) железа
96. Углерод не реагирует с
1) оксидом железа(II) 2) кислородом 3) водородом 4) хлоридом натрия
97. Хлор реагирует с 1) кислородом2)азотной кислотой 3)бромидом кальция4)сульфатом алюминия
98. С каждым из веществ – KOH, HCl, AgNO 3 – взаимодействует 1) Cu 2) Mg 3) Al 4) Fe
99. И хлор, и азот при нагревании реагируют с
1) соляной кислотой 2) гидроксидом натрия 3) водородом 4) магнием
100. При обычных условиях с водой не реагирует 1) хлор 2) кальций 3) фтор 4) сера
101. Водород может вступать в химическую реакцию с
1) аргоном 2) хлором 3) кремнием 4) железом
102. Окислительные свойства углерод проявляет при взаимодействии с
1) O 2 2) Ca 3) Fe 2 O 3 4) CuO
103. Водород реагирует с каждым из двух веществ:
1) H2S и O2 2) CuO и SO2 3) FeO и N2 4)NH3 и S
104. Хлор не вытесняет галоген из раствора
1) фторида натрия 2) бромида натрия 3) иодида натрия 4) бромоводорода
105. При взаимодействии сульфата меди(II) и цинка образуются
1) сера и оксид цинка2) медь и сульфат цинка 3)вода и сульфид цинка4)оксид цинка и сульфид меди
106. С кислородом реагирует 1) вода 2) оксид углерода(II) 3) оксид алюминия 4) нитрат натрия
107. Магний при комнатной температуре реагирует с
1) гидроксидом меди(II) 2) оксидом кальция 3) хлоридом цинка 4) водой
108. С разбавленным раствором щелочи реагирует
1) медь 2) алюминий 3) углерод 4) железо
109. Какой из указанных металлов проявляет наибольшую химическую активность в реакции с водой?
1) натрий 2) калий 3) цинк 4) магний
110. И с кислородом, и с водородом реагирует
1) оксид фосфора(V) 2) сера 3) вода 4) оксид алюминия
111. Выделение водорода не происходит при взаимодействии с цинком раствора
ГАУ ДПО (ПК) С «Брянский областной центр оценки качества образования»
Демонстрационный вариант
для аттестации педагогических и руководящих работников Брянской области на подтверждение соответствия занимаемой должности
Химия
г. Брянск
А1. Электронную конфигурацию атома криптона имеет частица
1) Br − 2) Cl 5+ 3)Rb o 4) Se 4+
А2. Химическому элементу, электронная конфигурация атома которого 1s 2 2s 2 2p 1 , отвечает общая формула высшего оксида
1) R 2 O 3 2)RO 2 3)R 2 O 4)RO 3
А3. Вещество с ковалентной полярной связью имеет формулу
1) S 8 2)NaCl 3)MgO 4) HCl
А4. Наибольшую степень окисления сера проявляет в соединении
1) SO 2 2)K 2 SO 3 3) Na 2 SO 4 4) K 2 S
А5. Молекулярную кристаллическую решётку имеет
1) поваренная соль 2) сода 3) алмаз 4) глюкоза
А6. В перечне веществ, формулы которых
А) С 5 Н 10 Б) С 4 Н 8 В) С 4 Н 6 Г) С 3 Н 6 Д) С 3 Н 4 Е) С 5 Н 8
к ацетиленовым углеводородам могут относиться
1) АВЕ 2) БГД 3) ВДЕ 4) ГДЕ
А7. Верны ли следующие суждения о железе?
А. Для железа характерна степень окисления, равная +8.
Б. Железо вытесняет медь из раствора сульфата меди (II)
А8. Азотной кислоте соответствует оксид, формула которого
1) NO 2)N 2 O 3 3) NO 2 4) N 2 O 5
А9. Железо вступает в реакцию с раствором
1) Hg(NO 3) 2 2) Mg(NO 3) 2 3) K 2 SO 4 4) ZnCl 2
А10. Оксид серы (VI) взаимодействует с каждым из двух веществ
1) P 2 O 5 и KOH 2) MgOи SO 2 3) NaOH и H 2 О 4) СО 2 и Ва(ОН) 2
А11. Хлороводородная кислота реагирует с каждым из двух веществ:
1) Cu(OH) 2 и Ag 2) NH 3 и CO 3) CaCO 3 и Fe 2 O 3 4) NaOH и Hg
А12. Верны ли следующие суждения о солях угольной кислоты?
А. Карбонаты образуются при взаимодействии щёлочи с избытком углекислого газа.
Б. В результате нагревания гидрокарбонатов образуются карбонаты.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
А13. В схеме превращений веществами «Х» и «Y» являются
1) X -HCl иY - Ca(OH) 2
2) X - H 2 SO 4 иY - CaHPO 4
3) X - H 2 O иY - Ca(OH) 2
4) X - Ca(OH) 2 иY - CaH 2
А14. Изомером диметилового эфира является:
1) метаналь 2) метан 3) этанол 4) этилен
А15. Число σ-связей в молекуле тетрахлорметана равно
1)1 2) 2 3) 3 4) 4
А16. Свежеосаждённый гидроксид меди (II) взаимодействует с:
1) бензолом 2) этанолом 3) стиролом 4) глицерином
А17. Как муравьиная, так и пропионовая кислота реагируют с
1) фенолом 2) этаналем 3) этанолом 4) этилацетатом
А18. В схеме превращений
веществом «Х» является
1) 1,2-дибромэтан 2) бромэтан 3) 1,1-дибромэтан 4) ацетилен
А19. Верны ли следующие суждения о типах химических реакций?
А. Взаимодействие оксида серы (IV) с кислородом относят к эндотермическим реакциям.
Б. Разложение метана относят к экзотермическим реакциям
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
А20. С наибольшей скоростью происходит реакция между соляной кислотой и
1) CaCO 3 2) Zn 3) NaOH (р-р) 4) Fe(OH) 3
А21. Верны ли суждения о смещении равновесия в системе: 2 NO (г) + O 2 (г) ⇄ 2 NO 2 (г) + Q?
А. При повышении давления химическое равновесие в данной системе сместится в сторону продукта реакции.
Б. При увеличении концентрации оксида азота (II) равновесие системы сместится в сторону продукта реакции.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
А22. Электролитом является каждое из двух веществ:
1) хлорид бария, ацетат натрия
2) этанол, уксусная кислота
3) ацетон, хлорная кислота
4) бром, бензол
А23. К реакциям ионного обмена относится
1) СH 4 + Cl 2 = CH 3 Cl + HCl
2) Zn + 2 HCl = ZnCl 2 + H 2
3) KOH + HCl = KCl + H 2 O
4) Cu(OH) 2 = CuO + H 2 О
А24. Окислительно-восстановительной является реакция между:
1) Са и Н 2 О 2) Р 2 О 3 и ВаО 3) Cl 2 O 7 и Н 2 O 4) Al 2 O 3 и Na 2 O
А25. Полному гидролизу подвергается
1) сульфид алюминия 2) сульфат натрия 3) хлорид меди (II) 4) нитрат железа (III)
А26. Пропан реагирует с веществом, формула которого
1) Н 2 O 2)HCl 3)Cl 2 4) H 2
А27. Пропанол-1 образуется при взаимодействии:
1) 1-хлорпропана со щелочью (водный раствор)
2) пропена со щелочью (водный раствор)
3) пропаналя с водой
4) дихлорпропана с водой
А28. Углекислый газ в сосуде можно обнаружить с помощью
1) палочки, смоченной соляной кислотой
2) горящей лучинки
3) влажной фенолфталеиновой бумажки
4) сухой фенолфталеиновой бумажки
А29. Только электролизом расплава соли в промышленности можно получить
1) натрий 2) цинк 3) хром 4) серебро
А30. Объём кислорода (н.у.), необходимый для полного сгорания 1 моль газообразного аммиака с образованием азота, равен
1) 12 л 2) 16,8 л 3) 18,4 л 4) 25,2 л
А31. Гидроксидом, который взаимодействует как с раствором кислоты, так и с раствором щёлочи, является
1) Mg(OH) 2 2) Cr(OH) 3 3) Ba(OH) 2 4) Ca(OH) 2
А32. И с раствором азотной кислоты, и с раствором гидроксида натрия взаимодействует
1) сульфат магния 2) сульфид аммония 3) хлорид калия 4) бромид свинца (II)
А33. В схеме превращений веществом «Y» является
1) сульфит железа (III) 2) сульфат железа (II) 3) сульфид железа (III) 4) сульфат железа (III)
А34. Изомером диэтилового эфира является:
1) пропанол-2 2) бутанол-1 3) пентанол-2 4) гексанол-3
А35. Атом кислорода в молекуле фенола образует
1) две σ-связи 2) одну σ-связь 3) одну σ- и одну π-связь 4) две π-связи
А36. Сера реагирует с каждым из двух веществ
1) О 2 и SiO 2 2) Cl 2 и NaCl 3) HCl и N 2 4) Fe и Н 2
Ключ


