02.02.2018
Ferrum 3 o 4 oksidacijsko stanje. Velika enciklopedija nafte i gasa


AT zemljine kore gvožđe je široko rasprostranjeno; čini oko 4,1% mase zemljine kore (4. mjesto među svim elementima, 2. među metalima). U omotaču i zemljinoj kori gvožđe je koncentrisano uglavnom u silikatima, dok je njegov sadržaj značajan u bazičnim i ultrabazičnim stenama, a nizak u kiselim i srednjim stenama. Poznat je veliki broj ruda i minerala koji sadrže željezo. Od najveće praktične važnosti su ruda crvenog željeza (hematit, Fe 2 O 3; sadrži do 70% Fe), magnetna željezna ruda (magnetit, FeFe 2 O 4, Fe 3 O 4; sadrži 72,4% Fe), ruda smeđeg željeza ili limonit (getit i hidrogoetit, odnosno FeOOH i FeOOH nH 2 O) hematit magnetit limonit getit

Siderit FeCO 3 sadrži približno 35% gvožđa. Ima žućkasto bijelu (sa sivom ili smeđom nijansom u slučaju kontaminacije) boju. Siderite Mispikel FeAsS sadrži 34,3% gvožđa. Mispikel Löllingite FeAs 2 sadrži 27,2% željeza Löllingite ilmenit FeTiO 3 ilmenit magnomagnetit (Fe, Mg) fibroferit FeSO 4 (OH) 4,5H 2 O jarozit KFe 3 (SO 4) 2 (OH) 6 jarozit


Glavna oksidaciona stanja gvožđa su +2 i +3. Kada se čuva na zraku na temperaturama do 200 °C, željezo se postepeno prekriva gustim filmom oksida, koji sprječava dalju oksidaciju metala. U vlažnom zraku, željezo je prekriveno labavim slojem rđe, koji ne sprječava pristup kisika i vlage metalu i njegovo uništavanje. Rđa nema postojanost hemijski sastav, otprilike hemijska formula može se napisati kao Fe 2 O 3 xH 2 O. oksid rđe

Gvožđe pri zagrevanju reaguje sa kiseonikom. Kada se željezo sagorijeva na zraku nastaje Fe 3 O 4 oksid, kada se sagorijeva u čistom kisiku, nastaje Fe 2 O 3 oksid. Ako se kisik ili zrak propuštaju kroz rastopljeno željezo, nastaje FeO oksid. Kada se sumpor i željezni prah zagriju, nastaje sulfid, čija se približna formula može napisati kao FeS. kiseonikFe 3 O 4Fe 2 O 3 FeO sumpor


13. ELEMENTI PODGRUPE CHROME.
atomski broj Ime Electronic
konfiguracijuρ
g/cm 3tpl.
0Ctboiling
0CEO Atomic
radijus,
nmStepen
oksidacija26 Iron Fe 3d64s2 7,87 1535 2750 1,64 0,128 +2,+3 27 Cobalt Co 3d74s2 8,9 1495 2870 1,7 0,125 +2,+3 28 Nickel Ni 3d8 4s2 8,9 1453 2732 1,75 0,124 +1,+2,+3,+4 Potvrda
metali podgrupe gvožđaOporavak od oksida ugljikom ili ugljičnim monoksidom (II)
FeO + C Fe + CO
Fe 2 O 3 + 3CO 2Fe + 3CO 2
NiO + C Ni + CO
Co 2 O 3 + 3C 2Co + 3COFe
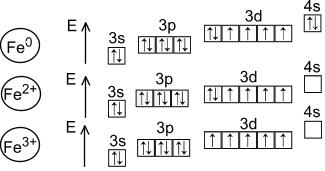
d- element grupe VIII; serijski broj - 26; atomska masa- 56; (26p; 30n), 26eMetal srednje aktivnosti, redukciono sredstvo.
Glavna oksidaciona stanja - +2, +3
Gvožđe i njegova jedinjenja
Na zraku, željezo se lako oksidira u prisustvu vlage (rđanje):
4Fe + 3O 2 + 6H 2 O 4Fe(OH) 3
Zagrijana željezna žica gori u kisiku, stvarajući kamenac - željezni oksid (II, III):
3Fe + 2O 2 Fe 3 O 4
At visoke temperature(700–900 0 C) gvožđe reaguje sa vodenom parom:
3Fe + 4H 2 O Fe 3 O 4 + 4H 2
Gvožđe pri zagrevanju reaguje sa nemetalima:2Fe + 3Br 2 2FeBr 3
Fe + S FeS
Gvožđe se lako otapa u hlorovodoničnom i razblaženom sumpornom kiselinom:Fe + 2HCl FeCl 2 + H 2
Fe + H 2 SO 4 (razb.) FeSO 4 + H 2U koncentriranim oksidirajućim kiselinama, željezo se otapa samo kada se zagrije.
2Fe + 6H 2 SO 4 (konc.) Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O
Fe + 6HNO 3 (konc.) Fe(NO 3) 3 + 3NO 2 + 3H 2 O(na hladnom, koncentrisana azotna i sumporna kiselina pasiviziraju gvožđe).
Gvožđe istiskuje metale desno od sebe u nizu naprezanja iz rastvora njihovih soli.Fe + CuSO 4 FeSO 4 + Cu
Gvozdena jedinjenja
Gvožđe(II) hidroksid
Nastaje djelovanjem alkalnih otopina na soli željeza (II) bez pristupa zraka:
FeCl + 2KOH 2KCl + Fe(OH) 2
Fe (OH) 2 je slaba baza, rastvorljiva u jakim kiselinama:
Fe(OH) 2 + H 2 SO 4 FeSO 4 + 2H 2 O
Kada se Fe (OH) 2 kalcinira bez pristupa zraka, nastaje željezni oksid (II) FeO:
Fe(OH) 2 FeO + H 2 O
U prisustvu atmosferskog kiseonika, bijeli talog Fe (OH) 2, oksidirajući, postaje smeđi - formirajući željezo (III) hidroksid Fe (OH) 3:
4Fe(OH) 2 + O 2 + 2H 2 O 4Fe(OH) 3
Jedinjenja gvožđa(II) imaju obnavljajuća svojstva, lako se pretvaraju u jedinjenja gvožđa (III) pod dejstvom oksidacionih sredstava:
10FeSO 4 + 2KMnO 4 + 8H 2 SO 4 5Fe 2 (SO 4) 3 + K 2 SO 4 + 2MnSO 4 + 8H 2 O
6FeSO 4 + 2HNO 3 + 3H 2 SO 4 3Fe 2 (SO 4) 3 + 2NO + 4H 2 OJedinjenja željeza su sklona formiranju kompleksa (koordinacijski broj = 6):
FeCl 2 + 6NH 3 Cl 2
Kvalitativna reakcija za Fe 2+
Fe(CN)2 + 4KCN K4 (žuta krvna so)Pod djelovanjem kalijevog heksacijanoferata (III) K 2 (crvena krvna sol) na otopine željeznih soli nastaje plavi talog (turnbull blue):
3FeSO 4 + 2K 3 Fe 3 + 3K 2 SO 4
Jedinjenja željeza
Gvožđe(III) oksid
Nastaje prilikom sagorijevanja željeznih sulfida, na primjer, prilikom pečenja pirita:
4FeS 2 + 11O 2 2Fe 2 O 3 + 8SO 2
ili kada se kalciniraju soli željeza:
2FeSO 4 Fe 2 O 3 + SO 2 + SO 3
Fe 2 O 3 - osnovni oksid, in beznačajan stepen amfoterično
Fe 2 O 3 + 6HCl 2FeCl 3 + 3H 2 O
Fe 2 O 3 + 2NaOH + 3H 2 O 2Na
Gvožđe(III) hidroksid
Nastaje djelovanjem alkalnih otopina na soli feri željeza: taloži se kao crveno-smeđi precipitat
Fe(NO 3) 3 + 3KOH Fe(OH) 3 + 3KNO 3
Fe (OH) 3 je slabija baza od gvožđe (II) hidroksida.
Ovo se objašnjava činjenicom da Fe 2+ ima manji naboj jona i veći radijus od Fe 3+, te stoga Fe 2+ slabije drži hidroksidne ione, tj. Fe(OH) 2 lakše disocira.
S tim u vezi, soli gvožđa (II) su slabo hidrolizovane, a soli gvožđa (III) su veoma jako hidrolizovane. Boja rastvora soli Fe(III) takođe se objašnjava hidrolizom: uprkos činjenici da je ion Fe3+ gotovo bezbojan, rastvori koji ga sadrže obojeni su žuto-smeđom bojom, što se objašnjava prisustvom hidroksijona gvožđa ili Fe(OH). )3 molekule, koje nastaju hidrolizom:Fe 3+ + H 2 O 2 + + H +
2 + + H 2 O + + H +
+ + H2O Fe(OH) 3 + H +Kada se zagrije, boja potamni, a kada se dodaju kiseline, postaje svjetlija zbog supresije hidrolize. Fe (OH) 3 ima slabo izraženu amfoternost: rastvara se u razrijeđenim kiselinama i u koncentriranim otopinama alkalija:
Fe(OH) 3 + 3HCl FeCl 3 + 3H 2 O
Fe(OH) 3 + NaOH Na
Jedinjenja željeza (III) su slabi oksidanti, reagiraju s jakim redukcijskim agensima:
2FeCl 3 + H2S S + 2FeCl 2 + 2HCl
Kvalitativne reakcije na Fe3+
17. d - elementi Gvožđe, opšte karakteristike, svojstva. Oksidi i hidroksidi, karakteristike CO i OM, biouloga, sposobnost formiranja kompleksa.
1. Opće karakteristike.
Iron - d-element sekundarne podgrupe osme grupe četvrtog perioda PSCE sa atomskim brojem 26.
Jedan od najčešćih metala u zemljinoj kori (drugo mjesto nakon aluminija).
Jednostavna supstanca gvožđe je savitljiv srebrno-beli metal sa visokom hemijskom reaktivnošću: gvožđe brzo korodira na visokim temperaturama ili visokoj vlažnosti u vazduhu.
4Fe + 3O2 + 6H2O = 4Fe(OH)3
U čistom kiseoniku gvožđe gori, au fino raspršenom stanju se spontano pali na vazduhu.
3Fe + 2O2 = FeO + Fe2O3
3Fe + 4H2O = FeO*Fe2O3
FeO*Fe2O3 = Fe3O4 (željezna skala)
Zapravo, željezo se obično naziva njegovim legurama s niskim sadržajem nečistoća (do 0,8%), koje zadržavaju mekoću i duktilnost čistog metala. Ali u praksi se češće koriste legure željeza s ugljikom: čelik (do 2,14 tež.% ugljika) i liveno željezo (više od 2,14 tež.% ugljika), kao i nehrđajući (legirani) čelik s dodatkom legiranja metali (hrom, mangan, nikl itd.). Kombinacija specifičnih svojstava gvožđa i njegovih legura čini ga „metalom br. 1“ po važnosti za ljude.
U prirodi se gvožđe rijetko nalazi u čistom obliku, najčešće se javlja kao dio željezo-nikl meteorita. Prevalencija gvožđa u zemljinoj kori iznosi 4,65% (4. mesto posle O, Si, Al). Takođe se veruje da gvožđe čini većinu Zemljinog jezgra.
2.Properties
1.Physical St. Gvožđe je tipičan metal, u slobodnom stanju je srebrnobele boje sa sivkastom nijansom. Čisti metal je duktilan, razne nečistoće (posebno ugljik) povećavaju njegovu tvrdoću i lomljivost. Ima izražena magnetna svojstva. Često se razlikuje takozvana "gvozdena trijada" - grupa od tri metala (gvožđe Fe, kobalt Co, nikal Ni) koji imaju slična fizička svojstva, atomske radijuse i vrednosti elektronegativnosti.
2.Chemical St. Islands.
|
Oksidacijsko stanje |
Oksid |
hidroksid |
karakter |
Bilješke |
|
Slabo osnovno | ||||
|
Vrlo slaba baza, ponekad amfoterna | ||||
|
Nije dobila |
|
Kiselina |
Jako oksidaciono sredstvo |
Za gvožđe, oksidaciona stanja gvožđa su karakteristična - +2 i +3.
Oksidacijsko stanje +2 odgovara crnom oksidu FeO i zelenom hidroksidu Fe(OH) 2 . Oni su osnovni. U solima je Fe(+2) prisutan kao kation. Fe(+2) je slab redukcioni agens.
+3 oksidaciona stanja odgovaraju crveno-smeđim Fe 2 O 3 oksidu i smeđom Fe(OH) 3 hidroksidu. Oni su amfoterne prirode, iako su njihova kisela i bazična svojstva slabo izražena. Dakle, Fe 3+ joni su potpuno hidrolizovančak i u kiseloj sredini. Fe (OH) 3 se rastvara (i tada ne u potpunosti), samo u koncentriranim alkalijama. Fe 2 O 3 reaguje sa alkalijama samo kada je fuzionisan, dajući feriti(formalne soli kiseline koja ne postoji u slobodnom obliku kiseline HFeO 2):
Gvožđe (+3) najčešće ispoljava slaba oksidaciona svojstva.
Stanja oksidacije +2 i +3 lako prelaze između sebe kada se redoks uslovi promene.
Osim toga, postoji Fe 3 O 4 oksid, formalno stanje oksidacije željeza u kojem je +8/3. Međutim, ovaj oksid se može smatrati i željeznim (II) feritom Fe +2 (Fe +3 O 2) 2 .
Takođe postoji oksidaciono stanje od +6. Odgovarajući oksid i hidroksid ne postoje u slobodnom obliku, ali su dobijene soli - ferati (na primjer, K 2 FeO 4). Gvožđe (+6) je u njima u obliku anjona. Ferati su jaki oksidanti.
Čisto metalno gvožđe je stabilno u vodi i u razblaženim rastvorima. alkalije. Gvožđe se ne otapa u hladnoj koncentriranoj sumpornoj i azotnoj kiselini zbog pasivizacije površine metala jakim oksidnim filmom. Vruća koncentrirana sumporna kiselina, kao jači oksidacijski agens, stupa u interakciju sa željezom.
OD hlorovodonična i razrijeđen (oko 20%) sumporna kiseline gvožđe reaguje da formira soli gvožđa(II):
Kada gvožđe reaguje sa približno 70% sumporne kiseline kada se zagrije, reakcija se nastavlja formiranjem gvožđe(III) sulfat:
3. Oksidi i hidroksidi, CO i OM char-ka ...
Jedinjenja gvožđa(II).
Oksid željeza (II) FeO ima osnovna svojstva, odgovara bazi Fe (OH) 2. Soli gvožđa (II) imaju svetlo zelenu boju. Kada se čuvaju, posebno na vlažnom zraku, postaju smeđi zbog oksidacije u željezo (III). Isti proces se dešava i prilikom skladištenja vodenih rastvora soli gvožđa(II):
Soli gvožđa(II) u vodenim rastvorima, stabilan mora salt- dvostruki amonijum i gvožđe (II) sulfat (NH 4) 2 Fe (SO 4) 2 6H 2 O.
Reagens za Fe 2+ jone u rastvoru može biti kalijum heksacijanoferat(III) K 3 (crvena krvna sol). Kada Fe 2+ i 3− joni interaguju, nastaje talog turnbull blue:
Za kvantitativno određivanje gvožđa (II) u rastvoru koristite fenantrolin, koji formira crveni FePhen 3 kompleks sa željezom (II) u širokom rasponu pH (4-9)
Jedinjenja gvožđa(III).
Gvožđe(III) oksid Fe 2 O 3 slabo amfoteren, odgovara još slabijoj od Fe (OH) 2, bazi Fe (OH) 3, koja reaguje sa kiselinama:
Fe 3+ soli imaju tendenciju stvaranja kristalnih hidrata. U njima je ion Fe 3+ obično okružen sa šest molekula vode. Takve soli su ružičaste ili ljubičaste boje.Jon Fe 3+ je potpuno hidrolizovan čak iu kiseloj sredini. Pri pH>4, ovaj ion se skoro potpuno istaloži u obliku Fe (OH) 3:
Parcijalnom hidrolizom Fe 3+ jona nastaju polinuklearne okso- i hidroksokacije, zbog čega rastvori postaju smeđi.Glavna svojstva gvožđe(III) hidroksida Fe(OH) 3 su veoma slabo izražena. Može reagirati samo s koncentriranim alkalnim otopinama:
Nastali hidroksokopleksi gvožđa(III) stabilni su samo u jako alkalnim rastvorima. Kada se rastvori razblaže vodom, oni se uništavaju, a Fe (OH) 3 precipitira.
Kada se stapa sa alkalijama i oksidima drugih metala, Fe 2 O 3 stvara različite feriti:
Jedinjenja željeza(III) u otopinama reduciraju se metalnim željezom:
Gvožđe(III) je sposobno da formira dvostruke sulfate sa jednostrukim nabojem katjoni tip alum, na primjer, KFe (SO 4) 2 - kalijum željezo alum, (NH 4) Fe (SO 4) 2 - željezo amonijum alum, itd.
Za kvalitativnu detekciju jedinjenja gvožđa(III) u rastvoru koristi se kvalitativna reakcija Fe 3+ jona sa tiocijanatnim ionima SCN − . Kada ioni Fe 3+ stupe u interakciju sa SCN − anjonima, nastaje mješavina svijetlocrvenih kompleksa željeznih tiocijanatnih 2+ , + , Fe(SCN) 3 , -. Sastav smeše (a samim tim i intenzitet njene boje) zavisi od različitih faktora, tako da ova metoda nije primenljiva za precizno kvalitativno određivanje gvožđa.
Još jedan visokokvalitetni reagens za Fe 3+ ione je kalijum heksacijanoferat(II) K 4 (žuta krvna sol). Prilikom interakcije Fe 3+ i 4− jona nastaje svijetloplavi talog pruska plava:
Jedinjenja gvožđa(VI).
ferrati- soli željezne kiseline H 2 FeO 4 koje ne postoje u slobodnom obliku. To su jedinjenja ljubičaste boje, koja po oksidacijskim svojstvima podsjećaju na permanganate, a po rastvorljivosti na sulfate. Ferati se dobijaju delovanjem gasova hlor ili ozona na suspenziji Fe (OH) 3 u lužini , na primjer, kalijum ferat (VI) K 2 FeO 4 . Ferati su obojeni ljubičastom bojom.
Ferati se također mogu nabaviti elektroliza 30% alkalni rastvor na gvozdenoj anodi:
Ferati su jaki oksidanti. U kiseloj sredini se razgrađuju oslobađanjem kiseonika:
Oksidirajuća svojstva ferata se koriste dezinfekcija vode.
4.Biorol
1) U živim organizmima gvožđe je važan element u tragovima koji katalizuje procese razmene kiseonika (disanje).
2) Gvožđe se obično nalazi u enzimima u obliku kompleksa, a posebno se ovaj kompleks nalazi u hemoglobinu, najvažnijem proteinu koji obezbeđuje transport kiseonika krvlju do svih organa čoveka i životinja. I upravo on boji krv u karakterističnu crvenu boju.
4) Prekomjerna doza željeza (200 mg i više) može imati toksični učinak. Predoziranje gvožđem deprimira antioksidativni sistem organizma, pa koristite suplemente gvožđa zdravi ljudi Nije preporuceno.
Stranica 3
Na sl. V.8 prikazuje shemu korelacije koja daje predstavu o intervalima izomernih pomaka 57Fe za jedinjenja željeza. Oksidacijsko stanje željeza može varirati od 0 do 6, a nije ga tako lako okarakterizirati izomernim pomakom 57Fe.
Redukciona atmosfera dovodi do smanjenja stepena oksidacije gvožđa u šljaci, dok se u oksidacionoj atmosferi, pod uticajem visokih temperatura plamena, nastavlja raspadanje viših oksida gvožđa. Povećanje stepena oksidacije željeza u šljaci djelovanjem oksidirajuće atmosfere moguće je samo pri temperaturi plamena ispod 1200 C i velikoj površini šljake.
Sadržaj Al2O3 i alkalija se prilično naglo mijenja u stijenama. Oksidacijsko stanje željeza ostaje konstantno.
| Temperaturna zavisnost viskoznosti. |
Uzorak C sa stepenom oksidacije od 13% nema plastičnu regiju, a šljaka se ponaša kao staklo. S povećanjem stupnja oksidacije željeza na 30 ili 56%, na krivuljama viskoznosti uzoraka B i A pojavljuje se zavoj, što ukazuje da šljaka na mjestu savijanja prelazi u plastično stanje.
Ali stupanj oksidacije sumpora, koji je dio ovih jona, je različit. U prvom slučaju, oksidaciono stanje gvožđa poklapa se sa nabojem jednostavnog Fe2 jona i sa valencijom gvožđa. Dakle, valencija datog elementa u kompleksnom jedinjenju naziva se ukupna količina veza koju centralni atom, agens za stvaranje kompleksa, ima u ovom spoju.
Sklonost stvaranju kompleksa potvrđuje i postojanje tipičnih dvostrukih soli kao što su šeniti i stipse. U ovom spoju stabilizira se oksidacijsko stanje željeza 2, dok se sulfat FeSO4 in vodeni rastvor sklon oksidaciji atmosferskim kiseonikom. Nikl ne stvara takve spojeve, jer je oksidacijsko stanje 3 za ovaj element toliko nekarakteristično da se ne stabilizira čak ni u dvostrukim solima.
Ovo povećanje stepena oksidacije gvožđa u šljaci nastavlja se do temperature od oko 1200 C. Daljnjim povećanjem temperature šljake stepen oksidacije gvožđa značajno opada.
Kao što je naznačeno, centralni atom gvožđa leži u ravni 16-članog porfirnog prstena, i vezan je za atome azota pirolnih prstenova pomoću četiri od šest dostupnih valencija, i stoga ostaju dve valencije da kompletiraju oktaedarski kompleks; ove valencije su iznad i ispod ravnine crteža prikazanog modela. Osim toga, mora se uzeti u obzir i stepen oksidacije gvožđa; kada je željezo u željeznom stanju, kao što je prikazano na slici, protoporfirin se naziva tema ili, jasnije, ferogem. Ako je hem u slobodnom stanju u rastvoru i nije vezan za protein, onda se pretpostavlja da su dva molekula vode u koordinaciji sa petom i šestom pozicijom valencije gvožđa. George označava ovaj ferogem na sljedeći način: H2O - Fep-H. Kada se oksidira, pretvara se u H O Fep NaO s jednim pozitivnim nabojem. Ovaj ferihem može koordinirati jon hlora sa prelaskom u H2O - Fep-Cl i u ovom slučaju se naziva hemin; sa koordinisanim hidroksilnim jonom, ferigem se označava kao hematin H2O - Pep-OH, iako se ovi termini ponekad koriste manje specifično, samo da bi ukazali na prisustvo željeznog oksida. Moguća je i koordinacija drugih molekula, a koordinacija sa vodikovim peroksidom igra ulogu na prvom mjestu. Ferohem lako koordinira azotne baze, kao što je piridin, formirajući hemokromogee B-Fp-B. Isti spoj sa ferihemom B-Fep-B naziva se parahematin.
Magnetskom metodom utvrđeno je prisustvo i kvantitativna procjena valentnih veza između susjednih pozitivnih jona. Dakle, u Fe203 na nosaču A1203, oksidacijsko stanje željeza je tri, ali istovremeno susjedni atomi željeza formiraju kovalentnu vezu jedan s drugim.
Magnetskom metodom utvrđeno je prisustvo i kvantitativna procjena valentnih veza između susjednih pozitivnih jona. Dakle, u Fe2O3 na nosaču A12O3, oksidacijsko stanje željeza je tri, ali istovremeno susjedni atomi željeza stvaraju kovalentnu vezu jedan s drugim.
Ako uzmemo u obzir hidrokside Fe (OH) 2 i Fe (OH) 3, onda bi sa stanovišta Kosselove sheme kisela svojstva drugog hidroksida trebala biti izraženija od prvog. To proizilazi iz činjenice da što je veći stepen oksidacije željeza (čak i ako pretpostavimo da su radijusi Fe2 i Fe3 iona isti), to je veća odbojnost protona i izraženija kisela svojstva odgovarajućeg hidroksid. Ako uzmemo u obzir da je polumjer iona Fe3 nešto manji od polumjera iona Fe2, tada postaje još očiglednije veće odbijanje protona u spoju Fe (OH) 3 u odnosu na Fe (OH) 2.
Dio željeznih oksida reducira se u metalno željezo, drugi dio u [dušikov oksid]; osim toga, na njima se oslobađa ugljik. Količina kiseonika koja se još uvek nalazi u rudi karakteriše stepen oksidacije gvožđa.
Ako nakon preliminarnih ispitivanja ostane sumnja da li je prisutan ion željeza, mogu se provesti verifikacijske reakcije. Ali treba imati na umu da ovim testom više nije moguće utvrditi početni stupanj oksidacije željeza u analiziranom uzorku.
Samo u prisustvu jakih oksidacionih sredstava moguće je dobiti prilično krhke derivate željezne kiseline H2FeO4 sa oksidacijskim stanjem željeza 6, međutim, nije bilo moguće izolovati odgovarajući oksid. Ako je RuO4 niskostabilna supstanca koja se dobija indirektno, onda je OsO4 potpuno stabilno jedinjenje koje nastaje tokom oksidacije metala u vazduhu.