02.02.2018
Starea de oxidare a ferului 3 sau 4. Marea enciclopedie a petrolului și gazelor


ÎN Scoarta terestra fierul este larg distribuit; el reprezintă aproximativ 4,1% din masa scoarței terestre (locul 4 între toate elementele, al 2-lea între metale). În mantaua și scoarța terestră, fierul este concentrat în principal în silicați, în timp ce conținutul său este semnificativ în rocile bazice și ultrabazice, și scăzut în rocile acide și intermediare. Sunt cunoscute un număr mare de minereuri și minerale care conțin fier. De cea mai mare importanță practică sunt minereul de fier roșu (hematit, Fe 2 O 3; conține până la 70% Fe), minereul de fier magnetic (magnetit, FeFe 2 O 4, Fe 3 O 4; conține 72,4% Fe), minereul de fier brun. sau limonit (goethit și hidrogoethit, respectiv FeOOH și FeOOH nH 2 O) hematit magnetit limonit goethit

Siderita FeCO3 conține aproximativ 35% fier. Are o culoare alb-gălbuie (cu o tentă gri sau maro în caz de contaminare). Siderite Mispikel FeAsS conține 34,3% fier. Mispikel Löllingite FeAs 2 conține 27,2% fier Löllingit ilmenit FeTiO 3 ilmenit magnomagnetit (Fe, Mg) fibroferită FeSO 4 (OH) 4,5H 2 O jarosit KFe 3 (SO 4) 2 (OH) 6 jarosit


Principalele stări de oxidare ale fierului sunt +2 și +3. Când este depozitat în aer la temperaturi de până la 200 °C, fierul este acoperit treptat cu o peliculă densă de oxid, care previne oxidarea ulterioară a metalului. În aerul umed, fierul este acoperit cu un strat liber de rugină, care nu împiedică accesul oxigenului și umezelii la metal și distrugerea acestuia. Rugina nu are permanent compoziție chimică, aproximativ formula chimica se poate scrie Fe 2 O 3 xH 2 O. oxid de rugină

Fierul reacționează cu oxigenul când este încălzit. Când fierul este ars în aer, se formează oxid Fe 3 O 4, când este ars în oxigen pur, oxid de Fe 2 O 3. Dacă oxigenul sau aerul sunt trecute prin fier topit, se formează oxid de FeO. Când sulful și pulberea de fier sunt încălzite, se formează sulfură, a cărei formulă aproximativă poate fi scrisă ca FeS. oxigenFe 3 O 4Fe 2 O 3 FeO sulf


13. ELEMENTE DE SUBGRUP CROM.
numar atomic Nume Electronic
configurațieρ
g/cm 3tpl.
0Cfierbere
0CEO Atomic
rază,
nmgrad
oxidare26 Fier Fe 3d64s2 7,87 1535 2750 1,64 0,128 +2,+3 27 Cobalt Co 3d74s2 8,9 1495 2870 1,7 0,125 +2,+3 28 Nichel Ni 3d8 4s2 8,9 1453 2732 1,75 0,124 +1,+2,+3,+4 chitanta
subgrupul fierului metalelorRecuperare din oxizi cu carbon sau monoxid de carbon (II)
FeO + C Fe + CO
Fe 2 O 3 + 3CO 2Fe + 3CO 2
NiO + C Ni + CO
Co 2 O 3 + 3C 2Co + 3COFe
d- element din grupa VIII; număr de serie - 26; masă atomică- 56; (26p; 30n), 26eMetal cu activitate medie, agent reducător.
Principalele stări de oxidare - +2, +3
Fierul și compușii săi
În aer, fierul se oxidează ușor în prezența umidității (rugină):
4Fe + 3O2 + 6H2O4Fe(OH)3
Un fir de fier încălzit arde în oxigen, formând sol - oxid de fier (II, III):
3Fe + 2O 2 Fe 3 O 4
La temperatura ridicata(700–900 0 C) fierul reacţionează cu vaporii de apă:
3Fe + 4H2O Fe3O4 + 4H2
Fierul reacționează cu nemetale atunci când este încălzit:2Fe + 3Br 2 2FeBr 3
Fe + S FeS
Fierul se dizolvă ușor în acizi clorhidric și sulfuric diluat:Fe + 2HCI FeCl2 + H2
Fe + H2S04 (razb.) FeS04 + H2În acizii oxidanți concentrați, fierul se dizolvă numai atunci când este încălzit.
2Fe + 6H 2 SO 4 (conc.) Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O
Fe + 6HNO 3 (conc.) Fe (NO 3) 3 + 3NO 2 + 3H 2 O(la rece, acizii azotic și sulfuric concentrați pasivează fierul).
Fierul deplasează metalele în dreapta lui în seria tensiunilor din soluțiile sărurilor lor.Fe + CuSO 4 FeSO 4 + Cu
Compuși feroși
Hidroxid de fier (II).
Se formează prin acțiunea soluțiilor alcaline asupra sărurilor de fier (II) fără acces la aer:
FeCl + 2KOH 2KCI + Fe(OH) 2
Fe (OH) 2 este o bază slabă, solubilă în acizi tari:
Fe(OH)2 + H2S04FeS04 + 2H2O
Când Fe (OH) 2 este calcinat fără acces la aer, se formează oxid de fier (II) FeO:
Fe(OH)2FeO + H2O
În prezența oxigenului atmosferic, un precipitat alb Fe (OH) 2, oxidant, devine maro - formând hidroxid de fier (III) Fe (OH) 3:
4Fe(OH) 2 + O 2 + 2H 2 O 4Fe(OH) 3
Compușii fierului(II) au proprietăți de restaurare, sunt ușor transformați în compuși de fier (III) sub acțiunea agenților oxidanți:
10FeSO 4 + 2KMnO 4 + 8H 2 SO 4 5Fe 2 (SO 4) 3 + K 2 SO 4 + 2MnSO 4 + 8H 2 O
6FeSO 4 + 2HNO 3 + 3H 2 SO 4 3Fe 2 (SO 4) 3 + 2NO + 4H 2 OCompușii de fier sunt predispuși la formarea complexă (număr de coordonare = 6):
FeCl2 + 6NH3CI2
Reacție calitativă pentru Fe 2+
Fe(CN)2 + 4KCN K4 (sare galbenă din sânge)Sub acțiunea hexacianoferratului de potasiu (III) K 2 (sare roșie din sânge) asupra soluțiilor de săruri feroase, se formează un precipitat albastru (turnbull blue):
3FeSO 4 + 2K 3 Fe 3 + 3K 2 SO 4
Compuși ferici
Oxid de fier (III).
Se formează în timpul arderii sulfurilor de fier, de exemplu, în timpul arderii piritei:
4FeS 2 + 11O 2 2Fe 2 O 3 + 8SO 2
sau la calcinarea sărurilor de fier:
2FeSO 4 Fe 2 O 3 + SO 2 + SO 3
Fe 2 O 3 - oxid bazic, in grad nesemnificativ amfoter
Fe2O3 + 6HCI2FeCl3 + 3H2O
Fe203 + 2NaOH + 3H202Na
Hidroxid de fier (III).
Se formează prin acțiunea soluțiilor alcaline asupra sărurilor de fier feric: precipită sub formă de precipitat roșu-brun
Fe(NO3)3 + 3KOH Fe(OH)3 + 3KNO3
Fe (OH) 3 este o bază mai slabă decât hidroxidul de fier (II).
Acest lucru se explică prin faptul că Fe 2+ are o sarcină ionică mai mică și o rază mai mare decât Fe 3+ și, prin urmare, Fe 2+ reține ionii de hidroxid mai slabi, adică. Fe(OH) 2 se disociază mai ușor.
În acest sens, sărurile de fier (II) sunt ușor hidrolizate, iar sărurile de fier (III) sunt foarte puternic hidrolizate. Culoarea soluțiilor de săruri de Fe(III) se explică și prin hidroliză: în ciuda faptului că ionul Fe3+ este aproape incolor, soluțiile care îl conțin sunt colorate galben-maro, ceea ce se explică prin prezența hidroxoionilor de fier sau Fe(OH). )3 molecule, care se formează prin hidroliză:Fe3+ + H2O2++ + H+
2 + + H20 + + H +
+ + H2O Fe(OH)3 + H+Când este încălzită, culoarea se întunecă, iar când se adaugă acizi, devine mai deschisă datorită suprimării hidrolizei. Fe (OH) 3 are o amfoteritate slab pronunțată: se dizolvă în acizi diluați și în soluții alcaline concentrate:
Fe(OH)3 + 3HCI FeCI3 + 3H20
Fe(OH)3 + NaOH Na
Compușii de fier (III) sunt agenți oxidanți slabi, ei reacționează cu agenți reducători puternici:
2FeCl3 + H2S S + 2FeCl2 + 2HCl
Reacții calitative pe Fe3+
17. d - elemente.Fier, caracteristici generale, proprietăți. Oxizi și hidroxizi, caracteristici CO și OM, biorol, capacitatea de a forma complexe.
1. Caracteristici generale.
Fier - element d al subgrupului secundar al grupei a opta din perioada a patra a PSCE cu număr atomic 26.
Unul dintre cele mai comune metale din scoarța terestră (locul al doilea după aluminiu).
O substanță simplă fierul este un metal maleabil alb-argintiu cu o reactivitate chimică ridicată: fier rapid corodează la temperaturi ridicate sau umiditate ridicată în aer.
4Fe + 3O2 + 6H2O = 4Fe(OH)3
În oxigen pur, fierul arde, iar în stare fin dispersată, se aprinde spontan în aer.
3Fe + 2O2 = FeO + Fe2O3
3Fe + 4H2O = FeO*Fe2O3
FeO*Fe2O3 = Fe3O4 (scara de fier)
De fapt, fierul este de obicei numit aliaje cu un conținut scăzut de impurități (până la 0,8%), care păstrează moliciunea și ductilitatea metalului pur. Dar, în practică, aliajele de fier cu carbon sunt mai des folosite: oțel (până la 2,14% în greutate carbon) și fontă (mai mult de 2,14% în greutate carbon), precum și oțel inoxidabil (aliat) cu adaos de aliaj. metale (crom, mangan, nichel etc.). Combinația dintre proprietățile specifice ale fierului și ale aliajelor sale îl fac „metalul nr. 1” în importanță pentru oameni.
În natură, fierul se găsește rar în forma sa pură, cel mai adesea apare ca parte a meteoriților fier-nichel. Prevalența fierului în scoarța terestră este de 4,65% (locul 4 după O, Si, Al). De asemenea, se crede că fierul constituie cea mai mare parte a miezului pământului.
2.Proprietăți
1.St. fizică Fierul este un metal tipic, în stare liberă este de culoare alb-argintiu cu o nuanță cenușie. Metalul pur este ductil, diverse impurități (în special carbonul) îi cresc duritatea și fragilitatea. Are proprietăți magnetice pronunțate. Adesea se distinge așa-numita „triada de fier” - un grup de trei metale (fier Fe, cobalt Co, nichel Ni) care au proprietăți fizice similare, raze atomice și valori de electronegativitate.
2.Insulele Chimice St.
|
Stare de oxidare |
Oxid |
Hidroxid |
Caracter |
Note |
|
Slab de bază | ||||
|
Bază foarte slabă, uneori amfoteră | ||||
|
Neprimit |
|
Acid |
Agent oxidant puternic |
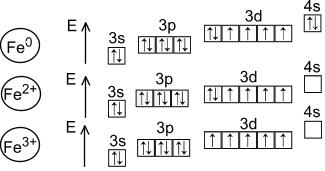
Pentru fier, stările de oxidare ale fierului sunt caracteristice - +2 și +3.
Starea de oxidare +2 corespunde oxidului negru FeO și hidroxidului verde Fe(OH)2. Sunt de bază. În săruri, Fe(+2) este prezent ca cation. Fe(+2) este un agent reducător slab.
+3 stări de oxidare corespund oxidului de Fe 2 O 3 roșu-brun și hidroxidului de Fe(OH) 3 maro. Sunt de natură amfoteră, deși proprietățile lor acide și bazice sunt slab exprimate. Deci, ionii Fe 3+ sunt complet hidrolizat chiar și într-un mediu acid. Fe (OH) 3 se dizolvă (și chiar și atunci nu complet), doar în alcalii concentrate. Fe 2 O 3 reacționează cu alcalii numai atunci când este fuzionat, dând ferite(săruri formale ale unui acid care nu există sub formă liberă de acid HFeO2):
Fierul (+3) prezintă cel mai adesea proprietăți oxidante slabe.
Stările de oxidare +2 și +3 trec ușor între ele atunci când condițiile redox se schimbă.
În plus, există oxid de Fe 3 O 4, starea formală de oxidare a fierului în care este +8/3. Totuși, acest oxid poate fi considerat și ca ferită de fier (II) Fe +2 (Fe +3 O 2) 2 .
Există, de asemenea, o stare de oxidare de +6. Oxidul și hidroxidul corespunzător nu există în formă liberă, dar s-au obținut săruri - ferați (de exemplu, K 2 FeO 4). Fierul (+6) este în ele sub formă de anion. Ferratele sunt agenți oxidanți puternici.
Fierul metalic pur este stabil în apă și în soluții diluate. alcalii. Fierul nu se dizolvă în acizi sulfuric și azotic concentrați la rece datorită pasivării suprafeței metalice cu o peliculă puternică de oxid. Acidul sulfuric concentrat fierbinte, fiind un agent oxidant mai puternic, interactioneaza cu fierul.
DIN clorhidricși diluat (aproximativ 20%) sulfuric acizi fierul reacționează pentru a forma săruri de fier (II):
Când fierul reacţionează cu aproximativ 70% acid sulfuric când este încălzit, reacţia continuă cu formarea sulfat de fier (III).:
3. Oxizi și hidroxizi, CO și OM char-ka ...
Compuși de fier (II).
Oxidul de fier (II) FeO are proprietăți de bază, corespunde bazei Fe (OH) 2. Sărurile de fier (II) au o culoare verde deschis. Când sunt depozitate, în special în aer umed, devin maronii din cauza oxidării la fier (III). Același proces are loc în timpul depozitării soluțiilor apoase de săruri de fier (II):
Din sărurile de fier(II) în soluții apoase, stabile sare mora- sulfat dublu de amoniu si fier (II) (NH 4) 2 Fe (SO 4) 2 6H 2 O.
Reactivul pentru ionii Fe 2+ în soluție poate fi hexacianoferat de potasiu (III) K 3 (sare roșie din sânge). Când ionii Fe 2+ și 3− interacționează, un precipitat turnbull albastru:
Pentru determinarea cantitativă a fierului (II) în soluție se utilizează fenantrolina, care formează un complex FePhen 3 roșu cu fier (II) într-un interval larg de pH (4-9)
Compuși de fier (III).
Oxid de fier(III) Fe 2 O 3 slab amfoteren, corespunde unei baze Fe (OH) 3 chiar mai slabe decât Fe (OH) 3, care reacţionează cu acizii:
Sărurile Fe 3+ tind să formeze hidrați cristalini. În ele, ionul Fe 3+ este de obicei înconjurat de șase molecule de apă. Astfel de săruri sunt de culoare roz sau violet.Ionul Fe 3+ este complet hidrolizat chiar și în mediu acid. La pH>4, acest ion este aproape complet precipitat sub formă de Fe (OH) 3:
Odată cu hidroliza parțială a ionului Fe 3+ se formează oxo- și hidroxocații polinucleare, din cauza cărora soluțiile devin maronii Principalele proprietăți ale hidroxidului de fier (III) Fe (OH) 3 sunt foarte slab exprimate. Este capabil să reacționeze numai cu soluții alcaline concentrate:
Hidroxocomplexii de fier (III) rezultați sunt stabili numai în soluții puternic alcaline. Când soluțiile sunt diluate cu apă, acestea sunt distruse, iar Fe (OH) 3 precipită.
Atunci când este fuzionat cu alcalii și oxizi ai altor metale, Fe 2 O 3 formează o varietate de ferite:
Compușii de fier (III) în soluții sunt reduși de fier metalic:
Fierul (III) este capabil să formeze sulfați dubli cu încărcare unică cationi tip alaun, de exemplu, KFe (SO 4) 2 - alaun potasiu fier, (NH 4) Fe (SO 4) 2 - alaun fier amoniu etc.
Pentru detectarea calitativă a compușilor de fier(III) într-o soluție, se utilizează o reacție calitativă a ionilor de Fe 3+ cu ionii de tiocianat. SCN − . Când ionii Fe 3+ interacționează cu anionii SCN −, se formează un amestec de complecși de tiocianat de fier roșu strălucitor 2+ , + , Fe(SCN) 3 , -. Compoziția amestecului (și, prin urmare, intensitatea culorii acestuia) depinde de diverși factori, astfel încât această metodă nu este aplicabilă pentru determinarea calitativă precisă a fierului.
Un alt reactiv de înaltă calitate pentru ionii Fe 3+ este hexacianoferat de potasiu (II) K 4 (sare galbenă de sânge). Când ionii Fe 3+ și 4− interacționează, se formează un precipitat albastru strălucitor albastru de Prusia:
Compuși de fier (VI).
ferate- săruri ale acidului de fier H 2 FeO 4 care nu există sub formă liberă. Aceștia sunt compuși de culoare violetă, care amintesc de permanganați în proprietăți oxidante și de sulfați în solubilitate. Ferrații se obțin prin acțiunea gazoșilor clor sau ozon pe o suspensie de Fe (OH) 3 în alcali , de exemplu, ferat de potasiu (VI) K2FeO4. Ferratele sunt colorate în violet.
Se pot obține și ferate electroliză Soluție alcalină 30% pe un anod de fier:
Ferratele sunt agenți oxidanți puternici. Într-un mediu acid, se descompun odată cu eliberarea de oxigen:
Proprietățile oxidante ale feratelor sunt folosite pentru dezinfectarea apei.
4.Biorol
1) În organismele vii, fierul este un oligoelement important care catalizează procesele de schimb de oxigen (respirație).
2) Fierul este de obicei inclus în enzime sub formă de complex.În special, acest complex este prezent în hemoglobină, cea mai importantă proteină care asigură transportul oxigenului cu sânge către toate organele oamenilor și animalelor. Și el este cel care colorează sângele într-o culoare roșie caracteristică.
4) O doză excesivă de fier (200 mg și peste) poate avea un efect toxic. O supradoză de fier deprimă sistemul antioxidant al organismului, așa că folosește suplimente de fier oameni sanatosi Nu se recomandă.
Pagina 3
Pe fig. V.8 prezintă o schemă de corelare care oferă o idee despre intervalele deplasărilor izomerice 57Fe pentru compușii de fier. Starea de oxidare a fierului poate varia de la 0 la 6 și nu este atât de ușor să-l caracterizezi prin deplasarea izomeră a 57Fe.
O atmosferă reducătoare determină o scădere a gradului de oxidare a fierului din zgură, în timp ce într-o atmosferă oxidantă sub acţiunea temperaturilor ridicate de flacără continuă descompunerea oxizilor de fier mai mari. O creștere a gradului de oxidare a fierului în zgură prin acțiunea unei atmosfere oxidante este posibilă numai la o temperatură a flăcării sub 1200 C și o suprafață mare a zgurii.
Conținutul de Al2O3 și alcalii se modifică destul de brusc în roci. Starea de oxidare a fierului rămâne constantă.
| Dependența de temperatură a vâscozității. |
Proba C cu o stare de oxidare de 13% nu are regiune plastică, iar zgura se comportă ca sticla. Odată cu creșterea gradului de oxidare a fierului la 30 sau 56%, în curbele de vâscozitate ale probelor B și A apare o îndoire, ceea ce indică faptul că zgura din locul îndoirii trece într-o stare plastică.
Dar gradul de oxidare al sulfului, care face parte din acești ioni, este diferit. În primul caz, starea de oxidare a fierului coincide cu sarcina unui ion Fe2 simplu și cu valența fierului. Astfel, valența unui element dat într-un compus complex se numește întreaga cantitate de legături pe care atomul central, agentul de complexare, le are în acest compus.
Tendința la formarea complexă este confirmată și de existența unor săruri duble tipice precum shenite și alaun. În acest compus, starea de oxidare a fierului 2 se stabilizează, în timp ce sulfatul FeSO4 intră soluție apoasă predispus la oxidare de către oxigenul atmosferic. Nichelul nu formează astfel de compuși, deoarece starea de oxidare de 3 pentru acest element este atât de necaracteristică încât nici măcar nu se stabilizează în săruri duble.
Această creștere a gradului de oxidare a fierului în zgură continuă până la o temperatură de aproximativ 1.200 C. Odată cu o creștere suplimentară a temperaturii zgurii, gradul de oxidare a fierului scade semnificativ.
După cum sa indicat, atomul central de fier se află în planul inelului porfir cu 16 atomi și este legat de atomii de azot ai inelelor pirol prin patru din cele șase valențe disponibile și, prin urmare, rămân două valențe pentru a completa complexul octaedric; aceste valențe sunt deasupra și sub planul de desen al modelului prezentat. În plus, trebuie luat în considerare și gradul de oxidare a fierului; când fierul este în stare feroasă, așa cum se arată în figură, protoporfirina este numită temă sau, mai clar, ferogem. Dacă hemul este în stare liberă în soluție și nu este legat de proteină, atunci se presupune că două molecule de apă sunt în coordonare cu pozițiile a cincea și a șasea ale valenței fierului. George desemnează această ferogemă astfel: H2O - Fep-H. Când este oxidat, se transformă în H O Fep NaO cu o sarcină pozitivă. Acest ferihem poate coordona ionul de clor cu trecerea la H2O - Fep-Cl si in acest caz se numeste hemin; cu un ion hidroxil coordonat, ferrigem este desemnată ca hematină H2O - Pep-OH, deși acești termeni sunt uneori folosiți mai puțin specific, doar pentru a indica prezența oxidului de fier. Coordonarea altor molecule este, de asemenea, posibilă, iar coordonarea cu peroxidul de hidrogen joacă un rol în primul rând. Ferrohem coordonează cu ușurință bazele azotate, cum ar fi piridina, formând hemocromogei B-Fp-B. Același compus cu ferihemul B-Fep-B se numește parahematină.
Prin metoda magnetică a fost stabilită prezența și evaluarea cantitativă a legăturilor de valență între ionii pozitivi vecini. Astfel, în Fe203 pe un suport A1203, starea de oxidare a fierului este de trei, dar, în același timp, atomii de fier vecini formează o legătură covalentă între ei.
Prin metoda magnetică a fost stabilită prezența și o evaluare cantitativă a legăturilor de valență între ionii pozitivi vecini. Astfel, în Fe2O3 pe un purtător A12O3, starea de oxidare a fierului este de trei, dar, în același timp, atomii de fier vecini formează o legătură covalentă între ei.
Dacă luăm în considerare hidroxizii Fe (OH) 2 și Fe (OH) 3, atunci din punctul de vedere al schemei Kossel, proprietățile acide ale celui de-al doilea hidroxid ar trebui să fie mai pronunțate decât primul. Aceasta rezultă din faptul că, cu cât este mai mare gradul de oxidare a fierului (chiar dacă presupunem că razele ionilor Fe2 și Fe3 sunt aceleași), cu atât este mai mare repulsia protonilor și cu atât proprietățile acide ale hidroxidului corespunzător sunt mai pronunțate. Dacă luăm în considerare că raza ionului Fe3 este ceva mai mică decât cea a ionului Fe2, atunci repulsia mai mare a protonului din compusul Fe (OH) 3 în comparație cu Fe (OH) 2 devine și mai evidentă.
O parte din oxizi de fier este redusă la fier metalic, cealaltă parte la [oxid de azot]; în plus, se eliberează carbon pe ele. Cantitatea de oxigen încă conținută în minereu caracterizează gradul de oxidare a fierului.
Dacă, în urma testelor preliminare, există dubii dacă este prezent un ion de fier, se pot efectua reacții de verificare. Dar trebuie amintit că prin acest test nu se mai poate stabili gradul inițial de oxidare a fierului din proba analizată.
Numai în prezența agenților oxidanți puternici, este posibil să se obțină derivați destul de fragili ai acidului de fier H2FeO4 cu o stare de oxidare a fierului de 6; cu toate acestea, nu a fost posibilă izolarea oxidului corespunzător. Dacă RuO4 este o substanță instabilă care se obține indirect, atunci OsO4 este un compus complet stabil, format în timpul oxidării unui metal în aer.