26.06.2019
Воспаление. воспаление – защитная реакция организма на вредные воздействия, приспособительная местная реакция. Воспаление: причины, условия возникновения и проявления
Воспаление – это сформировавшаяся в процессе эволюции защитно-приспособительная реакция организма, направленная на локализацию, уничтожение или удаление из организма патогенного агента и характеризующаяся явлениями альтерации, экссудации и пролиферации.
В этом определении следует обратить внимание на три момента. Во-первых, воспаление как реакция сформировалась в процессе эволюции. Во-вторых, воспаление выполняет защитно-приспособительную роль и направлено на локализацию, уничтожение или удаление из организма вредоносного фактора. В-третьих, для воспаления характерно сосуществование трех проявлений: альтерации (повреждение тканей), экссудации (накопление в тканях жидкости) и пролиферации (разрастание клеточных и тканевых элементов).
Этиология воспаления
Причиной воспаления могут быть весьма разнообразные повреждающие факторы: механические, физические (ожог, ионизирующая радиация), химические (действие кислот, щелочей, ядов), биологические (микробы, вирусы, патогенные грибы, гельминты, простейшие). Кроме различных экзогенных раздражителей, в воспалении участвуют и эндогенные факторы: например, некротизированная ткань, излившаяся кровь, гематома, инфаркт, тромбы, отложение солей.
Патологическому процессу в зависимости от места действия повреждающего фактора свойственно различное проявление.
Классификация форм воспалительной реакции
В зависимости от того, какой компонент преобладает в воспалительной реакции, воспаление подразделяют на: альтеративное (главное проявление – повреждение ткани), экссудативное (в воспалительном очаге имеется выраженный выпот) и пролиферативное (на первый план выступают процессы размножения клеток).
Экссудативное воспаление в свою очередь подразделяется на следующие виды:
серозное воспаление – с жидким экссудатом, содержащим белок и не содержащим ФЭК.
фибринозное воспаление, когда экссудат содержит значительное количество фибрина, выпадающего в осадок на воспаленных тканях в виде нитей и пленок. Разновидностями фибринозного воспаления является дифтиритическое воспаление – при снятии пленок фибрина обнаруживается кровоточащая язва и крупозное воспаление – плёнки легко отделяются.
гнойное воспаление, при котором в экссудате содержится большое количество лейкоцитов, в основном погибших.
геморрагическое воспаление – воспаление с экссудатом, содержащим эритроциты (кровь в экссудате).
ихорозное воспаление, когда в экссудате поселяется гнилостная микрофлора.
По течению воспаление подразделяют на острое, подострое и хроническое.
Кардинальные признаки воспаления.
Эти признаки были описаны еще Галеном и Цельсом, но не потеряли своего значения и до настоящего времени, поскольку наличие их совокупности позволяет ставить диагноз воспаления, а кроме того, за каждым признаком стоят определенные патофизиологические механизмы.
К кардинальным признакам воспаления относятся:
краснота (rubor). Покраснение воспаленного участка связано с развитием артериальной гиперемии, при которой происходит расширение артерий и увеличение их количества, возрастает приток богатой кислородом алой крови. Однако следует заметить, что при развитии мощной венозной гиперемии краснота может переходить в цианоз.
припухлость (tumor). Увеличение воспаленного участка в объеме связано с развитием отека.
жар (calor). Повышение температуры воспаленного участка обусловлено рядом факторов. Во-первых, оно связано с артериальной гиперемией, то есть с притоком более теплой крови. Во-вторых, среди биологически активных полипептидов, образующихся в очаге воспаления, имеются и такие, которые представляют собой пирогенные факторы (вызывающие лихорадку). В-третьих, усиление обменных процессов, интенсификация ряда экзотермических реакций также приводит к локальному повышению температуры.
боль (dolor). Болезненность воспаленного участка вызывается раздражением болевых рецепторов БАВ, а также в результате их сдавления воспалительным отеком.
нарушение функции (functio laesa). Если в каком либо органе имеется источник болевого раздражения, то организм щадит этот орган, и его функция будет пониженной. Кроме того, к снижению функции приводит воспалительный отек, сдавливающий орган, и альтерация тканей.
Общие признаки воспаления
Воспаление - это процесс, который проявляется не только ярко выраженными местными признаками, но и весьма характерными и нередко существенными изменениями во всем организме.
Какие же признаки общего характера могут свидетельствовать о развитии воспаления?
Изменение количества лейкоцитов в периферичес кой крови: лейкоцитоз (развивается при подавляющем большинстве воспалительных процессов) или значительно реже лейкопения (например, при воспалении вирусного происхождения). Лейкоцитоз обусловлен активацией лейкопоэза и перераспределением лейкоцитов в кровеносном русле. К числу основных причин его развития относятся стимуляция симпатоадреналовой системы, воздействие некоторых бактериальных токсинов, продуктов тканевого распада, а также ряда медиаторов воспаления (например, интерлейкина-I, фактора индукции моноцитопоэза и др.).
Лихорадка развивается под влиянием поступающих из очага воспаления пирогенных факторов, таких как липополисахариды, катионные белки, интерлейкин-I.
Изменение белкового «профиля» крови выражается в том, что при остром процессе в крови накапливаются синтезируемые печенью так называемые «белки острой фазы» (БОФ) воспаления - С-реактивный белок, церулоплазмин, гаптоглобин, компоненты комплемента и др. Для хронического течения воспаления характерно увеличение в крови содержания альфа- и особенно гамма-глобулинов.
Изменения ферментного состава крови выражаются в увеличении активности трансаминаз (например, аланинтрансаминазы при гепатите; аспартаттрансаминазы при миокардите), гиалуронидазы, тромбокиназы и т.д.
Увеличение скорости оседания эритроцитов (СОЭ) из-за снижения отрицательного заряда эритроцитов, повышения вязкости крови, агломерации эритроцитов, изменения белкового спектра крови, подъема температуры.
Изменения содержания гормонов в крови заключаются, как правило, в увеличении концентрации катехоламинов, кортикостероидов.
Изменения в иммунной системе и аллергизация ор ганизма выражаются в нарастании титра антител, появлении сенсибилизированных лимфоцитов в крови, развитии местных и общих аллергических реакций.
Кроме того, очаг воспаления может быть источником патологических рефлексов (например, развитие стенокардии при холецистите, аритмий сердца при аппендиците), интоксикации организма и сепсиса.
Механизмы развития воспаления. Компоненты воспаления
Динамика воспалительного процесса, независимо от вызывающих его причин, всегда достаточно стандартна, т.е. воспаление по существу является «моиопатогенетическим» процессом.
Патогенетическую основу воспаления составляют три взаимосвязанных компонента - альтерация, экссудация и пролиферация .
Альтерация
Альтерация (от лат. alteratio - изменение). Под альтерацией в очаге воспаления понимают комплекс обменных, физико-химических, структурно-функциональных изменений, а также образование и/или активацию медиаторов воспаления. Принято выделять первичную и вторичную альтерацию в очаге воспаления.
Первичная альтерация возникает в ответ на прямое воздействие флогогенного фактора. Реакции первичной альтерации как бы пролонгируют действие причины воспаления.
Вторичная альтерация возникает под воздействием как флогогенного раздражителя, так и факторов первичной альтерации. Эти воздействия опосредованы нервной системой, физико-химическими факторами (ацидоз и др.), а в основном - медиаторами воспаления.
Обменные изменения при развитии вторичной альтерации включают в себя интенсификацию процессов распада углеводов, жиров и белков, усиление анаэробного гликолиза и тканевого дыхания, разобщение биологического окисления и фосфорилирования, снижение активности анаболических процессов. Следствием указанных изменений являются увеличение теплопродукции, развитие дефицита макроэргов, накопление продуктов обмена, образование медиаторов воспаления.
Комплекс физико-химических изменений включает в себя ацидоз, гиперионию (накопление в очаге воспаления ионов К + , Cl - , HPO, Na +), дисионию. гиперосмию, гиперонкию (обусловлена увеличением концентрации белка, его дисперсности и гидрофильности).
Структурно-функциональные изменения при воспалении весьма разнообразны и могут развиваться на субклеточном, клеточном и органном уровнях.
Закономерный характер развития воспаления в большой мере обусловлен его медиаторами.
Медиаторы воспаления - это комплекс физиологически активных веществ, опосредующих действие флогогенных факторов, определяющих развитие и исходы процесса воспаления.
По происхождению условно различают клеточные и плазменные (гуморальные) медиаторы.
Экссудация
Экссудация – (от лат. еxsudatio - выпотевание). Этот компонент включает в себя триаду: а) сосудистые реакции и изменения кровообращения в очаге воспаления; б) выход жидкой части крови из сосудов - собственно экссудацию; в) эмиграцию (от лат. emigratio - выселение) - выход лейкоцитов в очаг воспаления и развитие фагоцитарной реакции.
Динамика сосудистых реакций и изменения кровообращения при развитии воспаления стереотипна: вначале возникает кратковременный рефлекторный спазм артериол и прекапилляров с замедлением кровотока. Затем, сменяя друг друга, развиваются артериальная гиперемия (вследствие доминирования холинергических влияний на стенку сосуда, ацидоза, гиперкалийионии, разрушения соединительнотканных муфт вокруг сосудов и, самое главное, накопления медиаторов воспаления); венозная гиперемия (вследствие микротромбоза вен и лимфатических сосудов, набухания эндотелия, краевого стояния лейкоцитов, сладжирования крови, сдавления сосудов экссудатом); престаз (толчкообразный кровоток, маятникообразное движение крови) и, наконец, стаз - остановка кровотока. В результате стаза формируется своеобразный барьер, обеспечивающий ограничительную функцию очага воспаления.
Выход жидкой части крови в очаг воспаления (собственно экссудация) происходит вследствие резкого усиления процесса фильтрации, диффузии, осмоса и микровезикулярного транспорта, а накопление избытка жидкости в тканях связано со снижением процесса резорбции из-за увеличения венозного давления. Экссудат как воспалительная жидкость в отличие от транссудата содержит большое количество белка (не менее 3 - 5 %), ферментов, иммуноглобулины, клетки крови, остатки тканевых элементов. Благодаря экссудации происходят отграничение очага воспаления, разбавление токсинов и продуктов распада тканей, осуществляется защита от флогогенных факторов и поврежденных клеток с помощью ферментов и иммуноглобулинов.
Эмиграция лейкоцитов в очаг воспаления начинается с их краевого (пристеночного) стояния, которое может продолжаться несколько десятков минут. Затем гранулоциты (через межэндотелиальные щели) и агранулоциты (путем цитопемзиса - трансэндотелиаль-ного переноса) проходят через сосудистую стенку и продвигаются к объекту фагоцитирования. Амебоидное движение лейкоцитов возможно благодаря обратимым изменениям состояния их цитоплазмы (взаимоперехода геля в золь - тиксотропии) и поверхностного натяжения мембран, обратимой «полимеризации» актина и миозина с использованием энергии АТФ анаэробного гликолиза. Направленное движение лейкоцитов объясняется накоплением в очаге воспаления хемоаттрактантов - белков, полипептидов, продуктов жизнедеятельности микробов (хемотаксис), повышением температуры (термотаксис), а также развитием условий для гальванотаксиса, гидротаксиса, тигмотаксиса (от греч. thigma - прикосновение).
Фагоцитоз - эволюционно выработанная защитно-приспособительная реакция организма, заключающаяся в узнавании, активном захвате (поглощении) и переваривании микроорганизмов, разрушенных клеток и инородных частиц специализированными клетками - фагоцитами. К ним относятся ПЯЛ (в основном нейтрофилы), клетки системы фагоцитирующих мононуклеаров (моноциты, тканевые макрофаги), а также клетки Купфера в печени, мезангиальные клетки почек, глиальные клетки в ЦНС и др.
Различают 4 стадии фагоцитоза: 1) сближение фагоцита с объектом; 2) прилипание (аттракция, адгезия); 3) захват фагоцитируемого объекта; 4) внутриклеточное положение и переваривание объекта, а также выведение остатков объекта во внеклеточное пространство. В процессе узнавания большую роль играют опсонины, которые являются посредниками при рецепторном взаимодействии фагоцитов с микроорганизмами. Основная роль при поглощении принадлежит сократительным белкам, способствующим образованию псевдоподий. Параллельно с поглощением в нем происходит образование токсичных для микробов активных форм О 2 - перекиси водорода, гидроксильных радикалов, супероксидного аниона (так называемый респираторный взрыв). Фермент миелопероксидаза усиливает их действие, а защита фагоцита от них обеспечивается супероксиддисмутазой, каталазой и в реакциях гексозомонофосфатного шунта.
Пролиферация
Пролиферация (от лат. proliferatio - размножение). В очаге воспаления размножаются и созревают местные тканевые элементы, преимущественно соединительнотканные (редко эпителиальные) с последующим замещением поврежденного участка ткани. Заключительный этап пролиферации - вторичная инволюция рубца, когда лишние коллагеновые структуры лизируются, удаляются и остается лишь то их количество, которое необходимо для адекватного завершения воспалительного процесса. Ход пролиферации находится под контролем многих факторов:
фибробласты синтезируют проколлаген и в то же время секретируют коллагеназу, расщепляющую коллаген. Между этими процессами существует взаимодействие по типу ауторегуляции. Нарушение этой регуляции может приводить к развитию склеропатий;
фибробласты образуют фибронектии, который детерминирует миграцию, пролиферацию и адгезию клеток соединительной ткани;
макрофаги в завершающей стадии воспаления секретируют особый фактор стимуляции фибробластов, увеличивающий их размножение и адгезивные свойства;
мононуклеары крови животных и птиц выделяют лимфокины и монокины, ингибирующие пролиферацию фибробластов и образование коллагена;
макрофаги секретируют простагландины группы Е, которые могут потенцировать рост путем усиления кровоснабжения в регенерирующей ткани;
нейтрофилы способны продуцировать тканеспецифические ингибиторы - кейлоны и антикейлоны - стимуляторы пролиферации, взаимодействующие по типу обратной связи;
кортикостероиды: глюкокортикоиды тормозят регенерацию, снижают чувствительность макрофагов к лимфокинам и тем самым тормозят секрецию коллагена; минералокортикоиды стимулируют регенераторный процесс;
циклические нуклеотиды: цАМФ ингибирует митотическую активность клеток; цГМФ, напротив, является стимулятором пролиферации.
Причинами воспаления могут быть:
Острое воспаление само по себе проявляется как местная реакция с симптомами, известными еще с античных времен: боль (dolor), припухлость (tumor), покраснение (rubor) и жар (calor). Кроме того, воспаление может сопровождаться системными реакциями (ответ острой фазы воспаления).
При дальнейшем развитии воспалительной реакции из нейтрофилов, эозинофилов и макрофагов выделяются лейкотриены и PAF. Последний также высвобождается из тромбоцитов. Это усиливает воспалительную реакцию и обусловливает вовлечение системы гемостаза в процесс воспаления. Названные клетки вовлекаются в очаг воспаления хемокинами (хемотаксис) . Эотаксин, PAF и лейкотриен В4 действуют на эозинофилы (и Тh 2 -клетки) подобно хемоаттрактантам. В силу того, что PAF активирует и тучные клетки, эти два типа клеток действуютсовместно. Нейтрофилы и моноциты вовлекаются в очаг воспаления лейкотриеном В4, компонентом комплемента С5а, NCF, TNF-α, IL-1, IL-4 и некоторыми хемокинами, например IL-8.
Гистамин, PAF, лейкотриены С4, D4 и Е4 действуют совместно с остальными медиаторами (PGE 2 , брадикинином) и вызывают: 1) расширение сосудов (артериол), 2) повышение парацеллюлярной проницаемости эндотелия и 3) стимуляцию ноцицепторов.
Расширение сосудов обусловливает покраснение воспаленной ткани и повышение ее температуры. Вазодилатация также приводит к замедлению кровотока, что дает возможность лейкоцитам после воздействия хемоаттрактантов перемещаться из осевого потока ближе к эндотелию. Эндотелиальные клетки, активированные в очаге воспаления различными веществами, в т. ч. IL-4 (из Тh 2 -клеток), экспрессируют на своей поверхности, обращенной в просвет сосуда, селектины. Эти селектины, по сути являющиеся молекулами клеточной адгезии, вызывают перемещение лейкоцитов по поверхности эндотелия и активируют другие молекулы адгезии (интегрины, ICAM-1, VCAM). Это дает возможность лейкоцитам прикрепляться к сосудистой стенке (маргиноция). Увеличение проницаемости эндотелия (потеря контактов между эндотелиальными клетками) позволяет лейкоцитам выходить из сосудов во внесосудистое пространство (диапедез). Кроме того, в интерстициальное пространство выходит жидкость, содержащая большое количество белков (воспалительный экссудат), вследствие чего развивается отек. В тяжелых случаях из сосудов выходят даже эритроциты (геморрагическое воспаление). Наконец, возникает боль,вследствие которой человек осознает наличие патологического процесса и рефлекторно стремится защитить воспаленный участок (например, конечность).
Нейтрофилы, мигрировавшие в очаг воспаления, и макрофаги, дифференцировавшиеся из мигрировавших в этот очаг моноцитов, начинают фагоцитировать патогены, вызвавшие воспаление, и переваривать их с помощью лизосом. «Аппетит» фагоцитов усиливается после опсонизации патогенов IgG или компонентом комплемента С3b.
При воспалении активируется также система комплемента . Это происходит либо классическим путем в присутствии комплексов антиген - антитело, либо более медленным, так называемым альтернативным путем через менее специфичное связывание с клетками, инфицированными бактериями или вирусами. В обоих случаях образуется С3b-компонент комплемента. Он не только опсонизирует антигены, ной вызывает полимеризацию других компонентов (С5-С9) на поверхности клеток, атакованных патогеном, с образованием мембраноатакующего комплекса, который запускает лизис патогена. Помимо этого система комплемента способна разрушать частицы вирусов и комплексы антиген - антитело. Побочные продукты активации системы комплемента (СЗа, С4а и С5а, так называемые анафилаксины) действуют в качестве хемоаттрактантов и активируют макрофаги.
Макрофаги активируются главным образом экзо- и эндотоксинами патогенов, комплексами антиген-антитело, С5а, различными кристаллами, а также при фагоцитозе. В результате их активации высвобождаются оксиданты, такие как O 2 -, OН-, 1 O 2 и Н 2 O 2 , повреждающие патогены. Макрофаги также выделяют медиаторы воспаления, например PAF, лейкотриены, простагландины и цитокины IL-1, IL-6, TNF-α. Последние действуют не только мест-но и не только в качестве хемоаттрактантов - они также вовлекают в воспалительную реакцию организм в целом (ответ острой фазы воспаления). Проявления этого ответа, опосредованные IL-1, IL-6, TNF-α и реализующиеся через специфические рецепторы, следующие:
- воздействие на нейроны, ответственные за медленный сон, вызывает заторможенность, сонливость, повышенную утомляемость, усталость;
- установочная точка терморегуляции смещается на более высокий уровень, развивается лихорадка;
- стимулируется высвобождение лейкоцитов из костного мозга с развитием лейкоцитоза;
- стимулируется функция печени, что проявляется усилением захвата гепатоцитами железа и образованием так называемых белков острой фазы;
- стимулируется иммунная система (в частности, усиливается выработка антител);
- запускаются липолиз и катаболические процессы, способствующие уменьшению массы тела.
Заживление ткани . После образования грануляционной ткани, богатой клетками (макрофагами и др.) и характеризующейся выраженной васкуляризацией, тромбоцитарный фактор роста (PDGF) и другие медиаторы стимулируют пролиферацию и миграцию фибробластов. Они продуцируют гликозаминогликаны, которые набухают и откладываются в ткани в виде коллагеновых волокон. Кроме того, образуются новые волокна коллагена, благодаря сокращению которых сближаются края раны.
В итоге в месте повреждения коллагеновые волокна (рубец) замещаются новой тканью (от лат. restitutio ad integrum - полное восстановление). Однако такое замещение поврежденной ткани характерно лишь для небольших по размеру и неинфицированных ран. При наличии вторичного воспаления (обусловленного наличием инородных тел в ране или ее инфицированием) заживление раны затягивается во времени, усиливается защитный ответ макрофагов. Это требует дополнительной энергии (повышение температуры). Синхронно активированная система гемостаза способствует окклюзии сосудов в прилегающих областях; в результате недостатка O 2 развивается дефицит АТФ; из-за накопления лактата в анаэробных условиях снижается рН. Высвобождающиеся оксиданты также повреждают собственные клетки организма. При гибели этих клеток во внеклеточное пространство выделяются лизосомные ферменты, способствующие гибели лейкоцитов и клеток в воспаленной ткани. Подобная гибель клеток (некроз) может приводить к формированию абсцесса с последующим рубцеванием,что следует рассматривать как своеобразную плату за предотвращение распространения воспаления. Образование рубца также происходит в случае обширного повреждения ткани (например, при зияющих ранах).
Нарушения процесса заживления ран возникают в случае дисбаланса между процессами воспаления и заживления (при хроническом воспалении , например при бронхите курильщиков или в случае алкогольного поражения печени). Образование слишком больших количеств коллагена вызывает фиброзирующее воспаление (в частности, при циррозе печени). В случаях с избыточным образованием грануляционной ткани развивается гранулематозное воспаление (при туберкулезе, а также при воспалении, вызванном инородными телами).
При дефектах качественных характеристик рубцовой ткани (например, в случае нарушения процесса синтеза коллагена под действием глюкокортикоидов или образования поперечных связей между волокнами коллагена при дефиците витамина С) локальное напряжение в области раны может способствовать ее повторному открытию (например, расхождение краев раны после абдоминальных хирургических вмешательств). Рубцы в области лица оставляют косметические дефекты , особенно при избыточном рубцевании (келоидныерубцы). В некоторых случаях рубцы могут вызывать серьезные функциональные расстройства : рубцы роговицы сопровождаются расстройствами зрения, рубцы в области клапанов сердца вызывают стенозы или регургитацию крови, рубцы в брюшной полости нередко бывают причиной спаечной болезни.
Если локализовать воспаление, вызванное патогенами, невозможно, они распространяются по всему организму, обычно по лимфатической системе, с развитием сепсиса . Такое происходит, например, при внезапном попадании патогенов на большую поверхность брюшины (при разрыве толстой кишки, вскрытии абсцесса).
Воспаление - типовой патологический процесс, направленный на уничтожение, инактивацию или ликвидацию повреждающего агента и восстановление повреждённой ткани.
Воспаление - местный процесс. Однако в его возникновении, развитии и исходах принимают участие практически все ткани, органы и системы организма.
Терминология. Для обозначения воспаления в какой-либо ткани или органе используют их латинское или греческое название и добавляют терминологический элемент «ит» (в сочетании с греко-латинским названием ткани или органа - itis). Например, воспаление кожи - дерматит, печени - гепатит, почки - нефрит, оболочек мозга - менингит, миокарда - миокардит, стенки вены - флебит и т.д.
Этиология
Воспаление - ответ организма на воздействие причины - флогогенного (от греч. phlox, phlogos - пламя) фактора, действующего в определенных условиях.
Причины воспаления
Природа флогогенного фактора может быть физической, химической или биологической.
♦ Физические факторы: механическая травма тканей, чрезмерно высокая или низкая температура, воздействие электрического тока или лучистой энергии.
♦ Химические факторы: органические и неорганические кислоты, щёлочи и соли; ЛС, вводимые в ткани.
♦ Биологические агенты: инфекционные (вирусы, риккетсии, бактерии, грибы); иммуноаллергические (комплексы Аг-АТ; денатурированные белки и погибшие участки ткани; инфицированные вирусом и опухолевые клетки); токсины насекомых, животных, растений.
Происхождение флогогенного фактора. Как повреждающие факторы, флогогенные факторы подразделяют на экзогенные и эндогенные, а в каждой из этих групп выделяют инфекционные и неинфекционные агенты.
Выраженность воспалительного эффекта флогогенных агентов зависит не только от их природы и происхождения, но и от интенсивности действия: чем она выше, тем, как правило, более остро протекает воспалительная реакция.
Условия, влияющие на возникновение и течение воспаления
Реактивность организма. Воспаление может иметь нормергическое, гиперергическое и гипоергическое течение, в зависимости от реактивности организма и реактивных свойств ткани или органа в данный момент.
Регионарные особенности тканей важны для возникновения и характера развития воспаления. Так, хроническая локальная травма тканей, дистрофические процессы, нарушения кровообращения или местного иммунитета облегчают реализацию действия патогенного фактора и нередко усугубляют повреждение тканей в очаге воспаления.
Патогенез
В механизме развития воспаления выделяют несколько компонентов: альтерацию, сосудистые реакции, изменения крово- и лимфообращения, экссудацию жидкости и выход форменных элементов крови в ткань, фагоцитоз и пролиферацию.
АЛЬТЕРАЦИЯ
Альтерация (от лат. alteratio - изменение, повреждение) как компонент механизма развития воспаления включает изменения: клеточных и внеклеточных структур, обмена веществ, физико-химических свойств, а также образование и реализацию эффектов медиаторов воспаления. При этом различают зоны первичной и вторичной альтерации.
Первичная альтерация реализуется за счёт действия патогенного агента в зоне его внедрения, что сопровождается грубыми, часто необратимыми изменениями.
Вторичная альтерация вызывается и патогенным агентом и, в основном, продуктами первичной альтерации. Позднее вторичная альтерация приобретает относительно самостоятельный характер. Объём зоны вторичного повреждения всегда больше, чем первичного, а длительность может варьировать от нескольких часов до нескольких лет.
Изменение структур
Степень изменений клеточных и неклеточных структур в очаге воспаления колеблется от минимальных до их разрушения и некроза. Причиной альтерации структур являются на начальном этапе воспаления прямое действие флогогенного фактора, а затем - расстройства обмена веществ, физико-химические, микроциркуляторные и регуляторные расстройства (подробнее причины повреждения структур см. в Главе 4 «Патология клетки»).
Изменения обмена веществ
Биологический смысл изменений обмена веществ заключается в энергетическом и пластическом обеспечении процессов, протекающих в очаге воспаления. На начальном этапе воспаления в тканях преобладают реакции катаболизма, а при активации процессов пролиферации начинают доминировать анаболические реакции. Изменения метаболизма в существенной мере регулируются медиаторами воспаления. В очаге воспаления, а нередко и в организме в целом, происходит перестройка всех видов обмена веществ: углеводного, белкового, жирового и водно-солевого, что приводит к физико-химическим изменениям в очаге воспаления.
Углеводы
♦ Активируются гликогенолиз и гликолиз, обеспечивающие увеличение выработки макроэргических соединений.
♦ Под влиянием разобщителей окисления и фосфорилирования нарушается образование АТФ в цикле Кребса и энергия выделяется в виде тепла.
♦ Гликолиз в условиях гипоксии в очаге воспаления переходит на анаэробный путь, следствием чего является накопление избытка лактата и пирувата, которые формируют метаболический ацидоз.
♦ Возобновление оксигенации тканей, как правило, сопровождается нормализацией энергетического обеспечения клеточных процессов.
Липиды
♦ Усиливаются липолиз (он сопровождается накоплением свободных ВЖК) и деструкция липидов за счёт интенсификации реакций СПОЛ (с образованием перекисей и гидроперекисей липидов, кетокислот).
♦ В связи с накоплением в клетках свободных ВЖК отмечаются их разобщающий эффект и снижение эффективности тканевого дыхания в митохондриях. ВЖК обладают также детергентным действием (см. раздел «Повреждение мембран», глава 4).
♦ Накопление избытка кетокислот (ацетоуксусной, β-оксимасляной, β-кетоглутаровой и других) вследствие нарушения окисления ВЖК обусловливает ацидоз и вторичную альтерацию в очаге воспаления.
♦ Образующаяся в избытке арахидоновая кислота служит субстратом для образования Пг, тромбоксанов и лейкотриенов.
Белки
♦ Активируется протеолиз, продукты которого служат субстратом синтеза клеточных компонентов взамен повреждённых.
♦ Развиваются иммунные (в том числе - иммунопатологические) реакции (в связи с денатурацией белков как собственных погибших клеток, так и флогогенного агента). Включение клеточных и гуморальных механизмов иммунитета обеспечивает обнаружение, деструкцию и элиминацию антигенно чужеродных структур.
Ионы и вода
♦ Расстраивается энергетическое обеспечение селективного переноса катионов и снижается активность катион-зависимых мембранных АТФаз (?+,К+-АТФазы, Са 2 +Mg 2 +-АТФазы). Это вызывает нарушение формирования МП и ПД, развитие стойкой деполяризации мембран возбудимых клеток (например, кардиомиоцитов и нейронов).
♦ Нарушается вне- и внутриклеточное соотношение между отдельными ионами. Происходит потеря клеткой К+, Mg 2 + и накопление их в межклеточной жидкости. В клетку поступают Na+ и Са 2 +.
♦ Высвобождается дополнительное количество катионов (К+, Na+, Са 2+ , железа, цинка) при гидролизе солей и поступлении большого количества Са 2 + из повреждённых внутриклеточных депо (митохондрий и цистерн эндоплазматической сети).
♦ Значительно увеличивается осмотическое давление внутри клеток и их органелл, что сопровождается перерастяжением и разрывом их мембран.
Физико-химические изменения
Метаболический ацидоз в очаге воспаления обусловлен накоплением избытка различных кислот: молочной, пировиноградной, аминокислот, ВЖК и КТ.
♦ Механизмы развития: нарушение удаления из очага воспаления образующихся в большом количестве кислых продуктов метаболизма. Это вызывает истощение буферных систем (бикарбонатной, фосфатной, белковой) клеток и межклеточной жидкости.
♦ Последствия:
Повышение проницаемости мембран, в том числе лизосом, что приводит к выходу гидролаз в цитозоль и межклеточное вещество.
Повышение проницаемости стенок сосудов за счёт усиления неферментного и ферментного гидролиза компонентов межклеточного матрикса, включая базальные мембраны.
Формирование ощущения боли в очаге воспаления в связи с раздражением и повреждением чувствительных нервных окончаний в условиях избытка Н + .
Изменения чувствительности рецепторов клеток (в том числе - стенок сосудов) к регуляторным факторам (нейромедиаторам, гормонам, медиаторам воспаления), что сопровождается расстройством регуляции тонуса сосудистой стенки.
Гиперосмия - повышенное осмотическое давление в регионе воспаления. Обусловлено накоплением большого количества ионов и низкомолекулярных соединений.
♦ Механизмы развития: повышенное ферментативное и неферментативное разрушение макромолекул, усиленный в условиях ацидоза гидролиз солей и выделение осмотически активных соединений из повреждённых клеток.
♦ Последствия: гипергидратация очага воспаления, стимуляция эмиграции лейкоцитов, изменение тонуса стенок сосудов, формирование чувства боли.
Гиперонкия - повышенное онкотическое давление в ткани при ее воспалении.
♦ Механизмы развития: увеличение концентрации белка в очаге воспаления в связи с усилением ферментативного и неферментативного гидролиза пептидов и выход белков (в основном - альбуминов) из крови в очаг воспаления в связи с повышением проницаемости сосудистой стенки.
♦ Последствия: развитие отёка в очаге воспаления.
Изменение поверхностного заряда клеток (как правило, снижение). Обусловлено нарушением водно-электролитного баланса в воспаленной ткани.
♦ Механизмы развития: нарушение энергообеспечения трансмембранного переноса ионов и развитие электролитного дисбаланса.
♦ Последствия: изменение порога возбудимости клеток, потенцирование миграции фагоцитов за счёт электрокинеза; стимуляция кооперации клеток в связи со снижением величины отрицательного поверхностного их заряда, нейтрализацией его или даже перезарядкой.
Изменения коллоидного состояния межклеточного вещества и гиалоплазмы клеток в очаге воспаления.
♦ Механизмы развития:
Ферментативный и неферментативный гидролиз макромолекул (гликозаминогликанов, белков, протеогликанов).
Фазовые изменения микрофиламентов, облегчающие переход их состояния из геля в золь и наоборот.
♦ Последствия (основное): увеличение тканевой проницаемости.
Уменьшение поверхностного натяжения клеточных мембран. Обусловлено изменениями структуры молекул плазмолеммы.
♦ Механизмы развития: воздействие на клеточные мембраны значительного количества поверхностноактивных веществ (фосфо-
липидов, ВЖК, К + , Са 2+).
♦ Последствия: облегчение подвижности клетки и потенцирование адгезии клеток при фагоцитозе.
Медиаторы воспаления
Медиаторы воспаления - биологически активные вещества, под влиянием которых осуществляются закономерное развитие и исходы воспаления, формируются его местные и общие признаки.
Выделяют две группы медиаторов воспаления: клеточные и плазменные.
Клеточные медиаторы воспаления
Основные группы клеточных медиаторов воспаления включают: биогенные амины, пептиды и белки, оксид азота, производные жирных кислот и липидов, нуклеотиды и нуклеозиды. Их источниками являются тучные клетки, нейтрофильные и базофильные гранулоциты, тромбоциты и ряд других клеток в очаге воспаления.
Биогенные амины. Важнейшими представителями являются гистамин и серотонин.
♦ Гистамин, воздействуя на Н 2 -рецепторы клеток-мишеней, вызывает дилатацию сосудов микроциркуляторного русла и повышает проницаемость венул, что способствует экссудации. Взаимодействуя с H 1 -рецепторами, гистамин обусловливает: ощущения боли, жжения, зуда, напряжения.
♦ Серотонин также повышает сосудистую проницаемость и активирует сокращение ГМК венул (что способствует развитию венозной гиперемии), приводит к формированию чувства боли, стимулирует тромбообразование.
Пептиды и белки
♦ Нейропептиды. Из числа нейропептидов при воспалении наиболее значимую роль выполняет вещество P.
♦ Цитокины регулируют пролиферативную активность, дифференцировку и фенотип клеток-мишеней. К цитокинам отнесены факторы роста, интерлейкины (ИЛ), фактор некроза опухоли
(ФНО), колониестимулирующие факторы, интерфероны (ИФН) и хемокины.
Общий современный термин для всего класса - цитокины, устаревшие наименования подклассов: лимфокины и монокины.
♦ Лейкокины - общее название для различных биологически активных веществ (БАВ), образуемых лейкоцитами, но не относящихся к иммуноглобулинам (Ig) и цитокинам. К группе лейкокинов относятся белки острой фазы, катионные белки, а также фибронектин.
♦ Ферменты. В очаге воспаления обнаруживаются ферменты всех основных групп. Их основным источником являются нейтрофилы и другие фагоциты. В начале воспаления ферменты вызывают разрыхление соединительнотканных муфт вокруг сосудов и разрушение межклеточного вещества сосудистых стенок, способствуя вазодилатации и повышению проницаемости сосудов. На поздних стадиях воспаления благодаря ферментам происходит очищение очага воспаления от погибших клеток и тканей, а также реализуются пролиферативные процессы.
Оксид азота (эндотелием освобождаемый фактор вазодилатации) - важный медиатор воспаления.
Липидные медиаторы воспаления
♦ Производными арахидоновой кислоты являются простагландины, тромбоксаны и лейкотриены. Арахидоновая кислота входит в состав фосфолипидов клеточных мембран, откуда и освобождается под влиянием фосфолипаз. Дальнейшие превращения этой кислоты происходят либо по циклооксигеназному (с образованием простагландинов и тромбоксанов), либо по липооксигеназному пути (с образованием лейкотриенов).
? Простагландины обладают широким спектром действия, в том числе повреждают стенки сосудов микроциркуляторного русла и повышают их проницаемость, усиливают хемотаксис и способствуют пролиферации фибробластов. Пг снижают порог болевой чувствительности и способствуют развитию лихорадки.
? Тромбоксаны вызывают вазоконстрикцию, способствуют агрегации клеток крови, стимулируют тромбообразование.
? Лейкотриены вызывают спазм ГМК стенок сосудов, бронхиол и кишечника (длительность эффекта лейкотриенов весьма велика), проявляют положительный хемотаксический эффект по отношению к фагоцитам и повышают проницаемость мембран.
♦ Фактор активации тромбоцитов образуется из мембранных фосфолипидов и является наиболее сильным сосудосуживающим веществом.
♦ Липопероксиды - продукты СПОЛ. Они дестабилизируют мембраны лизосом, способствуя высвобождению ферментов из них, и определяют эффективность заключительных этапов фагоцитоза.
Нуклеотиды и нуклеозиды
♦ АТФ обеспечивает энергетическую «поддержку» клеток и пластических процессов в них в очаге воспаления.
♦ АДФ стимулирует адгезию, агрегацию и агглютинацию форменных элементов крови. Это вызывает тромбообразование, формирование сладжа, нарушение крово- и лимфотока в сосудах микроциркуляторного русла.
♦ Аденозин, высвобождающийся из клеток, оказывает существенное сосудорасширяющее действие с развитием артериальной гиперемии.
Плазменные медиаторы воспаления
Плазменные медиаторы воспаления, так же как и клеточные, вырабатываются клетками и высвобождаются ими в неактивном состоянии. Они появляются при активации трёх систем крови - кининовой, комплемента и гемостаза. Все компоненты этих систем находятся в крови в виде предшественников и становятся активными после воздействия на них клеточных медиаторов воспаления.
Медиаторы кининовой системы. Основное значение при воспалении имеют брадикинин и калликреин.
♦ Брадикинин усиливает сосудистую проницаемость, обусловливает чувство боли, обладает выраженным гипотензивным действием.
♦ Калликреин вызывает хемотаксис лейкоцитов, но главное его значение - активация фактора Хагемана.
Медиаторы системы гемостаза: факторы свертывающей, противосвертывающей и фибринолитической систем. Первично активируется фактор Хагемана. Он инициирует свёртывание белков крови, повышает проницаемость стенок сосудов, усиливает миграцию нейтрофилов и агрегацию тромбоцитов.
Система комплемента состоит из группы специализированных белков плазмы крови, вызывающих лизис бактерий и клеток. Кроме того, некоторые компоненты комплемента, прежде всего C3b и C5b, повышают проницаемость стенок сосудов, усиливают хемотаксическую активность нейтрофилов и макрофагов.
Антимедиаторы воспаления. На всех этапах развития воспаления образуются и действуют вещества, предупреждающие избыточное накопление или прекращающие действие медиаторов, которые в совокупности могут быть объединены в систему антимедиаторов воспаления. Важнейшими антимедиаторами являются ферменты. Так, гистаминаза разрушает гистамин, карбоксипептидазы - кинины, эс-
теразы - фракции комплемента, простагландиндегидрогеназа - Пг. Большое значение имеют гуморальные влияния. Так, образующийся в гепатоцитах один из видов антитрипсина ингибирует ряд протеаз, участвующих в воспалении, что тормозит образование кининов. Глюкокортикоиды ослабляют сосудистые реакции, стабилизируя мембраны сосудов, уменьшают экссудацию и эмиграцию лейкоцитов, а также ослабляют фагоцитоз. Благодаря наличию антимедиаторов, воспаление прекращается после устранения или инактивации повреждающего агента и репарации повреждённых тканей.
СОСУДИСТЫЕ РЕАКЦИИ, ИЗМЕНЕНИЯ КРОВО-
И ЛИМФООБРАЩЕНИЯ. ЭКССУДАЦИЯ ЖИДКОСТИ.
ВЫХОД ФОРМЕННЫХ ЭЛЕМЕНТОВ КРОВИ В ТКАНЬ
Этот компонент воспаления включает следующие процессы:
♦ изменение тонуса стенок и просвета сосудов;
♦ нарушение гемо- и лимфодинамики;
♦ изменение реологических свойств крови;
♦ увеличение сосудистой проницаемости;
♦ собственно процесс экссудации жидкости из микрососудов;
♦ миграцию в очаг воспаления лейкоцитов и фагоцитоз, выход в ткань тромбоцитов и эритроцитов.
Изменение тонуса стенок и просвета сосудов. Нарушения регионарной гемодинамики
Просвет сосудов, крово- и лимфообращение в очаге воспаления изменяются с момента возникновения и в течение всего процесса воспаления. При этом, в разных его участках и на разных этапах оно, как правило, имеет разный характер.
♦ Ишемия является результатом спазма мышц артериол и прекапилляров за счёт рефлекторного (в ответ на боль) выделения нейромедиаторов (норадреналин). Внешние проявления: бледность, некоторое уменьшение объёма и температуры тканей. Продолжительность - от нескольких секунд до нескольких минут, так как норадреналин быстро расщепляется ферментативными системами.
♦ Артериальная гиперемия обусловлена снижением тонуса мышц стенок и расширением артериол под воздействием медиаторов воспаления. Увеличение кровоснабжения является важным защитным механизмом и способствует энергетическому обеспечению воспаления. Внешние проявления: покраснение, увеличение тургора, незначительное увеличение объёма и температуры тканей.
♦ Венозная гиперемия обусловлена нарушением оттока крови. Этому способствует сдавление венул и капилляров отёчной периваску-
лярной тканью, набухание эндотелия и изменение реологических свойств крови. Венозная гиперемия способствует повышению гидростатического давления в сосудах микроциркуляторного русла и фильтрации в ткани жидкой части крови, а следовательно, - усугублению отёка.
♦ Стаз - временное прекращение тока крови и лимфы в сосудах микроциркуляторного русла. Развивается вследствие значительного сдавления венул отёчной тканью и развитием в них сладж-феномена.
♦ Нормализация регионарного кровотока происходит по мере завершения воспаления.
Изменение реологических свойств крови. В сосудах воспалённой ткани происходит сгущение крови, краевое стояние лейкоцитов, образование сладжа и клеточных агрегатов, что снижает текучесть крови и способствует тромбозу мелких сосудов.
Увеличение сосудистой и тканевой проницаемости
Определяющим фактором экссудации жидкости за пределы сосудов при воспалении является повышение проницаемости сосудистой стенки, с чем связано образование экссудата. На проницаемость стенки сосудов основное влияние оказывают медиаторы воспаления. Повышение сосудистой проницаемости способствует межэндотелиальному и трансэндотелиальному транспорту плазмы и выходу форменных элементов крови из сосудов.
♦ Межэндотелиальные щели образуются за счёт сокращения актомиозина в эндотелиальных клетках и изменения в них структуры цитоскелета.
♦ Трансэндотелиальный транспорт осуществляется с помощью везикул и микроканалов.
Увеличение тканевой проницаемости обусловлено также изменениями коллоидного состояния межклеточного вещества.
ЭКССУДАЦИЯ ЖИДКОСТИ И ВЫХОД ФОРМЕННЫХ ЭЛЕМЕНТОВ
КРОВИ В ОЧАГ ВОСПАЛЕНИЯ
Экссудация (от лат. exsudatum - потеть, пропотевать) - процесс выхода плазмы и форменных элементов крови из сосудов микроциркуляторного русла в ткани и полости тела с образованием экссудата.
Экссудат - жидкость, образующаяся при воспалении и содержащая большое количество белка и форменные элементы крови (в основном лейкоциты).
В организме может образовываться также невоспалительная жидкость- транссудат. Он отличается от экссудата низким содержанием белка, лейкоцитов и других форменных элементов крови.
Причины экссудации
Основная причина плазморрагии (пассивного выхода плазмы крови в интерстиций) - увеличение сосудистой проницаемости и повышение гидростатического давления крови в сосудах микроциркуляторного русла.
Основная причина лейкоцитарной инфильтрации ткани - хемо- и электротаксис лейкоцитов.
Виды экссудата. Выделяют несколько видов экссудата: серозный, фибринозный, гнойный, гнилостный, геморрагический и катаральный. Вид экссудата определяет название формы острого экссудативного воспаления.
Значение экссудации. В очаге воспаления процесс экссудации имеет двоякое биологическое значение: адаптивное и патогенное.
Адаптивное значение заключается в фиксации в очаге воспаления флогогена и создании оптимальных условий его инактивации и элиминации.
Патогенное значение:
♦ сдавление и смещение органов и тканей экссудатом;
♦ возможно распространение воспалительного процесса в соседние ткани или биологические жидкости (в лимфу, кровь, ликвор и др.);
♦ образование очагов деструкции ткани при гнойном воспалении.
Эмиграция лейкоцитов
Эмиграция лейкоцитов - активный процесс их выхода из просвета сосудов микроциркуляторного русла в межклеточное пространство. Спустя 1-2 ч после воздействия на ткань флогогенного фактора в очаге воспаления обнаруживается большое число эмигрировавших нейтрофилов и других гранулоцитов, позднее - через 15-20 и более часов - моноцитов, а затем и лимфоцитов.
Процесс эмиграции последовательно проходит этапы роллинга (краевого стояния - «качения») лейкоцитов, их адгезии к эндотелию и проникновения через сосудистую стенку, а также - направленного движения лейкоцитов в очаге воспаления (рис. 5-1).
Функции лейкоцитов при воспалении
Фагоцитоз.
Синтез и выделение медиаторов воспаления.
Презентация антигена лимфоцитам. Эта функция фагоцитов реализуется за счёт процессинга (поглощение и трансформация антигенных структур) и представления Аг клеткам иммунной системы (передача информации об Аг лимфоцитам).
Рис. 5-1. Этапы миграции лейкоцитов через сосудистую стенку (на примере нейтрофилов). [по 4].
Позднее значительная часть лейкоцитов, мигрировавших в очаг воспаления, подвергается дистрофическим изменениям и превращается в «гнойные тельца» или подвергается апоптозу. Часть лейкоцитов, выполнив свои функции, возвращается в сосудистое русло и циркулирует в крови.
При значительном повышении проницаемости стенок сосудов микроциркуляторного русла в очаг воспаления «пассивно» выходят также эритроциты и тромбоциты.
ФАГОЦИТОЗ
Фагоцитоз (греч. phagein - поедать, пожирать + греч. kytos - клетка + греч. osis - процесс, состояние) - активный биологический процесс, заключающийся в распознавании, поглощении и внутриклеточной деструкции чужеродного материала специализированными клетками - фагоцитами: микрофагами (полиморфноядерными лейкоцитами) и макрофагами.
В ходе фагоцитоза выделяют несколько основных стадий (рис. 5-2).
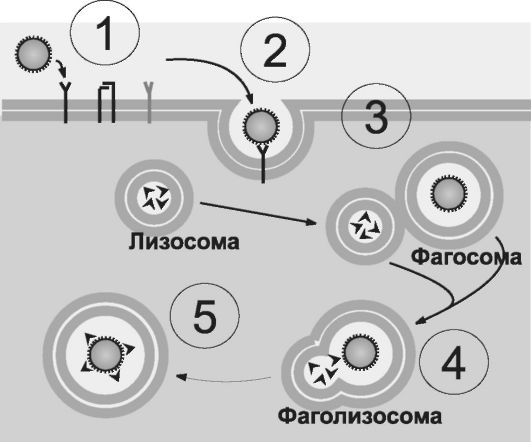 Рис. 5-2. Стадии фагоцитоза:
1
- адгезия частицы (например, бактерии) с помощью Fc-рецептора мембраны
фагоцита; 2 - погружение адгезированной частицы в фагоцит и образование
фагосомы; 3 - приближение и присоединение к фагосоме лизосом; 4 -
слияние мембран фагосомы и лизосом с образованием фаголизосомы; 5 -
разрушение поглощённой частицы. [по 4].
Рис. 5-2. Стадии фагоцитоза:
1
- адгезия частицы (например, бактерии) с помощью Fc-рецептора мембраны
фагоцита; 2 - погружение адгезированной частицы в фагоцит и образование
фагосомы; 3 - приближение и присоединение к фагосоме лизосом; 4 -
слияние мембран фагосомы и лизосом с образованием фаголизосомы; 5 -
разрушение поглощённой частицы. [по 4].
Распознавание фагоцитом объекта поглощения и адгезия к нему происходит в несколько этапов:
♦ Обнаружение поверхностных детерминант объекта фагоцитоза.
♦ Опсонизация объекта фагоцитоза.
♦ Адгезия фагоцита к объекту фагоцитоза. Этот процесс реализуется с участием рецепторов лейкоцита FcyR (при наличии у объекта соответствующего лиганда) и молекул адгезии (при отсутствии лиганда, например, у неклеточных частиц).
Поглощение объекта фагоцитом с последующим образованием фаголизосомы. Поглощенный материал погружается в клетку в составе фагосомы - пузырька, образованного плазматической мембраной. К фагосоме приближаются лизосомы, мембраны фагосомы и лизосом сливаются, и образуется фаголизосома.
Внутриклеточное разрушение объекта фагоцитоза реализуется в результате активации двух сложных механизмов: кислородзависимой и кислороднезависимой цитотоксичности фагоцитов.
♦ Кислородзависимая цитотоксичность играет ведущую роль в деструкции объекта фагоцитоза. Она сопряжена со значительным повышением интенсивности метаболизма с участием кислорода (респираторный взрыв).
♦ Кислороднезависимые механизмы обусловлены действием лизосомальных ферментов фагоцита.
Незавершённый фагоцитоз. При незавершённом фагоцитозе поглощён- ные фагоцитами микроорганизмы не разрушаются. Это способствует персистенции и распространению инфекции в организме. Причины незавершённого фагоцитоза:
Мембрано- и ферментопатии лизосом фагоцита.
Повышенная резистентность микробов к ферментам фагоцита.
Способность некоторых микробов быстро покидать фагосомы и персистировать в цитоплазме фагоцита (риккетсии, хламидии).
Недостаточный эффект гормонов - регуляторов процесса фагоцитоза.
ПРОЛИФЕРАЦИЯ
Пролиферация - важный компонент механизма развития воспалительного процесса и завершающая его стадия - характеризуется увеличением числа стромальных и паренхиматозных клеток, а также образованием межклеточного вещества в очаге воспаления. Эти процессы направлены на регенерацию или замещение разрушенных тканевых элементов.
♦ При благоприятном течении воспаления наблюдается полная регенерация ткани - восполнение её погибших и восстановление обратимо повреждённых структурных элементов (реституция).
♦ При значительном разрушении участка ткани или органа на месте дефекта паренхиматозных клеток образуется вначале грануляционная ткань, а по мере её созревания - рубец, т.е. наблюдается неполная регенерация.
Неспецифическое и специфическое воспаление
Неспецифическое воспаление не имеет специфических черт и может вызываться различными флогогенными агентами. Специфическое воспаление имеет, наряду с общими, специфические черты и вызывается определённым возбудителем. Выделяют несколько специфических воспалительных заболеваний: туберкулёз, сифилис, лепра, склерома и др.
ОСТРОЕ И ХРОНИЧЕСКОЕ ВОСПАЛЕНИЕ
По течению различают острое и хроническое воспаление.
Острое воспаление
Острое воспаление характеризуется:
Интенсивным течением и завершением воспаления, как правило, в течение одной или двух недель.
Наиболее часто в очаге воспаления преобладают процессы экссудации, и такое воспаление называют «экссудативным».
ЭКССУДАТИВНОЕ ВОСПАЛЕНИЕ
Экссудативное воспаление характеризуется образованием экссудата, состав которого определяется, главным образом, причиной воспаления и реакцией организма на повреждение.
Серозное воспаление характеризуется формированием мутного экссудата, который содержит небольшое количество лейкоцитов, слущенных эпителиальных клеток и до 2-2,5% белка. Примеры: воспаление при крапивнице или пузырчатке.
Фибринозное воспаление характеризуется образованием экссудата, содержащего, помимо лейкоцитов, большое количество фибриногена, который выпадает в тканях в виде нитей фибрина. Фибринозный экссудат пропитывает погибшие ткани, образуя светло-серую плён- ку. В зависимости от структуры эпителиальных покровов и особенностей подлежащей соединительной ткани выделяют два вида фибринозного воспаления:
♦ Крупозное воспаление. На однослойном эпителиальном покрове и плотной базальной мембране образуется тонкая, легко снимающаяся фибринозная плёнка. Такое фибринозное воспаление называется крупозным. Оно встречается на слизистых оболочках трахеи и бронхов, серозных оболочках.
♦ Дифтеритическое воспаление. Многослойный плоский неороговевающий эпителий, переходный эпителий и рыхлая широкая соединительнотканная основа органа способствуют развитию глубокого некроза и формированию толстой, трудно снимающейся фибринозной плёнки, после удаления которой остаются глубокие язвы. Такое фибринозное воспаление называется дифтеритическим. Оно развивается в зеве, на слизистых оболочках пищевода, матки и влагалища, кишечника и желудка, мочевого пузыря.
Гнойное воспаление характеризуется образованием гнойного экссудата. Он представляет собой сливкообразную массу, состоящую из детрита, погибших форменных элементов крови (от 17% до 29%),
микробов. Гной имеет специфический запах, синевато-зеленоватую окраску с различными оттенками, содержание белка в нём составляет 3-7% и более. Основными формами гнойного воспаления являются абсцесс, флегмона, эмпиема, гнойная рана.
♦ Абсцесс - отграниченное гнойное воспаление с образованием полости, заполненной гнойным экссудатом.
♦ Флегмона - разлитое гнойное воспаление, при котором экссудат пропитывает и расслаивает ткани.
♦ Эмпиема - очаговое гнойное воспаление полостей тела или полых органов.
♦ Гнойная рана - возникает либо вследствие нагноения травматической раны, либо в результате вскрытия во внешнюю среду очага гнойного воспаления и образования раневой поверхности.
Гнилостное воспаление (ихорозное) характеризуется выраженным некрозом тканей.
Геморрагическое воспаление сопровождается особенно высокой проницаемостью сосудов микроциркуляторного русла, диапедезом эритроцитов и их примесью к уже имеющемуся экссудату (серозногеморрагическое, гнойно-геморрагическое воспаление).
Катаральное воспаление характеризуется примесью слизи к любому экссудату.
ПРИЗНАКИ ОСТРОГО ВОСПАЛЕНИЯ
Признаки острого воспаления подразделяют на местные и общие (системные).
Местные признаки острого воспаления. В очаге острого воспаления наблюдаются: ❖ покраснение - rubor; ❖ припухлость - tumor;
♦ боль - dolor; ❖ жар (повышение температуры в очаге воспаления) - calor; ❖ нарушение функции - functio laesa.
Системные изменения при остром воспалении. Вследствие резорбции из очага воспаления в кровь медиаторов воспаления и продуктов распада ткани развивается ряд системных эффектов: лейкоцитоз, лихорадка, диспротеинемия, увеличение скорости оседания эритроцитов, изменение гормонального статуса организма, аллергизация организма.
Таким образом, воспаление, являясь местным процессом, отражает общую, системную реакцию организма на действие флогогенного агента.
Хроническое воспаление
Хроническое воспаление может быть первичным и вторичным.
Если воспаление после острого периода приобретает затяжной характер, то оно обозначается как «вторично хроническое».
Если воспаление изначально имеет персистирующее (вялое и длительное) течение, его называют «первично хроническим».
Проявления хронического воспаления. Для хронического воспаления характерен ряд признаков: развитие гранулём, формирование капсул, некроз, инфильтрация ткани моноцитами и лимфоцитами. Активация макрофагов иммунными и неиммунными факторами (рис. 5-3) обусловливает дополнительное повреждение тканей и развитие фиброза. При хроническом воспалении часто преобладает процесс пролиферации, и такое воспаление называют пролиферативным. Причины хронического воспаления многообразны:
Различные формы фагоцитарной недостаточности.
Длительный стресс и другие состояния, сопровождающиеся повышенной концентрацией в крови катехоламинов и глюкокортикоидов. Указанные группы гормонов подавляют процессы пролиферации, созревания фагоцитов, потенцируют их разрушение.
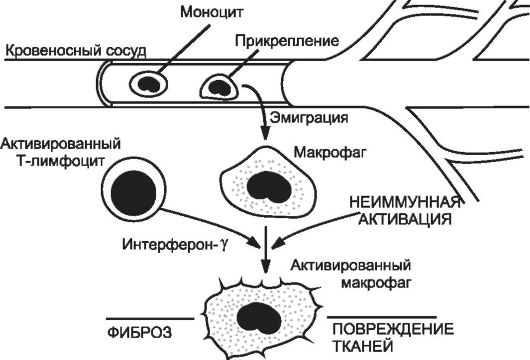 Рис. 5-3. Роль активированных макрофагов в развитии и течении хронического воспаления.
Активированные
макрофаги синтезируют арахидоновую кислоту, тромбоцитарные факторы
роста и другие медиаторы воспаления, потенцирующие вторичную альтерацию.
В развитии повреждения тканей принимают участие токсические метаболиты
кислорода, протеазы, факторы хемотаксиса нейтрофилов, факторы
свёртывания, метаболиты арахидоновой кислоты и оксид азота. Для развития
неиммунной активации важны эндотоксины, фибронектин, химические
медиаторы воспаления. Развитие фиброза зависит от перестройки коллагенов
под влиянием разных факторов роста и цитокинов, а также от факторов
ангиогенеза. [по 4].
Рис. 5-3. Роль активированных макрофагов в развитии и течении хронического воспаления.
Активированные
макрофаги синтезируют арахидоновую кислоту, тромбоцитарные факторы
роста и другие медиаторы воспаления, потенцирующие вторичную альтерацию.
В развитии повреждения тканей принимают участие токсические метаболиты
кислорода, протеазы, факторы хемотаксиса нейтрофилов, факторы
свёртывания, метаболиты арахидоновой кислоты и оксид азота. Для развития
неиммунной активации важны эндотоксины, фибронектин, химические
медиаторы воспаления. Развитие фиброза зависит от перестройки коллагенов
под влиянием разных факторов роста и цитокинов, а также от факторов
ангиогенеза. [по 4].
Взаимодействие лимфоцитов и макрофагов, в избытке инфильтрирующих ткани при хроническом воспалении, с высвобождением большого количества повреждающих медиаторов (рис. 5-4).
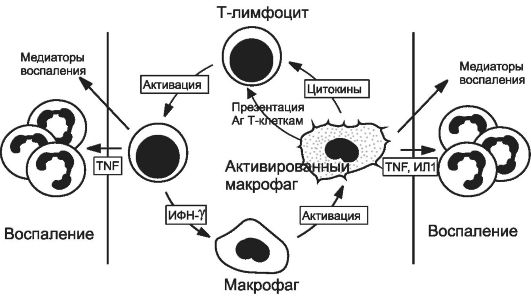 Рис. 5-4. Взаимодействие макрофагов и лимфоцитов при хроническом воспалении.
Активированные
лимфоциты и макрофаги оказывают влияние друг на друга, а также выделяют
медиаторы воспаления, которые повреждают окружающие клетки. TNF -
фактор некроза опухоли. [по 4].
Рис. 5-4. Взаимодействие макрофагов и лимфоцитов при хроническом воспалении.
Активированные
лимфоциты и макрофаги оказывают влияние друг на друга, а также выделяют
медиаторы воспаления, которые повреждают окружающие клетки. TNF -
фактор некроза опухоли. [по 4].
Повторное повреждение ткани или органа (например, лёгких компонентами пыли), сопровождающееся образованием чужеродных Аг и развитием иммунопатологических реакций.
Особенности микроорганизмов (устойчивость к действию факторов системы иммунобиологического надзора организма, мимикрия, образование L-форм).
Принципы терапии воспаления
Этиотропное лечение подразумевает устранение, прекращение, уменьшение силы и длительности действия на ткани и органы флогогенных факторов. С этой целью применяют, например, антибактериальные препараты.
Патогенетическое лечение имеет целью блокирование механизма развития воспаления. При этом воздействия направлены на разрыв звеньев патогенеза воспаления, лежащих в основе, главным образом, процессов альтерации и экссудации. Для этого используют, например,
антигистаминные препараты, глюкокортикоиды, ингибиторы циклооксигеназ.
Саногенетическая терапия направлена на активацию общих и местных механизмов компенсации, регенерации, защиты, восстановления и устранения изменений в тканях и клетках, вызванных флогогенным агентом.
Симптоматическое лечение. Мероприятия, направленные на предупреждение или устранение неприятных, тягостных, усугубляющих состояние пациента симптомов (с этой целью применяют, например, анестезирующие ЛС, вещества, способствующие нормализации функций органов и физиологических систем).
Общая характеристика воспаления
Воспаление - защитно-приспособительная реакция целостного организма на действие патогенного раздражителя, проявляющаяся развитием на месте повреждения ткани или органа изменений кровообращения и повышением сосудистой проницаемости в сочетании с дистрофией тканей и пролиферацией клеток. Воспаление является типовым патологическим процессом, направленным на устранение патогенного раздражителя и восстановление поврежденных тканей.
Известный русский ученый И.И. Мечников в конце XIX века впервые показал, что воспаление присуще не только человеку, но и низшим животным, даже одноклеточным, хотя и в примитивной форме. У высших животных и человека защитная роль воспаления проявляется:
а) в локализации и отграничении воспалительного очага от здоровых тканей;
б) фиксации на месте, в очаге воспаления патогенного фактора и его уничтожении; в) удалении продуктов распада и восстановлении целостности тканей; г) выработке в процессе воспаления иммунитета.
Вместе с тем еще И.И. Мечников считал, что эта защитная реакция организма относительна и несовершенна, так как воспаление составляет основу многих болезней, нередко заканчивающихся смертью больного. Поэтому необходимо знать закономерности развития воспаления, чтобы активно вмешиваться в его течение и устранять угрозу смерти от этого процесса.
Для обозначения воспаления какого-либо органа или ткани к корню их латинского названия добавляют окончание "ит": например, воспаление почек - нефрит, печени - гепатит, мочевого пузыря - цистит, плевры - плеврит и. т.д. Наряду с этим в медицине сохранились старые названия воспаления некоторых органов: пневмония - воспаление легких, панариций - воспаление ногтевого ложа пальца, ангина - воспаление зева и некоторые другие.
2 Причины и условия возникновения воспаления
Возникновение, течение и исход воспаления во многом зависят от реактивности организма, которая определяется возрастом, полом, конституциональными особенностями, состоянием физиологических систем, в первую очередь иммунной, эндокринной и нервной, наличием сопутствующих заболеваний. Немаловажное значение в развитии и исходе воспаления имеет его локализация. Например, крайне опасны для жизни абсцесс мозга, воспаление гортани при дифтерии.
По выраженности местных и общих изменений воспаление разделяют на нормергическое, когда ответная реакция организма соответствует силе и характеру раздражителя; гиперергическое, при котором ответ организма на раздражение значительно интенсивнее, чем действие раздражителя, и гипергическое, когда воспалительные изменения выражены слабо или совсем не выражены. Воспаление может иметь ограниченный характер, но может распространяться на целый орган или даже систему, например систеиу соединительной ткани.
3 Стадии и механизмы воспаления
Характерным для воспаления, отличающим его от всех других патологических процессов, является наличие трех последовательных стадий развития:
1) альтерации,
2) экссудации и 3) пролиферации клеток. Эти три стадии обязательно присутствуют в зоне любого воспаления.
Альтерация - повреждение ткани - является пусковым механизмом развития воспалительного процесса. Она приводит к высвобождению особого класса биологически активных веществ, называемых медиаторами воспаления. В целом все изменения, возникающие в очаге воспаления под влиянием этих веществ, направлены на развитие второй стадии воспалительного процесса - экссудации. Медиаторы воспаления изменяют метаболизм, физико-химические свойства и функции тканей, реологические свойства крови и функции форменных элементов. К медиаторам воспаления относятся биогенные амины - гистамин и серотонин. Гистамин выделяется лаброцитами в ответ на повреждение ткани. Он вызывает боль, расширение микрососудов и повышение их проницаемости, активирует фагоцитоз, усиливает высвобождение других медиаторов. Серотонин высвобождается из тромбоцитов в крови и изменяет микроциркуляцию в очаге воспаления. Лимфоциты выделяют медиаторы, называемые лимфокинами, которые активитуют важнейшие клетки иммунной системы - Т-лимфоциты.
Полипептиды плазмы крови - кинины, в том числе калликреины и брадикинин, вызывают боль, расширение микрососудов и повышение проницаемости их стенок, активируют фагоцитоз.
К медиаторам воспаления относятся и некоторые простагландины, вызывающие те же эффекты, что и кинины, регулируя при этом интенсивность воспалительной реакции.
воспаление защитный патогенный
Перестройка обмена веществ в зоне альтерации приводит к изменению физико-химических свойств тканей и развитию в них ацидоза. Ацидоз способствует повышению проницаемости сосудов и мембран лизосом, распаду белков и диссоциации солей, вызывая тем самым повышение онкотического и осмотического давления в поврежденных тканях. Это в свою очередь увеличивает выход жидкости из сосудов, обусловливая развитие экссудации, воспалительного отека и инфильтрации ткани в зоне воспаления.
Экссудация - выход, или пропотевание, из сосудов в ткань жидкой части крови с находящимися в ней веществами, а также клеток крови. Экссудация наступает очень быстро вслед за альтерацией и обеспечивается в первую очередь реакцией микроциркуляторного русла в очаге воспаления. Первой реакцией сосудов микроциркуляции и регионарного кровообращения в ответ на действие медиаторов воспаления, главным образом гистамина, являются спазм артериол и уменьшение притока артериальной крови. В результате возникает ишемия ткани в зоне воспаления, связанная с увеличением симпатических влияний. Эта реакция сосудов кратковременна. Замедление скорости кровотока и уменьшение объема протекающей крови приводит к нарушению обмена веществ в тканях и ацидозу. Спазм артериол сменяется их расширением, увеличением скорости кровотока, объема протекающей крови и повышением гидродинамического давления, т.е. появлением артериальной гиперемии. Механизм ее развития весьма сложен и связан с ослаблением симпатических и увеличением парасимпатических влияний, а также с действием медиаторов воспаления. Артериальная гиперемия способствует повышению обмена веществ в очаге воспаления, увеличивает приток к нему лейкоцитов и антител, способствует активации лимфатической системы, которая уносит продукты распада тканей. Гиперемия сосудов обусловливает повышение температуры и покраснение участка воспаления.
Артериальная гиперемия по мере развития воспаления сменяется венозной гиперемией. Давление крови в венулах и посткапиллярах повышается, скорость кровотока замедляется, объем протекающей крови снижается, венулы становятся извитыми, в них появляются толчкообразные движения крови. В развитии венозной гиперемии имеет значение потеря тонуса стенками венул вследствие нарушения обмена веществ и ацидоза тканей в очаге воспаления, тромбирования венул, сдавления их отечной жидкостью. Замедление скорости кровотока при венозной гиперемии способствует движению лейкоцитов из центра кровотока к его периферии и прилипанию их к стенкам сосудов. Это явление называется краевое стояние лейкоцитов, оно предшествует их выходу из сосудов и переходу в ткани. Венозная гиперемия завершается остановкой крови, т.е. возникновением стаза, который проявляется сначала в венулах, а позднее становится истинным, капиллярным. Лимфатические сосуды переполняются лимфой, лимфоток замедляется, а затем прекращается, так как наступает тромбоз лимфатических сосудов. Таким образом, очаг воспаления изолируется от неповрежденных тканей. При этом кровь к нему продолжает поступать, а отток ее и лимфы резко снижен, что препятствует распространению повреждающих агентов, в том числе токсинов, по организму.
Экссудация начинается в период артериальной гиперемии и достигает максимума при венозной гиперемии. Усиленный выход жидкой части крови и растворенных в ней веществ из сосудов в ткань обусловлен несколькими факторами. Ведущее значение в развитии экссудации имеет повышение проницаемости стенок микрососудов под влиянием медиаторов воспаления, метаболитов (молочная кислота, продукты распада АТФ), лизосомных ферментов, нарушения баланса ионов К и Са, гипоксии и ацидоза. Выход жидкости обусловлен также повышением гидростатического давления в микрососудах, гиперонкией и гиперосмией тканей. Морфологически повышение сосудистой проницаемости проявляется в усилении пиноцитоза в эндотелии сосудов, набухании базальных мембран. По мере увеличения сосудистой проницаемости из капилляров в очаг воспаления начинают выходить и форменные элементы крови.
Накапливающаяся в очаге воспаления жидкость носит название экссудат. По составу экссудат существенно отличается от транссудата - скопления жидкости при отеках. В экссудате значительно выше содержание белка (3-5%), причем экссудат содержит не только альбумины, как транссудат, но и белки с высокой молекулярной массой - глобулины и фибриноген. В экссудате в отличие от транссудата всегда имеются форменные элементы крови - лейкоциты (нейтрофилы, лимфоциты, моноциты), а нередко и эритроциты, которые, скапливаясь в очаге воспаления, образуют воспалительный инфильтрат. Экссудация, т.е. ток жидкости из сосудов в ткань по направлению к центру очага воспаления, предупреждает распространение патогенного раздражителя, продуктов жизнедеятельности микробов и продуктов распада собственных тканей, способствует поступлению в очаг воспаления лейкоцитов и других форменных элементов крови, антител и биологически активных веществ. В экссудате содержатся активные ферменты, которые высвобождаются из погибших лейкоцитов и лизосом клеток. Их действие направлено на уничтожение микробов, расплавление остатков погибших клеток и тканей. В экссудате находятся активные белки и полипептиды, стимулирующие пролиферацию клеток и восстановление тканей на заключительном этапе воспаления. Вместе с тем экссудат может сдавливать нервные стволы и вызывать боль, нарушать функцию органов и вызывать в них патологические изменения.
Экссудация сопровождается эмиграцией лейкоцитов и других форменных элементов крови, т.е. их переходом из сосудистого русла в ткань. Эмиграция лейкоцитов включает период краевого стояния у стенки сосуда, прохождения через стенку и период движения в ткани. Прохождение лейкоцитов через стенку сосуда осуществляется следующим образом. Эндотелиоциты сосуда сокращаются, и в образовавшуюся межэндотелиальную щель лейкоцит выбрасывает часть цитоплазмы - псевдоподию. Затем в псевдоподию переливается вся цитоплазма, и лейкоцит оказывается под эндотелиоцитом. Преодолев базальную мембрану, он выходит за пределы сосуда и движется к центру очага воспаления. Таким образом проходят через сосудистую стенку гранулоциты (нейтрофилы, эозинофилы, базофилы), а также эритроциты. Моноциты и лимфоциты эмигрируют из сосуда другим путем, проходя непосредственно через эндотелиальную клетку. Движению лейкоцитов к центру очага воспаления способствует их отрицательный заряд, в то время как в воспаленных тканях накапливаются положительно заряженные Н - ионы.
И.И. Мечников разработал представление о хемотаксисе лейкоцитов, т.е. их движении, обусловленным химическим раздражением. В соответствии с этим представлением лейкоцит не пассивно привлекается внешними силами - движением жидкости, разностью зарядов, а воспринимает разнообразные химические раздражения и активно реагирует на них перемещением по градиенту концентрации появляющихся в очаге воспаления веществ. В настоящее время известно много соединений, вызывающих хемотаксис лейкоцитов.
Фагоцитоз протекает в четыре стадии:
1) приближение к объекту,
2) прилипание объекта к оболочке фагоцита,
3) погружение объекта в фагоцит,
4) внутриклеточное переваривание фагоцитированного объекта. В цитоплазме фагоцита вокруг объекта фагоцитоза образуется вакуоль - фагосома. К ней приближается лизосома фагоцита, фагосома и лизосома сливаются, образуя фаголизосому, внутри которой лизосомные ферменты переваривают фагоцитированный объект.
Существует завершенный и незавершенный фагоцитоз. В первом случае объект фагоцитоза полностью уничтожается. При незавершенном фагоцитозе вследствие целого ряда причин фагоцитированный микроорганизм не уничтожается. Более того, в фагоците он находит хорошую среду обитания и размножается. В результате фагоцит гибнет и микроорганизмы разносятся кровью и лимфой. Такая недостаточность фагоцитоза может быть наследственной и приобретенной. Наследственная недостаточность фагоцитоза возникает при нарушении созревания фагоцитов, а также при угнетении образования их ферментов. Приобретенная недостаточность фагоцитоза может возникать при лучевой болезни, белковом голодании, в старческом возрасте, при длительном лечении стероидными гормонами, угнетающими фагоцитоз, и ряде других причин.
Пролиферация - процесс размножения клеток, является завершающей стадией воспаления. Размножаются клетки мезенхимы, сосудов, крови - лимфоциты и моноциты. Особенно активно пролиферируют фибробласты, которые служат источником белка коллагена, формирующего соединительную ткань. В результате клеточной пролиферации на месте очага воспаления либо восстанавливается ткань аналогичная разрушенной, либо вначале образуется молодая грануляционная ткань, которая, созревая, превращается в волокнистую зрелую соединительную ткань, формируя рубец. Он может не оказывать влияния на функцию органа, но в некоторых случаях становится причиной других патологических процессов. Так, рубец в пилорическом отделе желудка, образовавшийся на месте зажившей язвы, может препятствовать эвакуации пищевой массы. Рубец в тканях конечности может раздражать нервные окончания и вызывать боль, нарушать функцию сустава или мышцы. Иногда приходится удалять рубец хирургическим путем.
Таким образом, исходом воспаления является либо полное восстановление поврежденной ткани, либо образование на ее месте рубца.
4 Местные и общие проявления воспаления
Местные проявления воспаления позволили еще Галену и Цельсу (II век нашей эры) выделить 5 главных характерных его признаков: покраснение, жар, припухлость, боль и нарушение функции. Покраснение связано с развитием артериальной гиперемии. Увеличение притока артериальной крови, содержащей оксигемоглобин ярко-красного цвета, вызывает покраснение кожи. Артериальная гиперемия формирует и второй признак воспаления - жар (местное повышение температуры). Припухлость возникает вследствие скопления в воспалительных тканях экссудата. Типичным признаком воспаления является боль. Она возникает в связи с усиленным образованием в очаге воспаления медиаторов боли - в первую очередь гистамина, кининов, а также некоторых метаболитов (молочная кислота), ионов Н, К.
Имеет значение и отек, при котором сдавливаются болевые рецепторы и проводящие нервные пути. Нарушение функции воспаленного органа связано с патологическими изменениями в нем метаболизма, кровообращения, нервной регуляции.
Важную роль в нарушении функции органа при воспалении играет боль. Так, например, при воспалении мышц и суставов человек сознательно ограничивает движения, избегая боли.
Общие проявления воспаления , как правило носят защитно-приспособительный характер. Типичным общим признаком большинства воспалительных процессов является увеличение числа лейкоцитов в единице объема периферической крови - лейкоцитоз и изменение лейкоцитарной формулы. Вместе с тем известны воспалительные процессы, сопровождающие инфекционные заболевания (брюшной тиф), при которых количество лейкоцитов в периферической крови уменьшается.
Часто при воспалении возникает лихорадка. Она развивается под влиянием пирогенов, которые образуются нейтрофильными лейкоцитами. При воспалении изменяется белковый состав крови. Острое воспаление обычно сопровождается увеличением в плазме крови уровня - и - глобулинов, а хроническое воспаление - глобулинов. Лейкоцитоз, лихорадка и накопление в крови - глобулинов имеют важное приспособительное значение. Лейкоциты фагоцитируют и уничтожают микроорганизмы. Повышение температуры во время лихорадки вызывает различные приспособительные эффекты, в том числе повышает активность лейкоцитов, усиливает выработку иммунных - глобулинов, содержащих антитела. Вследствие изменения состава белковых фракций плазмы крови (снижение альбуминов и увеличение глобулинов), а также уменьшения заряда эритроцитов при воспалении увеличивается скорость оседания эритроцитов (СОЭ). Общие изменения в организме могут проявляться также головной болью, слабостью, недомоганием и другими симптомами.
Список использованной литературы
1. Пауков В.С., Хитров Н.К. Патология: учебник. - М.: Медицина, 1989.
2. Левченко В.А., Середюк Н.М., Вакалюк И.П., Малиновская О. И., Мудрак М.В., Коваль Н.М. Внутренние болезни: учебник. - Львов.: Издательство "Свет", 1995.
3. Черенько М.П. Справочник хирурга поликлиники: - К.: "Здоровья", 1990.


