23.09.2018
Βασικές ιδιότητες υδροξειδίου του σιδήρου 3. Αναγωγικές ιδιότητες
Δεδομένου ότι το Fe2+ οξειδώνεται εύκολα σε Fe+3:
Fe+2 – 1e = Fe+3
Έτσι, ένα πρόσφατα ληφθέν πρασινωπό ίζημα Fe(OH)2 στον αέρα αλλάζει πολύ γρήγορα χρώμα - γίνεται καφέ. Η αλλαγή χρώματος εξηγείται από την οξείδωση του Fe(OH)2 σε Fe(OH)3 από το ατμοσφαιρικό οξυγόνο:
4Fe+2(OH)2 + O2 + 2H2O = 4Fe+3(OH)3.
Αποκαταστατικές ιδιότητεςΤα άλατα δισθενούς σιδήρου παρουσιάζουν επίσης αυτό το αποτέλεσμα, ειδικά όταν εκτίθενται σε οξειδωτικά μέσα σε όξινο περιβάλλον. Για παράδειγμα, ο θειικός σίδηρος (II) μειώνει το υπερμαγγανικό κάλιο σε ένα μέσο θειικού οξέος σε θειικό μαγγάνιο (II):
Υπάρχουν πολλοί άλλοι τρόποι για να σταματήσετε ή να επιβραδύνετε τη σκουριά. Ένας τρόπος για να προστατεύσετε την επιφάνεια του σιδήρου είναι να την επικαλύψετε με ένα μέταλλο που δεν διαβρώνεται, όπως το χρώμιο. Ήταν επικαλυμμένα με ένα στρώμα χρωμίου για την προστασία της επιφάνειας του σιδήρου από την επαφή με τον αέρα.

Ρωτήστε τους μαθητές γιατί πιστεύουν ότι αυτό είναι ιδιαίτερα σημαντικό για τις βρύσες μπάνιου και πισίνας, οι οποίες πρέπει να προστατεύονται από τη σκουριά. Αυτό συμβαίνει επειδή βρίσκονται σε υγρό, υγρό περιβάλλον και το νερό κάνει το σίδερο πιο ευαίσθητο στη σκουριά. Ο ψευδάργυρος αντιδρά επίσης με το οξυγόνο για να σχηματίσει οξείδιο του ψευδαργύρου.
10Fe+2SO4 + 2KMn+7O4 + 8H2SO4 = 5Fe+32(SO4)3 + 2Mn+2SO4 + K2SO4 + 8H2O.
Ποιοτική αντίδραση σε κατιόν σιδήρου (II).
Το αντιδραστήριο για τον προσδιορισμό του κατιόντος σιδήρου Fe2+ είναι το εξακυανο(III) φερρατικό κάλιο (κόκκινο άλας αίματος) Κ3:
3FeSO4 + 2K3 = Fe32¯ + 3K2SO4.
Όταν 3-ιόντα αλληλεπιδρούν με κατιόντα σιδήρου Fe2+, σχηματίζεται ένα σκούρο μπλε ίζημα - Μπλε Turnbull:
3Fe2+ +23- = Fe32¯
Ο ψευδάργυρος είναι σε μια άλλη ομάδα για σιδέρωμα περιοδικός πίνακας. Αυτό υποδηλώνει ότι δεν αντιδρά με τον ίδιο τρόπο όπως ο σίδηρος με το οξυγόνο. Το οξείδιο του ψευδαργύρου δεν είναι πορώδες οξείδιο, αλλά σχηματίζει ένα πυκνό προστατευτικό στρώμα που δεν μπορεί να διεισδύσει από το οξυγόνο ή το νερό. Ο σίδηρος μπορεί να επικαλυφθεί με ένα λεπτό στρώμα ψευδαργύρου σε μια διαδικασία που ονομάζεται γαλβανισμός. Το στρώμα ψευδαργύρου αντιδρά γρήγορα με το οξυγόνο για να σχηματίσει οξείδιο του ψευδαργύρου. Αυτό το στρώμα προστατεύει τον ψευδάργυρο από κάτω από περαιτέρω οξείδωση. Προστατεύει επίσης τον σίδηρο κάτω από τον ψευδάργυρο από την επαφή με το οξυγόνο.
Ενώσεις σιδήρου (III).
Οξείδιο σιδήρου (III) Fe2O3– καφέ σκόνη, αδιάλυτη στο νερό. Το οξείδιο του σιδήρου (III) λαμβάνεται:
Α) αποσύνθεση υδροξειδίου του σιδήρου (III):
2Fe(OH)3 = Fe2O3 + 3H2O
Β) οξείδωση πυρίτη (FeS2):
4Fe+2S2-1 + 11O20 = 2Fe2+3O3 + 8S+4O2-2.
Fe+2 – 1e ® Fe+3
Το παρακάτω διάγραμμα δείχνει ένα τμήμα από γαλβανισμένο χάλυβα με μια γρατσουνιά στην προστατευτική επίστρωση. Τι πιστεύετε ότι θα συμβεί με τον χάλυβα που είναι εκτεθειμένος σε γρατσουνιές αέρα στην επίστρωση; Ο εκτεθειμένος χάλυβας θα σκουριάσει με την πάροδο του χρόνου. 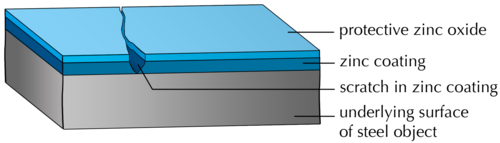
Ο σίδηρος, γαλβανισμένος, χρησιμοποιείται για διάφορους σκοπούς. Πιθανότατα, το έχετε δει να χρησιμοποιείται ως γαλβανισμένα πάνελ στέγης ή άλλα γαλβανισμένα οικοδομικά υλικά όπως βίδες, καρφιά, σωλήνες ή δάπεδα.
2S-1 – 10e ® 2S+4
O20 + 4e ® 2O-2 11e
Το οξείδιο του σιδήρου (III) παρουσιάζει αμφοτερικές ιδιότητες:
Α) αλληλεπιδρά με στερεά αλκάλια NaOH και ΚΟΗ και με ανθρακικό νάτριο και κάλιο σε υψηλή θερμοκρασία:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O,
Fe2O3 + 2OH- = 2FeO2- + H2O,
Fe2O3 + Na2CO3 = 2NaFeO2 + CO2.
Φερρίτης νατρίου
Υδροξείδιο σιδήρου (III).που λαμβάνονται από άλατα σιδήρου (III) με αντίδραση με αλκάλια:
Σχηματισμός σκουριάς και τρόποι πρόληψης. 



Σε αυτό το κεφάλαιο, μάθαμε πώς σχηματίζονται τα οξείδια μετάλλων. Είδαμε δύο επιδείξεις αντιδράσεων στις οποίες σχηματίστηκαν μέταλλα ως προϊόντα. Τέλος, μάθαμε για το οξείδιο του μετάλλου από τις καθημερινές μας εμπειρίες, καθώς και τρόπους πρόληψης της σκουριάς, ειδικά αυτών που χρησιμοποιούνται σε κτίρια και βιομηχανία.
FeCl3 + 3NaOH = Fe(OH)3¯ + 3NaCl,
Fe3+ + 3OH- = Fe(OH)3¯.
Το υδροξείδιο του σιδήρου (III) είναι ασθενέστερη βάση από το Fe(OH)2 και εμφανίζει αμφοτερικές ιδιότητες (με υπεροχή των βασικών). Όταν αλληλεπιδρά με αραιά οξέα, το Fe(OH)3 σχηματίζει εύκολα τα αντίστοιχα άλατα:
Fe(OH)3 + 3HCl « FeCl3 + H2O
2Fe(OH)3 + 3H2SO4 « Fe2(SO4)3 + 6H2O
Fe(OH)3 + 3H+ « Fe3+ + 3H2O
Αντιδράσεις με συμπυκνωμένα διαλύματα αλκαλίων συμβαίνουν μόνο με παρατεταμένη θέρμανση. Σε αυτή την περίπτωση, λαμβάνονται σταθερά υδροσύμπλεγμα με αριθμό συντονισμού 4 ή 6:
Κόψτε τα κομμάτια μήλου γίνονται καφέ επειδή οι ενώσεις σιδήρου στον πολτό του μήλου αντιδρούν με το οξυγόνο του αέρα! Την αντίδραση βοηθά ένα ένζυμο στο μήλο, άρα στάζει χυμό λεμονιούσε κομμάτια διασπά το ένζυμο και το εμποδίζει να μαυρίσει.
Γιατί τα μήλα γίνονται καφέ;
- Όταν ένα μέταλλο αντιδρά με το οξυγόνο, σχηματίζεται ένα οξείδιο μετάλλου.
- Η γενική εξίσωση αυτής της αντίδρασης είναι: οξυγόνο μετάλλου → οξείδιο μετάλλου.
- Ορισμένα μέταλλα θα αντιδράσουν με το οξυγόνο όταν καούν.
- Αυτές οι αντιδράσεις ονομάζονται αντιδράσεις καύσης.
Fe(OH)3 + NaOH = Na,
Fe(OH)3 + OH- = -,
Fe(OH)3 + 3NaOH = Na3,
Fe(OH)3 + 3OH- = 3-.
Οι ενώσεις με κατάσταση οξείδωσης του σιδήρου +3 παρουσιάζουν οξειδωτικές ιδιότητες, αφού υπό την επίδραση αναγωγικών παραγόντων το Fe+3 μετατρέπεται σε Fe+2:
Fe+3 + 1e = Fe+2.
Για παράδειγμα, ο χλωριούχος σίδηρος (III) οξειδώνει το ιωδιούχο κάλιο σε ελεύθερο ιώδιο:
2Fe+3Cl3 + 2KI = 2Fe+2Cl2 + 2KCl + I20
Ποιοτικές αντιδράσεις σε κατιόν σιδήρου (III).
Συμπληρώστε τον πίνακα παρέχοντας τις εξισώσεις που λείπουν για την αντίδραση μεταξύ ψευδαργύρου και οξυγόνου. Το οξείδιο του ασβεστίου αντιδρά με το νερό σχηματίζοντας υδροξείδιο του ασβεστίου. Ο ασβεστόλιθος και τα προϊόντα του έχουν πολλές χρήσεις, μεταξύ άλλων για τσιμέντο, κονίαμα και σκυρόδεμα.
Όταν θερμαίνεται έντονα, το ανθρακικό ασβέστιο καταστρέφεται. Αυτή η αντίδραση ονομάζεται θερμική αποσύνθεση. Εδώ είναι οι εξισώσεις για τη θερμική αποσύνθεση του ανθρακικού ασβεστίου. Διοξείδιο του ασβεστίου ανθρακικό ασβέστιο. Άλλα ανθρακικά μέταλλα αποσυντίθενται με τον ίδιο τρόπο, συμπεριλαμβανομένων.
Ανθρακικό ανθρακικό ανθρακικό ανθρακικό νάτριο. . Για παράδειγμα, εδώ είναι οι εξισώσεις για τη θερμική αποσύνθεση του ανθρακικού χαλκού. Διοξείδιο του άνθρακα του καρβοξυλικού οξέος. Τα μέταλλα ψηλά στη σειρά αντιδράσεων έχουν ανθρακικά άλατα, τα οποία απαιτούν πολλή ενέργεια για να αποσυντεθούν: εάν μια ουσία αποσυντεθεί, διασπάται σε απλούστερες ενώσεις ή στοιχεία. τους. Πράγματι, δεν αποσυντίθενται όλα τα ανθρακικά μετάλλων της Ομάδας 1 στις θερμοκρασίες που επιτυγχάνει ένας καυστήρας Bunsen.
Α) Το αντιδραστήριο για την ανίχνευση του κατιόντος Fe3+ είναι το εξακυανο(ΙΙ) φερρατικό κάλιο (κίτρινο άλας αίματος) Κ2.
Όταν 4-ιόντα αλληλεπιδρούν με ιόντα Fe3+, σχηματίζεται ένα σκούρο μπλε ίζημα - κυανούν χρώμα:
4FeCl3 + 3K4 « Fe43¯ +12KCl,
4Fe3+ + 34- = Fe43¯.
Β) Τα κατιόντα Fe3+ ανιχνεύονται εύκολα χρησιμοποιώντας θειοκυανικό αμμώνιο (NH4CNS). Ως αποτέλεσμα της αλληλεπίδρασης των ιόντων CNS-1 με τα κατιόντα σιδήρου (III) Fe3+, σχηματίζεται θειοκυανικός σίδηρος χαμηλής διάστασης (III) με κόκκινο χρώμα:
Μέταλλα χαμηλά στη σειρά αντιδραστικότητας, όπως ο χαλκός, έχουν ανθρακικά άλατα που αποσυντίθενται εύκολα. Αυτός είναι ο λόγος για τον οποίο ο ανθρακικός χαλκός χρησιμοποιείται συχνά στα σχολεία για να παρουσιάσει θερμική αποσύνθεση. Αποσυντίθεται εύκολα και η αλλαγή του χρώματός του, από πράσινο ανθρακικό χαλκό σε μαύρο οξείδιο του χαλκού, είναι εύκολα ορατή.
Νερό πηγής που περιέχει σίδηρο από το Königsbrunnen. Στομαχικό νερό της Επισκοπής του Αγίου Ιωάννη. Καθίζηση υδροξειδίου του σιδήρου από διάλυμα θειικού αμμωνίου με μερική οξείδωση σε υδροξείδιο του σιδήρου από ατμοσφαιρικό οξυγόνο. Επιπλέον, το υδροξείδιο του σιδήρου ανήκει στην ομάδα των υδροξειδίων του σιδήρου, αλλά είναι πολύ ασταθές και οξειδώνεται γρήγορα σε υδροξείδιο του σιδήρου παρουσία οξυγόνου.
FeCl3 + 3NH4CNS « Fe(CNS)3 + 3NH4Cl,
Fe3+ + 3CNS1- « Fe(CNS)3.
Εφαρμογή και βιολογικός ρόλος του σιδήρου και των ενώσεων του.
Τα σημαντικότερα κράματα σιδήρου - ο χυτοσίδηρος και ο χάλυβας - είναι τα κύρια δομικά υλικά σε όλους σχεδόν τους κλάδους της σύγχρονης παραγωγής.
Το χλωριούχο σίδηρο (III) FeCl3 χρησιμοποιείται για τον καθαρισμό του νερού. ΣΕ οργανική σύνθεσηΤο FeCl3 χρησιμοποιείται ως καταλύτης. Ο νιτρικός σίδηρος Fe(NO3)3 9H2O χρησιμοποιείται για τη βαφή υφασμάτων.
Το υδροξείδιο του σιδήρου λαμβάνεται με καθίζηση ενός διαλύματος χλωριούχου σιδήρου με αλκάλια, κατά προτίμηση με περίσσεια αμμωνίας. Κρυσταλλώνεται όταν καταψύχεται, και επίσης όταν αποθηκεύεται κάτω από το νερό για πολύ μεγάλες περιόδους και μετατρέπεται εύκολα σε υδατοδιαλυτές ενώσεις. Το αντίδοτο αρσενίκιο, που χρησιμοποιείται για δηλητηρίαση από αρσενικό, περιέχει επίσης υδροξείδιο του σιδήρου ως ενεργό συστατικό.
Ένα άλλο προηγουμένως επίσημο υδροξείδιο του σιδήρου είναι οι ίνες σιδήρου. Το ένυδρο οξείδιο του σιδήρου σχηματίζεται όταν ο σίδηρος αρχίζει να σκουριάζει σε υγρό άνθρακα ή σε αέρα που περιέχει διοξείδιο του θείου. Λόγω της παρουσίας μικρών ποσοτήτων διοξειδίου του άνθρακα, ο σίδηρος οξειδώνεται, ενώ σε κάθε περίπτωση καθαρό νερόή ξηρός αέρας δεν προκαλεί καμία αντίδραση. Το υδροξείδιο του σιδήρου είναι σκούρο καφέ, αδιάλυτο στο νερό, εύκολα διαλυτό σε οξέα και αποσυντίθεται όταν θερμαίνεται σε νερό και οξείδιο του σιδήρου. Μεταφέρει εύκολα το οξυγόνο του σε οξειδωτικά σώματα και μετατρέπεται σε οξείδιο του σιδήρου, το οποίο απορροφά έντονα το οξυγόνο από τον αέρα.
Ο σίδηρος είναι ένα από τα απαραίτητα μικροστοιχείαστο σώμα των ανθρώπων και των ζώων (το σώμα ενός ενήλικα περιέχει περίπου 4 g Fe με τη μορφή ενώσεων). Είναι μέρος της αιμοσφαιρίνης, της μυοσφαιρίνης, διαφόρων ενζύμων και άλλων σύνθετων συμπλεγμάτων σιδήρου-πρωτεΐνης που βρίσκονται στο ήπαρ και τη σπλήνα. Ο σίδηρος διεγείρει τη λειτουργία των αιμοποιητικών οργάνων.
Ως εκ τούτου, δρα ως παράγοντας σήψης και καταστρέφει τις περιστρεφόμενες ουσίες που περιέχονται στα υγρά. Το ξύλο μπορεί επίσης να προσβληθεί από πράγματα όπως σκουριασμένα καρφιά. Το υδροξείδιο του σιδήρου απορροφά τα ενεργειακά αέρια και επομένως έχει ευεργετική επίδραση στο έδαφος. όταν συνδυάζεται με ίνες και μερικές βαφές, χρησιμεύει ως λεκές για τη βαφή.
Υλικά που αποτελούν κράματα Zama. Ο ψευδάργυρος είναι ένα γαλαζωπό λευκό μέταλλο που δεν αλλάζει στον αέρα και μπορεί να γυαλιστεί. Μόνιμος σε κρύο, ξηρό αέρα, ο υγρός αέρας επικαλύπτεται με ένα ελαφρύ στρώμα διττανθρακικού, το οποίο τον κάνει πιο σκούρο και τον προστατεύει από βαθύτερη οξείδωση. Ο κοινός ψευδάργυρος προσκολλάται εύκολα, λόγω των ακαθαρσιών που περιέχει, από αραιά οξέα, για να σχηματίσει ένα άλας υδρογόνου και ψευδαργύρου. από ευγενή μέταλλα όπως χαλκός, μόλυβδος, ασήμι κ.λπ. εκτίθενται σε θερμά διαλύματα αλκαλικών υδροξειδίων παρέχοντας γαλβανισμένο διαλυτό και υδρογόνο.
Λίστα χρησιμοποιημένης βιβλιογραφίας:
1. «Χημεία. Επίδομα καθηγητή». Ροστόφ-ον-Ντον. "Φοίνιξ". 1997
2. «Εγχειρίδιο για υποψήφιους στα πανεπιστήμια». Μόσχα. "Γυμνάσιο", 1995.
3. Ε.Τ. Oganesyan. "Οδηγός χημείας για υποψήφιους πανεπιστημίου." Μόσχα. 1994
Η ανόργανη ένωση υδροξείδιο του σιδήρου 3 έχει τον χημικό τύπο Fe(OH)2. Ανήκει σε μια σειρά από αμφοτερικές ενώσεις στις οποίες κυριαρχούν οι ιδιότητες που χαρακτηρίζουν τις βάσεις. Αυτή η ουσία φαίνεται να είναι κρύσταλλοι λευκό, που σταδιακά σκουραίνουν όταν μένουν στην ύπαιθρο για αρκετή ώρα. Υπάρχουν επιλογές για κρύσταλλα με πρασινωπή απόχρωση. Στην καθημερινή ζωή, ο καθένας μπορεί να παρατηρήσει την ουσία με τη μορφή πρασινωπής επικάλυψης σε μεταλλικές επιφάνειες, που υποδηλώνει την έναρξη της διαδικασίας σκουριάς - το υδροξείδιο του σιδήρου 3 ενεργεί ως ένα από τα ενδιάμεσα στάδια αυτής της διαδικασίας.
Αυτή η λευκή σκόνη, που χρησιμοποιείται στο όνομα του λευκού ή λευκού χιονιού ψευδάργυρου, δεν είναι τοξική και δεν είναι μαύρη σε επαφή με το υδρόθειο. Η κρυσταλλική ποικιλία φωσφορίζεται πριν από το φως ή παρουσία ραδιενεργών ουσιών. Τα άλατα ψευδαργύρου είναι άχρωμα ή λευκά.
Τα διαλύματά τους παρέχουν ένα αλκαλικό ίζημα λευκού υδροξειδίου, διαλυτό σε περίσσεια του αντιδραστηρίου. Το θειούχο αμμώνιο σχηματίζει ένα λευκό ίζημα θειούχου. άνθρακες ψευδάργυρου - κακοσμίαυγρά, φουσκάλες? συνήθως εύφλεκτο στον αέρα και μπορεί να υποστεί επεξεργασία μόνο κάτω από ρεύμα αδρανούς αερίου όπως το άζωτο. Λαμβάνονται με αντίδραση ψευδαργύρου, καθαρού ή κράματος, με αλκυλοϊωδίδιο.
Στη φύση, η ένωση βρίσκεται με τη μορφή αμακινίτη. Αυτό το κρυσταλλικό ορυκτό, εκτός από τον ίδιο τον σίδηρο, περιέχει επίσης ακαθαρσίες μαγνησίου και μαγγανίου, όλες αυτές οι ουσίες δίνουν στον αμακινίτη διαφορετικές αποχρώσεις - από κίτρινο-πράσινο έως ανοιχτό πράσινο, ανάλογα με το ποσοστό ενός συγκεκριμένου στοιχείου. Η σκληρότητα του ορυκτού είναι 3,5-4 μονάδες στην κλίμακα Mohs και η πυκνότητα είναι περίπου 3 g/cm³.
Η ιολοειδής αλκυλοσίνη, η οποία σχηματίζεται ως ενδιάμεσο, αποσυντίθεται με την αύξηση της θερμοκρασίας σε ψευδάργυρο κατά τη διαδικασία σχηματισμού ιωδιούχου ψευδαργύρου. Φαίνεται ότι ο ψευδάργυρος είναι γνωστός στην Κίνα από την αρχαιότητα. Στην Ευρώπη, κράματα ψευδαργύρου με χαλκό χρησιμοποιήθηκαν την πρώτη χιλιετία π.Χ. Κατά την εξαγωγή μετάλλου, χρησιμοποιούνται δύο ομάδες ορυκτών. Δεδομένου ότι τα ορυκτά ψευδαργύρου συνήθως συνδέονται με ορυκτά μολύβδου, η προ-συγκέντρωση του ορυκτού πρέπει να επιτυγχάνεται με μαγνητικό διαχωρισμό και επίπλευση. Για να διευκολυνθεί ο διαχωρισμός των χρήσιμων εξαρτημάτων από τα αποστειρωμένα, προσθέστε αραιό θειικό λάδι ή θειικό οξύ, προσθέτοντας ένα ορυκτό επιφάνειας προκαλεί την απελευθέρωση αερίου, η οποία προάγει την επίπλευση.
ΝΑ φυσικές ιδιότητεςΗ ουσία θα πρέπει επίσης να αποδοθεί στην εξαιρετικά χαμηλή διαλυτότητά της. Όταν το υδροξείδιο του σιδήρου 3 θερμαίνεται, αποσυντίθεται.
Αυτή η ουσία είναι πολύ δραστική και αλληλεπιδρά με πολλές άλλες ουσίες και ενώσεις. Για παράδειγμα, έχοντας τις ιδιότητες μιας βάσης, αλληλεπιδρά με διάφορα οξέα. Συγκεκριμένα, το θειικό οξύ και το υδροξείδιο του σιδήρου 3 κατά την αντίδραση οδηγούν στην παραγωγή του (III). Δεδομένου ότι αυτή η αντίδραση μπορεί να συμβεί με συμβατική φρύξη σε ανοιχτό αέρα, αυτό το φθηνό θειικό άλας χρησιμοποιείται τόσο σε εργαστηριακό όσο και σε βιομηχανικό περιβάλλον.
Ανάλογα με τις χώρες και τη σύνθεση των ορυκτών ακολουθούνται δύο διαφορετικές διαδικασίες εξόρυξης. Η επόμενη φάση έχει ως αποτέλεσμα το σχηματισμό μετάλλου για τη μείωση του μονοξειδίου του άνθρακα. Η εργασία πρέπει να εκτελείται σε θερμοκρασία υψηλότερη από το σημείο βρασμού του ψευδαργύρου για να διαχωριστεί το μέταλλο από τις ακαθαρσίες με απόσταξη. Μέρος από τον ψευδάργυρο που θα είχε χαθεί στις παραβολές ανακτάται κατά τη διακοπή λειτουργίας. Το μέταλλο που λαμβάνεται με αυτόν τον τρόπο περιέχει κάδμιο, μόλυβδο, χαλκό και σίδηρο ως τις κύριες ακαθαρσίες.
Το καθαρισμένο διάλυμα υποβάλλεται σε ηλεκτρόλυση με μια αδιάλυτη άνοδο μολύβδου και μια κάθοδο που αποτελείται από ένα φύλλο αλουμινίου. Στη συνέχεια, ο ηλεκτρολυτικός ψευδάργυρος διαχωρίζεται από το υπόστρωμα αλουμινίου και αποστραγγίζεται σε κλίβανο με αντήχηση. Το έντομο της αμετάβλητότητάς του στον αέρα ψευδάργυρου χρησιμοποιείται σε φύλλα ή φύλλα για την κάλυψη στέγης, σε κατάσταση φύλλων ή φύλλων χρησιμοποιείται επίσης σε γραφικά και ξηρές μπαταρίες. Διάφορα αντικείμενα που στη συνέχεια επιμεταλλώνονται με ένα ειδικό κράμα που τους δίνει την όψη της τέχνης του μπρούτζου.
Κατά τη διάρκεια της αντίδρασης, το αποτέλεσμα είναι ο σχηματισμός χλωριούχου σιδήρου (II).
Σε ορισμένες περιπτώσεις, το υδροξείδιο του σιδήρου 3 μπορεί επίσης να παρουσιάζει όξινες ιδιότητες. Για παράδειγμα, όταν αλληλεπιδρά με ένα εξαιρετικά συμπυκνωμένο (η συγκέντρωση πρέπει να είναι τουλάχιστον 50%) διάλυμα υδροξειδίου του νατρίου, λαμβάνεται τετραϋδροξοφερικό νάτριο (II), το οποίο καθιζάνει. Είναι αλήθεια ότι για να συμβεί μια τέτοια αντίδραση, είναι απαραίτητο να παρασχεθούν μάλλον πολύπλοκες συνθήκες: η αντίδραση πρέπει να συμβεί υπό συνθήκες βρασμού διαλύματος σε ατμοσφαιρικό περιβάλλον αζώτου.
Ο ψευδάργυρος έχει αποτελεσματική προστατευτική επίδραση στον σίδηρο και τον χάλυβα που εκτίθενται σε ορισμένα περιβάλλοντα, όπως το νερό, ο ατμός, οι οργανικές ουσίες, το βενζόλιο ή οι χλωριωμένοι διαλύτες. Αυτή η προστασία παρέχεται από διάφορες διαδικασίες.
Το Lozinko είναι μέρος πολλών κραμάτων χαλκού: ορείχαλκος, ειδικός ορείχαλκος. Ο ψευδάργυρος είναι το κύριο συστατικό των κραμάτων Zama. Έρευνα του Γερμανού χημικού Friedrich Wörler κατέστησε δυνατή τη μέτρηση της σχετικής πυκνότητάς του, τονίζοντας την ιδιαίτερη ελαφρότητα του μετάλλου. Η διαδικασία Hall-Jorul εξακολουθεί να είναι η κύρια μέθοδος που χρησιμοποιείται για την παραγωγή αλουμινίου, αν και νέες μέθοδοι μελετώνται ακόμη. Το μέταλλο που έρχεται σε επαφή με τον αέρα καλύπτεται γρήγορα με ένα διαφανές και εξαιρετικά ανθεκτικό πέπλο οξειδίου, το οποίο προστατεύει την επιφάνεια από τις επιδράσεις επιθετικών ουσιών και τη βαθιά οξείδωση.
Όπως αναφέρθηκε ήδη, όταν θερμαίνεται, η ουσία αποσυντίθεται. Το αποτέλεσμα αυτής της αποσύνθεσης είναι το (II) και, επιπλέον, ο μεταλλικός σίδηρος και τα παράγωγά του λαμβάνονται με τη μορφή ακαθαρσιών: οξείδιο του δισιδήρου (III), χημικός τύποςπου Fe3O4.
Πώς να παραχθεί το υδροξείδιο του σιδήρου 3, η παραγωγή του οποίου συνδέεται με την ικανότητά του να αντιδρά με οξέα; Πριν ξεκινήσετε το πείραμα, θα πρέπει να θυμάστε τους κανόνες ασφαλείας κατά τη διεξαγωγή τέτοιων πειραμάτων. Αυτοί οι κανόνες ισχύουν για όλες τις περιπτώσεις χειρισμού διαλυμάτων οξέος-βάσης. Το κύριο πράγμα εδώ είναι να παρέχετε αξιόπιστη προστασία και να αποφύγετε την επαφή σταγόνων διαλυμάτων με τους βλεννογόνους και το δέρμα.
Έτσι, το υδροξείδιο μπορεί να ληφθεί μέσω μιας αντίδρασης στην οποία αντιδρούν χλωριούχος σίδηρος (III) και ΚΟΗ - υδροξείδιο του καλίου. Αυτή η μέθοδος- το πιο συνηθισμένο για το σχηματισμό αδιάλυτων βάσεων. Όταν αυτές οι ουσίες αλληλεπιδρούν, εμφανίζεται μια φυσιολογική αντίδραση ανταλλαγής, με αποτέλεσμα ένα καφέ ίζημα. Αυτό το ίζημα είναι η ουσία που αναζητούμε.
Η χρήση του υδροξειδίου του σιδήρου στη βιομηχανική παραγωγή είναι αρκετά διαδεδομένη. Η πιο συνηθισμένη είναι η χρήση του ως δραστική ουσία σε μπαταρίες σιδήρου-νικελίου. Επιπλέον, η ένωση χρησιμοποιείται στη μεταλλουργία για την παραγωγή διαφόρων κραμάτων μετάλλων, καθώς και στην ηλεκτρολυτική επιμετάλλωση και την κατασκευή αυτοκινήτων.


