27.03.2018
Periyodik tablodaki demir
ALT GRUPLARA AİT METALLER
Geçiş elementlerinin özellikleri - periyodik tablodaki konumlarına göre bakır, krom, demir kimyasal elementler DI. Mendeleev ve atomlarının yapısal özellikleri.
Geçiş elemanı terimi genellikle d veya f elemanlarından herhangi birini belirtmek için kullanılır. Bu elementler, elektropozitif s-elementler ve elektronegatif p-elementler arasında geçiş pozisyonunda bulunur. d-Elementler sırasıyla 4., 5. ve 6. periyotlarda üç geçiş serisi oluşturur. İlk geçiş serisi skandiyumdan çinkoya kadar 10 element içerir. 3 boyutlu yörüngelerin iç konfigürasyonu ile karakterize edilir. Krom ve bakırın 4'lü yörüngelerinde yalnızca bir elektron bulunur. Gerçek şu ki yarı dolu veya dolu d-alt kabukları kısmen dolu olanlardan daha kararlıdır. Krom atomunun, 3 boyutlu alt kabuğu oluşturan beş 3 boyutlu yörüngenin her birinde bir elektronu vardır. Bu alt kabuk yarıya kadar doludur. Bir bakır atomunda, beş 3 boyutlu yörüngenin her biri bir çift elektron içerir (gümüşün anomalisi de benzer şekilde açıklanır). Tüm d elementleri metaldir. Çoğu karakteristik metalik parlaklığa sahiptir. S-metallerle karşılaştırıldığında mukavemetleri genellikle önemli ölçüde daha yüksektir. Özellikle aşağıdaki özelliklerle karakterize edilirler: yüksek gerilme mukavemeti; süneklik; dövülebilirlik (darbelerle tabakalar halinde düzleştirilebilirler). d-elementleri ve bunların bileşiklerinin bir dizi karakteristik özelliği vardır: değişken oksidasyon durumları; karmaşık iyonlar oluşturma yeteneği; renkli bileşiklerin oluşumu. d-Elementler ayrıca diğer metallere kıyasla daha yüksek yoğunlukla karakterize edilir. Bu, atomlarının nispeten küçük yarıçaplarıyla açıklanmaktadır. Bu metallerin atom yarıçapları bu seride çok az değişir. d-Elementler, özellikle atomları yarı dolu veya dolu d-kabuğa ek olarak yalnızca bir dış s-elektronuna sahip olanlar, iyi elektrik iletkenleridir. Örneğin bakır.
Kimyasal özellikler.
Birinci geçiş serisinin metallerinin elektronegatifliği kromdan çinkoya doğru artar. Bu, ilk geçiş sırasının elemanlarının metalik özelliklerinin belirtilen yönde kademeli olarak zayıfladığı anlamına gelir. Özelliklerindeki bu değişiklik, negatif değerlerden pozitif değerlere geçişle birlikte redoks potansiyellerinde tutarlı bir artışla da kendini gösterir.
Krom ve bileşiklerinin özellikleri
Krom- sert, mavimsi beyaz metal.ρ = 7,2 g/cm3, t erime = 1857 0 C CO: +1,+2,+3,+4,+5,+6Kimyasal özellikler.
- Normal koşullar altında krom yalnızca flor ile reaksiyona girer. Yüksek sıcaklıklarda (600 0 C'nin üzerinde) oksijen, halojenler, nitrojen, silikon, bor, kükürt, fosfor ile etkileşime girer.
4Cr + 3O2 2Cr203
2Cr + 3Cl2 2CrCl3
2Cr + 3S Cr 2 S 3
- Isıtıldığında su buharı ile reaksiyona girer:
2Cr + 3H20Cr203 + 3H2
- Krom, seyreltik güçlü asitlerde (HCl, H2S04) çözünür. Havanın yokluğunda Cr2+ tuzları, havada ise Cr3+ tuzları oluşur.
Cr + 2HCl → CrCl 2 + H 2 -
2Cr + 6HCl + O2 → 2CrCl3 + 2H20 + H2 -
- Metalin yüzeyinde koruyucu bir oksit filminin varlığı, soğuk konsantre asitlere - oksitleyici maddelere karşı pasifliğini açıklar. Ancak kuvvetli bir şekilde ısıtıldığında bu asitler kromu çözer:
2 Сr + 6 Н 2 SO 4 (kons.) Сr 2 (SO 4) 3 + 3 SO 2 + 6 Н 2 О
Cr + 6 HNO 3 (kons.) Cr(NO 3) 3 + 3 NO 2 + 3 H 2 O
Fiş.Krom bileşikleri
Krom bileşikleri
Krom oksit (II) CRO
Fiziki ozellikleri: parlak kırmızı veya kahverengimsi kırmızı renkte katı, suda çözünmeyen bir madde. Kimyasal özellikler. CrO ana oksittir.Fiş.
Cr203 + 3H222Cr + 3H20 Krom hidroksit (II) Cr(OH) 2 Fiziki ozellikleri: suda çözünmeyen katı sarı renk. Kimyasal özellikler. Cr(OH)2 zayıf bir bazdır.- Asitlerle etkileşime girer: Cr(OH) 2 + 2HCl → CrCl 2 + 2H 2 O Cr(OH) 3'te nem varlığında atmosferik oksijen tarafından kolayca oksitlenir:
4Cr(OH)2 + O2 + 2H2O → 4Cr(OH)3
- Isıtıldığında ayrışır:
- Alkalilerin Cr(II) tuzlarının çözeltileri üzerindeki etkisi: CrCl 2 + 2 NaOH = Cr(OH) 2 ↓ + 2 NaCl.
Üç değerlikli krom bileşikleri
Krom oksit (III) CR 2 Ö 3 Fiziki ozellikleri: koyu yeşil, refrakter madde, suda çözünmez. Kimyasal özellikler. Cr203 bir amfoterik oksittir.Sodyum kromit
- Şu tarihte: Yüksek sıcaklık hidrojen, kalsiyum ve karbon ile kroma indirgenir:
Cr203 + 3H222Cr + 3H20
Fiş.
Krom hidroksit (III) CR(AH) 3 Fiziki ozellikleri: suda çözünmeyen madde Yeşil renk. Kimyasal özellikler. Cr(OH)3 - amfoterik hidroksit2Cr(OH)3 + 3H2SO4 →Cr2(S04)3 + 6H2O
Cr(OH)3 + KOH → KCrO2 + 2H20
(potasyum kromit) Fiş.
- Alkaliler Cr3+ tuzlarına etki ettiğinde yeşil krom (III) hidroksitin jelatinimsi bir çökeltisi çöker:
Cr2 (S04) 3 + 6NaOH → 2 Cr(OH)3 ↓ + 3 Na2S04,
Altı değerlikli krom bileşikleri
Krom oksit (VI) CRO 3 Fiziki ozellikleri: koyu kırmızı katı, suda oldukça çözünür. Zehirli! Kimyasal özellikler. CrO3 asidik bir oksittir.- Alkalilerle reaksiyona girerek sarı kromat tuzları oluşturur:
CrO3 + 2KOH → K2CrO4 + H2O
- Suyla reaksiyona girerek asitler oluşturur: CrO 3 + H 2 O → H 2 CrO 4 kromik asit
- Termal olarak kararsız: 4 CrO 3 → 2Cr 2 O 3 + 3O 2
- H2S04'ün (kons.) etkisiyle potasyum kromattan (veya dikromattan) elde edilir.
K 2 CrO 4 + H 2 SO 4 → CrO 3 + K 2 SO 4 + H 2 O
K 2 Cr 2 Ö 7 + H 2 SO 4 → 2CrO 3 + K 2 SO 4 + H 2 O
Hidroksitlerkrom(VI)H 2 CRO 4 - kromasit, H 2 CR 2 Ö 7 - dikromasit Her iki asit de kararsızdır; onları saf formda izole etmeye çalışırken su ve krom (VI) okside ayrışırlar. Ancak tuzları oldukça stabildir. Kromik asit tuzlarına kromatlar denir, sarı renktedirler ve dikromik asit tuzlarına dikromatlar denir, turuncu renktedirler.Demir ve bileşikleri
Ütü - nispeten yumuşak, dövülebilir, gümüş renginde, sünek, mıknatıslanmış bir metal. T eriyik = 1539 0 C. ρ = 7,87 g/cm3. CO: +2 – zayıf oksitleyici maddelerle – oksijen ve halojenler hariç asit, tuz ve metal olmayan çözeltiler +3 – güçlü oksitleyici maddelerle – konsantre asitler, oksijen, halojenler.Kimyasal özellikler.
- Basit maddelerle etkileşim.
- Oksijende yanar, kireç oluşturur - demir (II,III) oksit: 3Fe + 2O 2 → Fe 3 O 4 Demir ısıtıldığında metal olmayanlarla reaksiyona girer:
- Karmaşık maddelerle etkileşim.
- Yüksek sıcaklıklarda (700–900C) demir, su buharı ile reaksiyona girer:
3Fe + 4H 2 O Fe 3 O 4 + 4H 2 -
- Havada nem varlığında paslanır: 4Fe + 3O 2 + 6H 2 O → 4Fe(OH) 3. Demir, hidroklorik ve seyreltik sülfürik asitlerde kolayca çözünür ve CO +2 gösterir:
Fe + 2HCl → FeCl2 + H2 -
Fe + H 2 SO 4 (seyreltilmiş) → FeSO 4 + H 2 -
- Konsantre oksitleyici asitlerde demir yalnızca ısıtıldığında çözünür ve CO +3 gösterir:
2Fe + 6H 2 SO 4 (kons.) Fe 2 (SO 4) 3 + 3SO 2 - + 6H 2 O
Fe + 6HNO 3 (kons.) Fe(NO 3) 3 + 3NO 2 - + 3H 2 O
(soğukta konsantre nitrik ve sülfürik asitler demiri pasifleştirir).
- Demir, voltaj serisinde sağındaki metalleri tuzlarının çözeltilerinden uzaklaştırır.
Fe + CuS04 → FeS04 + Cu ↓
Fiş.- Oksitlerin kömür veya karbon monoksit ile indirgenmesi (II)
FeO + C Fe + CO
Fe203 + 3CO2Fe + 3CO2
Demirli bileşikler
HAKKINDADemir oksit (II) FeO
Fiziki ozellikleri: siyah katı, suda çözünmez. Kimyasal özellikler: FeO – bazik oksit 6 FeO + O 2 2Fe 3 O 4- Hidrojen, karbon, karbon monoksit (II) ile demire indirgenir:
FeO + C Fe + CO
Fiş. Fe 3 O 4 + H 2 - 3 FeO + H 2 ODemir hidroksit (II) Fe(AH) 2
Fiziki ozellikleri: pudra beyaz, suda çözünmez. Kimyasal özellikler: Fe(OH)2 zayıf bir bazdır. Fiş.- Alkali çözeltilerin hava erişimi olmayan demir (II) tuzları üzerindeki etkisiyle oluşur:
FeCl2 + 2KOH → 2KCl + Fe(OH)2 ↓
Niteliksel yanıt Fe 2+
Potasyum hekzasiyanoferrat (III) K3 (kırmızı kan tuzu) demirli demir tuzlarının çözeltilerine etki ettiğinde mavi bir çökelti (Turnboole mavisi) oluşur:3FeSO 4 + 2K 3 Fe 3 2 + 3K 2 SO 4
Ferrik bileşikler
Demir oksit (III) Fe 2 Ö 3
Fiziki ozellikleri: kırmızı-kahverengi katı. Kimyasal özellikler: Fe203 amfoterik bir oksittir. sodyum ferrit Fe 2 O 3 + 3H 2 - 2 Fe + 3H 2 O Fiş.Demir hidroksit (III) Fe(AH) 3
Fiziki ozellikleri: kırmızı-kahverengi katı. Kimyasal özellikler: Fe(OH)3 bir amfoterik hidroksittir.- Asitlerle çözünmeyen bir baz olarak reaksiyona girer:
2Fe(OH)3 + 3H2SO4 →Fe2(S04)3 + 6H2O
- Çözünmeyen bir asit olarak alkalilerle reaksiyona girer:
Fe(OH)3 + KOH (sol) → KFeO2 + 2H2O
Fe(OH)3 + 3KOH (kons.) → K3
Fiş.- Alkali çözeltilerin demir tuzları üzerindeki etkisiyle oluşur: kırmızı-kahverengi bir çökelti şeklinde çöker:
Fe(NO 3) 3 + 3KOH Fe(OH) 3 + 3KNO 3
Fe'ye nitel tepkiler 3+
- Potasyum hekzasiyanoferrat (II) K4 (sarı kan tuzu) ferrik tuzların çözeltilerine etki ettiğinde, mavi bir çökelti (Prusya mavisi) oluşur:
4FeCl 3 +3K 4 Fe 4 3 + 12KCl
- Fe3+ iyonları içeren bir çözeltiye potasyum veya amonyum tiyosiyanat eklendiğinde, yoğun kan kırmızısı demir(III) tiyosiyanat rengi ortaya çıkar:
FeCl 3 + 3KCNS 3КCl + Fe(CNS) 3
Bakır ve bileşikleri
Bakır- oldukça yumuşak, kırmızı-sarı renkli, dövülebilir, sünek ve yüksek ısı ve elektrik iletkenliğine sahip bir metal. T eriyik = 1083 0 C. ρ = 8,96 g/cm3. CO: 0,+1,+2
Kimyasal özellikler.
- Basit maddelerle etkileşim.
- Karmaşık maddelerle etkileşim.
Bakır, hidrojenin sağındaki voltaj serisindedir, bu nedenle seyreltik hidroklorik ve sülfürik asitlerle reaksiyona girmez, ancak oksitleyici asitlerde çözünür:
3Cu + 8HNO3 (inceltilmiş) → 3Cu(NO3) 2 + 2NO- + 2H2O
Cu + 4HNO 3 (kons.) → Cu(NO 3) 2 + 2NO 2 -+ 2H 2 O
Cu + 2H 2 SO 4 (kons.) → CuSO 4 + SO 2 -+2H 2 O
Fiş.
CuO + CO Cu + CO 2
- Bakır tuzlarının elektrolizi sırasında: 2CuSO 4 + 2H 2 O → 2
Cu + Ö 2
-
+ 2H 2 SO 4
Bakırlı bileşikler
Bakır oksit(BEN) İLEsen 2 Ö Fiziki ozellikleri: kırmızı katı, suda çözünmez. Kimyasal özellikler: Cu 2 O ana oksittir. Fiş.- Bakır (II) bileşiklerinin, örneğin glikozun alkali bir ortamda indirgenmesiyle elde edilir:
- Asitlerle etkileşime girer: CuOH + HCl → CuCl + H 2 O Havada kolaylıkla Cu(OH) 2'ye oksitlenir: 4CuOH + O 2 + 2H 2 O → 4 Cu(OH) 2
Bakır bileşikleri
Demir (Fe sembolü)- sekizinci grubun kimyasal elementi, dördüncü periyot. Ütü Kimyasal elementlerin periyodik tablosunda 26 numarada yer alır.
Demir alt grubu 4 element içerir: Fe demir, rutenyum Ru, osmiyum Os, Hs hasmiyum.
Demir kimyasal elementinin özellikleri
Ferrum Latince bir kelimedir, sadece demir değil aynı zamanda sertlik ve silah anlamına da gelir. Bazı Avrupa dillerinde demirin isimleri buradan gelmiştir: Fransızca fer, İtalyanca ferro, İspanyolca hierro ve ferrit, ferromanyetizma gibi terimler. Bu metalin Slav ve Baltık dillerinde benzer isimleri: Litvanca gelezis, Lehçe zelazo, Bulgarca zhelez, Ukraynaca zalizo ve Belarusça zalez. İngilizce Iron, Almanca Eisen, Hollandaca ijzer isimleri Sanskritçe isira (güçlü, güçlü) kelimesinden türetilmiştir.
Demirin Doğadaki Dağılımı
Periyodik tablonun demir 26 elementi
Ütü- dünyada birinci ve en yaygın ikinci metal yerkabuğu insanlar için çok önemli bir metal. Çok eski zamanlardan beri insanlar demirle demir göktaşları şeklinde karşılaşmışlardır. Tipik olarak göktaşı demiri %5 ila %30 nikel, neredeyse %0,5 kobalt ve %1'e kadar diğer elementleri içerir. En büyük göktaşı Goba, 80 bin yıl önce Afrika'ya düştü; ağırlığı 66 tondu. % 84 içerir bez ve %16 nikel. Rusya Bilimler Akademisi'nin göktaşı müzesinde, üzerine düşen 256 kg ağırlığında iki demir göktaşı parçası saklanıyor. Uzak Doğu. 1947'de Primorsky Bölgesi'nde 35 km 2'lik bir alana binlerce demir göktaşı parçası (60 ila 100 ton ağırlığında) "demir yağmuru" gibi düştü. Çok nadir bir mineral olan karasal kökenli doğal demir, küçük taneler halinde oluşur ve %2 oranında nikel ve diğer metallerin yüzde onda birini içerir. Yerli demir Ay'da ezilmiş halde bulundu.
MÖ 13.-12. yüzyıllarda. Avrasya'nın Atlantik'ten Pasifik Okyanusu'na kadar tüm alanı boyunca ve birkaç yüzyıl boyunca - MÖ 10-8 yüzyıllara kadar bir çöküş ve kültür değişimi var. halkların göçleri meydana gelir. Bu döneme Tunç Çağı felaketi ve Demir Çağı'na geçişin başlangıcı adı verildi.
Yerkabuğunda çok miktarda demir bulunur ancak çıkarılması zordur. Bu metal, cevherlerde oksijenle ve bazen de kükürtle sıkı bir şekilde bağlanır. Eski fırınlar, saf demirin eridiği ve kritsa adı verilen bir cevherden safsızlıklarla sünger şeklinde demir elde edildiği gerekli sıcaklığı üretemiyordu. Kritsa dövülürken demir cevherden kısmen ayrıldı.
Birçok mineral demir içerir. %72,3 oranında demir içeren manyetik demir cevheri, demir açısından en zengin mineraldir. Antik Yunan filozofu Miletli Thales, 2.500 yıldan daha uzun bir süre önce, demiri çeken demirli metal örneklerini incelemişti. Ona Magnesia'dan bir taş olan magnetis lithos adını verdi ve mıknatısın adı da bu şekilde ortaya çıktı. Artık bunun manyetik demir cevheri - siyah demir oksit olduğu biliniyor.
Demirin canlı organizmadaki rolü
En önemli demir cevheri hematittir. %69,9 oranında demir içerir. Hematit'e kırmızı demir taşı da denir ve eski adı kan taşıdır. Yunanca kan anlamına gelen haima kelimesinden türemiştir. Hemoglobin gibi kanla ilgili başka kelimeler de ortaya çıktı. Hemoglobin, solunum organlarından vücut dokularına oksijen taşıyıcısı görevi görür ve ters yönde karbondioksit taşır. Vücutta demir eksikliği şunlara yol açar: ciddi hastalık — demir eksikliği anemisi. Bu hastalıkta iskelet bozuklukları, merkezi sinir sistemi ve damar sistemleri, dokularda oksijen eksikliği var. Demir canlı organizmalar için gereklidir. Ayrıca kaslarda, dalakta ve karaciğerde de bulunur. Yetişkin bir insanın yaklaşık 4 gram demiri vardır ve vücudun her hücresinde bulunur. Bir kişinin her gün yemekle birlikte 15 miligram demir alması gerekir. Demir eksikliği varsa, doktorlar kolayca sindirilebilir formda demir içeren özel ilaçlar reçete eder.
Demir Uygulamaları
Eritilmiş demir% 2'den fazla karbon içeriyorsa, dökme demir elde edilir, saf demirden yüzlerce derece daha düşük bir sıcaklıkta eritilir. Dökme demir kırılgan olduğundan yalnızca çeşitli ürünlerin dökümünde kullanılabilir, dövülemez. Demir cevheri yüksek fırınlarda eritilir çok sayıda anıtların, ızgaraların ve ağır makine yataklarının dökümü için kullanılan dökme demir. Dökme demirin büyük kısmı çeliğe işlenir. Bunu yapmak için, bazı karbon ve diğer safsızlıklar, dönüştürücülerde veya açık ocak fırınlarında dökme demirin "yakılması" ile sağlanır.
Raylardan çivilere kadar tüm nesneler farklı karbon içeriğine sahip çelikten yapılmıştır. Demirde az karbon varsa yumuşak düşük karbonlu çelik elde edilir ve diğer elementlerin alaşım safsızlıklarının çeliğe katılmasıyla farklı derecelerde özel çelikler elde edilir. Çok çeşitli çelikler bilinmektedir ve her birinin kendi uygulaması vardır.
En ünlüsü nikel ve krom içeren paslanmaz çeliktir. Kimya tesisleri ve sofra takımları için ekipmanlar bu çelikten yapılmıştır. Çeliğe %18 tungsten, %1 vanadyum ve %4 krom eklerseniz, şunu elde edersiniz: yüksek hız çeliği, matkaplar ve kesici uçlar ondan yapılır. Demiri %1,5 karbon ve %15 manganezle kaynaştırırsanız, buldozer bıçakları ve ekskavatör dişlerinin yapımında kullanılan türden sert çelik elde edersiniz. %36 nikel, %0,5 karbon ve %0,5 manganez içeren çeliğe invar denir; hassas aletler ve bazı saat parçaları bundan yapılır. Platinit adı verilen çelik %46 nikel ve %15 karbon içeriyor ve tıpkı cam gibi ısıtıldığında genleşiyor. Platinitin camla birleşim yeri çatlamaz ve bu nedenle elektrik lambalarının imalatında kullanılır.
Paslanmaz çelik mıknatıslanmaz ve mıknatıs tarafından çekilmez. Yalnızca karbon çeliği mıknatıslanabilir. Saf demirin kendisi mıknatıslanmaz, ancak bir mıknatıs tarafından çekilir; bu tür demir, elektromıknatıs çekirdekleri yapmak için uygundur.
Dünyada her yıl bir milyar tondan fazla demir eritilmektedir. Ancak metalin korkunç bir düşmanı olan korozyon, yalnızca eritilmesi harcanan metalin kendisini yok etmekle kalmaz. buyuk gayret aynı zamanda metalin kendisinden daha pahalı olan bitmiş ürünleri de devre dışı bırakır. Her yıl on milyonlarca ton eritilmiş metali yok eder. Demir korozyona uğradığında oksijen ve su ile reaksiyona girerek pasa dönüşür.

Demir, D.I. Mendeleev'in kimyasal elementlerinin periyodik tablosundaki konumu, kükürt, hidroklorik asit, tuz çözeltileri ile etkileşimi.
CEVAP PLANI:
p.s.'deki konumu ve atom yapısı fiziki ozellikleri Kimyasal özellikler Demir kimyasal elementi ikincil alt grubun 8. grubunun 4. periyodundadır. Bir demir atomunun dört elektron katmanı vardır. Üçüncü katmanın d-alt düzeyi elektronlarla doludur, üzerinde 6 elektron bulunur, dördüncü katmandaki s-alt düzeyi ise 2 elektron içerir. Bileşiklerde demir, +2 ve +3 oksidasyon durumlarını sergiler.
| IV dönem VIII grup ikincil alt grup | Fe)))) | +2 | +3 | ||
| +26 2 8 8+6 2 | 4'ler | ?? | |||
| 3 boyutlu | ?? | ? | ? | ? | ? |
Basit demir maddesi, erime noktası 15390C, yoğunluğu 7,87 g/cm3 olan gümüşi beyaz bir metaldir ve manyetik özelliklere sahiptir. Demir reaktif bir metaldir. Isıtıldığında kükürt ile reaksiyona girerek demir(II) sülfit oluşturur: Fe0 + S0 = Fe+2S-2. Demir, asit çözeltilerindeki hidrojenin yerini alır ve örneğin demir üzerine etki ettiğinde demir(II) tuzları oluşur. hidroklorik asit demir(II) klorür oluşur: Fe0 + 2H+1Cl-1 = Fe+2Cl2-1 + H20. Demir, daha az aktif metalleri tuzlarının çözeltilerinden uzaklaştırabilir; örneğin, demir bir bakır(II) sülfat çözeltisine etki ettiğinde metalik bakır ve demir(II) sülfat oluşur: Fe0 + Cu+2SO4 = Cu0 + Fe+2SO4 .
Tüm reaksiyonlarda demir, indirgeyici bir maddenin özelliklerini sergiler. Daha güçlü oksitleyici maddeler - klor, oksijen, konsantre asitler - demiri +3 oksidasyon durumuna oksitler.
Eğer Ev ödevi konuyla ilgili: » Demir, kimyasal elementlerin periyodik tablosundaki konumu D I Mendeleev, etkileşim Yararlı bulursanız, bu mesajın bağlantısını sosyal ağınızdaki sayfanızda yayınlarsanız minnettar oluruz.
Son haberler
Kategoriler
Haberler
Konuyla ilgili yazılar
- Gymnasium No. 12, Lipetsk Znamenshchikova Nadezhda Aleksandrovna Ders konusu: Demir ve bileşikleri (9. sınıf) Amaç: Oksidasyon reaksiyonlarının yönünün “Kimyasal element” Testine bağımlılığı kavramını oluşturmak Kimyasal elementlerin isimleri esas olarak …… . Kökeni Kimyasal elementlerin işaretleri İngilizce Latin harfleriyle ve Rusça harflerle gösterilmiştir. 9. sınıftaki “Metallerin Dünyası” konulu Kimyasal Kimya dersi tablosundaki boşlukları doldurun. Gelişme, belediye özerk eğitim kurumu “Bazarno-Matakskaya ortaöğretim genel eğitiminin kimya öğretmeni tarafından derlendi. Ölçek kimyada “Oksijen ve kükürt” konulu Seçenek 1 1. Sülfürik asidin elektrolitik ayrışması için denklemler oluşturun. 2. Tam ve kısaltılmış bir denklem oluşturun
- Kimyada Birleşik Devlet Sınavı testi Tersinir ve geri döndürülemez kimyasal reaksiyonlar Kimyasal denge Cevapları
Tersinir ve geri dönüşü olmayan kimyasal reaksiyonlar. Kimyasal denge. Etki altında kimyasal dengede değişiklik Çeşitli faktörler 1. 2NO(g) sisteminde kimyasal denge
Kompakt halindeki niyobyum, gövde merkezli kübik kristal kafesli, parlak gümüşi beyaz (veya toz haline getirildiğinde gri) paramanyetik bir metaldir.
İsim. Metni isimlerle doyurmak dilsel mecaziliğin bir aracı olabilir. A. A. Fet'in "Fısıltı, ürkek nefes..." şiirinin metni.
1. Demir: D.I. Mendeleev'e göre kimyasal elementlerin periyodik tablosundaki konumu, atom yapısı, olası oksidasyon durumları, fiziksel özellikler, oksijenle etkileşim, halojenler, asit ve tuz çözeltileri. Demirin modern teknolojideki rolü. Demir alaşımları.
Demir, grup VIII'in küçük bir alt grubundadır periyodik tablo. Demir atomunun elektronik formülü:
Demirin tipik oksidasyon durumları +2 ve +3'tür. +2 oksidasyon durumu, iki 4s elektronunun kaybı nedeniyle oluşur. +3 oksidasyon durumu aynı zamanda bir Zd elektronunun daha kaybına karşılık gelir ve Zd seviyesi yarıya kadar doludur; bu tür elektronik konfigürasyonlar nispeten kararlıdır.
Fiziki ozellikleri. Demir tipik bir metaldir; metalik bir yapı oluşturur kristal kafes. Demir elektriği iletir, oldukça refrakterdir, erime noktası 1539°C'dir. Demir, mıknatıslanma yeteneği açısından diğer metallerin çoğundan farklıdır.
Kimyasal özellikler. Demir birçok metal olmayan maddeyle reaksiyona girer:
![]()
Demir ölçeği oluşur - karışık demir oksit. Formülü de şu şekilde yazılır: FeO Fe2O3.
![]()
Hidrojen açığa çıkarmak için asitlerle reaksiyona girer:
Bulunan metal tuzları ile yer değiştirme reaksiyonlarına girer. demirin sağında gerilim serisinde:
Demir bileşikleri. FeO, asit çözeltileriyle reaksiyona girerek demir (II) tuzları oluşturan bazik bir oksittir. Fe2O3, alkali çözeltilerle de reaksiyona giren bir amfoterik oksittir.

Demir hidroksitler. Fe(OH)2 tipik bir bazik oksittir; Fe(OH)3 amfoterik özelliklere sahiptir ve yalnızca asitlerle değil aynı zamanda alkalilerin konsantre çözeltileriyle de reaksiyona girer.
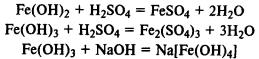
Demir (II) hidroksit, atmosferik oksijenle kolayca demir (III) hidroksite oksitlenir:
Demir (II) ve (III) tuzları alkalilerle reaksiyona girdiğinde çözünmeyen hidroksitler çöker:
Demir alaşımları. Modern metalurji endüstrisi, çeşitli bileşimlerde demir alaşımları üretmektedir.
Tüm demir alaşımları bileşim ve özelliklerine göre iki gruba ayrılır. Birinci grup çeşitli dökme demir türlerini, ikinci grup ise çeşitli çelik türlerini içerir.
Dökme demir kırılgandır; çelik sünektir, dövülebilir, haddelenebilir, çekilebilir, damgalanabilir. Dökme demir ve çeliğin mekanik özelliklerindeki fark öncelikle karbon içeriğine bağlıdır; dökme demir yaklaşık %4 karbon içerir ve çelik genellikle %1,4'ten az karbon içerir.
Modern metalurjide önce demir cevherinden dökme demir, daha sonra dökme demirden çelik elde edilir. Pik demir yüksek fırınlarda ergitilir, çelik ise çelik izabe fırınlarında pişirilir. Eritilmiş demirin %90'a kadarı çeliğe işlenir.
Dökme demir. İşlenerek çeliğe dönüştürülmesi amaçlanan pik demire pik demir denir. %3,9 ila %4,3 C, %0,3-1,5 Si, %1,5-3,5 Mn, %0,3'ten fazla P ve %0,07'den fazla S içermez. "Döküm üretimi için tasarlanan dökme demire döküm demiri denir. Ferroalaşımlar Ayrıca, esas olarak çelik üretiminde katkı maddesi olarak kullanılan yüksek fırınlarda da eritilir.Ferroalaşımlar, pik demirle karşılaştırıldığında, daha yüksek miktarda silikon (ferrosilikon), manganez (ferromangan), krom (ferrokrom) ve diğer elementlere sahiptir.
Haline gelmek. Tüm çelikler karbon ve alaşıma ayrılır.
Karbon çelikleri, dökme demirden birkaç kat daha az karbon, silikon ve manganez, çok az fosfor ve kükürt içerir. Karbon çeliğinin özellikleri öncelikle içindeki karbon içeriğine bağlıdır: çelikte ne kadar fazla karbon varsa o kadar serttir. Endüstri yumuşak çelikler, orta sert çelikler ve sert çelikler üretmektedir. Yumuşak çelikler ve orta sert çelikler makine parçaları, boru, cıvata, çivi vb. imalatında, sert çelikler ise alet imalatında kullanılır.
Bu safsızlıklar çeliklerin mekanik özelliklerini kötüleştirdiği için çelikler mümkün olduğunca az kükürt ve fosfor içermelidir. Artan miktarlarda kükürt kırmızı kırılganlığa neden olur - metalin sıcak işlenmesi sırasında çatlakların oluşması. Fosfor, normal sıcaklıklarda çelikte soğuk kırılganlığa neden olur. -
Alaşımlı çelikler.Çeliklerin fiziksel, kimyasal ve mekanik özellikleri, çeliklerin kullanılmaya başlanmasından itibaren önemli ölçüde değişmektedir. artan miktar manganez ve silikonun yanı sıra krom, nikel, tungsten ve diğer elementler. Bu elementlere alaşım elementleri, çeliklere ise alaşım elementleri (Latince ligare - bağlamak, bağlamak kelimesinden gelir) adı verilir.
Krom en yaygın kullanılan alaşım elementidir. Özellikle büyük önem makinelerin, aparatların ve birçok makine parçasının yapımı için krom-nikel haline gelmek. Bu çelikler yüksek sünekliğe, mukavemete, ısı direncine ve oksitleyici maddelere karşı dirence sahiptir. Herhangi bir konsantrasyondaki nitrik asit, kaynama sıcaklıklarında bile onları yok etmez. Krom-nikel çelikleri atmosferik koşullarda ve suda paslanmazlar. Parlak, gümüş renkli krom-nikel çelik levhalar, Moskova metrosunun Mayakovskaya istasyonunun kemerlerini süslüyor. Paslanmaz bıçaklar, kaşıklar, çatallar ve diğer ev eşyaları aynı çelikten yapılmıştır.
Molibden ve vanadyum çeliklerin sertliğini ve mukavemetini arttırır. yüksek sıcaklıklar ve baskılar. Bu yüzden, krom molibden Ve krom vanadyumçelikler, sentetik amonyak ve uçak motorlarının üretiminde boru hatları ve kompresör parçalarının imalatında kullanılmaktadır.
Yüksek hızlarda kesim yaparken alet çok ısınır ve çabuk aşınır. Tungsten eklenerek çeliğin sertliği yüksek sıcaklıklarda bile korunur. Bu nedenle yüksek hızlarda çalışan kesici takımların imalatında krom-tungsten çelikleri kullanılıyor."
Çeliğin mangan içeriğinin arttırılması sürtünme ve darbeye karşı direncini artırır. Manganez çelikleri demiryolu rampaları, makasları, traversleri ve taş kırma makinelerinin imalatında kullanılır.
Alaşımlı çeliklerin kullanılması, metal yapıların ağırlığının önemli ölçüde azaltılmasına, sağlamlığının, dayanıklılığının ve operasyonel güvenilirliğinin arttırılmasına olanak sağlar.
2. Sincaplar biyopolimerler olarak. Proteinlerin birincil, ikincil ve üçüncül yapıları. Özellikler ve biyolojik fonksiyonlar proteinler.
Proteinler (proteinler, polipeptitler) - yüksek moleküler ağırlık organik madde bir zincire bir peptit bağıyla bağlanan alfa-amino asitlerden oluşur.
Polisakkaritler gibi proteinler de biyolojik polimerlerdir. Çoğu protein molekülü, diğer organik bileşiklerle karşılaştırıldığında devasa boyutlara ulaşır ve çok büyük bir molekül ağırlığına sahiptir:
Penisilin grubunun proteinlerinden birinin moleküler formülü C43H58N4O12'dir; Kazein proteini inek sütü, – C47H48N3NaO7S2; hemoglobin - C 3032 H 48I6 O 872 N 780 S 8 Fe 4;


