27.03.2018
Σίδηρος στον περιοδικό πίνακα
ΜΕΤΑΛΛΑ ΥΠΟΟΜΑΔΩΝ
Χαρακτηριστικά των μεταβατικών στοιχείων - χαλκός, χρώμιο, σίδηρος ανάλογα με τη θέση τους στον περιοδικό πίνακα χημικά στοιχεία DI. Mendeleev και τα δομικά χαρακτηριστικά των ατόμων τους.
Ο όρος στοιχείο μετάβασης χρησιμοποιείται συνήθως για να αναφέρεται σε οποιοδήποτε από τα στοιχεία d ή f. Αυτά τα στοιχεία καταλαμβάνουν μια μεταβατική θέση μεταξύ των ηλεκτροθετικών στοιχείων s και των ηλεκτραρνητικών στοιχείων p. Τα d-Elements σχηματίζουν τρεις μεταβατικές σειρές - στην 4η, 5η και 6η περίοδο, αντίστοιχα. Η πρώτη μεταβατική σειρά περιλαμβάνει 10 στοιχεία, από σκάνδιο έως ψευδάργυρο. Χαρακτηρίζεται από την εσωτερική διαμόρφωση τρισδιάστατων τροχιακών. Το χρώμιο και ο χαλκός έχουν μόνο ένα ηλεκτρόνιο στα τροχιακά τους 4s. Το γεγονός είναι ότι τα μισογεμισμένα ή γεμάτα d-υποκέλυφα είναι πιο σταθερά από τα μερικώς γεμάτα. Το άτομο του χρωμίου έχει ένα ηλεκτρόνιο σε καθένα από τα πέντε τρισδιάστατα τροχιακά που σχηματίζουν το 3d υποκέλυφος. Αυτό το υποκέλυφος είναι μισογεμάτο. Σε ένα άτομο χαλκού, καθένα από τα πέντε τρισδιάστατα τροχιακά περιέχει ένα ζεύγος ηλεκτρονίων (η ανωμαλία του αργύρου εξηγείται με παρόμοιο τρόπο). Όλα τα στοιχεία d είναι μέταλλα. Τα περισσότερα από αυτά έχουν μια χαρακτηριστική μεταλλική λάμψη. Σε σύγκριση με τα μέταλλα s, η αντοχή τους είναι γενικά σημαντικά υψηλότερη. Συγκεκριμένα, χαρακτηρίζονται από τις ακόλουθες ιδιότητες: υψηλή αντοχή σε εφελκυσμό. εύπλαστο; ελατότητα (μπορούν να ισοπεδωθούν σε φύλλα με χτυπήματα). Τα d-στοιχεία και οι ενώσεις τους έχουν μια σειρά από χαρακτηριστικές ιδιότητες: μεταβλητές καταστάσεις οξείδωσης. ικανότητα σχηματισμού σύνθετων ιόντων. σχηματισμός έγχρωμων ενώσεων. Τα d-στοιχεία χαρακτηρίζονται επίσης από μεγαλύτερη πυκνότητα σε σύγκριση με άλλα μέταλλα. Αυτό εξηγείται από τις σχετικά μικρές ακτίνες των ατόμων τους. Οι ατομικές ακτίνες αυτών των μετάλλων αλλάζουν ελάχιστα σε αυτή τη σειρά. Τα d-στοιχεία είναι καλοί αγωγοί του ηλεκτρισμού, ειδικά εκείνα των οποίων τα άτομα έχουν μόνο ένα εξωτερικό ηλεκτρόνιο s εκτός από ένα μισογεμάτο ή πλήρες κέλυφος d. Για παράδειγμα, ο χαλκός.
Χημικές ιδιότητες.
Η ηλεκτραρνητικότητα των μετάλλων της πρώτης μεταβατικής σειράς αυξάνεται προς την κατεύθυνση από χρώμιο προς ψευδάργυρο. Αυτό σημαίνει ότι οι μεταλλικές ιδιότητες των στοιχείων της πρώτης μεταβατικής σειράς εξασθενούν σταδιακά προς την υποδεικνυόμενη κατεύθυνση. Αυτή η αλλαγή στις ιδιότητές τους εκδηλώνεται επίσης με μια σταθερή αύξηση των οξειδοαναγωγικών δυναμικών με μια μετάβαση από τις αρνητικές στις θετικές τιμές.
Χαρακτηριστικά του χρωμίου και των ενώσεων του
Χρώμιο- σκληρό, μπλε-λευκό μέταλλο.ρ = 7,2 g/cm 3, t melt = 1857 0 C CO: +1,+2,+3,+4,+5,+6Χημικές ιδιότητες.
- Υπό κανονικές συνθήκες, το χρώμιο αντιδρά μόνο με το φθόριο. Σε υψηλές θερμοκρασίες (πάνω από 600 0 C) αλληλεπιδρά με οξυγόνο, αλογόνα, άζωτο, πυρίτιο, βόριο, θείο, φώσφορο.
4Cr + 3O 2 2Cr 2 O 3
2Cr + 3Cl 2 2CrCl 3
2Cr + 3S Cr 2 S 3
- Όταν θερμαίνεται, αντιδρά με υδρατμούς:
2Cr + 3H 2 O Cr 2 O 3 + 3H 2
- Το χρώμιο διαλύεται σε αραιά ισχυρά οξέα (HCl, H 2 SO 4). Ελλείψει αέρα, σχηματίζονται άλατα Cr 2 + και στον αέρα, άλατα Cr 3 +.
Cr + 2HCl → CrCl 2 + H 2 -
2Cr + 6HCl + O 2 → 2CrCl 3 + 2H 2 O + H 2 -
- Η παρουσία προστατευτικής μεμβράνης οξειδίου στην επιφάνεια του μετάλλου εξηγεί την παθητικότητα του προς ψυχρά συμπυκνωμένα οξέα - οξειδωτικά μέσα. Ωστόσο, όταν θερμαίνονται έντονα, αυτά τα οξέα διαλύουν το χρώμιο:
2 Сr + 6 Н 2 SO 4 (συμπ.) Сr 2 (SO 4) 3 + 3 SO 2 + 6 Н 2 О
Cr + 6 HNO 3 (συμπ.) Cr(NO 3) 3 + 3 NO 2 + 3 H 2 O
Παραλαβή.Ενώσεις χρωμίου
Ενώσεις χρωμίου
Οξείδιο του χρωμίου (II) CrO
Φυσικές ιδιότητες:μια στερεή, αδιάλυτη στο νερό ουσία έντονο κόκκινο ή καστανοκόκκινο χρώμα. Χημικές ιδιότητες.Το CrO είναι το κύριο οξείδιο.Παραλαβή.
Cr 2 O 3 + 3H 2 2Cr + 3H 2 O υδροξείδιο χρωμίου (II) Cr(OH) 2 Φυσικές ιδιότητες:στερεό αδιάλυτο στο νερό κίτρινο χρώμα. Χημικές ιδιότητες.Το Cr(OH) 2 είναι αδύναμη βάση.- Αλληλεπιδρά με οξέα: Cr(OH) 2 + 2HCl → CrCl 2 + 2H 2 O Οξειδώνεται εύκολα παρουσία υγρασίας από το ατμοσφαιρικό οξυγόνο σε Cr(OH) 3:
4Cr(OH) 2 + O 2 + 2H 2 O → 4Cr(OH) 3
- Όταν θερμαίνεται, αποσυντίθεται:
- Η επίδραση των αλκαλίων σε διαλύματα αλάτων Cr(II): CrCl 2 + 2 NaOH = Cr(OH) 2 ↓ + 2 NaCl.
Ενώσεις τρισθενούς χρωμίου
Οξείδιο του χρωμίου (III) Cr 2 Ο 3 Φυσικές ιδιότητες:σκούρο πράσινο, πυρίμαχη ουσία, αδιάλυτη στο νερό. Χημικές ιδιότητες.Το Cr 2 O 3 είναι ένα αμφοτερικό οξείδιο.Χρωμικό νάτριο
- Στο υψηλή θερμοκρασίαανάγεται από υδρογόνο, ασβέστιο, άνθρακα σε χρώμιο:
Cr 2 O 3 + 3H 2 2Cr + 3H 2 O
Παραλαβή.
υδροξείδιο χρωμίου (III) Cr(OH) 3 Φυσικές ιδιότητες:ουσία αδιάλυτη στο νερό Πράσινο χρώμα. Χημικές ιδιότητες. Cr(OH) 3 – αμφοτερικό υδροξείδιο2Cr(OH) 3 + 3H 2 SO 4 → Cr 2 (SO 4) 3 + 6H 2 O
Cr(OH) 3 + KOH → KCrO 2 + 2H 2 O
(χρωμίτης καλίου) Παραλαβή.
- Όταν τα αλκάλια δρουν σε άλατα Cr 3+, κατακρημνίζεται ένα ζελατινώδες ίζημα πράσινου υδροξειδίου του χρωμίου (III):
Cr 2 (SO 4) 3 + 6NaOH → 2 Cr(OH) 3 ↓ + 3 Na 2 SO 4,
Ενώσεις εξασθενούς χρωμίου
Οξείδιο του χρωμίου (VI) CrO 3 Φυσικές ιδιότητες:σκούρο κόκκινο στερεό, πολύ διαλυτό στο νερό. Δηλητηριώδης! Χημικές ιδιότητες.Το CrO 3 είναι ένα όξινο οξείδιο.- Αντιδρά με αλκάλια, σχηματίζοντας κίτρινα χρωμικά άλατα:
CrO 3 + 2KOH → K 2 CrO 4 + H 2 O
- Αντιδρά με το νερό για να σχηματίσει οξέα: CrO 3 + H 2 O → H 2 CrO 4 χρωμικό οξύ
- Θερμικά ασταθές: 4 CrO 3 → 2Cr 2 O 3 + 3O 2
- Λαμβάνεται από χρωμικό κάλιο (ή διχρωμικό) με τη δράση του H 2 SO 4 (συγκ.).
K 2 CrO 4 + H 2 SO 4 → CrO 3 + K 2 SO 4 + H 2 O
K 2 Cr 2 O 7 + H 2 SO 4 → 2CrO 3 + K 2 SO 4 + H 2 O
Υδροξείδιαχρώμιο(VI)H 2 CrO 4 - χρώμιοοξύ, Χ 2 Cr 2 Ο 7 - διχρωμίαοξύΚαι τα δύο οξέα είναι ασταθή· όταν προσπαθούν να τα απομονώσουν στην καθαρή τους μορφή, αποσυντίθενται σε νερό και οξείδιο του χρωμίου (VI). Ωστόσο, τα άλατά τους είναι αρκετά σταθερά. Τα άλατα του χρωμικού οξέος ονομάζονται χρωμικά, έχουν κίτρινο χρώμα και τα άλατα του διχρωμικού οξέος ονομάζονται διχρωμικά, έχουν χρώμα πορτοκαλί.Ο σίδηρος και οι ενώσεις του
Σίδερο -ένα σχετικά μαλακό ελατό μέταλλο ασημί χρώματος, όλκιμο, μαγνητισμένο. Τ τήγμα = 1539 0 C. ρ = 7,87 g/cm 3. CO: +2 – με ασθενή οξειδωτικά μέσα – διαλύματα οξέων, αλάτων, μη μετάλλων, εκτός από οξυγόνο και αλογόνα +3 – με ισχυρά οξειδωτικά μέσα – πυκνά οξέα, οξυγόνο, αλογόνα.Χημικές ιδιότητες.
- Αλληλεπίδραση με απλές ουσίες.
- Καίγεται σε οξυγόνο, σχηματίζοντας άλατα - οξείδιο σιδήρου (II,III): 3Fe + 2O 2 → Fe 3 O 4 Ο σίδηρος αντιδρά με τα μη μέταλλα όταν θερμαίνεται:
- Αλληλεπίδραση με σύνθετες ουσίες.
- Σε υψηλές θερμοκρασίες (700–900C), ο σίδηρος αντιδρά με τους υδρατμούς:
3Fe + 4H 2 O Fe 3 O 4 + 4H 2 -
- Στον αέρα παρουσία υγρασίας σκουριάζει: 4Fe + 3O 2 + 6H 2 O → 4Fe(OH) 3. Ο σίδηρος διαλύεται εύκολα σε υδροχλωρικά και αραιά θειικά οξέα, εμφανίζοντας CO +2:
Fe + 2HCl → FeCl 2 + H 2 -
Fe + H 2 SO 4 (αραιωμένο) → FeSO 4 + H 2 -
- Στα πυκνά οξειδωτικά οξέα, ο σίδηρος διαλύεται μόνο όταν θερμαίνεται, εμφανίζοντας CO +3:
2Fe + 6H 2 SO 4 (συμπ.) Fe 2 (SO 4) 3 + 3SO 2 - + 6H 2 O
Fe + 6HNO 3 (συμπ.) Fe(NO 3) 3 + 3NO 2 - + 3H 2 O
(στο κρύο, τα συμπυκνωμένα νιτρικά και θειικά οξέα παθητικοποιούν τον σίδηρο).
- Ο σίδηρος εκτοπίζει τα μέταλλα που βρίσκονται στα δεξιά του στη σειρά τάσης από διαλύματα των αλάτων τους.
Fe + CuSO 4 → FeSO 4 + Cu ↓
Παραλαβή.- Αναγωγή από οξείδια με άνθρακα ή μονοξείδιο του άνθρακα (II)
FeO + C Fe + CO
Fe 2 O 3 + 3CO 2Fe + 3CO 2
Σιδήρους ενώσεις
ΣΧΕΤΙΚΑ ΜΕοξείδιο του σιδήρου (II) FeO
Φυσικές ιδιότητες:μαύρο στερεό, αδιάλυτο στο νερό. Χημικές ιδιότητες: FeO – βασικό οξείδιο 6 FeO + O 2 2Fe 3 O 4- Ανάγεται από υδρογόνο, άνθρακα, μονοξείδιο του άνθρακα (II) σε σίδηρο:
FeO + C Fe + CO
Παραλαβή. Fe 3 O 4 + H 2 - 3 FeO + H 2 Oυδροξείδιο σιδήρου (II) Fe(OH) 2
Φυσικές ιδιότητες:σκόνη άσπρο, αδιάλυτο στο νερό. Χημικές ιδιότητες:Το Fe(OH) 2 είναι μια ασθενής βάση. Παραλαβή.- Σχηματίζεται από τη δράση αλκαλικών διαλυμάτων σε άλατα σιδήρου (II) χωρίς πρόσβαση αέρα:
FeCl 2 + 2KOH → 2KCl + Fe(OH) 2 ↓
Ποιοτική απάντηση σε Fe 2+
Όταν το εξακυανοφερρικό κάλιο (III) K 3 (κόκκινο άλας αίματος) δρα σε διαλύματα αλάτων σιδήρου σιδήρου, σχηματίζεται ένα μπλε ίζημα (μπλε Turnboole):3FeSO 4 + 2K 3 Fe 3 2 + 3K 2 SO 4
Ενώσεις σιδήρου
οξείδιο σιδήρου (III) Fe 2 Ο 3
Φυσικές ιδιότητες:κόκκινο-καφέ στερεό. Χημικές ιδιότητες:Το Fe 2 O 3 είναι ένα αμφοτερικό οξείδιο. φερρίτης νατρίου Fe 2 O 3 + 3H 2 - 2 Fe + 3H 2 O Παραλαβή.υδροξείδιο σιδήρου (III) Fe(OH) 3
Φυσικές ιδιότητες:κόκκινο-καφέ στερεό. Χημικές ιδιότητες:Το Fe(OH) 3 είναι ένα αμφοτερικό υδροξείδιο.- Αντιδρά με οξέα ως αδιάλυτη βάση:
2Fe(OH) 3 + 3H 2 SO 4 → Fe 2 (SO 4) 3 + 6H 2 O
- Αντιδρά με τα αλκάλια ως αδιάλυτο οξύ:
Fe(OH) 3 + KOH (sol) → KFeO 2 + 2H 2 O
Fe(OH) 3 + 3KOH (συμπ.) → K 3
Παραλαβή.- Σχηματίζεται από τη δράση αλκαλικών διαλυμάτων σε άλατα σιδήρου: καθιζάνει με τη μορφή ενός κόκκινου-καφέ ιζήματος:
Fe(NO 3) 3 + 3KOH Fe(OH) 3 + 3KNO 3
Ποιοτικές αντιδράσεις σε Fe 3+
- Όταν το εξακυανοφερρικό κάλιο (II) K 4 (κίτρινο άλας αίματος) δρα σε διαλύματα αλάτων σιδήρου, σχηματίζεται ένα μπλε ίζημα (μπλε της Πρωσίας):
4FeCl 3 +3K 4 Fe 4 3 + 12KCl
- Όταν προστίθεται θειοκυανικό κάλιο ή αμμώνιο σε διάλυμα που περιέχει ιόντα Fe 3+, εμφανίζεται ένα έντονο κόκκινο χρώμα του θειοκυανικού σιδήρου (III):
FeCl 3 + 3KCNS 3KCl + Fe(CNS) 3
Ο χαλκός και οι ενώσεις του
Χαλκός- ένα μάλλον μαλακό μέταλλο κόκκινου-κίτρινου χρώματος, εύπλαστο, όλκιμο και έχει υψηλή θερμική και ηλεκτρική αγωγιμότητα. Τ τήγμα = 1083 0 C. ρ = 8,96 g/cm 3. CO: 0,+1,+2
Χημικές ιδιότητες.
- Αλληλεπίδραση με απλές ουσίες.
- Αλληλεπίδραση με σύνθετες ουσίες.
Ο χαλκός βρίσκεται στη σειρά τάσης στα δεξιά του υδρογόνου, επομένως δεν αντιδρά με αραιά υδροχλωρικά και θειικά οξέα, αλλά διαλύεται σε οξειδωτικά οξέα:
3Cu + 8HNO 3 (διυλ.) → 3Cu(NO 3) 2 + 2NO- + 2H 2 O
Cu + 4HNO 3 (συμπ.) → Cu(NO 3) 2 + 2NO 2 -+ 2H 2 O
Cu + 2H 2 SO 4 (συμπ.) → CuSO 4 + SO 2 -+2H 2 O
Παραλαβή.
CuO + CO Cu + CO 2
- Κατά την ηλεκτρόλυση αλάτων χαλκού: 2CuSO 4 + 2H 2 O → 2
Cu + Ο 2
-
+ 2H 2 SO 4
Ενώσεις χαλκού
οξείδιο του χαλκού (Εγώ) ΜΕu 2 Ο Φυσικές ιδιότητες:κόκκινο στερεό, αδιάλυτο στο νερό. Χημικές ιδιότητες:Το Cu 2 O είναι το κύριο οξείδιο. Παραλαβή.- Λαμβάνεται με αναγωγή των ενώσεων χαλκού (II), για παράδειγμα, γλυκόζης σε αλκαλικό μέσο:
- Αλληλεπιδρά με οξέα: CuOH + HCl → CuCl + H 2 O Στον αέρα, οξειδώνεται εύκολα σε Cu(OH) 2: 4CuOH + O 2 + 2H 2 O → 4 Cu(OH) 2
Ενώσεις χαλκού
Σίδηρος (σύμβολο Fe)− χημικό στοιχείο όγδοης ομάδας, τέταρτη περίοδος. Σίδεροστον περιοδικό πίνακα των χημικών στοιχείων βρίσκεται στον αριθμό 26.
Η υποομάδα του σιδήρου περιέχει 4 στοιχεία: σίδηρος Fe, ρουθήνιο Ru, όσμιο Os, Hs hasmium.
Χαρακτηριστικά του χημικού στοιχείου Σίδηρος
Το Ferrum είναι λατινική λέξη, σημαίνει όχι μόνο σίδερο, αλλά και σκληρότητα και όπλο. Από αυτό προήλθαν τα ονόματα του σιδήρου σε ορισμένες ευρωπαϊκές γλώσσες: γαλλικά fer, ιταλικά ferro, ισπανικά hierro και όροι όπως φερρίτες, σιδηρομαγνητισμός. Παρόμοιες ονομασίες για αυτό το μέταλλο στις σλαβικές και βαλτικές γλώσσες: λιθουανικά gelezis, πολωνικά zelazo, βουλγαρικά zhelez, ουκρανικά zalizo και λευκορωσικά zalez. Το αγγλικό όνομα Iron, το γερμανικό Eisen, το ολλανδικό ijzer προέρχονται από το σανσκριτικό isira (δυνατό, δυνατό).
Κατανομή του σιδήρου στη φύση
Σίδηρος 26 στοιχείο του περιοδικού πίνακα
Σίδερο- το πρώτο στον κόσμο και το δεύτερο πιο κοινό μέταλλο φλοιός της γης, ένα πολύ σημαντικό μέταλλο για τον άνθρωπο. Από αμνημονεύτων χρόνων, οι άνθρωποι έχουν συναντήσει σίδηρο με τη μορφή σιδερένιων μετεωριτών. Τυπικά, ο σίδηρος από μετεωρίτη περιέχει από 5 έως 30% νικέλιο, σχεδόν 0,5% κοβάλτιο και έως 1% άλλα στοιχεία. Ο μεγαλύτερος μετεωρίτης, ο Γκόμπα, έπεσε στην Αφρική πριν από 80 χιλιάδες χρόνια, ζύγιζε 66 τόνους. Περιέχει 84% αδέναςκαι 16% νικέλιο. Στο μουσείο μετεωριτών της Ρωσικής Ακαδημίας Επιστημών, φυλάσσονται δύο θραύσματα ενός σιδερένιου μετεωρίτη, που ζυγίζουν 256 κιλά, που έπεσαν πάνω Απω Ανατολή. Το 1947, στην επικράτεια Primorsky, σε μια περιοχή 35 km 2, χιλιάδες θραύσματα (που ζυγίζουν από 60 έως 100 τόνους) ενός σιδερένιου μετεωρίτη έπεσαν σαν «σιδηρά βροχή». Ένα πολύ σπάνιο ορυκτό - εγγενής σίδηρος χερσαίας προέλευσης, εμφανίζεται με τη μορφή μικρών κόκκων και περιέχει 2% νικέλιο και δέκατα του τοις εκατό άλλων μετάλλων. Ο φυσικός σίδηρος βρέθηκε στη Σελήνη σε θρυμματισμένη κατάσταση.
Τον 13ο-12ο αιώνα π.Χ. Υπάρχει κατάρρευση και αλλαγή πολιτισμών σε ολόκληρο τον χώρο της Ευρασίας από τον Ατλαντικό έως τον Ειρηνικό Ωκεανό, και κατά τη διάρκεια αρκετών αιώνων - μέχρι τους 10-8 αιώνες π.Χ. συμβαίνουν μεταναστεύσεις λαών. Αυτή η περίοδος ονομάστηκε καταστροφή της Εποχής του Χαλκού και η αρχή της μετάβασης στην Εποχή του Σιδήρου.
Υπάρχει πολύς σίδηρος στον φλοιό της γης, αλλά είναι δύσκολο να εξαχθεί. Αυτό το μέταλλο είναι στενά συνδεδεμένο στα μεταλλεύματα με οξυγόνο και μερικές φορές με θείο. Οι αρχαίοι φούρνοι δεν μπορούσαν να παράγουν την απαιτούμενη θερμοκρασία στην οποία έλιωνε ο καθαρός σίδηρος και ο σίδηρος λαμβανόταν σε μορφή σφουγγαριού με ακαθαρσίες από ένα μετάλλευμα που ονομαζόταν κρίτσα. Κατά τη σφυρηλάτηση της κρίτσας, το σίδερο διαχωριζόταν μερικώς από το μετάλλευμα.
Πολλά μέταλλα περιέχουν σίδηρο. Το μαγνητικό σιδηρομετάλλευμα, που περιέχει 72,3% σίδηρο, είναι το πλουσιότερο ορυκτό σε σίδηρο. Ο αρχαίος Έλληνας φιλόσοφος Θαλής από τη Μίλητο πριν από περισσότερα από 2.500 χρόνια μελέτησε δείγματα σιδηρούχων μετάλλων που προσελκύουν σίδηρο. Του έδωσε το όνομα magnetis lithos - μια πέτρα από τη Μαγνησία, έτσι προέκυψε το όνομα του μαγνήτη. Είναι πλέον γνωστό ότι ήταν μαγνητικό σιδηρομετάλλευμα - μαύρο οξείδιο του σιδήρου.
Ο ρόλος του σιδήρου σε έναν ζωντανό οργανισμό
Το πιο σημαντικό σιδηρομετάλλευμα είναι ο αιματίτης. Περιέχει 69,9% σίδηρο. Ο αιματίτης ονομάζεται επίσης κόκκινος σιδηρόλιθος και η αρχαία ονομασία είναι αιμολιθική. Από το ελληνικό haima, που σημαίνει αίμα. Εμφανίστηκαν και άλλες λέξεις που σχετίζονται με το αίμα, όπως η αιμοσφαιρίνη. Η αιμοσφαιρίνη χρησιμεύει ως φορέας οξυγόνου από τα αναπνευστικά όργανα στους ιστούς του σώματος και προς την αντίθετη κατεύθυνση μεταφέρει το διοξείδιο του άνθρακα. Η έλλειψη σιδήρου στον οργανισμό οδηγεί σε σοβαρή ασθένεια — Σιδηροπενική αναιμία. Με αυτή την ασθένεια, διαταραχές του σκελετού, του κεντρικού νευρικού και αγγειακά συστήματα, υπάρχει έλλειψη οξυγόνου στους ιστούς. Ο σίδηρος είναι απαραίτητος για τους ζωντανούς οργανισμούς. Βρίσκεται επίσης στους μύες, τη σπλήνα και το συκώτι. Ένας ενήλικας έχει περίπου 4 g σιδήρου· υπάρχει σε κάθε κύτταρο του σώματος. Ένα άτομο πρέπει να λαμβάνει 15 χιλιοστόγραμμα σιδήρου κάθε μέρα με το φαγητό. Εάν υπάρχει έλλειψη σιδήρου, οι γιατροί συνταγογραφούν ειδικά φάρμακα που περιέχουν σίδηρο σε εύπεπτη μορφή.
Εφαρμογές Σιδήρου
Εάν ο λιωμένος σίδηρος περιέχει περισσότερο από 2% άνθρακα, τότε λαμβάνεται χυτοσίδηρος· τήκεται εκατοντάδες βαθμούς χαμηλότερα από τον καθαρό σίδηρο. Δεδομένου ότι ο χυτοσίδηρος είναι εύθραυστος, μπορεί να χρησιμοποιηθεί μόνο για τη χύτευση διαφόρων προϊόντων, δεν μπορεί να σφυρηλατηθεί. Το σιδηρομετάλλευμα τήκεται σε υψικάμινους ένας μεγάλος αριθμός απόχυτοσίδηρος, ο οποίος χρησιμοποιείται για τη χύτευση μνημείων, σχαρών και βαρέων κρεβατιών μηχανών. Το μεγαλύτερο μέρος του χυτοσιδήρου μεταποιείται σε χάλυβα. Για να γίνει αυτό, μέρος του άνθρακα και άλλες ακαθαρσίες «καίγονται» από χυτοσίδηρο σε μετατροπείς ή φούρνους ανοιχτής εστίας.
Όλα τα αντικείμενα από τις ράγες μέχρι τα καρφιά είναι κατασκευασμένα από χάλυβα με διαφορετική περιεκτικότητα σε άνθρακα. Εάν υπάρχει λίγος άνθρακας στο σίδερο, λαμβάνεται μαλακός χάλυβας χαμηλής περιεκτικότητας σε άνθρακα, και με την εισαγωγή ακαθαρσιών κραμάτων άλλων στοιχείων στον χάλυβα, λαμβάνονται διαφορετικές ποιότητες ειδικών χάλυβων. Είναι γνωστή μια τεράστια ποικιλία από χάλυβα και ο καθένας έχει τη δική του εφαρμογή.
Το πιο γνωστό είναι ο ανοξείδωτος χάλυβας, ο οποίος περιέχει νικέλιο και χρώμιο. Ο εξοπλισμός για τις χημικές εγκαταστάσεις και τα επιτραπέζια σκεύη κατασκευάζονται από αυτόν τον χάλυβα. Και αν προσθέσετε 18% βολφράμιο, 1% βανάδιο και 4% χρώμιο στον χάλυβα, θα έχετε χάλυβας υψηλής ταχύτητας, τρυπάνια και μύτες κοπής κατασκευάζονται από αυτό. Εάν συντήξετε το σίδερο με 1,5% άνθρακα και 15% μαγγάνιο, θα έχετε το είδος του σκληρού χάλυβα που χρησιμοποιείται για την κατασκευή λεπίδων μπουλντόζας και δοντιών εκσκαφέων. Ο χάλυβας που περιέχει 36% νικέλιο, 0,5% άνθρακα και 0,5% μαγγάνιο ονομάζεται invar· από αυτόν κατασκευάζονται όργανα ακριβείας και ορισμένα εξαρτήματα ρολογιών. Ο χάλυβας, που ονομάζεται πλατινίτης, περιέχει 46% νικέλιο και 15% άνθρακα και διαστέλλεται όταν θερμαίνεται, ακριβώς όπως το γυαλί. Η ένωση του πλατινίτη με το γυαλί δεν ραγίζει και ως εκ τούτου χρησιμοποιείται στην κατασκευή ηλεκτρικών λαμπτήρων.
Ο ανοξείδωτος χάλυβας δεν μαγνητίζεται και δεν έλκεται από μαγνήτη. Μόνο ανθρακούχο χάλυβα μπορεί να μαγνητιστεί. Ο ίδιος ο καθαρός σίδηρος δεν μαγνητίζεται, αλλά έλκεται από έναν μαγνήτη· αυτός ο σίδηρος είναι κατάλληλος για την κατασκευή πυρήνων ηλεκτρομαγνητών.
Περισσότεροι από ένα δισεκατομμύριο τόνοι σιδήρου λιώνουν ετησίως στον κόσμο. Αλλά η διάβρωση, που είναι ένας τρομερός εχθρός του μετάλλου, όχι μόνο καταστρέφει το ίδιο το μέταλλο, η τήξη του οποίου ξοδεύτηκε σπουδαία προσπάθεια, απενεργοποιεί επίσης τα τελικά προϊόντα που είναι πιο ακριβά από το ίδιο το μέταλλο. Κάθε χρόνο καταστρέφει δεκάδες εκατομμύρια τόνους λιωμένο μέταλλο. Όταν ο σίδηρος διαβρώνεται, αντιδρά με το οξυγόνο και το νερό, μετατρέποντας σε σκουριά.

Σίδηρος, η θέση του στον περιοδικό πίνακα των χημικών στοιχείων του D.I. Mendeleev, αλληλεπίδραση με διαλύματα θείου, υδροχλωρικού οξέος, αλάτων.
ΣΧΕΔΙΟ ΑΠΑΝΤΗΣΕΩΝ:
θέση στο π.σ. και ατομική δομή φυσικές ιδιότητες Χημικές ιδιότητεςΤο χημικό στοιχείο σίδηρος βρίσκεται στην 4η περίοδο της 8ης ομάδας της δευτερεύουσας υποομάδας. Ένα άτομο σιδήρου έχει τέσσερις στοιβάδες ηλεκτρονίων. Το d-υποεπίπεδο του τρίτου στρώματος είναι γεμάτο με ηλεκτρόνια· υπάρχουν 6 ηλεκτρόνια πάνω του και το s-υποεπίπεδο στο τέταρτο στρώμα περιέχει 2 ηλεκτρόνια. Στις ενώσεις, ο σίδηρος εμφανίζει καταστάσεις οξείδωσης +2 και +3.
| IV περίοδος VIII ομάδα δευτερεύουσα υποομάδα | Fe)))) | +2 | +3 | ||
| +26 2 8 8+6 2 | 4s | ?? | |||
| 3d | ?? | ? | ? | ? | ? |
Η απλή ουσία σίδηρος είναι ένα ασημί-λευκό μέταλλο με σημείο τήξης 15390C, πυκνότητα 7,87 g/cm3 και έχει μαγνητικές ιδιότητες. Ο σίδηρος είναι ένα αντιδραστικό μέταλλο. Όταν θερμαίνεται, αντιδρά με το θείο για να σχηματίσει θειούχο σίδηρο(II): Fe0 + S0 = Fe+2S-2. Ο σίδηρος εκτοπίζει το υδρογόνο από τα όξινα διαλύματα και σχηματίζονται άλατα σιδήρου (II), για παράδειγμα, όταν δρουν στο σίδηρο υδροχλωρικού οξέοςΣχηματίζεται χλωριούχος σίδηρος(II): Fe0 + 2H+1Cl-1 = Fe+2Cl2-1 + H20. Ο σίδηρος μπορεί να εκτοπίσει λιγότερο ενεργά μέταλλα από διαλύματα των αλάτων τους, για παράδειγμα, όταν ο σίδηρος δρα σε διάλυμα θειικού χαλκού (II), σχηματίζεται μεταλλικός χαλκός και θειικός σίδηρος (II): Fe0 + Cu + 2SO4 = Cu0 + Fe + 2SO4 .
Σε όλες τις αντιδράσεις, ο σίδηρος εμφανίζει τις ιδιότητες ενός αναγωγικού παράγοντα. Ισχυρότερα οξειδωτικά μέσα - χλώριο, οξυγόνο, συμπυκνωμένα οξέα - οξειδώνουν τον σίδηρο σε κατάσταση οξείδωσης +3.
Αν εργασία για το σπίτιμε θέμα: » Σίδηρος, η θέση του στον περιοδικό πίνακα των χημικών στοιχείων D I Mendeleev, αλληλεπίδρασηΕάν το βρείτε χρήσιμο, θα είμαστε ευγνώμονες αν δημοσιεύσετε έναν σύνδεσμο προς αυτό το μήνυμα στη σελίδα σας στο κοινωνικό σας δίκτυο.
Τελευταία νέα
Κατηγορίες
Νέα
Δοκίμια για το θέμα
- Gymnasium No. 12, Lipetsk Znamenshchikova Nadezhda Aleksandrovna Θέμα μαθήματος: Ο σίδηρος και οι ενώσεις του (βαθμός 9) Σκοπός: να σχηματιστεί η έννοια της εξάρτησης της κατεύθυνσης των αντιδράσεων οξείδωσης από τη δοκιμή "Χημικό στοιχείο" Τα ονόματα των χημικών στοιχείων είναι κυρίως …… . Προέλευση Τα σημάδια των χημικών στοιχείων υποδεικνύονται με λατινικά γράμματα στα αγγλικά και γράμματα με ρωσικά γράμματα Συμπληρώστε τα κενά στον πίνακα Μάθημα Χημικής Χημείας στην τάξη 9 με θέμα "Ο κόσμος των μετάλλων". Η ανάπτυξη συντάχθηκε από έναν δάσκαλο χημείας του δημοτικού αυτόνομου εκπαιδευτικού ιδρύματος «Bazarno-Matakskaya δευτεροβάθμια γενική εκπαίδευση Δοκιμήστη χημεία με θέμα «Οξυγόνο και θείο» Επιλογή 1 1. Να δημιουργήσετε εξισώσεις για την ηλεκτρολυτική διάσταση του θειικού οξέος. 2. Δημιουργήστε μια πλήρη και συντομευμένη εξίσωση
- Ενιαίο Κρατικό Εξεταστικό τεστ στη χημεία Αναστρέψιμο και μη αναστρέψιμο χημικές αντιδράσειςΑπαντήσεις χημικής ισορροπίας
Αναστρέψιμες και μη αναστρέψιμες χημικές αντιδράσεις. Χημική ισορροπία. Μετατόπιση της χημικής ισορροπίας υπό την επίδραση διάφορους παράγοντες 1. Χημική ισορροπία στο σύστημα 2NO(g).
Το νιόβιο στη συμπαγή του κατάσταση είναι ένα λαμπερό ασημί-λευκό (ή γκρι όταν είναι σε σκόνη) παραμαγνητικό μέταλλο με ένα κυβικό κρυσταλλικό πλέγμα στο κέντρο του σώματος.
Ουσιαστικό. Ο κορεσμός του κειμένου με ουσιαστικά μπορεί να γίνει μέσο γλωσσικής μεταφορικότητας. Το κείμενο του ποιήματος του A. A. Fet «Whisper, tid breathing...», στο δικό του
1. Σίδηρος: θέση στον περιοδικό πίνακα των χημικών στοιχείων του D.I. Mendeleev, ατομική δομή, πιθανές καταστάσεις οξείδωσης, φυσικές ιδιότητες, αλληλεπίδραση με οξυγόνο, αλογόνα, διαλύματα οξέων και αλάτων. Ο ρόλος του σιδήρου στη σύγχρονη τεχνολογία. Κράματα σιδήρου.
Ο σίδηρος ανήκει σε μια δευτερεύουσα υποομάδα της ομάδας VIII Περιοδικός Πίνακας. Ηλεκτρονικός τύπος του ατόμου σιδήρου:
Οι τυπικές καταστάσεις οξείδωσης του σιδήρου είναι +2 και +3. Η κατάσταση οξείδωσης +2 συμβαίνει λόγω της απώλειας δύο ηλεκτρονίων 4s. Η κατάσταση οξείδωσης +3 αντιστοιχεί επίσης στην απώλεια ενός ακόμη ηλεκτρονίου Zd και η στάθμη Zd είναι κατά το ήμισυ γεμάτη. Τέτοιες ηλεκτρονικές διαμορφώσεις είναι σχετικά σταθερές.
Φυσικές ιδιότητες.Ο σίδηρος είναι ένα τυπικό μέταλλο, σχηματίζει ένα μέταλλο κρυσταλλικού πλέγματος. Ο σίδηρος άγει τον ηλεκτρισμό, είναι αρκετά πυρίμαχος, σημείο τήξης 1539°C. Ο σίδηρος διαφέρει από τα περισσότερα άλλα μέταλλα ως προς την ικανότητά του να μαγνητίζεται.
Χημικές ιδιότητες.Ο σίδηρος αντιδρά με πολλά αμέταλλα:
![]()
Σχηματίζεται ζυγαριά σιδήρου - μικτό οξείδιο σιδήρου. Ο τύπος του γράφεται επίσης ως εξής: FeO Fe2O3.
![]()
Αντιδρά με οξέα για να απελευθερώσει υδρογόνο:
Εισέρχεται σε αντιδράσεις υποκατάστασης με εντοπισμένα μεταλλικά άλατα στα δεξιά του σίδερουστη σειρά τάσεων:
Ενώσεις σιδήρου.Το FeO είναι ένα βασικό οξείδιο που αντιδρά με διαλύματα οξέος για να σχηματίσει άλατα σιδήρου (II). Το Fe2O3 είναι ένα αμφοτερικό οξείδιο που επίσης αντιδρά με αλκαλικά διαλύματα.

Υδροξείδια σιδήρου.Το Fe(OH)2 είναι ένα τυπικό βασικό οξείδιο· το Fe(OH)3 έχει αμφοτερικές ιδιότητες και αντιδρά όχι μόνο με οξέα, αλλά και με πυκνά διαλύματα αλκαλίων.
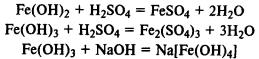
Το υδροξείδιο του σιδήρου (II) οξειδώνεται εύκολα σε υδροξείδιο του σιδήρου (III) από το ατμοσφαιρικό οξυγόνο:
Όταν τα άλατα σιδήρου (II) και (III) αντιδρούν με αλκάλια, καθιζάνουν αδιάλυτα υδροξείδια:
Κράματα σιδήρου.Η σύγχρονη μεταλλουργική βιομηχανία παράγει κράματα σιδήρου διαφόρων συνθέσεων.
Όλα τα κράματα σιδήρου χωρίζονται σε δύο ομάδες ανάλογα με τη σύνθεση και τις ιδιότητες. Η πρώτη ομάδα περιλαμβάνει διάφορους τύπους χυτοσιδήρου, η δεύτερη ομάδα περιλαμβάνει διάφορους τύπους χάλυβα.
Ο χυτοσίδηρος είναι εύθραυστος. Ο χάλυβας είναι όλκιμος, μπορούν να σφυρηλατηθούν, να τυλιχτούν, να συρθούν, να σφραγιστούν. Η διαφορά στις μηχανικές ιδιότητες του χυτοσιδήρου και του χάλυβα εξαρτάται κυρίως από την περιεκτικότητά τους σε άνθρακα - ο χυτοσίδηρος περιέχει περίπου 4% άνθρακα και ο χάλυβας συνήθως περιέχει λιγότερο από 1,4%.
Στη σύγχρονη μεταλλουργία, ο χυτοσίδηρος παράγεται αρχικά από μεταλλεύματα σιδήρου και στη συνέχεια ο χάλυβας λαμβάνεται από χυτοσίδηρο. Ο χυτοσίδηρος τήκεται σε υψικάμινους, ο χάλυβας μαγειρεύεται σε κλίβανους τήξης χάλυβα. Έως και το 90% του συνόλου του λιωμένου σιδήρου μεταποιείται σε χάλυβα.
Χυτοσίδηρος. Ο χυτοσίδηρος που προορίζεται για επεξεργασία σε χάλυβα ονομάζεται χυτοσίδηρος. Περιέχει από 3,9 έως 4,3% C, 0,3-1,5% Si, 1,5-3,5% Mn, όχι περισσότερο από 0,3% P και όχι περισσότερο από 0,07% S. Ο χυτοσίδηρος, που προορίζεται "για την παραγωγή χυτοσιδήρου, ονομάζεται χυτοσίδηρος. Σιδηροκράματα τήκονται επίσης σε υψικάμινους, οι οποίες χρησιμοποιούνται κυρίως στην παραγωγή χάλυβα ως πρόσθετα.Τα σιδηροκράματα έχουν, σε σύγκριση με τον χυτοσίδηρο, αυξημένη περιεκτικότητα σε πυρίτιο (σιδηροπυρίτιο), μαγγάνιο (σιδηρομαγγάνιο), χρώμιο (σιδηρόχρωμο) και άλλα στοιχεία.
Γίνομαι. Όλοι οι χάλυβες χωρίζονται σε άνθρακα και κράμα.
Οι ανθρακούχες χάλυβες περιέχουν πολλές φορές λιγότερο άνθρακα, πυρίτιο και μαγγάνιο από τον χυτοσίδηρο και πολύ λίγο φώσφορο και θείο. Οι ιδιότητες του ανθρακούχου χάλυβα εξαρτώνται κυρίως από την περιεκτικότητα σε άνθρακα σε αυτόν: όσο περισσότερος άνθρακας στον χάλυβα, τόσο πιο σκληρός είναι. Η βιομηχανία παράγει μαλακούς χάλυβες, μέτριας σκληρότητας χάλυβες και σκληρούς χάλυβες. Οι μαλακοί χάλυβες και οι μέτριας σκληρότητας χάλυβες χρησιμοποιούνται για την κατασκευή εξαρτημάτων μηχανών, σωλήνων, μπουλονιών, καρφιών κ.λπ., ενώ οι σκληροί χάλυβες χρησιμοποιούνται για την κατασκευή εργαλείων.
Οι χάλυβες πρέπει να περιέχουν όσο το δυνατόν λιγότερο θείο και φώσφορο, καθώς αυτές οι ακαθαρσίες επιδεινώνουν τις μηχανικές ιδιότητες των χάλυβα. Σε αυξημένες ποσότητες, το θείο προκαλεί ερυθρότητα - το σχηματισμό ρωγμών κατά τη θερμή κατεργασία μετάλλου. Ο φώσφορος προκαλεί ψυχρή ευθραυστότητα στον χάλυβα σε συνηθισμένες θερμοκρασίες. -
Κραματοποιημένοι χάλυβες.Οι φυσικές, χημικές και μηχανικές ιδιότητες των χάλυβα αλλάζουν σημαντικά από την εισαγωγή τους αυξημένο ποσόμαγγάνιο και πυρίτιο, καθώς και χρώμιο, νικέλιο, βολφράμιο και άλλα στοιχεία. Αυτά τα στοιχεία ονομάζονται στοιχεία κράματος και οι χάλυβες ονομάζονται στοιχεία κράματος [από τη λατινική λέξη ligare - συνδέω, συνδέω].
Το χρώμιο είναι το πιο ευρέως χρησιμοποιούμενο στοιχείο κράματος. Ειδικά μεγάλης σημασίαςγια την κατασκευή μηχανημάτων, συσκευών και πολλών ανταλλακτικών μηχανών έχουν χρώμιο-νικέλιογίνομαι. Αυτοί οι χάλυβες έχουν υψηλή ολκιμότητα, αντοχή, αντοχή στη θερμότητα και αντοχή σε οξειδωτικά μέσα. Το νιτρικό οξύ οποιασδήποτε συγκέντρωσης δεν τα καταστρέφει ακόμη και σε θερμοκρασίες βρασμού. Οι χάλυβες χρωμιονικελίου δεν σκουριάζουν σε ατμοσφαιρικές συνθήκες και στο νερό. Λαμπερά, ασημί φύλλα από χάλυβα χρωμίου-νικελίου διακοσμούν τις καμάρες του σταθμού Mayakovskaya του μετρό της Μόσχας. Από τον ίδιο χάλυβα κατασκευάζονται ανοξείδωτα μαχαίρια, κουτάλια, πιρούνια και άλλα είδη οικιακής χρήσης.
Το μολυβδαίνιο και το βανάδιο αυξάνουν τη σκληρότητα και την αντοχή των χάλυβων σε υψηλές θερμοκρασίεςκαι πιέσεις. Ετσι, χρώμιο μολυβδαίνιοΚαι χρώμιο βανάδιοΟι χάλυβες χρησιμοποιούνται για την κατασκευή αγωγών και εξαρτημάτων συμπιεστών για την παραγωγή συνθετικής αμμωνίας και κινητήρων αεροσκαφών.
Όταν κόβετε σε υψηλές ταχύτητες, το εργαλείο ζεσταίνεται πολύ και φθείρεται γρήγορα. Με την προσθήκη βολφραμίου, η σκληρότητα του χάλυβα διατηρείται ακόμη και σε υψηλές θερμοκρασίες. Ως εκ τούτου, οι χάλυβες χρωμίου-βολφραμίου χρησιμοποιούνται για την κατασκευή κοπτικών εργαλείων που λειτουργούν σε υψηλές ταχύτητες».
Η αύξηση της περιεκτικότητας σε μαγγάνιο στον χάλυβα αυξάνει την αντοχή του στην τριβή και την κρούση. Οι χάλυβες μαγγανίου χρησιμοποιούνται για την κατασκευή ράμπων σιδηροδρόμων, διακοπτών, σταυρών και μηχανών σύνθλιψης πέτρας.
Η χρήση κραματοποιημένων χάλυβων καθιστά δυνατή τη σημαντική μείωση του βάρους των μεταλλικών κατασκευών, την αύξηση της αντοχής, της ανθεκτικότητας και της λειτουργικής αξιοπιστίας τους.
2. σκίουροιως βιοπολυμερή. Πρωτογενείς, δευτερογενείς και τριτοταγείς δομές πρωτεϊνών. Ιδιότητες και βιολογικές λειτουργίεςπρωτεΐνες.
Πρωτεΐνες (πρωτεΐνες, πολυπεπτίδια) - υψηλό μοριακό βάρος οργανική ύλη, που αποτελείται από άλφα-αμινοξέα συνδεδεμένα σε μια αλυσίδα με έναν πεπτιδικό δεσμό.
Οι πρωτεΐνες, όπως και οι πολυσακχαρίτες, είναι βιολογικά πολυμερή. Τα περισσότερα μόρια πρωτεΐνης φτάνουν σε γιγαντιαία μεγέθη σε σύγκριση με άλλες οργανικές ενώσεις και έχουν πολύ μεγάλο μοριακό βάρος:
Ο μοριακός τύπος μιας από τις πρωτεΐνες της ομάδας πενικιλίνης είναι C 43 H 58 N 4 O 12. καζεΐνη - πρωτεΐνη αγελαδινό γάλα, – C 47 H 48 N 3 NaO 7 S 2 ; αιμοσφαιρίνη - C 3032 H 48I6 O 872 N 780 S 8 Fe 4;


