11.04.2018
Proprietățile chimice ale substanțelor simple: metale și nemetale
În sistemul periodic, fierul se află în perioada a patra, în subgrupa secundară a grupei VIII.
Numărul de serie este 26, formula electronică este 1s 2 2s 2 2p 6 3d 6 4s 2.
Electronii de valență ai unui atom de fier se află pe ultimul strat de electroni (4s 2) și penultimul (3d 6). În reacțiile chimice, fierul poate dona acești electroni și poate prezenta stări de oxidare de +2, +3 și uneori +6.
Fierul este al doilea cel mai abundent metal din natură (după aluminiu). Cei mai importanți compuși naturali: Fe2O3x3H2O - minereu de fier brun; Fe2O3 - minereu de fier roșu; Fe3O4 (FeO Fe2O3) - minereu de fier magnetic; FeS2 - pirita de fier (pirită). Compușii de fier fac parte din organismele vii.
Fierul este un metal cenușiu argintiu, are o mare maleabilitate, ductilitate și proprietăți magnetice puternice. Densitatea fierului este de 7,87 g/cm3, punctul de topire este de 1539C.
Luarea de fier
În industrie, fierul se obține prin reducerea lui din minereurile de fier cu carbon (cocs) și monoxid de carbon (II) în furnalele înalte.
Chimia procesului de domeniu este după cum urmează:
C + O 2 \u003d CO 2,
3Fe 2 O 3 + CO \u003d 2Fe 3 O 4 + CO 2,
Fe 3 O 4 + CO \u003d 3FeO + CO 2,
FeO + CO \u003d Fe + CO 2.
În reacții fierul este un agent reducător. Cu toate acestea, când temperatura normala nu interacționează nici cu cei mai activi agenți oxidanți (halogeni, oxigen, sulf), dar atunci când este încălzit devine activ și reacționează cu aceștia:
2Fe + 3Cl 2 = 2FeCl 3 Clorura de fier (III)
3Fe + 2O 2 \u003d Fe 3 O 4 (FeO x Fe 2 O 3) Oxid de fier (II, III)
Fe + S = FeS Sulfura de fier(II).
La foarte temperatura ridicata fierul reacționează cu carbonul, siliciul și fosforul:
3Fe + C = Fe 3 C Carbură de fier (cementită)
3Fe + Si = Fe 3 Si Siliciur de fier
3Fe + 2P \u003d Fe 3 P 2 fosfură de fier (II)
În aer umed, fierul se oxidează rapid (corodează):
4Fe + 3O 2 + 6H 2 O \u003d 4Fe (OH) 3,
Fierul se află în mijlocul seriei de tensiune electrochimică a metalelor, prin urmare se află metal cu activitate medie. Capacitatea de reducere a fierului este mai mică decât cea a metalelor alcaline, alcalino-pământoase și a aluminiului. Numai la temperaturi ridicate fierul fierbinte reacționează cu apa:
3Fe + 4H 2 O \u003d Fe 3 O 4 + 4H 2
Fierul reacționează cu acizii sulfuric și clorhidric diluați, înlocuind hidrogenul din acizi:
Fe + 2HCl \u003d FeCl 2 + H 2
Fe + H 2 SO 4 \u003d FeSO 4 + H 2
La temperatura normala fierul nu interacționează cu acidul sulfuric concentrat, deoarece este pasivizat de acesta . Când este încălzit, H2SO4 concentrat oxidează fierul în sulfit de fier (III):
2Fe + 6H 2 SO 4 \u003d Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O.
Acidul azotic diluat oxidează fierul în nitrat de fier (III):
Fe + 4HNO 3 \u003d Fe (NO 3) 3 + NO + 2H 2 O.
Acidul azotic concentrat pasivează fierul.
Din soluțiile sărate, fierul înlocuiește metalele care sunt situate în dreapta lui în seria electrochimică de tensiuni:
Fe + CuSO 4 \u003d FeSO 4 + Cu
Oxid de fier (II). FeO- oxidul bazic reacționează ușor cu acizii, în timp ce se formează săruri de fier(II):
FeO + 2HCl \u003d FeCl 2 + H 2O
FeO + 2H + = Fe2+ + H2O
Hidroxid de fier (II) Fe (OH) 2 - pulbere albă, insolubilă în apă. Se obține din sărurile de fier (II) prin interacțiunea cu alcalii:
FeSO 4 + 2NaOH \u003d Fe (OH) 2 + Na 2 SO 4,
Fe(OH) 2 prezintă proprietățile unei baze, reacționează ușor cu acizii:
Fe (OH) 2 + 2HCl \u003d FeCl 2 + 2H 2 O,
Fe(OH)2 + 2H+ = Fe2+ + 2H2O.
Când este încălzit, hidroxidul de fier (II) se descompune:
Fe (OH) 2 \u003d FeO + H 2O.
Compușii cu starea de oxidare a fierului +2 prezintă proprietăți reducătoare, deoarece Fe 2+ se oxidează ușor la Fe +3: Fe +2 - 1e \u003d Fe +3
Deci, un precipitat verzui proaspăt obținut de Fe (OH) 2 în aer își schimbă foarte repede culoarea - devine maro. Schimbarea culorii este explicată prin oxidarea Fe (OH) 2 la Fe (OH) 3 de către oxigenul atmosferic:
4Fe(OH)2 + O2 + 2H20 = 4Fe(OH)3.
Oxid de fier (III) Fe 2 O 3 - pulbere brună, insolubilă în apă.
Oxidul de fier (III) se obține prin descompunerea hidroxidului de fier (III):
2Fe(OH)3 = Fe2O3 + 3H2O
Oxidul de fier (III) prezintă proprietăți amfotere:
interacționează cu acizi și alcaline solide NaOH și KOH, precum și cu carbonați de sodiu și potasiu la temperatură ridicată:
Fe 2 O 3 + 2NaOH \u003d 2NaFeO 2 + H 2 O,
Fe 2 O 3 + 2OH - \u003d 2FeO 2- + H2O,
Fe 2 O 3 + Na 2 CO 3 \u003d 2NaFeO 2 + CO 2.
ferită de sodiu
Hidroxid de fier (III). obținute din sărurile de fier (III) atunci când interacționează cu alcalii:
FeCl 3 + 3NaOH \u003d Fe (OH) 3 + 3NaCl,
Hidroxidul de fier (III) este o bază mai slabă decât Fe (OH) 2 și prezintă proprietăți amfotere (cu predominarea celor principale). Când interacționează cu acizii diluați, Fe (OH) 3 formează cu ușurință sărurile corespunzătoare:
Fe(OH)3 + 3HCI = FeCI3 + H2O
2Fe(OH) 3 + 3H 2 SO 4 = Fe 2 (SO 4) 3 + 6H 2 O
Reacțiile cu soluții alcaline concentrate au loc numai cu încălzire prelungită.:
Fe (OH) 3 + KOH \u003d K
Compuși cu stare de oxidare a fierului +3 prezinta proprietati oxidante , deoarece sub acțiunea agenților reducători Fe + 3 se transformă în Fe + 2: Fe + 3 + 1e \u003d Fe + 2.
Deci, de exemplu, clorura de fier (III) oxidează iodura de potasiu la iod liber:
2FeCl 3 + 2KI = 2FeCl 2 + 2KCl + I 2 0
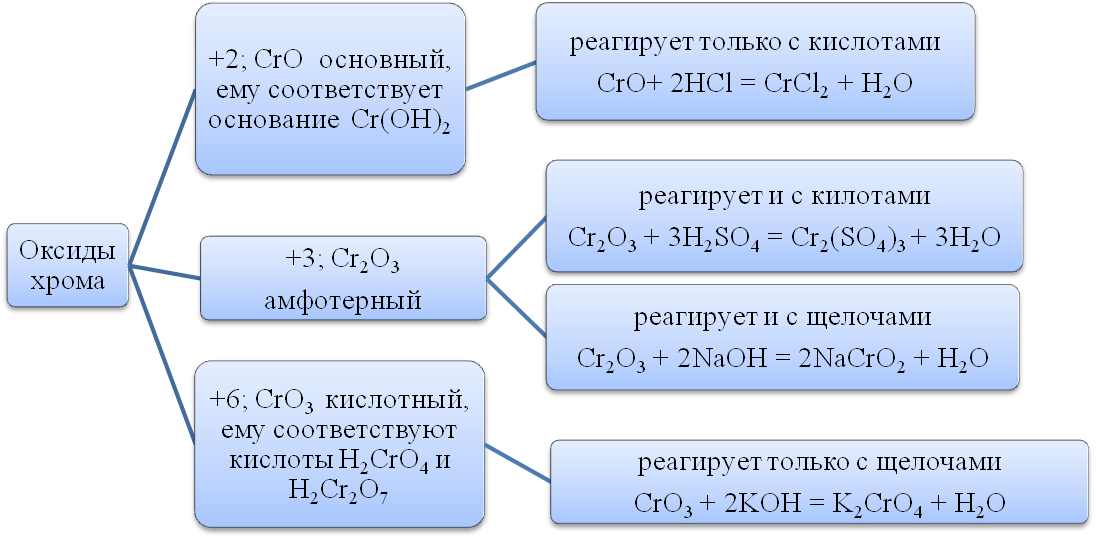
Crom.
 Cromul se află într-un subgrup lateral al grupului VI al sistemului periodic. Structura învelișului de electroni a cromului: Cr 3d 5 4s 1. Stările de oxidare sunt de la +1 la +6, dar cele mai stabile sunt +2, +3, +6.
Cromul se află într-un subgrup lateral al grupului VI al sistemului periodic. Structura învelișului de electroni a cromului: Cr 3d 5 4s 1. Stările de oxidare sunt de la +1 la +6, dar cele mai stabile sunt +2, +3, +6.
Fracția de masă a cromului în Scoarta terestra este 0,02%. Cele mai importante minerale care alcătuiesc minereurile de crom sunt cromitul sau minereul de crom de fier și soiurile sale, în care fierul este parțial înlocuit cu magneziu, iar cromul cu aluminiu.
Cromul este un metal gri argintiu. Cromul pur este destul de ductil, în timp ce cromul tehnic este cel mai dur dintre toate metalele.
Cromul este inactiv din punct de vedere chimic . În condiții normale, reacționează numai cu fluor (din nemetale), formând un amestec de fluoruri. La temperaturi ridicate (peste 600°C) interacționează cu oxigenul, halogenii, azotul, siliciul, borul, sulful, fosforul:
4Cr + 3O 2 = 2Cr 2 O 3
2Cr + 3Cl 2 = 2CrCl 3
2Cr + N2 = 2CrN
2Cr + 3S = Cr2S3
În acizii azotic și sulfuric concentrat, se pasivează, acoperit cu o peliculă de oxid protector. Se dizolvă în acizi clorhidric și sulfuric diluat, iar dacă acidul este complet eliberat de oxigenul dizolvat, se obțin săruri de crom (II), iar dacă reacția are loc în aer, săruri de crom (III): Cr + 2HCl \u003d CrCl 2 + H2; 2Cr + 6HCl + O 2 = 2CrCl 3 + 2H 2 O + H 2
1. Proprietăți nemetalice substanțe simple intensifică la rând
1) azot → fosfor → arsen 2) fluor → clor → brom
3) seleniu → sulf → oxigen 4) fosfor → siliciu → aluminiu
2. Atât sodiul, cât și cuprul reacţionează cu
1) hidroxid de sodiu 2) apă 3) hidrogen 4) acid azotic
3. Atat fierul cat si zincul reactioneaza cu
1) hidroxid de magneziu 2) monoxid de carbon (II) 3) sulfat de cupru (II) 4) apă
4. Fierul reacționează cu fiecare dintre cele două substanțe 1) O2 și NaCl 2) KOH și H2S 3) HCl și S 4) Na2S și K2O
5. Aluminiu nu reactioneaza cu solutie
1) acid sulfuric 2) sulfat de magneziu 3) hidroxid de sodiu 4) cupru (II) azotat
6. Acidul sulfuric diluat interacționează cu 1) Zn 2) Ag 3) NaNO3 4) SO2
7. Cu care dintre următoarele metale reacționează acid clorhidric?
1) argint 2) aur 3) aluminiu 4) cupru
8. Reacționează atât cu zincul, cât și cu cuprul
1) clor 2) monoxid de carbon (II) 3) hidroxid de sodiu 4) acid clorhidric
9. Aluminiu nu reactioneaza din
1) apă 2) hidroxid de potasiu 3) acid clorhidric 4) clorură de sodiu
10. Fiecare dintre cele două substanțe poate reacționa cu fierul:
1) CuSO 4 și O 2 2) S și NaOH (p-p) 3) MgCl 2 și H 2 O 4) Na 2 SO 4 și Hg (NO 3) 2
11. Fiecare dintre cele două metale reacţionează cu apa la temperatura camerei:
1) Zn și Cu 2) K și Ca 3) Zn și K 4) Ca și Ag
12. Fiecare dintre cele două metale reacţionează cu o soluţie de acid sulfuric:
1) Zn și Hg 2) Ag și Mg 3) Zn și Mg 4) Cu și Hg
13. Reacționează cu litiul 1) azot 2) oxid de sodiu 3) calciu 4) fosfat de calciu
14. Aluminiul reacţionează cu
1) magneziu 2) monoxid de carbon (II) 3) fier (II) hidroxid 4) azotat de argint (soluție)
15. Atat zincul cat si calciul la temperatura camerei reactioneaza cu
1) apă 2) brom 3) hidroxid de sodiu 4) acid silicic
16. Fierul deplasează metalul din soluție
1) clorură de aluminiu 2) sulfat de zinc 3) azotat de cupru (II) 4) silicat de potasiu
17. Zincul la temperatura camerei reacționează cu fiecare dintre cele două substanțe:
1) acid clorhidric și azotat de argint 2) apă și hidroxid de sodiu
3) oxid de sulf (VI) și oxid de aluminiu 4) sulfat de cupru (II) și apă
18. Reacția este posibilă între 1) Fe și S 2) P și H2 3) Cl2 și O2 4) Fe și K
19. Formarea cuprului are loc ca urmare a reacției
1) hidrogen cu oxid de cupru (II) 2) hidrogen cu clorură de cupru (II)
3) argint cu clorură de cupru (II) 4) oxigen cu sulfură de cupru (II)
20. Soluția de acid clorhidric nu reacționează cu
1) argint 2) oxid de cupru (II) 3) hidroxid de cupru (II) 4) carbonat de cupru (II)
21. Cu magneziu nu reactioneaza 1) clor 2) oxid de calciu 3) acid clorhidric 4) sulfat de cupru (II) (soluție)
22. Cu cupru nu reactioneaza 1) clor 2) oxigen 3) acid sulfuric (conc.) 4) clorură de fier (II) (soluție)
23. Reacționează cu magneziul 1) cuprul 2) oxid de calciu 3) hidroxid de sodiu 4) acid azotic
24. 1) fier 2) zinc 3) cupru 4) interacționează cu o soluție alcalină
25. Aluminiul nu reacționează cu
1) acid sulfuric 2) hidroxid de sodiu 3) clorură de cupru (II) 4) hidroxid de zinc
26. Soluția reacționează cu fierul 1) Na2S 2) BaCl2 3) K2CO3 4) AgNO3
27. Magneziul reacționează cu
1) oxid de sodiu 2) sulfat de litiu 3) clorură de zinc (soluție) 4) hidroxid de potasiu (soluție)
28. Nu reacționează cu o soluție de cupru (II) sulfat 1) zinc 2) argint 3) fier 4) cositor
29 Zincul reacţionează cu
1) oxid de aluminiu 2) acid clorhidric 3) hidroxid de fier (III) 4) sulfură de fier (II)
treizeci . Atât litiul, cât și zincul reacţionează cu
31. Reacție practic fezabilă între o soluție de clorură de zinc și
1) fier 2) cupru 3) plumb 4) aluminiu
32. Soluția de azotat de cupru (II) poate interacționa
1) zinc 2) hidroxid de fier (III) 3) oxid de siliciu (IV) 4) carbon
33. Când este încălzit, este posibilă o reacție între
1) fier și sulf 2) azot și apă 3) cupru și oxid de sulf (IV) 4) fosfor și oxid de zinc
34. Aluminiul interacționează cu fiecare dintre cele două substanțe
1) K 2 O și K 2 SO 4 2) S și LiCl 3) Cl 2 și H 2 SO 4 4) H 2 O și Cu (OH) 2
35. Atat litiul cat si fierul la temperatura camerei reactioneaza cu
1) hidroxid de sodiu 2) apă 3) sulf 4) acid clorhidric
36. Reacționează atât cu magneziul, cât și cu aluminiul
1) clorură de sodiu 2) oxid de bariu 3) hidroxid de potasiu 4) acid sulfuric
37. Fierul reacționează cu 1) brom 2) oxid de sodiu 3) clorură de calciu 4) hidroxid de sodiu
38. Alcalii și hidrogenul se formează prin interacțiunea apei cu
1) siliciu 2) potasiu 3) zinc 4) aluminiu
39. Potasiul interacționează cu fiecare dintre cele două substanțe
1) H 2 O și S 2) O 2 și Ba 3) Cu și N 2 4) HCl și NaOH
40. Fier nu reactioneaza cu solutie
1) acid clorhidric 2) acid sulfuric 3) clorură de bariu 4) azotat de argint
41. Magneziul reacționează în condiții normale cu fiecare dintre cele două substanțe:
1) apă și acid clorhidric 2) apă și hidroxid de sodiu
3) acid clorhidric și hidroxid de sodiu 4) soluție de acid clorhidric și sulfat de cupru (II)
42. Fierul înlocuiește metalul din soluție 1) Zn(NO3)2 2) CuSO4 3) AlCl3 4) Ba(OH)2
43. Hidrogenul dintr-o soluție de acid fosforic se poate deplasa
1) fier 2) cupru 3) aur 4) argint
44. Potasiul interacționează cu fiecare dintre cele două substanțe: 1) Ca și O 2 2) Cu și N 2 3 HCl și S 4) H 2 O și NaOH
45. Pentru a reface metalele din oxizii lor, utilizați 1) CO 2 2) CO 3) SO 3 4) NU
46. Aluminiul interacționează cu fiecare dintre cele două substanțe:
1) Cl 2 și H 2 SO 4 2) S și NaCl 3) H 2 O și Cu (OH) 2 4) K 2 O și Na 2 SO 4
47. Care dintre următoarele metale înlocuiește hidrogenul dintr-o soluție de acid clorhidric?
1) mercur 2) cupru 3) fier 4) argint
48. 1) cuprul 2) aurul 3) zincul 4) argintul reacţionează cu acidul sulfuric diluat
49. Atat clorul cat si oxigenul reactioneaza cu
1) acid clorhidric 2) hidroxid de sodiu 3) apă 4) fier
50. Fierul în condiții normale reacționează cu fiecare dintre cele două substanțe
1) oxid de sulf (VI) și oxigen 2) hidrogen și carbon
3) oxigen și clor 4) apă și fier
51. 52. Fluorul în reacții 1) prezintă numai proprietățile unui agent reducător
2) prezintă proprietățile doar ale unui agent oxidant
3) poate prezenta proprietățile atât ale unui agent oxidant, cât și ale unui agent reducător
4) nu prezintă proprietăți redox
51. Atat magneziul cat si sodiul la temperatura camerei reactioneaza viguros cu
1) apă 2) acid clorhidric 3) hidroxid de bariu 4) carbonat de calciu
52. Intră reacția de substituție cu nitrat de plumb
1) hidrogen 2) fier 3) cupru 4) argint
53. Azotul reacţionează cu 1) apa 2) acidul clorhidric 3) oxigenul 4) fosforul
54. Cuprul reacţionează cu o soluţie de 1) AgNO3 2) FeSO4 3) Al2(SO4)3 4) NaOH
55. La temperatura camerei, fiecare dintre cele două metale reacţionează cu apa:
1) Ba și Fe 2) Ag și Al 3) Na și Ba 4) Pb și K
56. Zincul reacţionează cu 1) clorura de sodiu 2) clorura de cupru (II)
3) oxid de siliciu (IV) 4) oxid de fosfor (V).
57. Zincul înlocuiește metalul din soluție
1) azotat de potasiu 2) azotat de calciu 3) sulfat de cupru (II) 4) sulfat de magneziu
58. Reactioneaza cu oxigenul fara incalzire 1) sodiu 2) azot 3) argint 4) clor
59. Atât calciul, cât și fosforul alb reacţionează cu
1) acid clorhidric 2) hidroxid de potasiu 3) oxigen 4) apă
60. Fiecare dintre cele două metale reacţionează cu acidul clorhidric:
1) Ca și Ag 2) Hg și Na 3) Cu și Zn 4) Mg și Zn
61. Cu care dintre următoarele substanțe reacționează oxigenul în condiții normale?
1) azot) sodiu 3) oxid de aluminiu 4) monoxid de carbon (IV)
62. Reacționează cu oxigenul 1) cupru 2) monoxid de carbon (IV) 3) hidroxid de sodiu 4) acid sulfuric
63. Reacționează cu carbonul 1) hidrogen 2) hidroxid de magneziu 3) clorură de calciu 4) acid fosforic
64. Hidrogenul reacţionează cu 1) cupru 2) cupru (II) oxid 3) cupru (II) hidroxid 4) cupru (II) sulfat
65. Sulful este un agent reducător în reacția cu 1) magneziu 2) oxigen 3) hidrogen 4) fier
66. Fiecare dintre cele două metale reacţionează cu acidul clorhidric:
1) Zn și Cu 2) Ag și Mg 3) Zn și Mg 4) Cu și Ag
67. Reacționează cu hidrogenul 1) clorul 2) cuprul 3) hidroxidul de potasiu 4) acidul clorhidric
68. Reactioneaza cu hidrogenul fara incalzire 1) fluor 2) azot 3) sulf 4) fier
69. 1) oxigen 2) fier 3) carbon 4) siliciu reacționează cu acidul sulfuric diluat
70.nu reactioneaza împreună
1) clor și hidrogen 2) oxigen și calciu
o 3) azot și apă 4) fier și sulf
71. 1) Ag 2) Mg 3) Fe 4) Al interacționează cu soluții de hidroxid de sodiu și acid clorhidric
72. Fosforul reacţionează cu 1) NaCl 2) O 2 3) KBr 4) H 2
73 . Bromul înlocuiește un alt halogen din soluție
1) clorură de sodiu 2) iodură de potasiu 3) fluorură de sodiu 4) fluorură de hidrogen
74. Atat magneziul cat si sulful reactioneaza cu
1) alcalii 2) acid sulfuric diluat 3) azot 4) oxigen
75. Hidrogenul reacționează cu 1) CuO 2) NaOH 3) NH 3 4) K 2 O
76. Atât oxigenul, cât și hidrogenul reacţionează cu 1) FeO 2) CuO 3) NH 3 4) H 2 S
77. Atât fierul, cât și fosforul reacționează cu 1) hidrogen 2) clor 3) alcalii 4) acid clorhidric
78. 1) oxid de fier (III) 2) hidroxid de sodiu 3 acid clorhidric 4) cuprul interacționează cu carbonul
79. Reacționează cu o soluție de bromură de bariu 1) ZnCl 2 2) KI 3) FeO 4) Cl 2
80. Hidrogenul nu reacționează cu 1) cupru (II) oxid 2) clor 3) hidroxid de sodiu 4) oxigen
81. Când este încălzit, hidrogenul intră în reactie chimica din
1) apă 2) cupru (II) oxid 3) clorură de sodiu 4) amoniac
82. Hidrogenul poate fi înlocuit din soluțiile acide
1) platină 2) cupru 3) magneziu 4) argint
83. Soluția de hidroxid de potasiu este capabilă să dizolve 1) cupru 2) magneziu 3) carbon 4) aluminiu
84. Fiecare dintre cele două substanțe reacționează cu apa la temperatura camerei:
1) magneziu și sulf 2) aluminiu și fosfor 3) sodiu și calciu 4) oxigen și carbon
85. 1) argint 2) mercur 3) sulf 4) reacționează cu soluția de sulfat de cupru (II)
86. Cu acid sulfuric diluat nu reactioneaza
1) fier 2) zinc 3) cupru 4) magneziu
87. Sulful reacționează cu fiecare dintre cele două substanțe:
1) azot și zinc 2) oxigen și oxid de magneziu 3) hidroxid de sodiu și amoniac 4) hidrogen și mercur
88. Oxigenul reacționează cu 1) NaOH 2) SO 2 3) FeCl 3 4) CO 2
89. Oxigenul reacționează cu fiecare dintre cele două substanțe:
1) CO și Mg 2) CO 2 și Mg 3) MgO și C 4) SiO 2 și P
90. Reacționează atât cu magneziul, cât și cu hidrogenul
1) clor 2) oxid de fosfor (V) 3) hidroxid de calciu 4) acid hidrosulfurat
91. Reacţionează cu hidrogenul
1) amoniac 2) hidroxid de sodiu 3) sulf 4) acid fosforic
92. Azotul, când este ușor încălzit, poate intra într-o reacție chimică cu
1) sulf 2) magneziu 3) carbon 4) fier
93. Clorul reacţionează cu 1) N 2 2) KF 3) NaI 4) O 2
94. Nu reacționează cu carbonul
1) sodiu 2) hidrogen 3) monoxid de carbon (II) 4) acid sulfuric (conc.)
95. Hidrogenul se formează prin interacţiunea unei soluţii de acid sulfuric şi
1) oxid de sodiu 2) carbonat de sodiu 3) cupru 4) fier
96. Carbonul nu reacționează cu
1) oxid de fier (II) 2) oxigen 3) hidrogen 4) clorură de sodiu
97. Clorul reacţionează cu 1) oxigenul 2) acidul azotic 3) bromura de calciu 4) sulfatul de aluminiu
98. Cu fiecare dintre substanțe - KOH, HCl, AgNO 3 - interacționează 1) Cu 2) Mg 3) Al 4) Fe
99. Atat clorul cat si azotul reactioneaza cu
1) acid clorhidric 2) hidroxid de sodiu 3) hidrogen 4) magneziu
100. În condiții normale, nu reacționează cu apa 1) clor 2) calciu 3) fluor 4) sulf
101. Hidrogenul poate intra într-o reacție chimică cu
1) argon 2) clor 3) siliciu 4) fier
102. Carbonul prezintă proprietăți oxidante atunci când interacționează cu
1) O 2 2) Ca 3) Fe 2 O 3 4) CuO
103. Hidrogenul reacționează cu fiecare dintre cele două substanțe:
1) H2S și O2 2) CuO și SO2 3) FeO și N2 4) NH3 și S
104. Clorul nu deplasează halogen din soluție
1) fluorură de sodiu 2) bromură de sodiu 3) iodură de sodiu 4) bromură de hidrogen
105. Interacţiunea sulfatului de cupru(II) şi zincului produce
1) sulf și oxid de zinc 2) cupru și sulfat de zinc 3) apă și sulfură de zinc 4) oxid de zinc și sulfură de cupru
106. Reacționează cu oxigenul 1) apa 2) monoxid de carbon (II) 3) oxid de aluminiu 4) azotat de sodiu
107. Magneziul la temperatura camerei reacţionează cu
1) hidroxid de cupru (II) 2) oxid de calciu 3) clorură de zinc 4) apă
108. Reacţionează cu o soluţie diluată de alcali
1) cupru 2) aluminiu 3) carbon 4) fier
109. Care dintre metalele indicate prezintă cea mai mare activitate chimică în reacția cu apa?
1) sodiu 2) potasiu 3) zinc 4) magneziu
110. Reacționează atât cu oxigenul, cât și cu hidrogenul
1) oxid de fosfor (V) 2) sulf 3) apă 4) oxid de aluminiu
111. Eliberare de hidrogen nu se intampla atunci când interacționează cu soluția de zinc
GAU DPO (PC) C „Centrul regional Bryansk pentru evaluarea calității educației”
Versiunea demo
pentru certificarea angajaților pedagogici și executivi ai regiunii Bryansk pentru confirmarea conformității cu funcția deținută
Chimie
Bryansk
A1. Configurația electronică a atomului de cripton are o particulă
1) Br - 2) Cl 5+ 3) Rb o 4) Se 4+
A2. element chimic, a cărui configurație electronică este 1s 2 2s 2 2p 1 , îi corespunde formula generala oxid mai mare
1) R 2 O 3 2) RO 2 3) R 2 O 4) RO 3
A3. O substanță cu o legătură polară covalentă are formula
1) S8 2) NaCI 3) MgO 4) HCI
A4. Sulful prezintă cea mai mare stare de oxidare din compus
1) SO 2 2) K 2 SO 3 3) Na 2 SO 4 4) K 2 S
A5. Reţeaua cristalină moleculară are
1) sare de masă 2) sifon 3) diamant 4) glucoză
A6. În lista substanţelor ale căror formule
A) C 5 H 10 B) C 4 H 8 C) C 4 H 6 D) C 3 H 6 E) C 3 H 4 E) C 5 H 8
hidrocarburile acetilenice pot include
1) AVE 2) BGD 3) VDE 4) UNDE
A7. Sunt corecte următoarele afirmații despre fier?
A. Fierul are o stare de oxidare de +8.
B. Fierul înlocuiește cuprul din soluția de sulfat de cupru (II).
A8. Acidul azotic corespunde unui oxid a cărui formulă este
1) NO 2) N 2 O 3 3) NO 2 4) N 2 O 5
A9. Fierul reacţionează cu soluţia
1) Hg(NO 3) 2 2) Mg(NO 3) 2 3) K 2 SO 4 4) ZnCl 2
A10. Oxidul de sulf (VI) interacționează cu fiecare dintre cele două substanțe
1) P 2 O 5 și KOH 2) MgO și SO 2 3) NaOH și H 2 O 4) CO 2 și Ba (OH) 2
A11. Acidul clorhidric reacționează cu fiecare dintre cele două substanțe:
1) Cu(OH) 2 și Ag 2) NH 3 și CO 3) CaCO 3 și Fe 2 O 3 4) NaOH și Hg
A12. Sunt corecte următoarele afirmații despre sărurile acidului carbonic?
A. Carbonații se formează prin interacțiunea alcaline cu un exces de dioxid de carbon.
B. Ca urmare a încălzirii bicarbonaților, se formează carbonați.
1) doar A este adevărat 2) doar B este adevărat 3) ambele judecăți sunt corecte 4) ambele judecăți sunt greșite
A13. În schema de transformare, substanțele „X” și „Y” sunt
1) X-HCl și Y-Ca (OH) 2
2) X - H2S04 şi Y - CaHP04
3) X - H20 și Y - Ca (OH)2
4) X - Ca (OH) 2 și Y - CaH 2
A14. Un izomer al dimetil eterului este:
1) metanal 2) metan 3) etanol 4) etilenă
A15. Numărul de legături σ dintr-o moleculă de tetraclorură de carbon este
1)1 2) 2 3) 3 4) 4
A16. Hidroxidul de cupru (II) proaspăt precipitat interacționează cu:
1) benzen 2) etanol 3) stiren 4) glicerina
A17. Atât acidul formic, cât și acidul propionic reacţionează cu
1) fenol 2) etanol 3) etanol 4) acetat de etil
A18. În schema de transformare
substanța „X” este
1) 1,2-dibrometan 2) brometan 3) 1,1-dibrometan 4) acetilenă
A19. Sunt corecte următoarele judecăți despre tipurile de reacții chimice?
A. Interacțiunea oxidului de sulf (IV) cu oxigenul este denumită reacții endoterme.
B. Descompunerea metanului este denumită reacții exoterme.
1) doar A este adevărat 2) doar B este adevărat 3) ambele judecăți sunt corecte 4) ambele judecăți sunt greșite
A20. Cea mai rapidă reacție are loc între acidul clorhidric și
1) CaCO 3 2) Zn 3) NaOH (soluție) 4) Fe(OH) 3
A21. Sunt corecte judecățile despre schimbarea echilibrului în sistem: 2 NO (g) + O 2 (g) ⇄ 2 NO 2 (g) + Q?
A. Odată cu creșterea presiunii, echilibrul chimic din acest sistem se va deplasa către produsul de reacție.
B. Odată cu creșterea concentrației de oxid nitric (II), echilibrul sistemului se va deplasa către produsul de reacție.
1) doar A este adevărat 2) doar B este adevărat 3) ambele judecăți sunt corecte 4) ambele judecăți sunt greșite
A22. Un electrolit este fiecare dintre cele două substanțe:
1) clorură de bariu, acetat de sodiu
2) etanol, acid acetic
3) acetonă, acid percloric
4) brom, benzen
A23. Reacțiile de schimb ionic includ
1) CH4 + CI2 = CH3CI + HCI
2) Zn + 2 HCl \u003d ZnCl 2 + H 2
3) KOH + HCI = KCI + H2O
4) Cu (OH) 2 \u003d CuO + H 2O
A24. O reacție redox este o reacție între:
1) Ca și H 2 O 2) P 2 O 3 și BaO 3) Cl 2 O 7 și H 2 O 4) Al 2 O 3 și Na 2 O
A25. suferă hidroliză completă.
1) sulfură de aluminiu 2) sulfat de sodiu 3) cupru (II) clorură 4) fier (III) azotat
A26. Propanul reacţionează cu o substanţă a cărei formulă este
1) H2O2) HCI 3) CI2 4) H2
A27. Propanol-1 se formează prin interacțiunea:
1) 1-cloropropan cu alcali (soluție apoasă)
2) propenă cu alcali (soluție apoasă)
3) propanal cu apă
4) dicloropropan cu apă
A28. Dioxidul de carbon dintr-un vas poate fi detectat folosind
1) bețișoare înmuiate în acid clorhidric
2) o așchie care arde
3) hârtie fenolftaleină umedă
4) hârtie fenolftaleină uscată
A29. Numai prin electroliza sării topite în industrie se poate obține
1) sodiu 2) zinc 3) crom 4) argint
A30. Volumul de oxigen (N.O.) necesar pentru arderea completă a 1 mol de amoniac gazos cu formarea azotului este
1) 12 l 2) 16,8 l 3) 18,4 l 4) 25,2 l
A31. Un hidroxid care reacționează atât cu o soluție acidă, cât și cu o soluție alcalină este
1) Mg(OH) 2 2) Cr(OH) 3 3) Ba(OH) 2 4) Ca(OH) 2
A32. Și cu o soluție de acid azotic și cu o soluție de hidroxid de sodiu interacționează
1) sulfat de magneziu 2) sulfură de amoniu 3) clorură de potasiu 4) bromură de plumb (II)
A33. În schema de transformare, substanța „Y” este
1) fier (III) sulfit 2) fier (II) sulfat 3) fier (III) sulfură 4) fier (III) sulfat
A34. Un izomer al dietil eterului este:
1) propanol-2 2) butanol-1 3) pentanol-2 4) hexanol-3
A35. Se formează atomul de oxigen din molecula de fenol
1) două legături σ 2) o legătură σ 3) una σ și una π 4) două legături π
A36. Sulful reacționează cu fiecare dintre cele două substanțe
1) O 2 și SiO 2 2) Cl 2 și NaCl 3) HCl și N 2 4) Fe și H 2
Cheie


