27.03.2018
Fier în tabelul periodic
METALELE DE GRUP LATERAL
Caracteristicile elementelor de tranziție - cupru, crom, fier în funcție de poziția lor în sistemul periodic elemente chimice DI. Mendeleev și caracteristicile structurale ale atomilor lor.
Conceptul de element de tranziție este de obicei folosit pentru a se referi la oricare dintre elementele d sau f. Aceste elemente ocupă o poziție de tranziție între elementele s electropozitive și elementele p electronegative. d-Elementele formează trei serii de tranziție - în perioada a 4-a, a 5-a și, respectiv, a 6-a. Prima serie de tranziție include 10 elemente, de la scandiu la zinc. Se caracterizează prin construirea internă a orbitalilor 3d. Cromul și cuprul au un singur electron fiecare în orbitali de 4s. Ideea este că subshell-urile d semi-umplute sau umplute sunt mai stabile decât cele parțial umplute. În atomul de crom, fiecare dintre cei cinci orbitali 3d care formează subînvelișul 3d are câte un electron. O astfel de subshell este umplută pe jumătate. În atomul de cupru, fiecare dintre cei cinci orbitali 3d are o pereche de electroni (anomalia argintului este explicată într-un mod similar). Toate elementele d sunt metale. Cele mai multe dintre ele au un luciu metalic caracteristic. În comparație cu metalele s, rezistența lor este în general mult mai mare. În special, se caracterizează prin proprietăți: rezistență ridicată la tracțiune; ductilitate; maleabilitatea (pot fi aplatizate prin lovituri în foi). elementele d şi compuşii lor au o serie de proprietăţi caracteristice: stări de oxidare variabile; capacitatea de a forma ioni complecși; formarea compușilor colorați. Elementele d sunt, de asemenea, caracterizate printr-o densitate mai mare decât alte metale. Acest lucru se datorează razelor relativ mici ale atomilor lor. Razele atomice ale acestor metale se modifică puțin în această serie. Elementele d sunt bune conductoare de curent electric, în special cele în care atomii au un singur electron s extern în plus față de coaja d pe jumătate umplută sau umplută. De exemplu, cupru.
Proprietăți chimice.
Electronegativitatea metalelor din prima serie de tranziție crește în direcția de la crom la zinc. Aceasta înseamnă că proprietățile metalice ale elementelor primului rând de tranziție slăbesc treptat în direcția indicată. O astfel de modificare a proprietăților lor se manifestă și prin creșterea succesivă a potențialelor redox odată cu trecerea de la valorile negative la cele pozitive.
Caracteristicile cromului și compușilor săi
Crom- metal dur, alb-albăstrui.Proprietăți chimice.
- În condiții normale, cromul reacționează numai cu fluor. La temperaturi ridicate (peste 600 0 C) interacționează cu oxigenul, halogenii, azotul, siliciul, borul, sulful și fosforul.
4Cr + 3O 2 2Cr 2 O 3
2Cr + 3Cl 2 2CrCl 3
2Cr + 3SCr2S3
- În stare fierbinte, reacţionează cu vaporii de apă:
2Cr + 3H2OCr2O3 + 3H2
- Cromul se dizolvă în acizi tari diluați (HCl, H2SO4). În absenţa aerului se formează sărurile Cr 2+, iar în aer se formează sărurile Cr 3+.
Cr + 2HCl → CrCl 2 + H 2 -
2Cr + 6HCl + O 2 → 2CrCl 3 + 2H 2 O + H 2 -
- Prezența unui film protector de oxid pe suprafața metalului explică pasivitatea acestuia în raport cu acizii concentrați la rece - agenți oxidanți. Cu toate acestea, atunci când sunt încălziți puternic, acești acizi dizolvă cromul:
2 Cr + 6 H 2 SO 4 (conc) Cr 2 (SO 4) 3 + 3 SO 2 + 6 H 2 O
Cr + 6 HNO 3 (conc) Cr (NO 3) 3 + 3 NO 2 + 3 H 2 O
chitanta.Compuși ai cromului
Compuși ai cromului divalenți
oxid de crom (II) CrO
Proprietăți fizice: o substanță solidă, insolubilă în apă, de culoare roșu aprins sau roșu maro. Proprietăți chimice. CrO este oxidul principal.chitanta.
Cr 2 O 3 + 3Н 2 2Cr + 3H 2 O hidroxid de crom (II) Cr(OH) 2 Proprietăți fizice: solid insolubil în apă Culoarea galbena. Proprietăți chimice. Cr(OH)2 este o bază slabă.- Interacționează cu acizii: Cr (OH) 2 + 2HCl → CrCl 2 + 2H 2 O Se oxidează ușor în prezența umidității cu oxigenul atmosferic la Cr (OH) 3:
4Cr(OH) 2 + O 2 + 2H 2 O → 4Cr(OH) 3
- Când este aprins, se descompune:
- Acțiunea alcaline asupra soluțiilor de săruri Cr(II): CrCl 2 + 2 NaOH = Cr(OH) 2 ↓ + 2 NaCl.
Compuși trivalenți ai cromului
oxid de crom (III) Cr 2 O 3 Proprietăți fizice: substanță refractară de culoare verde închis, insolubilă în apă. Proprietăți chimice. Cr 2 O 3 - oxid amfoter.cromit de sodiu
- La temperatura ridicata redus cu hidrogen, calciu, carbon la crom:
Cr 2 O 3 + 3Н 2 2Cr + 3H 2 O
chitanta.
hidroxid de crom (III) Cr(Oh) 3 Proprietăți fizice: substanță insolubilă în apă Culoarea verde. Proprietăți chimice. Cr (OH) 3 - hidroxid amfoter2Cr(OH) 3 + 3H 2 SO 4 →Cr 2 (SO 4) 3 + 6H 2 O
Cr(OH)3 + KOH → KCrO2 + 2H2O
(cromit de potasiu) chitanta.
- Sub acțiunea alcalinelor asupra sărurilor Cr 3+, un precipitat gelatinos de hidroxid de crom (III) verde precipită:
Cr 2 (SO 4) 3 + 6NaOH → 2 Cr (OH) 3 ↓ + 3 Na 2 SO 4,
Compuși ai cromului hexavalent
oxid de crom (VI) CrO 3 Proprietăți fizice: solid roșu închis, foarte solubil în apă. Otrăvitoare! Proprietăți chimice. CrO3 este un oxid acid.- Interacționează cu alcalii, formând săruri galbene - cromați:
CrO3 + 2KOH → K2CrO4 + H2O
- Interacționează cu apa pentru a forma acizi: CrO 3 + H 2 O → H 2 CrO 4 acid cromic
- Instabil termic: 4 CrO 3 → 2Cr 2 O 3 + 3O 2
- Preparat din cromat (sau dicromat) de potasiu prin acţiunea H2SO4 (conc.).
K 2 CrO 4 + H 2 SO 4 → CrO 3 + K 2 SO 4 + H 2 O
K 2 Cr 2 O 7 + H 2 SO 4 → 2CrO 3 + K 2 SO 4 + H 2 O
Hidroxizicrom(VI)H 2 CrO 4 - cromacid, H 2 Cr 2 O 7 - bicromacid Ambii acizi sunt instabili; atunci când încearcă să-i izoleze în forma lor pură, se descompun în apă și oxid de crom (VI). Cu toate acestea, sărurile lor sunt destul de stabile. Sărurile acidului cromic se numesc cromați, sunt colorate în galben, iar sărurile acidului dicromic se numesc dicromați, sunt colorate portocaliu.Fierul și compușii săi
Fier - metal relativ moale, maleabil, de culoare argintie, ductil, magnetizat. T se topește \u003d 1539 0 C. ρ \u003d 7,87 g / cm 3. CO: +2 - cu agenți oxidanți slabi - soluții de acizi, săruri, nemetale, cu excepția oxigenului și halogenilor +3 - cu agenti oxidanti puternici - acizi concentrati, oxigen, halogeni.Proprietăți chimice.
- Interacțiunea cu substanțe simple.
- Arde în oxigen, formând calcar - oxid de fier (II, III): 3Fe + 2O 2 → Fe 3 O 4 Fierul reacționează cu nemetale atunci când este încălzit:
- Interacțiunea cu substanțe complexe.
- La temperaturi ridicate (700–900°C), fierul reacţionează cu vaporii de apă:
3Fe + 4H 2 O Fe 3 O 4 + 4H 2 -
- Ruginește în aer în prezența umidității: 4Fe + 3O 2 + 6H 2 O → 4Fe (OH) 3. Fierul se dizolvă ușor în acizi clorhidric și acizi sulfuric diluați, arătând CO +2:
Fe + 2HCl → FeCl 2 + H 2 -
Fe + H 2 SO 4 (dif.) → FeSO 4 + H 2 -
- În acizii oxidanți concentrați, fierul se dizolvă numai atunci când este încălzit, arătând CO +3:
2Fe + 6H 2 SO 4 (conc.) Fe 2 (SO 4) 3 + 3SO 2 - + 6H 2 O
Fe + 6HNO 3 (conc.) Fe (NO 3) 3 + 3NO 2 - + 3H 2 O
(la rece, acizii azotic și sulfuric concentrați pasivează fierul).
- Fierul deplasează metalele în dreapta lui în seria tensiunilor din soluțiile sărurilor lor.
Fe + CuSO 4 → FeSO 4 + Cu↓
chitanta.- Recuperare din oxizi cu carbon sau monoxid de carbon (II)
FeO + C Fe + CO
Fe 2 O 3 + 3CO 2Fe + 3CO 2
Compuși feroși
DESPREoxid de fier (II) FeO
Proprietăți fizice: solid negru, insolubil în apă. Proprietăți chimice: FeO - oxid bazic 6 FeO + O 2 2Fe 3 O 4- Este redus de hidrogen, carbon, monoxid de carbon (II) la fier:
FeO + C Fe + CO
chitanta. Fe3O4 + H2-3 FeO + H2Ohidroxid de fier (II) Fe(Oh) 2
Proprietăți fizice: pulbere albă, insolubilă în apă. Proprietăți chimice: Fe(OH)2 este o bază slabă. chitanta.- Se formează prin acțiunea soluțiilor alcaline asupra sărurilor de fier (II) fără acces la aer:
FeCl 2 + 2KOH → 2KCl + Fe(OH) 2 ↓
răspuns de calitate la Fe 2+
Sub acțiunea hexacianoferratului de potasiu (III) K 3 (sare roșie din sânge) asupra soluțiilor de săruri feroase, se formează un precipitat albastru (turnbull blue):3FeSO 4 + 2K 3 Fe 3 2 + 3K 2 SO 4
Compuși ferici
oxid de fier (III) Fe 2 O 3
Proprietăți fizice: solid roșu-brun. Proprietăți chimice: Fe 2 O 3 este un oxid amfoter. ferită de sodiu Fe 2 O 3 + 3H 2 - 2 Fe + 3H 2 O chitanta.hidroxid de fier (III) Fe(Oh) 3
Proprietăți fizice: solid roșu-brun. Proprietăți chimice: Fe (OH) 3 - hidroxid amfoter.- Reacționează cu acizii ca o bază insolubilă:
2Fe(OH) 3 + 3H 2 SO 4 → Fe 2 (SO 4) 3 + 6H 2 O
- Reacționează cu alcalii ca un acid insolubil:
Fe (OH) 3 + KOH (tv) → KFeO 2 + 2H 2 O
Fe (OH) 3 + 3KOH (conc) → K 3
chitanta.- Se formează prin acțiunea soluțiilor alcaline asupra sărurilor de fier feric: precipită sub formă de precipitat roșu-brun:
Fe(NO 3) 3 + 3KOH Fe(OH) 3 + 3KNO 3
Reacții calitative pentru Fe 3+
- Sub acțiunea hexacianoferratului de potasiu (II) K 4 (sare galbenă de sânge) asupra soluțiilor de săruri ferice, se formează un precipitat albastru (albastru de Prusia):
4FeCl 3 + 3K 4 Fe 4 3 + 12KCl
- Când se adaugă tiocianat de potasiu sau amoniu la o soluție care conține ioni de Fe 3+, apare o culoare intensă roșie sânge a tiocianatului de fier (III):
FeCl 3 + 3KCNS 3KCl + Fe(CNS) 3
Cuprul și compușii săi
Cupru- un metal destul de moale de culoare roșu-galben, maleabil, ductil, are conductivitate termică și electrică ridicată. T se topește \u003d 1083 0 C. ρ \u003d 8,96 g / cm 3. CO: 0,+1,+2
Proprietăți chimice.
- Interacțiunea cu substanțe simple.
- Interacțiunea cu substanțe complexe.
Cuprul se află în seria tensiunilor din dreapta hidrogenului, prin urmare nu reacționează cu acizii clorhidric și sulfuric diluați, ci se dizolvă în acizi oxidanți:
3Cu + 8HNO 3 (dec.) → 3Cu(NO 3) 2 + 2NO- + 2H 2 O
Cu + 4HNO 3 (conc.) → Cu(NO 3) 2 + 2NO 2 -+ 2H 2 O
Cu + 2H 2 SO 4 (conc.) → CuSO 4 + SO 2 - + 2H 2 O
chitanta.
CuO + CO Cu + CO 2
- În electroliza sărurilor de cupru: 2CuSO 4 + 2H 2 O → 2
Cu + O 2
-
+ 2H2S04
Compuși monovalenți de cupru
oxid de cupru (eu) DINu 2 O Proprietăți fizice: solid roșu, insolubil în apă. Proprietăți chimice:Сu 2 O este oxidul principal. chitanta.- Obținut prin reducerea compușilor de cupru (II), de exemplu, glucoză într-un mediu alcalin:
- Reacționează cu acizi: CuOH + HCl → CuCl + H 2 O Se oxidează ușor în aer la Cu(OH) 2: 4CuOH + O 2 + 2H 2 O → 4 Cu(OH) 2
Compuși ai cuprului divalent
Fier (simbol Fe)- element chimic din grupa a opta, perioada a patra. Fierîn tabelul periodic al elementelor chimice se află la numărul 26.
Subgrupul Fier conține 4 elemente: fier Fe, ruteniu Ru, osmiu Os, Hs hasmiu.
Caracteristicile elementului chimic Fier
Ferrum este un cuvânt latin, înseamnă nu numai fier, ci și duritate și arme. De la el au venit numele fierului în unele limbi europene: fer franceză, ferro italiană, hierro spaniolă și termeni precum ferite, feromagnetism. Nume similare pentru acest metal în limbile slave și baltice: gelezis lituanian, zelazo polonez, fier bulgar, zalizo ucrainean și zhalez belarus. Numele englezesc Iron, germanul Eisen, olandezul ijzer sunt derivate din sanscrita isira (puternic, puternic).
Distribuția fierului în natură
Fier 26 element al tabelului periodic
Fier- primul de pe glob și al doilea cel mai răspândit metal în Scoarta terestra, un metal foarte important pentru oameni. Din timpuri imemoriale, oamenii au întâlnit fier sub formă de meteoriți de fier. De obicei, fierul meteorit conține de la 5 la 30% nichel, aproape 0,5% cobalt și până la 1% alte elemente. În Africa, acum 80 de mii de ani, a căzut cel mai mare meteorit Goba, cântărind 66 de tone. Contine 84% glandăși 16% nichel. Muzeul de meteorit al Academiei Ruse de Științe păstrează două fragmente dintr-un meteorit de fier care cântărește 256 kg și a căzut în Orientul Îndepărtat. În 1947, mii de fragmente (cu o greutate de la 60 la 100 de tone) dintr-un meteorit de fier au căzut sub formă de „ploaie de fier” pe teritoriul Primorsky pe o suprafață de 35 km 2. Un mineral foarte rar - fier nativ de origine terestră, apare sub formă de boabe mici și conține 2% nichel și zecimi de procent din alte metale. Fierul nativ a fost găsit pe Lună în stare zdrobită.
În secolele 13-12 î.Hr. are loc o dezintegrare și schimbare a culturilor în toată Eurasia de la Atlantic până la Oceanul Pacific și timp de câteva secole - până în secolele 10-8 î.Hr. au loc migrații. Această perioadă se numește catastrofa epocii bronzului și începutul trecerii la epoca fierului.
Există mult fier în scoarța terestră, dar este dificil de extras. Acest metal este puternic legat în minereuri cu oxigen și uneori cu sulf. Cuptoarele antice nu puteau asigura temperatura necesară la care se topea fierul pur și se obținea fierul sub formă de burete cu impurități dintr-un minereu numit kritsa. La forjarea florii, fierul a fost parțial separat de minereu.
Multe minerale conțin fier. Minereul de fier magnetic, care conține 72,3% fier, este cel mai bogat mineral în fier. Filosoful grec antic Thales din Milet a studiat acum mai bine de 2500 de ani mostre de metal feros care atrag fierul. I-a dat numele magnetis lithos - o piatră din Magnezia, așa a apărut numele magnetului. Acum se știe că era minereu de fier magnetic - oxid de fier negru.
Rolul fierului în organismul viu
Hematitul este cel mai important minereu de fier. Conține 69,9% fier. Hematitul mai este numit și minereu de fier roșu, iar numele vechi este piatră de sânge. Din grecescul haima, adică sânge. Au apărut și alte cuvinte legate de sânge, precum hemoglobina. Hemoglobina servește ca purtător de oxigen de la organele respiratorii la țesuturile corpului, iar în direcția opusă transportă dioxid de carbon. Deficitul de fier în organism duce la boala grava — anemie cu deficit de fier. Cu această boală, există încălcări ale scheletului, ale funcțiilor sistemului nervos central și sisteme vasculare, există o lipsă de oxigen în țesuturi. Fierul este esențial pentru organismele vii. Se găsește și în mușchi, splină și ficat. La un adult, fierul are aproximativ 4 g, este prezent în fiecare celulă a corpului. O persoană ar trebui să primească 15 miligrame de fier în fiecare zi cu alimente. Cu o lipsă de fier, medicii prescriu preparate speciale în care fierul este într-o formă ușor digerabilă.
Aplicarea fierului
Dacă în fierul topit există mai mult de 2% carbon, atunci se obține fontă, se topește cu sute de grade mai jos decât fierul pur. Deoarece fonta este casantă, este posibil doar turnarea diferitelor produse din ea, nu poate fi forjată. Din minereul de fier din furnalele înalte, se topește o mare cantitate de fontă, care este folosită la turnarea monumentelor, grătarelor și paturi grele pentru mașini-unelte. Cea mai mare parte a fierului este transformată în oțel. Pentru aceasta, o parte din carbon și alte impurități sunt „arse” din fontă în convertoare sau în cuptoare cu vatră deschisă.
Totul, de la șine la cuie, este realizat din oțel cu conținut diferit de carbon. Dacă există puțin carbon în fier, se obține oțel ușor cu conținut scăzut de carbon, iar prin introducerea impurităților de aliere ale altor elemente în oțel se obțin diferite grade de oțeluri speciale. Există un număr mare de oțeluri și fiecare are propria sa aplicație.
Cel mai cunoscut este oțelul inoxidabil, care conține nichel și crom. Acest oțel este folosit pentru fabricarea de echipamente pentru fabrici chimice și vesela. Și dacă introduceți 18% wolfram, 1% vanadiu și 4% crom în oțel, obțineți oțel de mare viteză, din el se fac burghii si varfuri incisive. Dacă topiți fierul cu 1,5% carbon și 15% mangan, obțineți un astfel de oțel dur, care este folosit pentru a face cuțite de buldozer și dinți de excavator. Oțelul care conține 36% nichel, 0,5% carbon și 0,5% mangan se numește invar, este folosit la fabricarea instrumentelor de precizie și a unor piese pentru ceasuri. Oțelul, care se numește platină, conține 46% nichel și 15% carbon și se extinde atunci când este încălzit în același mod ca sticla. Joncțiunea platinei cu sticla nu se crăpă și, prin urmare, este utilizată la fabricarea lămpilor electrice.
Oțelul inoxidabil nu este magnetizat și nu este atras de un magnet. Numai oțelul carbon poate fi magnetizat. Fierul pur în sine nu este magnetizat, dar este atras de un magnet, un astfel de fier este potrivit pentru fabricarea miezurilor de electromagneți.
Peste un miliard de tone de fier sunt topite anual în lume. Dar coroziunea, care este un dușman teribil al metalului, nu numai că distruge metalul în sine, pentru a cărui topire efort imens, dezactivează și produsele finite care costă mai mult decât metalul în sine. Distruge anual zeci de milioane de tone de metal topit. Când fierul se corodează, acesta reacționează cu oxigenul și apa, transformându-se în rugină.

Fierul, poziția sa în sistemul periodic al elementelor chimice ale lui D. I. Mendeleev, interacțiunea cu sulful, acidul clorhidric, soluțiile de sare.
PLAN DE RĂSPUNSURI:
pozitia in p. și structura atomului proprietăți fizice Proprietăți chimice Elementul chimic fier se află în perioada a 4-a din grupa a 8-a a subgrupului secundar. Un atom de fier are patru straturi de electroni. Subnivelul d al celui de-al treilea strat este umplut cu electroni, pe el sunt 6 electroni, iar pe al patrulea strat, subnivelul s are 2 electroni. În compuși, fierul prezintă stări de oxidare +2 și +3.
| IV perioada VIII grupa subgrup secundar | Fe)))) | +2 | +3 | ||
| +26 2 8 8+6 2 | 4s | ?? | |||
| 3d | ?? | ? | ? | ? | ? |
O substanță simplă fier este un metal alb-argintiu cu un punct de topire de 15390C, o densitate de 7,87 g/cm3 și are proprietăți magnetice. Fierul este un metal reactiv. Când este încălzit, interacționează cu sulful pentru a forma sulfură de fier (II): Fe0 + S0 = Fe + 2S-2. Fierul înlocuiește hidrogenul din soluțiile acide, cu formarea de săruri de fier (II), de exemplu, acționând asupra fierului de acid clorhidric se formează clorura de fier(II): Fe0 + 2H+1Cl-1 = Fe+2Cl2-1 + H20. Fierul poate înlocui metalele mai puțin active din soluțiile sărurilor lor, de exemplu, când fierul acționează asupra unei soluții de sulfat de cupru (II), se formează cupru metalic și sulfat de fier (II): Fe0 + Cu + 2SO4 = Cu0 + Fe + 2SO4 .
În toate reacțiile, fierul prezintă proprietățile unui agent reducător. Agenți oxidanți mai puternici - clor, oxigen, acizi concentrați - oxidează fierul la o stare de oxidare de +3.
Dacă teme pentru acasă pe subiect: » Fier, poziția sa în Tabelul Periodic al Elementelor Chimice de D.I. Mendeleev, interacțiune s-a dovedit a fi util pentru dvs., vă vom fi recunoscători dacă plasați un link către acest mesaj pe pagina dvs. din rețeaua dvs. de socializare.
(!LANG:Ultimele știri
Categorii
știri
Eseuri înrudite
- Gimnaziul nr. 12, Lipetsk Znamenshchikova Nadezhda Aleksandrovna Subiectul lecției: Fier și compușii săi (Grada 9) Scop: pentru a forma un concept al dependenței direcției reacțiilor de oxidare de Testul „Element chimic” Numele elementelor chimice sunt în principal . ...... Originea Semnele elementelor chimice sunt indicate prin litere latine, litere engleze și litere ruse Completați golurile din tabel Lecția de chimie chimică din clasa a 9-a pe tema „Lumea metalelor”. Dezvoltarea a fost realizată de un profesor de chimie al instituției de învățământ autonome municipale „Bazarno-Matakskaya învățământ general secundar Test la chimie pe tema „Oxigenul şi sulful” Opţiunea 1 1. Alcătuiţi ecuaţiile pentru disocierea electrolitică a acidului sulfuric. 2. Compuneți ecuațiile complete și reduse
- Test de UTILIZARE în chimie Reversibil și ireversibil reacții chimice Răspunsuri de echilibru chimic
Reacții chimice reversibile și ireversibile. echilibru chimic. Deplasarea echilibrului chimic sub acțiune diverși factori 1. Echilibru chimic în sistemul 2NO(g).
Niobiul în stare compactă este un metal paramagnetic alb-argintiu strălucitor (sau gri sub formă de pulbere), cu o rețea cristalină cubică centrată pe corp.
Substantiv. Saturarea textului cu substantive poate deveni un mijloc de reprezentare lingvistică. Textul poeziei de A. A. Fet „Șoaptă, respirație timidă...”, în a lui
1. Fier: poziție în sistemul periodic al elementelor chimice de către D. I. Mendeleev, structura atomică, posibile stări de oxidare, proprietăți fizice, interacțiune cu oxigenul, halogenii, soluțiile de acizi și săruri. Rolul fierului în tehnologia modernă. Aliaje de fier.
Fierul se află într-un subgrup lateral al grupului VIII sistem periodic. Formula electronică a atomului de fier:
Stările de oxidare tipice ale fierului sunt +2 și +3. Starea de oxidare +2 se manifestă prin pierderea a doi electroni 4s. Starea de oxidare +3 corespunde, de asemenea, cu pierderea încă un electron 3d, în timp ce nivelul 3d este umplut pe jumătate; astfel de configurații electronice sunt relativ stabile.
proprietăți fizice. Fierul este un metal tipic care formează o rețea cristalină metalică. Fierul conduce electricitatea, este destul de refractar, punctul de topire 1539°C. Fierul diferă de majoritatea celorlalte metale prin capacitatea sa de a fi magnetizat.
Proprietăți chimice. Fierul reacționează cu multe nemetale:
![]()
Se formează sol de fier - oxid de fier amestecat. Formula sa se mai scrie astfel: FeO Fe2O3.
![]()
Reacționează cu acizii pentru a elibera hidrogen:
Intră în reacții de substituție cu săruri metalice localizate la dreapta fieruluiîntr-o serie de tensiuni:
compuși de fier. FeO - oxid bazic, reacţionează cu soluţiile acide pentru a forma săruri de fier (II). Fe2O3 este un oxid amfoter care reacționează și cu soluțiile alcaline.

Hidroxizi de fier. Fe (OH) 2 este un oxid bazic tipic, Fe (OH) 3 are proprietăți amfotere, reacționează nu numai cu acizii, ci și cu soluțiile alcaline concentrate.
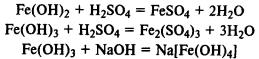
Hidroxidul de fier (II) este ușor oxidat la hidroxid de fier (III) de oxigenul atmosferic:
Când sărurile de fier (II) și (III) reacţionează cu alcalii, hidroxizii insolubili precipită:
Aliaje de fier. Industria metalurgică modernă produce aliaje de fier de diferite compoziții.
Toate aliajele de fier sunt împărțite după compoziție și proprietăți în două grupe. Primul grup include diverse clase de fontă, al doilea - diferite clase de oțel.
Fonta este casantă; oțelurile sunt plastice, pot fi forjate, laminate, trase, ștanțate. Diferența dintre proprietățile mecanice ale fontelor și oțelurilor depinde în primul rând de conținutul lor de carbon - fontele conțin aproximativ 4% carbon, iar oțelurile de obicei mai puțin de 1,4%.
În metalurgia modernă, minereurile de fier sunt folosite mai întâi pentru a produce fontă, iar apoi din fontă la oțel. Fonta este topită în furnalele înalte, oțelul este topit în cuptoarele din oțel. Până la 90% din fonta topită este transformată în oțel.
Fontă. Fonta brută destinată procesării în oțel se numește fontă brută. Conține de la 3,9 la 4,3% C, 0,3-1,5% Si, 1,5-3,5% Mn, nu mai mult de 0,3% P și nu mai mult de 0,07% S. Fonta , destinată „producției de piese turnate, se numește fier de turnătorie. Feroaliajele sunt, de asemenea, topite în furnalele, care sunt utilizate în principal în producția de oțeluri ca aditivi. Feroaliajele, în comparație cu fonta brută, au un conținut ridicat de siliciu (ferosiliciu), mangan (feromangan), crom (ferocrom) și altele. elemente.
Deveni. Toate oțelurile sunt împărțite în oțeluri carbon și aliate.
Oțelurile carbon conțin de câteva ori mai puțin carbon, siliciu și mangan decât fonta și foarte puțin fosfor și sulf. Proprietățile oțelului carbon depind în primul rând de conținutul de carbon din acesta: cu cât este mai mult carbon în oțel, cu atât este mai dur. Industria produce oțeluri moale, oțeluri de duritate medie și oțeluri dure. La fabricarea pieselor de mașini, țevilor, șuruburilor, cuielor etc. se folosesc oțelurile moale și mijlocii dure, în timp ce oțelurile dure sunt folosite pentru fabricarea sculelor.
Oțelurile trebuie să conțină cât mai puțin sulf și fosfor posibil, deoarece aceste impurități afectează proprietățile mecanice ale oțelurilor. În cantități crescute, sulful provoacă fragilitate roșie - formarea de fisuri în timpul prelucrării la cald a metalului. Fosforul provoacă fragilitate la rece - fragilitatea oțelului la temperatura obișnuită. -
Oteluri aliate. Proprietățile fizice, chimice și mecanice ale oțelurilor se modifică semnificativ de la introducerea în compoziția lor cantitate crescută mangan și siliciu, precum și crom, nichel, wolfram și alte elemente. Aceste elemente se numesc aliere, iar oțelul - aliat [de la cuvântul latin ligare - a lega, a lega].
Cromul este cel mai utilizat element de aliere. Mai ales mare importanță pentru construcția de mașini, aparate și multe părți de mașini au crom-nichel deveni. Aceste oțeluri au ductilitate mare, rezistență, rezistență la căldură și rezistență la agenți oxidanți. Acidul azotic de orice concentrație nu le distruge nici la temperaturi de fierbere. Oțelurile crom-nichel nu ruginesc în condiții atmosferice și în apă. Foi strălucitoare, de culoare argintie, de oțel crom-nichel împodobesc arcurile stației Mayakovskaya a metroului din Moscova. Cuțitele, lingurile, furculițele și alte articole de uz casnic din inox sunt fabricate din același oțel.
Molibdenul și vanadiul cresc duritatea și rezistența oțelurilor la temperaturi ridicate si presiuni. Asa de, crom-molibdenȘi crom vanadiu oțelurile sunt utilizate pentru fabricarea conductelor și a pieselor de compresoare în producția de amoniac sintetic, motoare de aeronave.
Când tăiați la viteză mare, unealta se încălzește și se uzează rapid. Când se adaugă wolfram, duritatea oțelului este menținută chiar și la temperaturi ridicate. Prin urmare, oțelurile crom-tungsten sunt utilizate pentru fabricarea sculelor de tăiere care funcționează la viteze mari.
Creșterea conținutului de mangan din oțel crește rezistența acestuia la frecare și impact. Otelurile cu mangan sunt folosite pentru fabricarea rampelor de cale ferata, macazelor, crucilor, concasoarelor de piatra.
Utilizarea oțelurilor aliate poate reduce semnificativ greutatea structurilor metalice, crește rezistența, durabilitatea și fiabilitatea în funcționare a acestora.
2. Veverițe precum biopolimerii. Structuri primare, secundare și terțiare ale proteinelor. proprietăţi şi functii biologice proteine.
Proteinele (proteine, polipeptide) sunt substanțe organice cu molecul înalt, formate din alfa-aminoacizi legați într-un lanț printr-o legătură peptidică.
Proteinele, ca și polizaharidele, sunt polimeri biologici. Majoritatea moleculelor de proteine ating dimensiuni gigantice în comparație cu alți compuși organici și au o greutate moleculară foarte mare:
Formula moleculară a uneia dintre proteinele grupei penicilinei este C 43 H 58 N 4 O 12; cazeină – proteină Laptele vacii, – C47H48N3NaO7S2; hemoglobină - C3032H48I6O872N780S8Fe4;


