27.03.2018
Gvožđe u periodnom sistemu
METALI BOČNE GRUPE
Karakteristike prelaznih elemenata - bakar, hrom, gvožđe prema njihovom položaju u periodnom sistemu hemijski elementi DI. Mendeljejev i strukturne karakteristike njihovih atoma.
Koncept prijelaznog elementa se obično koristi za upućivanje na bilo koji od d- ili f-elemenata. Ovi elementi zauzimaju prelaznu poziciju između elektropozitivnih s-elemenata i elektronegativnih p-elemenata. d-elementi čine tri prelazne serije - u 4., 5. i 6. periodu. Prva prelazna serija uključuje 10 elemenata, od skandijuma do cinka. Karakteriše ga unutrašnja izgradnja 3d-orbitala. Krom i bakar imaju samo po jedan elektron na 4s orbitalama. Poenta je da su polupopunjene ili popunjene d-podljuske stabilnije od djelomično ispunjenih. U atomu hroma, svaka od pet 3d orbitala koje formiraju 3d podljusku ima jedan elektron. Takva podljuska je napola popunjena. U atomu bakra svaka od pet 3d orbitala ima par elektrona (anomalija srebra se objašnjava na sličan način). Svi d-elementi su metali. Većina njih ima karakterističan metalni sjaj. U poređenju sa s-metalima, njihova čvrstoća je generalno mnogo veća. Posebno ih karakteriziraju svojstva: visoka vlačna čvrstoća; duktilnost; savitljivost (mogu se spljoštiti udarcima u listove). d-elementi i njihovi spojevi imaju niz karakterističnih svojstava: varijabilna oksidaciona stanja; sposobnost formiranja kompleksnih jona; formiranje obojenih jedinjenja. d-elemente takođe karakteriše veća gustoća od ostalih metala. To je zbog relativno malih radijusa njihovih atoma. Atomski radijusi ovih metala se malo mijenjaju u ovoj seriji. d-elementi su dobri provodnici električne struje, posebno oni u kojima atomi imaju samo jedan vanjski s-elektron pored polupopunjene ili ispunjene d-ljuske. Na primjer, bakar.
Hemijska svojstva.
Elektronegativnost metala prvog prelaznog niza raste u pravcu od hroma do cinka. To znači da metalna svojstva elemenata prvog prelaznog reda postepeno slabe u naznačenom pravcu. Takva promjena njihovih svojstava očituje se iu sukcesivnom porastu redoks potencijala sa prelaskom sa negativnih na pozitivne vrijednosti.
Karakteristike hroma i njegovih spojeva
Chromium- tvrdi, plavičasto-bijeli metal.Hemijska svojstva.
- U normalnim uslovima, hrom reaguje samo sa fluorom. Na visokim temperaturama (iznad 600 0 C) stupa u interakciju sa kiseonikom, halogenima, azotom, silicijumom, borom, sumporom i fosforom.
4Cr + 3O 2 2Cr 2 O 3
2Cr + 3Cl 2 2CrCl 3
2Cr + 3SCr2S3
- U vrućem stanju reagira s vodenom parom:
2Cr + 3H 2 O Cr 2 O 3 + 3H 2
- Krom se rastvara u razrijeđenim jakim kiselinama (HCl, H 2 SO 4). U nedostatku vazduha nastaju soli Cr 2+, a u vazduhu soli Cr 3+.
Cr + 2HCl → CrCl 2 + H 2 -
2Cr + 6HCl + O 2 → 2CrCl 3 + 2H 2 O + H 2 -
- Prisutnost zaštitnog oksidnog filma na površini metala objašnjava njegovu pasivnost u odnosu na hladno koncentrirane kiseline - oksidirajuća sredstva. Međutim, kada se jako zagrijavaju, ove kiseline otapaju krom:
2 Cr + 6 H 2 SO 4 (konc.) Cr 2 (SO 4) 3 + 3 SO 2 + 6 H 2 O
Cr + 6 HNO 3 (konc.) Cr (NO 3) 3 + 3 NO 2 + 3 H 2 O
Potvrda.Jedinjenja hroma
Dvovalentna jedinjenja hroma
hrom oksid (II) CrO
Fizička svojstva:čvrsta, u vodi netopiva supstanca jarko crvene ili smeđe-crvene boje. Hemijska svojstva. CrO je glavni oksid.Potvrda.
Cr 2 O 3 + 3N 2 2Cr + 3H 2 O hrom hidroksid (II) Cr(OH) 2 Fizička svojstva:čvrsta materija nerastvorljiva u vodi žuta boja. Hemijska svojstva. Cr(OH) 2 je slaba baza.- Reaguje sa kiselinama: Cr (OH) 2 + 2HCl → CrCl 2 + 2H 2 O Lako oksidira u prisustvu vlage atmosferskim kiseonikom u Cr (OH) 3:
4Cr(OH) 2 + O 2 + 2H 2 O → 4Cr(OH) 3
- Kada se zapali, razlaže se:
- Djelovanje alkalija na rastvore soli Cr(II): CrCl 2 + 2 NaOH = Cr(OH) 2 ↓ + 2 NaCl.
Trovalentna jedinjenja hroma
hrom oksid (III) Cr 2 O 3 Fizička svojstva: tamnozelena vatrostalna tvar, nerastvorljiva u vodi. Hemijska svojstva. Cr 2 O 3 - amfoterni oksid.natrijum hromita
- At visoke temperature redukovano vodikom, kalcijem, ugljikom u krom:
Cr 2 O 3 + 3N 2 2Cr + 3H 2 O
Potvrda.
hrom hidroksid (III) Cr(Oh) 3 Fizička svojstva: materija nerastvorljiva u vodi Zelena boja. Hemijska svojstva. Cr (OH) 3 - amfoterni hidroksid2Cr(OH) 3 + 3H 2 SO 4 →Cr 2 (SO 4) 3 + 6H 2 O
Cr(OH) 3 + KOH → KCrO 2 + 2H 2 O
(kalijum kromit) Potvrda.
- Pod dejstvom alkalija na Cr 3+ soli, taloži se želatinasti talog zelenog hrom (III) hidroksida:
Cr 2 (SO 4) 3 + 6NaOH → 2 Cr (OH) 3 ↓ + 3 Na 2 SO 4,
Heksavalentna jedinjenja hroma
hrom oksid (VI) CrO 3 Fizička svojstva: tamnocrvena čvrsta supstanca, dobro rastvorljiva u vodi. Otrovno! Hemijska svojstva. CrO 3 je kiseli oksid.- Interagira sa alkalijama, formirajući žute soli - hromate:
CrO 3 + 2KOH → K 2 CrO 4 + H 2 O
- Interagira s vodom i stvara kiseline: CrO 3 + H 2 O → H 2 CrO 4 hromna kiselina
- Termički nestabilno: 4 CrO 3 → 2Cr 2 O 3 + 3O 2
- Pripremljen od kalijum hromata (ili dihromata) djelovanjem H 2 SO 4 (konc.).
K 2 CrO 4 + H 2 SO 4 → CrO 3 + K 2 SO 4 + H 2 O
K 2 Cr 2 O 7 + H 2 SO 4 → 2CrO 3 + K 2 SO 4 + H 2 O
Hidroksidihrom(VI)H 2 CrO 4 - hromkiselina, H 2 Cr 2 O 7 - dihromkiselina Obje kiseline su nestabilne; kada se pokušavaju izolovati u njihovom čistom obliku, razlažu se na vodu i hrom (VI) oksid. Međutim, njihove soli su prilično stabilne. Soli hromne kiseline nazivaju se hromati, obojene su žuto, a soli dihromne kiseline se zovu dihromati, obojene su narandžasto.Gvožđe i njegova jedinjenja
željezo - relativno mekan savitljiv metal srebrne boje, duktilan, magnetiziran. T topljenje = 1539 0 C. ρ = 7,87 g / cm 3. CO: +2 - sa slabim oksidantima - rastvori kiselina, soli, nemetala, osim kiseonika i halogena +3 - sa jakim oksidantima - koncentrisanim kiselinama, kiseonikom, halogenima.Hemijska svojstva.
- Interakcija sa jednostavnim supstancama.
- Sagoreva u kiseoniku, formirajući kamenac - oksid gvožđa (II, III): 3Fe + 2O 2 → Fe 3 O 4 Gvožđe reaguje sa nemetalima kada se zagreva:
- Interakcija sa složenim supstancama.
- Na visokim temperaturama (700-900C), gvožđe reaguje sa vodenom parom:
3Fe + 4H 2 O Fe 3 O 4 + 4H 2 -
- Hrđa na vazduhu u prisustvu vlage: 4Fe + 3O 2 + 6H 2 O → 4Fe (OH) 3. Gvožđe se lako otapa u hlorovodoničkoj i razrijeđenoj sumpornoj kiselini, pokazujući CO +2:
Fe + 2HCl → FeCl 2 + H 2 -
Fe + H 2 SO 4 (dif.) → FeSO 4 + H 2 -
- U koncentriranim oksidirajućim kiselinama, željezo se otapa samo kada se zagrije, pokazujući CO +3:
2Fe + 6H 2 SO 4 (konc.) Fe 2 (SO 4) 3 + 3SO 2 - + 6H 2 O
Fe + 6HNO 3 (konc.) Fe(NO 3) 3 + 3NO 2 - + 3H 2 O
(na hladnom, koncentrisana azotna i sumporna kiselina pasiviziraju gvožđe).
- Gvožđe istiskuje metale desno od sebe u nizu naprezanja iz rastvora njihovih soli.
Fe + CuSO 4 → FeSO 4 + Cu↓
Potvrda.- Oporavak od oksida ugljikom ili ugljičnim monoksidom (II)
FeO + C Fe + CO
Fe 2 O 3 + 3CO 2Fe + 3CO 2
Gvozdena jedinjenja
Ogvožđe oksid (II) FeO
Fizička svojstva: crna čvrsta supstanca, nerastvorljiva u vodi. Hemijska svojstva: FeO - osnovni oksid 6 FeO + O 2 2Fe 3 O 4- Redukuje se vodonikom, ugljikom, ugljičnim monoksidom (II) u željezo:
FeO + C Fe + CO
Potvrda. Fe 3 O 4 + H 2 - 3 FeO + H 2 OGvožđe hidroksid (II) Fe(Oh) 2
Fizička svojstva: bijeli prah, nerastvorljiv u vodi. Hemijska svojstva: Fe(OH) 2 je slaba baza. Potvrda.- Nastaje djelovanjem alkalnih otopina na soli željeza (II) bez pristupa zraka:
FeCl 2 + 2KOH → 2KCl + Fe(OH) 2 ↓
kvalitetan odgovor na Fe 2+
Pod djelovanjem kalijevog heksacijanoferata (III) K 3 (crvena krvna sol) na otopine željeznih soli nastaje plavi talog (turnbull blue):3FeSO 4 + 2K 3 Fe 3 2 + 3K 2 SO 4
Jedinjenja željeza
gvožđe oksid (III) Fe 2 O 3
Fizička svojstva: crveno-braon čvrsta supstanca. Hemijska svojstva: Fe 2 O 3 je amfoterni oksid. natrijum ferit Fe 2 O 3 + 3H 2 - 2 Fe + 3H 2 O Potvrda.Gvožđe hidroksid (III) Fe(Oh) 3
Fizička svojstva: crveno-braon čvrsta supstanca. Hemijska svojstva: Fe (OH) 3 - amfoterni hidroksid.- Reaguje sa kiselinama kao nerastvorljiva baza:
2Fe(OH) 3 + 3H 2 SO 4 → Fe 2 (SO 4) 3 + 6H 2 O
- Reaguje sa alkalijama kao nerastvorljiva kiselina:
Fe (OH) 3 + KOH (tv) → KFeO 2 + 2H 2 O
Fe (OH) 3 + 3KOH (konc) → K 3
Potvrda.- Nastaje djelovanjem alkalnih otopina na soli feri željeza: taloži se u obliku crveno-smeđeg taloga:
Fe(NO 3) 3 + 3KOH Fe(OH) 3 + 3KNO 3
Kvalitativne reakcije za Fe 3+
- Pod djelovanjem kalijevog heksacijanoferata (II) K 4 (žuta krvna sol) na otopine feri soli nastaje plavi talog (prusko plavo):
4FeCl 3 + 3K 4 Fe 4 3 + 12KCl
- Kada se kalijev ili amonijum tiocijanat doda rastvoru koji sadrži ione Fe 3+, pojavljuje se intenzivna krvnocrvena boja gvožđe(III) tiocijanata:
FeCl 3 + 3KCNS 3KCl + Fe(CNS) 3
Bakar i njegova jedinjenja
Bakar- prilično mekan metal crveno-žute boje, savitljiv, duktilan, ima visoku toplinsku i električnu provodljivost. T topljenje = 1083 0 C. ρ = 8,96 g / cm 3. CO: 0,+1,+2
Hemijska svojstva.
- Interakcija sa jednostavnim supstancama.
- Interakcija sa složenim supstancama.
Bakar je u nizu napona desno od vodonika, stoga ne reaguje sa razrijeđenim hlorovodoničnom i sumpornom kiselinom, već se otapa u oksidirajućim kiselinama:
3Cu + 8HNO 3 (razg.) → 3Cu(NO 3) 2 + 2NO- + 2H 2 O
Cu + 4HNO 3 (konc.) → Cu(NO 3) 2 + 2NO 2 -+ 2H 2 O
Cu + 2H 2 SO 4 (konc.) → CuSO 4 + SO 2 - + 2H 2 O
Potvrda.
CuO + CO Cu + CO 2
- U elektrolizi soli bakra: 2CuSO 4 + 2H 2 O → 2
Cu + O 2
-
+ 2H2SO4
Monovalentna jedinjenja bakra
Bakar oksid (I) SAu 2 O Fizička svojstva: crvena čvrsta supstanca, nerastvorljiva u vodi. Hemijska svojstva: Su 2 O je glavni oksid. Potvrda.- Dobiva se redukcijom jedinjenja bakra (II), na primjer, glukoze u alkalnom mediju:
- Reaguje sa kiselinama: CuOH + HCl → CuCl + H 2 O Lako oksidira na vazduhu u Cu(OH) 2: 4CuOH + O 2 + 2H 2 O → 4 Cu(OH) 2
Jedinjenja dvovalentnog bakra
željezo (simbol Fe)- hemijski element osme grupe, četvrti period. Iron u periodnom sistemu hemijskih elemenata nalazi se na broju 26.
Podgrupa gvožđa sadrži 4 elementa: Fe gvožđe, rutenijum Ru, osmijum Os, Hs hasmijum.
Karakteristike hemijskog elementa Gvožđe
Ferrum je latinska riječ, ne znači samo željezo, već i tvrdoću i oružje. Od njega su nastala imena gvožđa u nekim evropskim jezicima: francuski fer, italijanski fero, španski hierro i termini kao što su ferit, feromagnetizam. Slični nazivi za ovaj metal na slavenskim i baltičkim jezicima: litvanski gelezis, poljski zelazo, bugarsko gvožđe, ukrajinski zalizo i beloruski zhalez. Englesko ime Iron, njemačko Eisen, holandsko ijzer izvedeno je iz sanskritskog isira (snažan, jak).
Rasprostranjenost gvožđa u prirodi
Gvozdeni 26 element periodnog sistema
Iron- prvi na svijetu i drugi najčešći metal u zemljine kore, veoma važan metal za ljude. Od pamtivijeka ljudi su se susreli sa željezom u obliku željeznih meteorita. Obično meteoritsko željezo sadrži od 5 do 30% nikla, skoro 0,5% kobalta i do 1% drugih elemenata. U Africi je prije 80 hiljada godina pao najveći meteorit Goba, težak 66 tona. Sadrži 84% žlezda i 16% nikla. Muzej meteorita Ruske akademije nauka čuva dva fragmenta željeznog meteorita koji je težak 256 kg i pao je na Daleki istok. Godine 1947. hiljade fragmenata (težine od 60 do 100 tona) željeznog meteorita palo je kao "gvozdena kiša" na Primorskom teritoriju na površini od 35 km 2. Vrlo rijedak mineral - samorodno željezo kopnenog porijekla, javlja se u obliku sitnih zrna i sadrži 2% nikla i desetine procenta ostalih metala. Samorodno gvožđe pronađeno je na Mesecu u smrvljenom stanju.
U 13-12 veku pre nove ere. dolazi do raspada i promjene kultura širom Evroazije od Atlantskog do Tihog okeana, i nekoliko stoljeća - do 10-8 stoljeća prije Krista. dešavaju se migracije. Ovaj period se naziva katastrofa bronzanog doba i početak tranzicije u gvozdeno doba.
U zemljinoj kori ima dosta gvožđa, ali ga je teško izvući. Ovaj metal je snažno vezan u rudama sa kiseonikom, a ponekad i sa sumporom. Drevne peći nisu mogle da obezbede potrebnu temperaturu na kojoj se topilo čisto gvožđe i dobijalo gvožđe u obliku sunđera sa nečistoćama iz rude zvane kritsa. Prilikom kovanja bluma, željezo je djelomično odvojeno od rude.
Mnogi minerali sadrže gvožđe. Magnetna željezna ruda, koja sadrži 72,3% željeza, je najbogatiji mineral željezom. Drevni grčki filozof Tales iz Mileta prije više od 2500 godina proučavao je uzorke crnog metala koji privlače željezo. Dao mu je ime magnetis lithos - kamen iz Magnezije, tako je nastao naziv magneta. Sada se zna da je to bila magnetna željezna ruda - crni željezni oksid.
Uloga gvožđa u živom organizmu
Hematit je najvažnija ruda željeza. Sadrži 69,9% gvožđa. Hematit se još naziva i crvena željezna ruda, a stari naziv je krvavi kamen. Od grčkog haima, što znači krv. Pojavile su se i druge riječi vezane za krv, kao što je hemoglobin. Hemoglobin služi kao prijenosnik kisika iz dišnih organa u tkiva tijela, au suprotnom smjeru prenosi ugljični dioksid. Nedostatak gvožđa u organizmu dovodi do ozbiljna bolest — anemija zbog nedostatka gvožđa. Kod ove bolesti dolazi do kršenja skeleta, funkcija središnjeg živčanog sustava i vaskularni sistemi, postoji nedostatak kiseonika u tkivima. Gvožđe je neophodno za žive organizme. Takođe se nalazi u mišićima, slezeni i jetri. Kod odrasle osobe gvožđe je oko 4 g, prisutno je u svakoj ćeliji tela. Osoba treba da dobije 15 miligrama gvožđa svakog dana hranom. Uz nedostatak gvožđa, lekari propisuju posebne preparate u kojima je gvožđe u lako svarljivom obliku.
Primena gvožđa
Ako u istopljenom gvožđu ima više od 2% ugljenika, onda se dobija liveno gvožđe, ono se topi stotinama stepeni niže od čistog gvožđa. Budući da je lijevano željezo krhko, od njega je moguće lijevati samo razne proizvode, ne može se kovati. Od željezne rude u visokim pećima topi se velika količina livenog gvožđa koje se koristi za livenje spomenika, rešetki i teških ležišta za alatne mašine. Većina željeza se prerađuje u čelik. Za to se dio ugljika i drugih nečistoća „sagorijeva“ iz lijevanog željeza u konverterima ili u pećima na otvorenom ložištu.
Sve od šina do eksera napravljeno je od čelika s različitim sadržajem ugljika. Ako u željezu ima malo ugljika, dobija se blagi niskougljični čelik, a unošenjem legirajućih nečistoća drugih elemenata u čelik dobijaju se različiti razredi specijalnih čelika. Postoji ogroman broj čelika i svaki ima svoju primjenu.
Najpoznatiji je nerđajući čelik, koji sadrži nikal i hrom. Ovaj čelik se koristi za izradu opreme za hemijska postrojenja i posuđa. A ako u čelik unesete 18% volframa, 1% vanadijuma i 4% hroma, dobićete brzorezni čelik, od njega se izrađuju burgije i vrhovi sjekutića. Ako stapate željezo sa 1,5% ugljika i 15% mangana, dobijete tako čvrst čelik od kojeg se prave noževi buldožera i zubi bagera. Čelik koji sadrži 36% nikla, 0,5% ugljenika i 0,5% mangana naziva se invar, koristi se za izradu preciznih instrumenata i nekih delova za satove. Čelik, koji se naziva platina, sadrži 46% nikla i 15% ugljika i širi se kada se zagrije na isti način kao staklo. Spoj platine sa staklom ne puca i stoga se koristi u proizvodnji električnih svjetiljki.
Nerđajući čelik nije magnetizovan i ne privlači ga magnet. Samo ugljenični čelik se može magnetizirati. Samo čisto željezo nije magnetizirano, već ga privlači magnet, takvo željezo je pogodno za proizvodnju jezgri elektromagneta.
Godišnje se u svijetu istopi više od milijardu tona željeza. Ali korozija, koja je strašni neprijatelj metala, ne uništava samo sam metal, zbog čijeg topljenja ogroman trud, također onemogućuje gotove proizvode koji koštaju više od samog metala. Godišnje uništi desetine miliona tona istopljenog metala. Kada gvožđe korodira, reaguje sa kiseonikom i vodom, pretvarajući se u rđu.

Gvožđe, njegov položaj u periodičnom sistemu hemijskih elemenata D. I. Mendeljejeva, interakcija sa sumporom, hlorovodoničnom kiselinom, rastvorima soli.
PLAN ODGOVORA:
pozicija na str. i strukturu atoma fizička svojstva Hemijska svojstva Hemijski element gvožđe nalazi se u 4. periodu 8. grupe sekundarne podgrupe. Atom gvožđa ima četiri elektronska sloja. D-podnivo trećeg sloja je ispunjen elektronima, na njemu se nalazi 6 elektrona, a na četvrtom sloju s-podnivo ima 2 elektrona. U jedinjenjima, željezo pokazuje oksidaciona stanja +2 i +3.
| IV period VIII grupa sekundarna podgrupa | fe)))) | +2 | +3 | ||
| +26 2 8 8+6 2 | 4s | ?? | |||
| 3d | ?? | ? | ? | ? | ? |
Jednostavna supstanca gvožđe je srebrno-beli metal sa tačkom topljenja od 15390C, gustinom od 7,87 g/cm3, i ima magnetna svojstva. Gvožđe je reaktivan metal. Kada se zagrije, stupa u interakciju sa sumporom i formira željezo(II) sulfid: Fe0 + S0 = Fe + 2S-2. Gvožđe istiskuje vodonik iz kiselih rastvora, uz formiranje soli gvožđa(II), na primer, delovanjem na gvožđe hlorovodonične kiseline Nastaje gvožđe(II) hlorid: Fe0 + 2H+1Cl-1 = Fe+2Cl2-1 + H20. Gvožđe može istisnuti manje aktivne metale iz rastvora njihovih soli, na primer, kada gvožđe deluje na rastvor bakar (II) sulfata, nastaju metalni bakar i gvožđe (II) sulfat: Fe0 + Cu + 2SO4 = Cu0 + Fe + 2SO4 .
U svim reakcijama željezo pokazuje svojstva redukcijskog agensa. Jači oksidanti - hlor, kiseonik, koncentrisane kiseline - oksidiraju gvožđe do oksidacionog stanja od +3.
Ako a zadaća na temu: » Gvožđe, njegova pozicija u periodnom sistemu hemijskih elemenata D. I. Mendeljejeva, interakcija se pokazalo korisnim za vas, bit ćemo vam zahvalni ako postavite link na ovu poruku na svoju stranicu na društvenoj mreži.
(!LANG: Najnovije vijesti
Kategorije
Vijesti
Povezani eseji
- Gimnazija br. 12, Lipeck Znamenshchikova Nadezhda Aleksandrovna Tema časa: Gvožđe i njegova jedinjenja (9. razred) Svrha: formirati koncept zavisnosti pravca oksidacionih reakcija na testu "Hemijski element" Nazivi hemijskih elemenata su uglavnom . ...... Poreklo Znakovi hemijskih elemenata su označeni latiničnim slovima, engleskim slovima i ruskim slovima Popunite praznine u tabeli Lekcija hemijske hemije u 9. razredu na temu „Svet metala“. Razvoj je napravio nastavnik hemije opštinske autonomne obrazovne ustanove "Bazarno-Matakskaya srednje opšte obrazovanje Test iz hemije na temu "Kiseonik i sumpor" 1. opcija 1. Sastaviti jednačine za elektrolitičku disocijaciju sumporne kiseline. 2. Sastavite punu i redukovanu jednačinu
- UPOTREBA test iz hemije Reverzibilan i nepovratan hemijske reakcije Odgovori na hemijsku ravnotežu
Reverzibilne i ireverzibilne hemijske reakcije. hemijska ravnoteža. Promena hemijske ravnoteže pod dejstvom razni faktori 1. Hemijska ravnoteža u sistemu 2NO(g).
Niobij u svom kompaktnom stanju je briljantni srebrno-bijeli (ili sivi u obliku praha) paramagnetski metal sa kubičnom kristalnom rešetkom usredsređenom na tijelo.
Imenica. Zasićenost teksta imenicama može postati sredstvo jezičke reprezentacije. Tekst pjesme A. A. Feta "Šapat, stidljivo disanje...", u njegovoj
1. Gvožđe: položaj u periodnom sistemu hemijskih elemenata D. I. Mendeljejeva, struktura atoma, moguća oksidaciona stanja, fizička svojstva, interakcija sa kiseonikom, halogenima, rastvorima kiselina i soli. Uloga gvožđa u modernoj tehnologiji. Legure gvožđa.
Gvožđe je u sporednoj podgrupi grupe VIII periodični sistem. Elektronska formula atoma željeza:
Tipična oksidaciona stanja gvožđa su +2 i +3. Oksidacijsko stanje +2 se manifestuje gubitkom dva 4s elektrona. Oksidacijsko stanje +3 takođe odgovara gubitku još jednog 3d elektrona, dok je 3d nivo napola popunjen; takve elektronske konfiguracije su relativno stabilne.
fizička svojstva. Gvožđe je tipičan metal koji formira metalnu kristalnu rešetku. Gvožđe provodi struju, prilično je vatrostalno, tačka topljenja 1539°C. Gvožđe se od većine drugih metala razlikuje po svojoj sposobnosti magnetizacije.
Hemijska svojstva. Gvožđe reaguje sa mnogim nemetalima:
![]()
Nastaje željezni kamenac - miješani željezni oksid. Njegova formula je također zapisana na sljedeći način: FeO Fe2O3.
![]()
Reaguje sa kiselinama i oslobađa vodonik:
Ulazi u reakcije supstitucije sa lociranim metalnim solima desno od gvožđa u nizu napona:
jedinjenja gvožđa. FeO - bazični oksid, reaguje sa rastvorima kiselina i formira soli gvožđa (II). Fe2O3 je amfoterni oksid koji takođe reaguje sa rastvorima alkalija.

Gvožđe hidroksidi. Fe (OH) 2 je tipičan bazični oksid, Fe (OH) 3 ima amfoterna svojstva, reaguje ne samo sa kiselinama, već i sa koncentrisanim rastvorima alkalija.
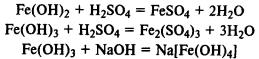
Gvožđe (II) hidroksid se lako oksidira u gvožđe (III) hidroksid atmosferskim kiseonikom:
Kada soli gvožđa (II) i (III) reaguju sa alkalijama, talože se nerastvorljivi hidroksidi:
Legure gvožđa. Moderna metalurška industrija proizvodi legure željeza različitih sastava.
Sve legure željeza podijeljene su po sastavu i svojstvima u dvije grupe. Prva grupa uključuje različite vrste lijevanog željeza, druga - različite vrste čelika.
Lijevano željezo je krto; čelici su plastični, mogu se kovati, valjati, vući, štancati. Razlika u mehaničkim svojstvima livenog gvožđa i čelika zavisi prvenstveno od njihovog sadržaja ugljenika – liveno gvožđe sadrži oko 4% ugljenika, a čelici obično manje od 1,4%.
U modernoj metalurgiji željezne rude se prvo koriste za proizvodnju lijevanog željeza, a zatim od lijevanog željeza u čelik. Liveno gvožđe se topi u visokim pećima, čelik se topi u čeličnim pećima. Do 90% sveg istopljenog sirovog gvožđa se prerađuje u čelik.
Liveno gvožde. Sirovo željezo namijenjeno preradi u čelik naziva se sirovo željezo. Sadrži od 3,9 do 4,3% C, 0,3-1,5% Si, 1,5-3,5% Mn, ne više od 0,3% P i ne više od 0,07% S. Liveno gvožđe, namenjeno "proizvodnji odlivaka, naziva se livnički gvožđe". U visokim pećima se tope i ferolegure koje se uglavnom koriste u proizvodnji čelika kao aditivi.Ferolegure u poređenju sa sirovim gvožđem imaju visok sadržaj silicijuma (ferosilicijuma), mangana (feromangana), hroma (ferohrom) i dr. elementi.
Postani. Svi čelici se dijele na ugljične i legirane čelike.
Ugljični čelici sadrže nekoliko puta manje ugljika, silicija i mangana od lijevanog željeza, a vrlo malo fosfora i sumpora. Svojstva ugljičnog čelika prvenstveno ovise o sadržaju ugljika u njemu: što je više ugljika u čeliku, to je on tvrđi. Industrija proizvodi blage čelike, čelike srednje tvrdoće i tvrde čelike. Blagi i srednje tvrdi čelici koriste se za izradu mašinskih dijelova, cijevi, vijaka, eksera itd., dok se tvrdi čelici koriste za izradu alata.
Čelici treba da sadrže što je moguće manje sumpora i fosfora, jer te nečistoće narušavaju mehanička svojstva čelika. U povećanim količinama, sumpor uzrokuje crvenu lomljivost - stvaranje pukotina tokom vruće obrade metala. Fosfor uzrokuje hladnokrvnost - lomljivost čelika na običnoj temperaturi. -
Legirani čelici. Fizička, kemijska i mehanička svojstva čelika značajno se mijenjaju od uvođenja u njihov sastav povećan iznos mangan i silicijum, kao i hrom, nikl, volfram i drugi elementi. Ovi elementi se nazivaju legirani, a čelik - legirani (od latinske riječi ligare - spojiti, spojiti).
Krom je najčešće korišteni legirajući element. Posebno veliki značaj za konstrukciju mašina, aparata i mnogih delova mašina imaju hrom-nikl postati. Ovi čelici imaju visoku duktilnost, čvrstoću, otpornost na toplinu i otpornost na oksidirajuća sredstva. Dušična kiselina bilo koje koncentracije ne uništava ih čak ni na temperaturama ključanja. Krom-nikl čelici ne rđaju u atmosferskim uvjetima i u vodi. Sjajni listovi hrom-nikl čelika srebrne boje krase lukove stanice Majakovska moskovskog metroa. Od istog čelika izrađuju se nerđajući noževi, kašike, viljuške i ostali kućni predmeti.
Molibden i vanadij povećavaju tvrdoću i čvrstoću čelika na povišene temperature i pritiscima. dakle, hrom-molibden i hrom vanadijčelici se koriste za proizvodnju cevovoda i delova kompresora u proizvodnji sintetičkog amonijaka, avionskih motora.
Prilikom rezanja velikom brzinom, alat se zagrijava i brzo se troši. Kada se doda volfram, tvrdoća čelika se održava čak i na povišenim temperaturama. Stoga se krom-volfram čelici koriste za proizvodnju reznih alata koji rade pri velikim brzinama.
Povećanje sadržaja mangana u čeliku povećava njegovu otpornost na trenje i udar. Manganski čelici se koriste za izradu željezničkih rampi, skretnica, križeva, drobilica kamena.
Upotreba legiranih čelika može značajno smanjiti težinu metalnih konstrukcija, povećati njihovu čvrstoću, izdržljivost i pouzdanost u radu.
2. Vjeverice poput biopolimera. Primarne, sekundarne i tercijarne strukture proteina. svojstva i biološke funkcije proteini.
Proteini (proteini, polipeptidi) su visokomolekularne organske supstance koje se sastoje od alfa-amino kiselina povezanih u lanac peptidnom vezom.
Proteini, kao i polisaharidi, su biološki polimeri. Većina proteinskih molekula dostiže gigantske veličine u poređenju sa drugim organskim jedinjenjima i imaju veoma veliku molekulsku težinu:
Molekularna formula jednog od proteina penicilinske grupe je C 43 H 58 N 4 O 12; kazein - protein kravljeg mleka, – C 47 H 48 N 3 NaO 7 S 2 ; hemoglobin - C 3032 H 48I6 O 872 N 780 S 8 Fe 4;


