24.06.2020
Sinteza și secreția, metabolismul hormonilor tiroidieni. Schema generală a biosintezei
1. Definirea conceptului de „hormoni”, clasificarea și caracteristicile biologice generale ale hormonilor.
2. Clasificarea hormonilor după natura chimică, exemple.
3. Mecanisme de acțiune ale hormonilor îndepărtați și care pătrund celular.
4. Intermediari ai acțiunii hormonilor asupra metabolismului - nucleotide ciclice (cAMP, cGMP), ioni de Ca2 +, inozitol trifosfat, proteine receptorilor de citosol. Reacții de sinteză și dezintegrare a cAMP.
5. Mecanisme în cascadă de activare a enzimelor ca modalitate de a spori semnalul hormonal. Rolul protein kinazelor.
6. Ierarhie sistemul hormonal. Principiul feedback-ului în reglarea secreției hormonale.
7. Hormoni ai hipotalamusului și glandei pituitare anterioare: natura chimică, mecanismul de acțiune, țesuturile și celulele țintă, efect biologic.
23.1. Definirea conceptului de „hormoni” și clasificarea lor după natura chimică.
23.1.1. Aflați definiția conceptului: hormoni- compuși biologic activi secretați de glandele endocrine în sânge sau limfă și care afectează metabolismul celular.
23.1.2. Amintiți-vă principalele caracteristici ale acțiunii hormonilor asupra organelor și țesuturilor:
- hormonii sunt sintetizați și eliberați în sânge de către celulele endocrine specializate;
- hormonii au activitate biologică mare - efectul fiziologic se manifestă atunci când concentrația lor în sânge este de aproximativ 10-6 - 10-12 mol/l;
- fiecare hormon este caracterizat de propria sa structură unică, loc de sinteză și funcție; deficiența unui hormon nu poate fi completată cu alte substanțe;
- hormonii, de regulă, afectează organe și țesuturi îndepărtate de locul sintezei lor.
23.1.3. Hormonii își desfășoară acțiunea biologică formând un complex cu molecule specifice - receptori . Celulele care conțin receptori pentru un anumit hormon sunt numite celule țintă pentru acest hormon. Majoritatea hormonilor interactioneaza cu receptorii situati pe membrana plasmatica a celulelor tinta; alți hormoni interacționează cu receptorii localizați în citoplasmă și nucleul celulelor țintă. Rețineți că o deficiență atât a hormonilor, cât și a receptorilor acestora poate duce la dezvoltarea bolilor.
23.1.4. Unii hormoni pot fi sintetizați de celulele endocrine ca precursori inactivi - prohormoni . Prohormonii pot fi stocați în cantități mari în granule secretoare speciale și activați rapid ca răspuns la semnalul corespunzător.
23.1.5. Clasificarea hormonilor pe baza structurii lor chimice. Diverse grupe chimice de hormoni sunt prezentate în Tabelul 23.1.
| Clasa chimica | Hormon sau grup de hormoni | Locul principal al sintezei |
|---|---|---|
| Proteine și peptide | liberienii Statine |
Hipotalamus |
| Vasopresina Oxitocina |
Hipotalamus* | |
|
Hormonii tropicali |
Glanda pituitară anterioară (adenohipofiză) |
|
| Insulină Glucagon |
Pancreas (insulele Langerhans) | |
| Parathormon | glande paratiroide | |
| Calcitonina | Glanda tiroida | |
| Derivați de aminoacizi | Iodotironine (tiroxina, triiodotironina) |
Glanda tiroida |
| Catecolamine (adrenalină, norepinefrină) |
Medula suprarenală, sistemul nervos simpatic | |
| Steroizi | Glucocorticoizi (cortizol) |
Cortexul suprarenal |
| Mineralocorticoizi (aldosteron) |
Cortexul suprarenal | |
| Androgeni (testosteron) |
testicule | |
| Estrogenii (estradiol) |
ovarele | |
| Progestative (progesteron) |
ovarele |
* Locul de secreție al acestor hormoni este lobul posterior al glandei pituitare (neurohipofiza).
Trebuie avut în vedere că, pe lângă hormonii adevărați, ei mai secretă hormoni locali. Aceste substanțe sunt sintetizate, de regulă, de celule nespecializate și își au efectul în imediata vecinătate a locului de producție (nu sunt transferate de sânge în alte organe). Exemple de hormoni locali sunt prostaglandinele, kininele, histamina, serotonina.
23.2. Ierarhia sistemelor de reglementare din organism.
23.2.1. Amintiți-vă că există mai multe niveluri de reglare a homeostaziei în organism, care sunt strâns interconectate și funcționează ca un singur sistem (vezi Figura 23.1).
Figura 23.1. Ierarhia sistemelor de reglementare ale organismului (explicații în text).
23.2.2. 1. Semnalele din mediul extern și intern intră în sistemul nervos central ( cel mai inalt nivel reglare, exercitarea controlului în cadrul întregului organism). Aceste semnale sunt transformate în impulsuri nervoase care cad asupra celulelor neurosecretoare ale hipotalamusului. Hipotalamusul produce:
- liberali (sau factori de eliberare) care stimulează secreția de hormoni pituitari;
- statine - substante care inhiba secretia acestor hormoni.
Liberinele și statinele prin sistemul capilarelor portal ajung în glanda pituitară, unde sunt produse. hormoni tropicali . Hormonii tropicali acționează asupra țesuturilor țintă periferice și stimulează formarea și secreția (semnul „+”) hormonii glandelor endocrine periferice. Hormonii glandelor periferice inhibă (semnul „-”) formarea hormonilor tropicali, acționând asupra celulelor glandei pituitare sau a celulelor neurosecretoare ale hipotalamusului. În plus, hormonii, care acționează asupra metabolismului în țesuturi, provoacă modificări ale conținutului metaboliți în sânge , iar acestea, la rândul lor, afectează (prin un mecanism de feedback) secreția de hormoni în glandele periferice (fie direct, fie prin intermediul hipofizarului și hipotalamusului).
2. Se formează hipotalamusul, glanda pituitară și glandele periferice nivel mediu reglarea homeostaziei, oferind controlul mai multor căi metabolice în cadrul aceluiași organ, sau țesut sau organe diferite.
Hormonii glandelor endocrine pot afecta metabolismul:
- prin modificarea cantității de proteină enzimatică;
- prin modificarea chimică a proteinei enzimatice cu modificarea activității acesteia, precum și
- prin modificarea vitezei de transport a substantelor prin membranele biologice.
3. Mecanismele de reglare intracelulare sunt Cel mai mic nivel regulament. Semnalele pentru schimbarea stării celulei sunt substanțe care se formează în celulele în sine sau intră în ea.
23.3. Mecanismele de acțiune ale hormonilor.
29.3.1. Vă rugăm să rețineți că mecanismul de acțiune al hormonilor depinde de natura și proprietățile sale chimice - solubilitatea în apă sau grăsimi. După mecanismul de acțiune, hormonii pot fi împărțiți în două grupe: acțiune directă și acțiune la distanță.
29.3.2. Hormoni cu acțiune directă. Acest grup include hormoni lipofili (solubili în grăsimi) - steroizi și iodotironine . Aceste substanțe sunt slab solubile în apă și, prin urmare, formează compuși complecși cu proteinele plasmatice din sânge. Aceste proteine includ atât proteine de transport specifice (de exemplu, transcortina, care leagă hormonii cortexului suprarenal), cât și cele nespecifice (albumine).
Hormonii cu acțiune directă, datorită lipofilității lor, sunt capabili să difuzeze prin stratul dublu lipidic al membranelor celulelor țintă. Receptorii acestor hormoni se găsesc în citosol. Cele emergente complexul hormono-receptor se deplasează la nucleul celulei, unde se leagă de cromatină și acționează asupra ADN-ului. Ca rezultat, se modifică viteza de sinteză a ARN-ului pe matrița ADN (transcripție) și viteza de formare a proteinelor enzimatice specifice pe matrița ARN (traducere). Acest lucru duce la o modificare a cantității de proteine enzimatice din celulele țintă și la o schimbare a direcției reacțiilor chimice din acestea (vezi Figura 2).

Figura 23.2. Mecanismul de influență asupra celulei hormonilor cu acțiune directă.
După cum știți deja, reglarea sintezei proteinelor poate fi efectuată folosind mecanismele de inducție și represiune.
Inducerea sintezei proteinelor apare ca urmare a stimulării sintezei ARN-ului mesager corespunzător. În același timp, crește concentrația unei anumite proteine-enzime în celulă și crește viteza reacțiilor chimice catalizate de aceasta.
Reprimarea sintezei proteinelor are loc prin suprimarea sintezei ARN-ului mesager corespunzător. Ca urmare a represiunii, concentrația unei anumite proteine-enzime în celulă scade selectiv și scade viteza reacțiilor chimice catalizate de aceasta. Rețineți că același hormon poate induce sinteza unor proteine și poate reprima sinteza altor proteine. Efectul hormonilor cu acțiune directă apare de obicei numai după 2 - 3 ore de la pătrunderea în celulă.
23.3.3. Hormoni de acțiune la distanță. Hormonii cu acțiune lungă includ hidrofil (solubil în apă) hormoni - catecolamine si hormoni de natura proteino-peptidica. Deoarece aceste substanțe sunt insolubile în lipide, ele nu pot pătrunde în membranele celulare. Receptorii acestor hormoni sunt localizați pe suprafața exterioară a membranei plasmatice a celulelor țintă. Hormonii îndepărtați își realizează acțiunea asupra celulei cu ajutorul intermediar secundar, care este cel mai adesea AMP ciclic (AMPc).
AMP ciclic este sintetizat din ATP de către adenilat ciclază:

Mecanismul de acțiune la distanță a hormonilor este prezentat în Figura 23.3.

Figura 23.3. Mecanismul de influență asupra hormonilor celulari de acțiune la distanță.
Interacțiunea unui hormon cu specificul său receptor conduce la activareG-veveriţă membrana celulara. Proteina G leagă GTP și activează adenilat ciclaza.
Adenilat ciclaza activă transformă ATP în AMPc, AMPc activează protein kinaza.
O protein kinază inactivă este un tetramer care constă din două subunități reglatoare (R) și două subunități catalitice (C). Ca rezultat al interacțiunii cu AMPc, tetramerul se disociază și centrul activ al enzimei este eliberat.
Protein kinaza fosforilează proteinele enzimatice în detrimentul ATP, fie activându-le, fie inactivându-le. Ca urmare a acestui fapt, viteza reacțiilor chimice în celulele țintă se modifică (în unele cazuri crește, în altele scade).
Inactivarea cAMP are loc cu participarea enzimei fosfodiesteraze:

23.4. Hormonii hipotalamusului și glandei pituitare.
După cum sa menționat deja, locul de interacțiune directă a departamentelor superioare ale centralei sistem nervos iar sistemul endocrin este hipotalamusul. Aceasta este o zonă mică a creierului anterior, care este situată direct deasupra glandei pituitare și este conectată la aceasta printr-un sistem de vase de sânge care formează sistemul portal.
23.4.1. Hormonii hipotalamusului. Acum se știe că celulele neurosecretoare ale hipotalamusului produc 7 liberini(somatoliberină, corticoliberină, tireoliberină, luliberină, folliberină, prolactoliberină, melanoliberină) și 3 statine(somatostatina, prolactostatina, melanostatin). Toate aceste conexiuni sunt peptide.
Hormonii din hipotalamus printr-un sistem vascular portal special intră în lobul anterior al glandei pituitare (adenohipofiză). Liberinele stimulează, iar statinele suprimă sinteza și secreția hormonilor hipofizari tropicali. Efectul liberinelor și statinelor asupra celulelor pituitare este mediat de mecanisme dependente de cAMP și Ca2+.
Caracteristicile celor mai studiate liberine și statine sunt prezentate în Tabelul 23.2.
| Factor | Scenă | Reglarea secreției | |
|---|---|---|---|
| Corticoliberină | Adenohipofiza | Stimulează secreția de hormon adrenocorticotrop (ACTH) | Secreția este stimulată de stres și suprimată de ACTH |
| Tireoliberină | - “ - “ - | Stimulează secreția de hormon de stimulare a tiroidei (TSH) și prolactină | Secretia inhibata de hormonii tiroidieni |
| Somatoliberină | - “ - “ - | Stimulează secreția de hormon de creștere (STH) | Secreție stimulată de hipoglicemie |
| Luliberin | - “ - “ - | Stimulează secreția de hormon foliculostimulant (FSH) și hormon luteinizant (LH) | La bărbați, secreția este cauzată de o scădere a conținutului de testosteron din sânge, la femei - de o scădere a concentrației de estrogeni. O concentrație mare de LH și FSH în sânge inhibă secreția |
| Somatostatina | - “ - “ - | Inhibă secreția de STH și TSH | Secreția este indusă de efort. Factorul este inactivat rapid în țesuturile corpului. |
| Prolactostatina | - “ - “ - | Inhibă secreția de prolactină | Secreția este stimulată de o concentrație mare de prolactină și suprimată de estrogeni, testosteron și semnalele nervoase în timpul alăptării. |
| Melanostatina | - “ - “ - | Inhibă secreția de MSH (hormon de stimulare a melanocitelor) | Secreția este stimulată de melanotonină |
23.4.2. Hormonii adenohipofizei. Adenohipofiza (glanda pituitară anterioară) produce și eliberează în sânge o serie de hormoni tropicali care reglează funcția atât a organelor endocrine, cât și a celor non-endocrine. Toți hormonii hipofizari sunt proteine sau peptide. Mediatorul intracelular al tuturor hormonilor hipofizari (cu excepția somatotropinei și prolactinei) este AMP ciclic (AMPc). Caracteristicile hormonilor glandei pituitare anterioare sunt prezentate în tabelul 3.
| Hormonul | țesut țintă | Principalele efecte biologice | Reglarea secreției |
|---|---|---|---|
| Hormonul adrenocorticotrop (ACTH) | Cortexul suprarenal | Stimulează sinteza și secreția de steroizi de către cortexul suprarenal | Stimulat de corticoliberină |
| Hormonul de stimulare a tiroidei (TSH) | Glanda tiroida | Îmbunătățește sinteza și secreția hormonilor tiroidieni | Stimulat de tiroliberină și suprimat de hormonii tiroidieni |
| Hormonul somatotrop (hormonul de creștere, STH) | Toate țesăturile | Stimulează sinteza ARN și proteinelor, creșterea țesuturilor, transportul glucozei și aminoacizilor în celule, lipoliza | Stimulat de somatoliberină, inhibat de somatostatina |
| Hormonul foliculostimulant (FSH) | Tubuli seminiferi la bărbați, foliculi ovarieni la femei | Crește producția de spermă la bărbați și formarea foliculilor la femei | Stimulat de luliberin |
| hormonul luteinizant (LH) | Celulele interstițiale ale testiculelor (la bărbați) și ale ovarelor (la femei) | Provoacă secreția de estrogeni, progesteron la femei, îmbunătățește sinteza și secreția de androgeni la bărbați | Stimulat de luliberin |
| Prolactina | Glandele mamare (celule alveolare) | Stimulează sinteza proteinelor din lapte și dezvoltarea glandelor mamare | Suprimat de prolactostatina |
| Hormonul de stimulare a melanocitelor (MSH) | celule pigmentare | Crește sinteza melaninei în melanocite (determină întunecarea pielii) | Suprimată de melanostatină |
23.4.3. Hormonii neurohipofizei. Hormonii secretați în fluxul sanguin de hipofiza posterioară includ oxitocina și vasopresina. Ambii hormoni sunt sintetizați în hipotalamus ca proteine precursoare și călătoresc de-a lungul fibrelor nervoase până la glanda pituitară posterioară.
Oxitocina - o nonapeptidă care provoacă contracții ale mușchilor netezi ai uterului. Este folosit în obstetrică pentru a stimula activitatea munciiși lactația.
Vasopresina - nonapeptidă secretată ca răspuns la o creștere a presiunii osmotice a sângelui. Celulele țintă pentru vasopresină sunt celulele tubulare renale și celulele musculare netede vasculare. Acțiunea hormonului este mediată de cAMP. Vasopresina determină vasoconstricție și creșterea tensiunii arteriale și, de asemenea, crește reabsorbția apei în tubii renali, ceea ce duce la scăderea diurezei.
23.4.4. Principalele tipuri de tulburări ale funcției hormonale a hipofizei și hipotalamusului. Cu o deficiență de hormon somatotrop care apare în copilărie, se dezvoltă nanism (creștere scăzută). Cu un exces de hormon somatotrop care apare în copilărie, se dezvoltă gigantism (anormal de înalt).
Cu un exces de hormon somatotrop care apare la adulți (ca urmare a unei tumori hipofizare), se dezvoltă acromegalie - cresterea crescuta a mainilor, picioarelor, maxilarului inferior, nasului.
Cu o lipsă de vasopresină rezultată din infecții neurotrope, se dezvoltă leziuni cerebrale traumatice, tumori ale hipotalamusului. diabet insipid. Principalul simptom al acestei boli este poliurie- o creștere bruscă a diurezei cu o densitate relativă redusă (1,001 - 1,005) a urinei.
28.4. Hormonii pancreasului.
Vă rugăm să rețineți că partea endocrină a pancreasului produce și eliberează hormonii insulină și glucagon în sânge.
1. Insulină. Insulina este un hormon protein-peptidic produs de celulele β din insulele Langerhans. Molecula de insulină este formată din două lanțuri polipeptidice (A și B) care conțin 21, respectiv 30 de resturi de aminoacizi; Lanțurile de insulină sunt legate prin două punți disulfurice. Insulina este formată dintr-o proteină precursoare (preproinsulină) prin proteoliză parțială (vezi Figura 4). După ce secvența semnalului este scindată, se formează proinsulina. Ca rezultat al transformării enzimatice, un fragment al lanțului polipeptidic care conține aproximativ 30 de resturi de aminoacizi (peptidă C) este îndepărtat și se formează insulină.
Stimulul pentru secreția de insulină este hiperglicemia - o creștere a glicemiei (de exemplu, după masă). Principalele ținte pentru insulină sunt celulele hepatice, musculare și ale țesutului adipos. Mecanismul de acțiune este îndepărtat.

Figura 4 Schema conversiei preproinsulinei în insulină.
receptor de insulină este o proteină complexă - o glicoproteină situată pe suprafața celulei țintă. Această proteină constă din două subunități α și două subunități β legate prin punți disulfură. Subunitățile β conțin mai multe resturi de aminoacizi de tirozină. Receptorul de insulină are activitate tirozin kinazei, de exemplu. este capabil să catalizeze transferul reziduurilor de acid fosforic de la ATP la grupa OH a tirozinei (Figura 5).

Figura 5 receptor de insulină.
În absența insulinei, receptorul nu apare activitate enzimatică. Când se leagă de insulină, receptorul suferă autofosforilare, adică. Subunitățile β se fosforilează între ele. Ca urmare, conformația receptorului se modifică și dobândește capacitatea de a fosforila alte proteine intracelulare. Ulterior, complexul receptor de insulină este scufundat în citoplasmă și componentele sale sunt scindate în lizozomi.
Formarea unui complex hormon-receptor crește permeabilitatea membranelor celulare pentru glucoză și aminoacizi. Sub acțiunea insulinei în celulele țintă:
a) activitatea adenilat-ciclazei scade și activitatea fosfodiesterazei crește, ceea ce duce la scăderea concentrației de cAMP;
b) viteza de oxidare a glucozei crește și rata gluconeogenezei scade;
c) sinteza glicogenului si a grasimilor creste si mobilizarea acestora este suprimata;
d) sinteza proteinelor este accelerată și degradarea acesteia este inhibată.
Toate aceste modificări vizează utilizarea accelerată a glucozei, ceea ce duce la scăderea glicemiei. Inactivarea insulinei are loc în principal la nivelul ficatului și constă în ruperea legăturilor disulfurice dintre lanțurile A și B.
2. Glucagon. Glucagonul este o polipeptidă care conține 29 de resturi de aminoacizi. Este produs de celulele α din insulele Langerhans ca proteină precursoare (proglucagon). Proteoliza parțială a prohormonului și secreția de glucagon în sânge au loc în timpul hipoglicemiei induse de post.
Celulele țintă pentru glucagon - ficat, țesut adipos, miocard. Mecanismul de acțiune este îndepărtat (mediatorul este cAMP).
Sub acțiunea glucagonului în celulele țintă:
a) mobilizarea glicogenului în ficat este accelerată (vezi Figura 6) și sinteza acestuia este inhibată;
b) se accelerează mobilizarea grăsimilor (lipoliza) în ţesutul adipos şi sinteza acestora este inhibată;
c) sinteza proteinelor este inhibata si catabolismul acesteia este intensificat;
d) gluconeogeneza si cetogeneza accelerata in ficat.
Efectul final al glucagonului este menținerea nivelului ridicat de glucoză din sânge.

Figura 6 Mecanismul în cascadă de activare a glicogen fosforilazei sub influența glucagonului.
3. Încălcări ale funcției hormonale a pancreasului. Cel mai frecvent diabet zaharat este o boală cauzată de o încălcare a sintezei și secreției de insulină de către celulele β (diabet de tip I) sau de o deficiență a receptorilor sensibili la insulină din celulele țintă (diabet de tip II). Diabetul se caracterizează prin următoarele tulburări metabolice:
a) o scădere a utilizării glucozei de către celule, o creștere a mobilizării glicogenului și activarea gluconeogenezei în ficat duc la creșterea glicemiei (hiperglicemie) și la depășirea acesteia a pragului renal (glucozurie);
b) accelerarea lipolizei (descompunerea grăsimilor), formarea excesivă de acetil-CoA, utilizat pentru sinteza cu intrarea ulterioară în sânge a colesterolului (hipercolesterolemie) și a corpilor cetonici (hipercetonemie); corpii cetonici trec cu ușurință în urină (cetonurie);
c) o scădere a ratei sintezei proteinelor și o creștere a catabolismului aminoacizilor în țesuturi duce la o creștere a concentrației de uree și a altor substanțe azotate în sânge (azotemie) și o creștere a excreției lor în urină ( azoturie);
d) excreția de către rinichi a unor cantități mari de glucoză, corpi cetonici și uree este însoțită de o creștere a diurezei (poliurie).
28.5. Hormonii medulei suprarenale.
Hormonii medularei suprarenale includ epinefrina și norepinefrina (catecolamine). Ele sunt sintetizate în celule cromafine din tirozină (Figura 7).

Figura 7 Schema pentru sinteza catecolaminelor.
Secreția de adrenalină crește odată cu stresul, efortul fizic. Țintele pentru catecolamine sunt celulele hepatice, țesutul muscular și adipos și sistemul cardiovascular. Mecanismul de acțiune este îndepărtat. Efectele sunt realizate prin sistemul adenil-ciclazei și se manifestă prin modificări ale metabolismului carbohidraților. Ca și glucagonul, epinefrina determină activarea mobilizării glicogenului (vezi Figura 6) în mușchi și ficat, lipoliza în țesutul adipos. Acest lucru duce la o creștere a conținutului de glucoză, lactat și acizi grași din sânge. Adrenalina sporește și activitatea cardiacă, provoacă vasoconstricție.
Neutralizarea adrenalinei are loc în ficat. Principalele moduri de neutralizare sunt: metilarea (enzima - catecol-orto-metiltransferaza, COMT), dezaminarea oxidativa (enzima - monoaminoxidaza, MAO) si conjugarea cu acid glucuronic. Produsele neutralizării sunt excretate prin urină.
Universitatea de Stat de Medicină din VolgogradFacultatea de Medicină și Biologie, curs III
biochimiei umane
BIOCHIMIE
STEROID
HORMONI
Prezentarea slide-ului prelegerii
Ph.D. Valeri Ghennadievici Zaitsev
(Departamentul de Biochimie Teoretică cu Cursul de Biochimie Clinică, Universitatea Medicală de Stat din Volgograd)
© 2007, V.G. Zaitsev
Planul cursului
IntroducereHormoni steroizi - structura, nomenclatura si
clasificare
Prezentare generală a căilor de biosinteză a hormonilor steroizi
Enzime implicate în biosinteză
Căile biosintetice ale hormonilor individuali și reglarea acestora
Hormoni steroizi în sânge
Mecanism de acțiune/interacțiune cu celulele țintă
Inactivarea și catabolismul hormonilor steroizi
© 2007, V.G. Zaitsev
Caracteristicile hormonilor steroizi
Origine comună (precursor -colesterol)
Solubil în grăsimi, prin urmare pătrunde ușor
membranelor
Nu este depozitat sau depozitat în țesutul endocrin
secretat imediat după sinteză
Sinteză reglată, nu eliberare
Enzime pentru biosinteza hormonilor steroizi
localizat în mitocondrii și RE neted
Transportul de sânge necesită special
proteine purtătoare care leagă hormonii
În unele cazuri, acestea pot fi convertite în
forme cu activitate biologică alterată
țesuturi non-endocrine (ficat, țesuturi țintă)
© 2007, V.G. Zaitsev
Scheletul hormonilor steroizi
1,2-Ciclopentanoperhidrofenantren4 inele de hidrocarburi
(3 cu șase membri și 1
cu cinci membri)
Poziții alternative
indicat prin săgeți
Posibili înlocuitori:
metil-, hidroxi-, oxo-,
carboxil-, acetil-,
hidroxiacetil-,
carboxialchil și altele.
© 2007, V.G. Zaitsev
Origine metabolică
Toți hormonii steroizi– lipofil
greutate moleculară mică
conexiuni, comune
predecesor
care este
colesterolul
Surse de colesterol
corpul uman:
hrana si biosinteza
(în principal în
hepatocite)
© 2007, V.G. Zaitsev
Locul hormonilor steroizi în metabolismul colesterolului
COLESTEROLAcizi biliari
Progesteron
Glucocorticoizi
Mineralocorticoizi
Vitamina D
Androgeni
Estrogenii
© 2007, V.G. Zaitsev
Stereochimia steroizilor
Pentru comunicarea B/Csteroizi de origine animală
cunoscută numai conformaţia cis
Legături A/B și C/D
poate fi atât cis cât și
trans-majoritar
steroid
hormoni umani
au o conformatie
trans-trans-trans
(5α-steroizi)
5α-steroizi
5β-steroizi
© 2007, V.G. Zaitsev
Steroizi de reglementare
1.2.
Hormoni steroizi „adevărați”:
sintetizate în principal în glandele interne
secretii
efecte endocrine
Neurosteroizi (Baulieu E.E., 1991; Biol. Cell. 71:3-10)
sintetizat de celulele sistemului nervos central
(CNS)
efecte autocrine și paracrine
© 2007, V.G. Zaitsev
Pașii necesari de schimb
Sinteza hormonilor steroizi direct din colesterolsau de la intermediari
Secreția hormonilor steroizi în sânge / transportul către ținte
actiuni
Metabolismul periferic (conversia steroidului primar
hormoni în metaboliți cu altă activitate biologică,
apare în ficat și în celulele țintă)
Absorbție de către celulele țintă
Inactivarea și catabolismul hormonilor steroizi / excreție
produse de degradare
© 2007, V.G. Zaitsev
10. Clasificări ale hormonilor steroizi
După locul de studiiPrin funcții biologice (care sisteme
a afecta)
Pe tipuri de activitate biologică
Prin activitatea biochimică
După tipul de celulă țintă
După structura chimică
După gen (universal/bărbați/feminin)
© 2007, V.G. Zaitsev
11. Locuri de educație
SURENALE (corticosteroizi)glucocorticoizi și mineralocorticoizi, în parte -
progesteron și unii androgeni)
TESTURI (hormoni sexuali masculini - androgeni)
OVARELE (hormonii sexuali feminini - progestative și
estrogen)
ȚESUT ENDOCRIN FETOPLANTENTAL
(progesteron din saptamana 6-8 de sarcina, precum si
estrogeni - din sulfat de dehidroepiandrosteron)
© 2007, V.G. Zaitsev
12. Clase de hormoni steroizi
GLUCOCORTICOIDE (principalul reprezentant -cortizol)
MINERALOCORTICOIZII (cei mai cunoscuți și mai studiati
aldosteron)
ANDROGENI (ex. testosteron)
PROGESTINE sau PROGESTOGENE (progesteron)
ESTROGENI (cele mai semnificative sunt estradiolul și estrona)
© 2007, V.G. Zaitsev
13. Schema generală a biosintezei
© 2007, V.G. Zaitsev14. Precursor metabolic comun
Pregnenolon (steroid C21)Format în prima etapă a sintezei
TOȚI hormonii steroizi
Reacție de scindare a lanțului lateral
colesterolul este catalizat de un special
dependent de citocrom P450
enzimă - Р450scc (de asemenea
numită 20,22-desmolază sau
20,22-liaza)
Etapa cheie în sinteza steroizilor
hormoni
Reglată de adrenocorticotrop
hormonul (ACTH) în glandele suprarenale și
hormonul luteinizant (LH) în
gonade
© 2007, V.G. Zaitsev
15. Steroizi androgeni
Testosteron17p-hidroxiandrost-4-en-3-onă
Androstenedionă
Androst-4-en-3,17-dione
5α-dihidrotestosteron
17p-hidroxi-5p-androstan-3-onă
© 2007, V.G. Zaitsev
16. Steroizi androgeni
Locuri de sintezătesticule
Cortexul suprarenal
Activitate androgenă
Creșterea și dezvoltarea organelor reproducătoare masculine
Implicat în determinarea sexului fetal
Influențați comportamentele specifice sexului
Determinați manifestarea caracteristicilor sexuale secundare
Stimulanti si regulatori ai spermatogenezei
Acțiune anabolică
Dezvoltarea masei musculare
Dezvoltarea scheletului și a țesutului conjunctiv
Dezvoltarea părului
Cauza inversarea proceselor catabolice,
ducând la scăderea masei anumitor tipuri de țesuturi
Stimularea sintezei proteinelor, suprimarea defalcării acesteia
© 2007, V.G. Zaitsev
17. Steroizi anabolizanți
© 2007, V.G. Zaitsev18. Steroizi estrogeni
EstroneEstradiol
3-hidroxiestr-1,3,5-trien-17-onă
estr-1,3,5-trien-3,17p-diol
Estriol
Estr-1,3,5-trien-3,16a,17p-triol
© 2007, V.G. Zaitsev
19. Steroizi estrogeni
Locuri de sintezăovarele
Placenta
În cantități mici - glandele suprarenale, hipotalamus,
adenohipofiză, testicul
Activitatea fiziologică a estrogenilor naturali
Reglementarea reproducerii
Dezvoltarea organelor reproducătoare feminine
Reglarea ovulației
Pregătirea corpului unei femei pentru sarcină
reglarea etapelor sarcinii
Reglarea metabolismului țesutului osos (creștere)
Reglarea naturii grăsimii corporale
© 2007, V.G. Zaitsev
20. Estrogeni sintetici
Mai puternic decât estrogenii naturali, suprimaovulatie
Inclus în contraceptivele orale
© 2007, V.G. Zaitsev
21. Progestative
Locuri de sintezăCorpul galben al ovarelor
Placenta
testicule
Cortexul suprarenal
Activitatea fiziologică
estrogeni naturali
Conservare și întreținere
sarcina
suprimarea maturării
foliculi și ovulație
Prevenirea spontană
contractii uterine
Dezvoltarea sanilor
Progesteron
preg-4-en-3,20-dionă
© 2007, V.G. Zaitsev
22. Mineralocorticoizi
Locuri de sintezăCortexul suprarenal (zona glomeruloasă)
Activitatea fiziologică
Reglarea nivelului și echilibrului electroliților (întărire
reabsorbția sodiului și excreția de potasiu)
Reglarea schimbului de apă
Creșterea tensiunii arteriale
formă de aldehidă
formă hemiacetală
Aldosteron
11p,21-dihidroxipregn-4-en-3,18,20-trionă
© 2007, V.G. Zaitsev
23. Glucocorticoizi
Locuri de sintezăCortexul suprarenal (zona fasciculata)
Activitatea fiziologică
Reglarea metabolismului carbohidraților (gluconeogeneza), proteinelor
(proteoliză), grăsimi (lipoliză), calciu
suprimarea activității sistem imunitar, regulament,
reacții inflamatorii și alergice
Unii dintre hormonii stresului
Implicat în formarea memoriei, învățării,
stări de spirit, ritmuri circadiene
© 2007, V.G. Zaitsev
24. Ritmul zilnic al secretiei de cortizol
© 2007, V.G. Zaitsev25. Regulatori ai sintezei hormonilor steroizi
1.hormonul luteinizant (LH)
progesteron și testosteron
2.
Hormonul adrenocorticotrop (ACTH)
cortizol
3.
Hormonul foliculostimulant (FSH)
estrogeni
4.
Angiotensinele II și III
aldosteronului
© 2007, V.G. Zaitsev
26. Enzime steroidogene
localizat în mitocondrii și RE neted1.
2.
3.
4.
Desmolaze (liaze)
P450scc elimină o parte din lanțul lateral al colesterolului. Reacţie
necesită citocrom P450, O2, NADPH. Enzimă
mitocondriale, cuplate cu transportul de electroni
sistem
Hidroxilaze
Necesită citocrom P450, O2, NADPH și poate fi
găsit atât în mitocondrii, cât și în ER
Dehidrogenazele steroizilor hidroxilați
(oxidoreductaza)
Poate fi citosolic sau microzomal. Reacții
reversibil, direcția depinde de raport
NAD(P)/NAD(P)H
Aromatază
Transformă inelul A într-un inel aromatic. Enzima dependentă de citocromul P450 legată de membrană
© 2007, V.G. Zaitsev
27. Enzime steroidogene
Nume banal"Vechi"
desemnare
"Nou"
desemnare
Desmolaza
P450scc
CYP11A1
3β-hidroxisteroid dehidrogenază
3p-HSD
3p-HSD
17α-hidroxilază / 17,20 lază
P450C17
CYP17
21-hidroxilaza
P450C21
CYP21A2
11p-hidroxilază
P450C11
CYP11B1
Aldosteron sintetaza
P450C11AS
CYP11B2
Aromatază
P450aro
CYP19
© 2007, V.G. Zaitsev
28. Enzime steroidogene
© 2007, V.G. Zaitsev29. Sinteza steroizilor în glandele suprarenale
* DHEA-S - sulfat de dehidroepiandrosteron© 2007, V.G. Zaitsev
30. Reglarea sintezei steroizilor la nivelul glandelor suprarenale
zona fasciculata + zona reticularishormon adrenocorticotrop (ACTH) + corticotropinliberin + cortizol (feedback negativ)
reglare dependentă de cAMP
zona glomeruloasa
angiotensinele II și III stimulează P450scc
reglarea nivelului de Ca2+ intracelular de către
mecanism dependent de protein kinaza C
potasiul plasmatic poate regla sinteza
mineralocorticoizii direct, prin acţiune
canale de Ca2+ dependente de tensiune
modificarea nivelului de potasiu plasmatic cu doar 0,1 mM
determină o modificare aproape dublă a secreţiei
aldosteronului
© 2007, V.G. Zaitsev
31. Sinteza hormonilor sexuali
© 2007, V.G. Zaitsev32. Reglarea sintezei androgenilor
BĂRBAȚIcelulele Leydig
producția de testosteron este stimulată de LH printr-un mecanism dependent de cAMP
nu poate sintetiza dihidrotestosteron
celule Sertoli
Producția de testosteron este stimulată de FSH printr-un mecanism dependent de cAMP
pot folosi endogene și exogene (din celule
Leydig) testosteron pentru sinteza dihidrotestosteronului
FEMEI
Celulele tecale ale ovarelor
producerea de androstenedionă și testosteron
stimulat de LH prin mecanism dependent de cAMP
© 2007, V.G. Zaitsev
33. Reglarea sintezei androgenilor
* StAR - Proteina reglatoare acută steroidogenă© 2007, V.G. Zaitsev
34. Antagonişti androgeni
CH3OHO
CH3
CH
CH3
N
H
CH3
CH3
CH3
CH3
N
O
O
N
H H
Finesterid
Danazol
(chelie)
(endometrioza)
O
O
O
CH3
O
HN
S
HN
HO
CH3
CH3
F
CF3
CF3
CN
NO2
Bicalutamidă
Flutamidă
(cancer de prostată)
(cancer de prostată)
© 2007, V.G. Zaitsev
35. Aromatază în sinteza estrogenului
Aromataza este prezentă în celulele tecale și granuloaseovarele
În celulele tecale, sinteza estrogenului (secreție în sânge)
stimulat de LH prin activarea sintezei androgenilor
În sinteza granulară a estrogenilor (din androgeni tecali
celule, secreție în lichidul folicular)
stimulat de FSH prin activitate crescută
aromataza. Maturarea celulelor granuloasei le mărește
sensibilitate la LH
© 2007, V.G. Zaitsev
36. Aromatază în sinteza estrogenului
OCYP19
O
CYP19
O
HO
H
HO
HO
O2, NADPH
O
O2, NADPH
O
O
androstenedionă
19,19-dihidroxiandrostendionă
19-hidroxiandrostendionă
O
-H2O
+3
Fe
O
-HCOOH
HO
O
CYP19
O
O2, NADPH
H2O
O
O
HO
O
estrone
O
enzima peroxi
intermediar
19-oxoandrostenedionă
© 2007, V.G. Zaitsev
37. Aromatază în sinteza estrogenului
OH
O
androstenedionă
Oh
17-HSD
Oh
aromataza
HO
+H2O
+
HCOOH
O
estradiol
testosteron
© 2007, V.G. Zaitsev
44. Receptorii hormonilor steroizi
(intranuclear)
dimerizare
(intracelular)
transcriere
traducere
Efecte intracelulare
proteine
efecte extracelulare
© 2007, V.G. Zaitsev 45. Receptorii hormonilor steroizi
S
R
hsp hsp
R
S
+
hsp hsp
R
S
R
+sau-
S
HRE
Gena țintă
© 2007, V.G. Zaitsev 46. Receptorii hormonilor steroizi
Citoplasma
Ligand
Nucleu
specific celulei
Raspuns
SR
SR SR
proteină
SR
TF TF
SR SR
HRE
ARNm
© 2007, V.G. Zaitsev 47. Reglarea funcției hormonilor steroizi
Concentrația hormonală
Fosforilare/Defosforilare
La concentrații scăzute de steroizi, fosforilare
de obicei slab
Serina și treonina fosforilate
Enzimă: protein kinaze activate de mitogeni
(MAPK-uri)
Legarea steroizilor poate crește gradul
fosforilarea
Fosforilarea crește afinitatea receptorului pentru
ADN, activitate transcripțională și stabilitate
complex hormon-receptor-ADN
© 2007, V.G. Zaitsev 48. Receptorii hormonilor steroizi
© 2007, V.G. Zaitsev 49. Receptorii hormonilor steroizi
E
ER
E
ER
element de răspuns estrogen
E
ER
Fos
iunie
Element AP-1 (sau Sp-1)
© 2007, V.G. Zaitsev 50.
Receptori de steroizi Receptori de clasa II
GR Glucocorticoid
PR Progesteron
AR Android
ER Estrogen
SR
SR
Palindrom HRE
Receptori orfani
VDR, PPAR
TR, FXR
RXR, LXR
RAR, PXR
NR RXR
HRE cu repetare directă
NGFI-B
SF-I
ERR
Reverb
NR
Halfsite HRE-uri
AAA-ACGGTCA NBRE
AGAACA-N3-TGTTCT GRE/PRE ACGGTCA-N1-5-AGGTCA
TCA-AGGTCA SFRE
AGGTCA-N3-TGACCT ERE 51. Coactivatori ai receptorilor de estrogen
CBP
pCAF
acetilarea histonelor
SRC SRC
ER
RGGTCA
ER
ACTGGR
TFII-B
TBP
transcriere
ARN
Paul
© 2007, V.G. Zaitsev 52. Sinergia hormonilor
© 2007, V.G. Zaitsev 53. Inactivarea hormonilor steroizi
© 2007, V.G. Zaitsev 54. Boli asociate cu tulburări ale metabolismului steroizilor
HIRSUTISM (producție în exces
dehidroepiandrosteron, un defect la unul dintre cele 3
enzime biosintetice)
BOALA ADDISON (hipocorticism)
SINDROMUL CUSHING (hipercortizolism – tumori
suprarenal sau hipofizar, iatrogen)
HIPERCORTICISM fără sindrom Cushing
SINDROMUL DE INSENSITIVITATE LA ANDROGEN
(feminizare testiculară)
© 2007, V.G. Zaitsev
Fiziologie normală Marina Gennadievna Drangoy
27. Sinteza, secretia si excretia de hormoni din organism
Biosinteza hormonilor este un lanț de reacții biochimice care formează structura unei molecule hormonale. Aceste reacții au loc spontan și sunt fixate genetic în celulele endocrine corespunzătoare.
Controlul genetic se realizează fie la nivelul formării ARNm (ARN mesager) a hormonului în sine sau a precursorilor săi, fie la nivelul formării proteinelor ARNm ale enzimelor care controlează diferitele etape de formare a hormonului.
În funcție de natura hormonului sintetizat, există două tipuri de control genetic al biogenezei hormonale:
1) directă, schemă de biosinteză: „gene – ARNm – pro-hormoni – hormoni”;
2) mediat, schema: „gene – (ARNm) – enzime – hormon”.
Secreția de hormoni - procesul de eliberare a hormonilor din celulele endocrine în golurile intercelulare cu intrarea ulterioară a acestora în sânge, limfă. Secreția hormonului este strict specifică fiecărei glande endocrine.
Procesul secretor se desfășoară atât în repaus, cât și în condiții de stimulare.
Secreția hormonului are loc impulsiv, în porțiuni separate separate. Caracterul impulsiv al secreției hormonale se explică prin natura ciclică a proceselor de biosinteză, depunere și transport al hormonului.
Secreția și biosinteza hormonilor sunt strâns legate între ele. Această relație depinde de natura chimică a hormonului și de caracteristicile mecanismului de secreție.
Există trei mecanisme de secreție:
1) eliberarea din granulele secretoare celulare (secreția de catecolamine și hormoni proteino-peptidici);
2) eliberarea din forma legată de proteine (secreția de hormoni tropicali);
3) difuzie relativ liberă prin membranele celulare (secreție de steroizi).
Gradul de legătură între sinteza și secreția de hormoni crește de la primul tip la al treilea.
Hormonii, care intră în sânge, sunt transportați către organe și țesuturi. Legat de proteinele plasmatice și elemente de formă hormonul se acumulează în fluxul sanguin, este oprit temporar din cercul acțiunii biologice și al transformărilor metabolice. Un hormon inactiv este ușor de activat și are acces la celule și țesuturi.
În paralel, există două procese: implementarea efectului hormonal și inactivarea metabolică.
În procesul de metabolism, hormonii se modifică funcțional și structural. Marea majoritate a hormonilor sunt metabolizați și doar o mică parte (0,5-10%) este excretată neschimbată. Inactivarea metabolică are loc cel mai intens în ficat, intestinul subtire si rinichii. Produsele metabolismului hormonal sunt excretate în mod activ cu urină și bilă, componentele bilei sunt în cele din urmă excretate prin fecale prin intestine.
autor Marina Gennadievna Drangoy Din cartea Homeopatie. Partea a II-a. Recomandări practice la alegerea medicamentelor de Gerhard Keller Din cartea Fundamentals of Intensive Rehabilitation. leziunea coloanei vertebrale şi măduva spinării autor Vladimir Alexandrovici Kacesov Din cartea Fiziologie normală autor Din cartea Fiziologie normală autor Nikolai Alexandrovici Agadzhanyan Din cartea Atlas: anatomie și fiziologie umană. Complet ghid practic autor Elena Iurievna Zigalova Din cartea Piatra filosofală a homeopatiei autor Natalia Konstantinovna Simeonova Din cartea Healing Forces. Cartea 1. Curăţarea organismului şi alimentație adecvată. Biosinteză și bioenergetică autor Ghenadi Petrovici Malahov Din cartea Secretele vindecătorilor din Orient autor Victor Fedorovici Vostokov Din cartea Thalasso and Relaxation autor Irina Krasotkina autor Boris Vasilievici Bolotov Din cartea Rețetele lui Bolotov pentru fiecare zi. Calendar pentru 2013 autor Boris Vasilievici Bolotov autor Galina Ivanovna Unchiul Din cartea Cum să-ți echilibrezi hormonii glanda tiroida, glandele suprarenale, pancreasul autor Galina Ivanovna Unchiul Din cartea Ceaiuri medicinale autor Mihail Ingerleib Din cartea Minimum Fat, Maximum Muscle! de Max LisCapitolul 16
Conceptul de hormoni. Principii de bază ale reglării metabolismului
Una dintre caracteristicile unice ale organismelor vii este capacitatea lor de a menține constanta homeostaziei (constanța multor proprietăți ale corpului în condiții constante de mediu) folosind mecanisme de autoreglare, în coordonarea cărora unul dintre locurile principale aparține hormonilor. . Hormonii sunt substanțe biologic active de natură organică care sunt produse în celulele glandelor endocrine și au un efect reglator asupra metabolismului.
Ca urmare a acțiunii mecanismelor de autoreglare, și anume, a mecanismelor neurohormonale, într-o celulă vie, ratele tuturor reacțiilor chimice și proceselor fizico-chimice sunt coordonate între ele, coordonarea funcțiilor tuturor organelor și un răspuns adecvat al organismului la schimbările din mediul extern sunt asigurate. În reglarea proceselor metabolice, hormonii ocupă o poziție intermediară între sistemul nervos și acțiunea enzimelor, adică. reglarea metabolismului se realizează prin modificarea vitezei reacțiilor enzimatice. Hormonii provoacă fie o reacție foarte rapidă, fie invers, o reacție lentă asociată cu sinteza din nou a enzimei necesare. Astfel, tulburările în sinteza și descompunerea hormonilor, cauzate, de exemplu, de boli ale glandelor endocrine, duc la o modificare a sintezei normale a enzimelor și, în consecință, la tulburări metabolice și energetice.
Se pot distinge trei niveluri în mecanismele de autoreglare.
Primul nivel - mecanisme intracelulare de reglare. Diferiți metaboliți servesc ca semnale pentru schimbarea stării celulei. Ei pot:
- modifica activitatea enzimelor prin inhibarea sau activarea acestora;
- modificarea cantității de enzime prin reglarea sintezei și degradarii acestora;
- modificarea vitezei de deformare transmembranară a substanțelor. Coordonarea interorganică a acestui nivel de reglare este asigurată de transmiterea semnalului în două moduri: prin sânge cu ajutorul hormonilor (sistemul endocrin) și prin sistemul nervos.
Al doilea nivel de reglementare - Sistemul endocrin. Hormonii sunt eliberați în sânge ca răspuns la un stimul specific, care poate fi un impuls nervos sau o modificare a concentrației unui metabolit din sângele care curge prin glanda endocrină (de exemplu, o scădere a concentrației de glucoză). Hormonul este transportat cu sângele și, ajungând la celulele țintă, le modifică metabolismul prin mecanisme intracelulare. În acest caz, apare o modificare a metabolismului și stimulul care a provocat eliberarea hormonului este eliminat. Hormonul care și-a îndeplinit funcția este distrus de enzime speciale.
Al treilea nivel de reglare este sistemul nervos cu receptori pentru semnale atât din mediul extern cât și din cel intern. Semnalele sunt transformate într-un impuls nervos, care, în sinapsa cu celula efectoră, determină eliberarea unui mediator - un semnal chimic. Mediatorul prin mecanisme intracelulare de reglare determină o modificare a metabolismului. Celulele efectoare pot fi, de asemenea, celule endocrine care răspund la un impuls nervos prin sinteza și eliberarea de hormoni.
Toate cele trei niveluri de reglare sunt strâns interconectate și acționează ca un singur sistem de reglare neuro-hormonală sau neuro-umorală (Fig. 43).
Fluxul de informații despre starea mediului extern și intern al corpului intră în sistemul nervos, unde este procesat și, ca răspuns, semnalele de reglare sunt trimise către organele și țesuturile periferice. Sub controlul direct al sistemului nervos se află medula suprarenală și hipotalamusul. Impulsurile nervoase care provin din diferite părți ale creierului afectează secreția de neuropeptide de către celulele hipotalamice - liberine și statine, care reglează eliberarea hormonilor tropicali din glanda pituitară. Liberinele stimulează sinteza și eliberarea de hormoni tripli, în timp ce statinele îi inhibă. Hormonii hipofizari tripli afectează secreția de hormoni în glandele periferice. Formarea și secreția de hormoni de către glandele periferice are loc continuu. Acest lucru este necesar pentru a menține nivelul dorit al acestora în sânge, deoarece sunt rapid inactivate și excretate din organism.
Orez. 43. Schema de reglare neurohormonală (săgețile solide indică sinteza hormonilor, iar săgețile punctate indică efectul hormonului asupra organelor țintă)
Concentrația de hormoni în sânge este scăzută: aproximativ 10 -6 - 10 - 11 mol/l. Timpul de înjumătățire este de obicei de câteva minute, pentru unii este de zeci de minute, foarte rar este de ore. Nivelul necesar al hormonului din sânge este menținut prin mecanismul de autoreglare conform principiului plus sau minus al relațiilor interhormonale. Hormonii tropicali stimulează formarea și secreția de hormoni de către glandele periferice (semnul „+”), iar acestea din urmă, printr-un mecanism de feedback negativ, inhibă (semnul „-”) formarea hormonilor tropicali, acționând prin glanda pituitară. celulele (feedback scurt) sau celulele neurosecretoare ale hipotalamusului (feedback lung), fig.44. În acest din urmă caz, secreția de liberine în hipotalamus este inhibată.

În plus, există un feedback metabolit-hormonal: hormonul, acționând asupra metabolismului în țesuturi, provoacă o modificare a conținutului oricărui metabolit din sânge și care, prin mecanismul de feedback, afectează secreția de hormoni în periferie. glandele fie direct (mecanism intracelular), fie prin hipofizar și hipotalamus (vezi Fig. 44). Astfel de metaboliți sunt glucoza (un indicator al stării metabolismului carbohidraților), aminoacizii (un indicator al stării metabolismului proteinelor), nucleotide și nucleozide (indicatori ai stării metabolismului nucleic și proteic), acizii grași, colesterolul (indicatori de starea metabolismului lipidelor); H 2 O, Ca 2+, Na+, K +, CI¯ și alți alți ioni (indicatori ai stării echilibrului apă-sare).
Clasificarea hormonilor
Hormonii au următoarele caracteristici biologice comune:
1) acțiune dismorfă, adică reglează metabolismul și funcțiile celulelor efectoare la distanță;
2) specificitatea strictă a acțiunii biologice, adică un hormon nu poate fi înlocuit complet cu altul;
3) activitate biologică ridicată - cantități foarte mici, uneori o duzină de micrograme, sunt suficiente pentru a menține organismul în viață.
Hormonii sunt clasificați după:
1) natura chimică;
2) mecanismul de transmitere a semnalului în celulă - ţintă;
3) funcții biologice.
Toate tipurile de clasificare sunt imperfecte și oarecum arbitrare, în special clasificarea după funcție, deoarece mulți hormoni sunt polifuncționali.
După structura chimică hormonii sunt împărțiți după cum urmează:
1) proteină-peptidă (hormoni ai hipotalamusului, hipofizei, pancreasului și glandelor paratiroide, calciotonina ai glandei tiroide);
2) derivați ai aminoacizilor (adrenalina este un derivat al fenilaninei și tirozinei);
3) steroizi (hormoni sexuali - androgeni, estrogeni si gestageni, corticosteroizi).
După funcţiile biologice hormonii sunt împărțiți în următoarele grupe:
1) reglarea metabolismului carbohidraților, grăsimilor, aminoacizilor - insulină, glucagon, adrenalină, glucocorticosteroizi (cortizol);
2) reglarea metabolismului apă-sare - mineralocorticosteroizi (aldosteron), hormon antidiuretic (vasopresină);
3) reglarea schimbului de calciu și fosfați - hormon paratiroidian, calcitonina, calcitriol;
4) reglarea metabolismului asociat cu funcția de reproducere (hormoni sexuali) - estradiol, progesteron, testosteron.
5) funcțiile de reglare ale glandelor endocrine (hormoni tripli) - corticotropină, tirotropină, gonadotropină.
Această clasificare nu include somatotropina, tiroxina și alți hormoni care au un efect polifuncțional.
În plus, pe lângă hormonii eliberați în sânge și care acționează asupra organelor îndepărtate de locul sintezei hormonale, există și hormoni locali care reglează metabolismul în acele organe în care se formează. Acestea includ hormoni ai tractului gastrointestinal, hormoni ai mastocitelor țesutului conjunctiv (heparină, histamina), hormoni secretați de celulele rinichilor, vezicule seminale și alte organe (prostaglandine), etc.
Informații similare.
Structura modulului | Subiecte |
Unitate modulară 1 | 11.1. Rolul hormonilor în reglarea metabolismului 11.2. Mecanisme de transmitere a semnalelor hormonale către celule 11.3. Structura și sinteza hormonilor 11.4. Reglarea schimbului principalilor purtători de energie cu un ritm normal de nutriție 11.5. Modificări ale metabolismului în timpul hipo și hipersecreției de hormoni |
Unitatea modulară 2 | 11.6. Schimbări starea hormonalăși metabolismul de post 11.7. Modificări ale statusului hormonal și metabolismului în diabetul zaharat |
Unitate modulară 3 | 11.8. Reglarea metabolismului apă-sare 11.9. Reglarea metabolismului calciului și fosfatului. Structura, sinteza și mecanismul de acțiune al hormonului paratiroidian, calcitriolului și calcitoninei |
Unitatea modulară 1 ROLUL HORMONILOR ÎN REGLAREA METABOLISMULUI. REGLAREA METABOLISMULUI GLUCILOR, LIPIDELOR, AMINOACIZILOR CU UN RITM NORMAL AL DIETA
Obiective de învățare Pentru a fi capabil să:
1. Aplicați cunoștințele despre mecanismele moleculare de reglare a metabolismului și a funcțiilor organismului pentru a înțelege fundamentele biochimice ale homeostaziei și adaptării.
2. Să utilizeze cunoștințele despre mecanismele de acțiune ale hormonilor (insulina și hormonii contrainsulari: glucagon, cortizol, adrenalină, somatotropină, iodotironine) pentru a caracteriza modificările metabolismului energetic la schimbarea perioadelor de digestie și a stării post-absorbtive.
3. Analizați modificările metabolismului în timpul hipo și hiperproducției de cortizol și hormon de creștere, boala și sindromul Itsenko-Cushing (acromegalie), precum și hiper și hipofuncția glandei tiroide (gușă toxică difuză, gușă endemică).
Știi:
1. Nomenclatura modernă și clasificarea hormonilor.
2. Principalele etape ale transmiterii semnalelor hormonale în celulă.
3. Etape de sinteza si secretie de insulina si principalii hormoni contrainsulari.
4. Mecanisme de menținere a concentrației principalilor purtători de energie în sânge
viței cu un ritm normal de alimentație.
Subiectul 11.1. ROLUL HOMONELOR ÎN REGLAREA METABOLISMULUI
1. Pentru funcționarea normală a unui organism multicelular, este necesară relația dintre celulele, țesuturile și organele individuale. Această relație se realizează:
sistem nervos(centrale și periferice) prin impulsuri nervoase și neurotransmițători;
Sistemul endocrin prin glandele endocrine și hormonii, care sunt sintetizați de celulele specializate ale acestor glande, sunt eliberați în sânge și transportați în diferite organe și țesuturi;
paracrinăși autocrină sisteme prin diverși compuși care sunt secretați în spațiul intercelular și interacționează cu receptorii fie ai celulelor din apropiere, fie ai aceleiași celule (prostaglandine, hormoni). tract gastrointestinal, histamina etc.);
sistemul imunitar prin proteine specifice (citokine, anticorpi).
2. Sistemul endocrin asigură reglarea și integrarea metabolismului în diferite țesuturi ca răspuns la modificările condițiilor mediului extern și intern. Hormonii funcționează ca mesageri chimici care transportă informații despre aceste modificări către diferite organe și țesuturi. Răspunsul unei celule la acțiunea unui hormon este determinat atât de structura chimică a hormonului, cât și de tipul de celulă către care este îndreptată acțiunea acestuia. Hormonii sunt prezenți în sânge în concentrații foarte scăzute și acțiunea lor este de obicei de scurtă durată.
Acest lucru se datorează, în primul rând, reglării sintezei și secreției lor și, în al doilea rând, ratei ridicate de inactivare a hormonilor circulanți. Principalele conexiuni dintre sistemele nervos și endocrin de reglare sunt realizate cu ajutorul unor părți speciale ale creierului - hipotalamus și glanda pituitară. Sistemul de reglare neuroumorală are propria sa ierarhie, al cărui vârf este SNCși secvența strictă a proceselor.
3. Ierarhia sistemelor de reglementare. Sistemele de reglare a metabolismului și a funcțiilor organismului formează trei niveluri ierarhice (Fig. 11.1).
Primul nivel- sistem nervos central. Celulele nervoase primesc semnale din mediul extern și intern, le transformă în forma unui impuls nervos, care în sinapsă determină eliberarea mediatorului. Mediatorii provoacă modificări metabolice în celulele efectoare prin mecanisme de reglare intracelulare.
Al doilea nivel- Sistemul endocrin- cuprinde hipotalamusul, glanda pituitară, glandele endocrine periferice, precum și celule specializate ale unor organe și țesuturi (tractul gastrointestinal, adipocite), sintetizează hormoni și eliberându-i în sânge sub acțiunea unui stimul adecvat.
Al treilea nivel- intracelular- constituie modificări ale metabolismului în interiorul unei celule sau a unei anumite căi metabolice care rezultă din:
Schimbări activitate enzime prin activare sau inhibare;
Schimbări cantitate enzime prin mecanismul de inducție sau reprimare a sintezei proteinelor sau modificări ale vitezei de degradare a acestora;
Schimbări viteza de transport substanțe peste membranele celulare. Sintezăși secretia de hormoni stimulat de extern si intern
semnale către SNC. Aceste semnale prin conexiunile nervoase intră în hipotalamus, unde stimulează sinteza hormonilor peptidici (așa-numiții hormoni de eliberare) - liberine și statine. liberieniiși statine sunt transportate la glanda pituitară anterioară, unde stimulează sau inhibă sinteza hormonilor tropicali. Hormonii tropicali ai glandei pituitare stimulează sinteza și secreția de hormoni din glandele endocrine periferice, care intră în circulația generală. Unii hormoni hipotalamici sunt stocati in hipofiza posterioara, de unde sunt secretati in sange (vasopresina, oxitocina).
 O modificare a concentrației metaboliților în celulele țintă printr-un mecanism de feedback negativ suprimă sinteza hormonilor, acționând fie asupra glandelor endocrine, fie asupra hipotalamusului; sinteza si secretia hormonilor tropici este suprimata de hormonii glandelor periferice.
O modificare a concentrației metaboliților în celulele țintă printr-un mecanism de feedback negativ suprimă sinteza hormonilor, acționând fie asupra glandelor endocrine, fie asupra hipotalamusului; sinteza si secretia hormonilor tropici este suprimata de hormonii glandelor periferice.
TEMA 11.2. MECANISME DE TRANSMISIE A SEMNALELOR HORMONALE ÎN CELULE
Acțiunea biologică a hormonilor manifestata prin interactiunea lor cu celulele care au receptori pentru acest hormon (celule țintă). Pentru a fi activ din punct de vedere biologic, legarea unui hormon de un receptor trebuie să aibă ca rezultat un semnal chimic în interiorul celulei care declanșează un răspuns biologic specific, cum ar fi o modificare a ratei de sinteză a enzimelor și a altor proteine sau o modificare a activității acestora ( vezi Modulul 4). Ținta pentru hormon poate servi ca celule ale unuia sau mai multor țesuturi. Acționând asupra celulei țintă, hormonul provoacă un răspuns specific, a cărui manifestare depinde de ce căi metabolice sunt activate sau inhibate în această celulă. De exemplu, glanda tiroidă este o țintă specifică pentru tirotropină, care crește numărul de celule tiroidiene acinare și crește rata de biosinteză a hormonilor tiroidieni. Glucagonul, acționând asupra adipocitelor, activează lipoliza, stimulează mobilizarea glicogenului și gluconeogeneza în ficat.
Receptorii hormonii pot fi localizați fie în membrana plasmatică, fie în interiorul celulei (în citosol sau nucleu).
După mecanismul de acţiune Hormonii pot fi împărțiți în două grupe:
La primul Acest grup include hormoni care interacționează cu receptorii membranari(hormoni peptidici, adrenalina, precum și hormoni de acțiune locală - citokine, eicosanoide);
- al doilea grupul include hormoni care interacționează cu receptorii intracelulari- hormoni steroizi, tiroxina (vezi modulul 4).
Legarea unui hormon (mesager primar) de receptor duce la o modificare a conformației receptorului. Aceste modificări sunt captate de alte macromolecule, adică. legarea hormonului de receptor duce la împerecherea unor molecule cu altele (transducția semnalului). Astfel, se generează un semnal care reglează răspunsul celular. În funcție de metoda de transmitere a semnalului hormonal, viteza reacțiilor metabolice în celule se modifică:
Ca urmare a modificărilor activității enzimelor;
Ca urmare a unei modificări a numărului de enzime (Fig. 11.2).
 Orez. 11.2. Principalii pași în transmiterea semnalelor hormonale către celulele țintă
Orez. 11.2. Principalii pași în transmiterea semnalelor hormonale către celulele țintă
TEMA 11.3. STRUCTURA ȘI BIOSINTEZA HORMUNILOR
1. Hormonii peptidici sintetizate, ca și alte proteine, în procesul de translație din aminoacizi. Unii hormoni peptidici sunt peptide scurte; de exemplu, hormonul hipotalamic tirotropină - liberină - tripeptidă. Majoritatea hormonilor hipofizari anterioare sunt glicoproteine.
Unii hormoni peptidici sunt produse ale unei gene comune (Fig. 11.3). Majoritatea hormonilor polipeptidici sunt sintetizați ca precursori inactivi - preprohormoni. Formarea hormonilor activi are loc prin proteoliză parțială.
2. Insulină- o polipeptidă formată din două lanțuri polipeptidice. Lanțul A conține 21 de resturi de aminoacizi, lanțul B - 30 de resturi de aminoacizi. Ambele lanțuri sunt interconectate prin două punți disulfurice. Molecula de insulină conține, de asemenea, o punte disulfurică intramoleculară în lanțul A.
biosinteza insulineiÎncepe cu formarea precursorilor inactivi, preproinsulină și proinsulină, care, ca urmare a proteolizei secvențiale, sunt transformate într-un hormon activ. Biosinteza preproinsulinei începe cu formarea unei peptide semnal pe poliribozomi asociate cu reticulul endoplasmatic. Semnal
 Orez. 11.3. Formarea hormonilor peptidici care sunt produse ale unei gene comune:
Orez. 11.3. Formarea hormonilor peptidici care sunt produse ale unei gene comune:
A - POMC (proopiomelanocortin) este sintetizat în lobii anteriori și intermediari ai glandei pituitare și în unele alte țesuturi (intestin, placentă). Lanțul polipeptidic este format din 265 de resturi de aminoacizi; B - după scindarea peptidei semnal N-terminal, lanțul polipeptidic este împărțit în două fragmente: ACTH (39 a.k.) și β-lipotropină (42-134 a.k.); C, D, E - cu proteoliza ulterioară, are loc formarea de α- și β-MSH (hormon de stimulare a melanocitelor) și endorfine. CPPDH este un hormon asemănător corticotropinei din lobul intermediar al glandei pituitare. Procesarea POMC în lobii anteriori și intermediari ai glandei pituitare se desfășoară diferit, cu formarea unui set diferit de peptide.
peptida pătrunde în lumenul reticulului endoplasmatic și direcționează lanțul polipeptidic în creștere în RE. După ce sinteza preproinsulinei este finalizată, peptida semnal este scindată (Fig. 11.4).
Proinsulina (86 de resturi de aminoacizi) intră în aparatul Golgi, unde, sub acțiunea unor proteaze specifice, este scindată în mai multe locuri pentru a forma insulină (51 de resturi de aminoacizi) și o peptidă C formată din 31 de resturi de aminoacizi. Insulina și peptida C sunt încorporate în granulele secretoare în cantități echimolare. În granule, insulina se combină cu zincul pentru a forma dimeri și hexameri. Granulele mature fuzionează cu membrana plasmatică și insulina și peptida C sunt secretate în lichidul extracelular prin exocitoză. După secreția în sânge, oligomerii de insulină se descompun. Timpul de înjumătățire plasmatică al insulinei este de 3-10 minute, peptida C - aproximativ 30 de minute. Degradarea insulinei are loc sub acțiunea enzimei insulinaza în principal în ficat și într-o măsură mai mică în rinichi.
Principalul stimulator al sintezei și secreției de insulină este glucoza. Secreția de insulină este, de asemenea, îmbunătățită de anumiți aminoacizi (în special arginină și lizină), corpi cetonici și acizi grași. Adrenalina, somatostatina și unele peptide gastrointestinale inhibă secreția de insulină.
 Orez. 11.4. Schema biosintezei insulinei în celulele pancreatice:
Orez. 11.4. Schema biosintezei insulinei în celulele pancreatice:
1 - sinteza lanțului polipeptidic al proinsulinei; 2 - sinteza are loc pe poliribozomi atașați de suprafața exterioară a membranei RE; 3 - peptida semnal este scindată la terminarea sintezei lanțului polipeptidic și se formează proinsulina; 4 - proinsulina este transportată din ER în aparatul Golgi și este scindată în insulină și C-peptidă; 5 - insulina si peptida C sunt incorporate in granule secretoare si eliberate prin exocitoza (6); ER - reticul endoplasmatic; N este partea terminală a moleculei;
3. Glucagon- polipeptidă monocatenar, constând din 29 de resturi de aminoacizi. Biosinteza glucagonului are loc în celulele α ale insulelor Langerhans dintr-un precursor inactiv al preproglucagonului, care, ca urmare a proteolizei parțiale, este transformat într-un hormon activ. Glucoza și insulina suprimă secreția de glucagon; mulți compuși, inclusiv aminoacizi, acizi grași, neurotransmițători (adrenalina), îl stimulează. Timpul de înjumătățire al hormonului este de aproximativ 5 minute. În ficat, glucagonul este degradat rapid de proteaze specifice.
4. Somatotropina sintetizat ca prohormon în celulele somatotrofe, care sunt cele mai numeroase în glanda pituitară anterioară. Hormonul de creștere la toate speciile de mamifere este un singur lanț
o peptidă cu greutate moleculară de 22 kDa constând din 191 de resturi de aminoacizi și având două legături disulfurice intramoleculare. Secreția de hormon de creștere este pulsatilă la intervale de 20-30 de minute. Unul dintre cele mai mari vârfuri este observat la scurt timp după ce a adormit. Sub influența diverșilor stimuli ( exercitii fizice, post, alimente proteice, aminoacidul arginina) chiar și la adulții care nu sunt în creștere, nivelul hormonului de creștere din sânge poate crește la 30-100 ng/ml. Reglarea sintezei și secreției hormonului de creștere este realizată de mulți factori. Principalul efect de stimulare este exercitat de somatoliberină, principalul efect inhibitor este somatostatina hipotalamică.
5. Iodotironine sintetizată ca parte a unei proteine - tiroglobulina (Tg)
 Orez. 11.5. Sinteza iodotironinelor:
Orez. 11.5. Sinteza iodotironinelor:
ER - reticul endoplasmatic; DIT - diiodotironina; Tg - tiroglobulina; T3 - triiodotironina, T4 - tiroxina. Tiroglobulina este sintetizată pe ribozomi, apoi intră în complexul Golgi, iar apoi în coloidul extracelular, unde este depozitată și unde reziduurile de tirozină sunt iodate. Formarea iodotironinelor are loc în mai multe etape: transportul iodului în celulele glandei tiroide, oxidarea iodului, iodarea reziduurilor de tirozină, formarea iodotironinelor, transportul iodotironinelor în sânge
tiroglobulina- glicoproteina, contine 115 resturi de tirozina, este sintetizata in partea bazala a celulei si depozitata in coloidul extracelular, unde reziduurile de tirozina sunt iodate si se formeaza iodotironine.
Sub influenta tiroperoxidaza iodul oxidat reacționează cu reziduurile de tirozină pentru a forma monoiodotironine (MIT) și diiodotironine (DIT). Două molecule DIT se condensează pentru a forma T 4 , iar MIT și DIT se condensează pentru a forma T 3 . Iodtiroglobulina este transportată în celulă prin endocitoză și hidrolizată de enzimele lizozomale cu eliberarea de T 3 și T 4 (Fig. 11.6).
 Orez. 11.6. Structura hormonilor tiroidieni
Orez. 11.6. Structura hormonilor tiroidieni
T 3 este principala formă biologic activă de iodotironine; afinitatea sa pentru receptorul celulei țintă este de 10 ori mai mare decât cea a T4. În țesuturile periferice, ca urmare a deiodarii părții T4 la al cincilea atom de carbon, se formează așa-numita formă „inversă” a T3, care este aproape complet lipsită de activitate biologică.
În sânge, iodotironinele sunt într-o formă legată într-un complex cu proteina de legare a tiroxinei. Doar 0,03% T4 și 0,3% T3 sunt în stare liberă. Activitatea biologică a iodotironinelor se datorează fracției nelegate. Proteinele de transport servesc ca un fel de depozit, care poate oferi o cantitate suplimentară de hormoni liberi. Sinteza și secreția de iodotironine este reglată de sistemul hipotalamo-hipofizar
 Orez. 11.7. Reglarea sintezei și secreției de iodotironine:
Orez. 11.7. Reglarea sintezei și secreției de iodotironine:
1 - tirotropina-liberina stimulează eliberarea de TSH; 2 - TSH stimuleaza sinteza si secretia de iodotironine; 3, 4 - iodotironinele inhibă sinteza și secreția de TSH
Iodotironinele reglează două tipuri de procese:
Creșterea și diferențierea țesuturilor;
Schimb de energie.
6. Corticosteroizi. Precursorul comun al tuturor corticosteroizilor este colesterolul. Sursa de colesterol pentru sinteza corticosteroizilor sunt esterii săi, care intră în celulă ca parte a LDL sau se depun în celulă. Eliberarea colesterolului din esterii săi și sinteza corticosteroizilor sunt stimulate de corticotropină. Reacțiile de sinteză a cortizolului apar în diferite compartimente ale celulelor cortexului suprarenal (vezi Fig. 11.12). În timpul sintezei corticosteroizilor, se formează mai mult de 40 de metaboliți, care diferă ca structură și activitate biologică. Principalii corticosteroizi cu activitate hormonală pronunțată sunt cortizolul, principalul reprezentant al grupului de glucocorticoizi, aldosteronul, principalul mineralocorticoid, și androgenii.
În prima etapă a sintezei corticosteroizilor, colesterolul este transformat în pregnenolon prin separarea fragmentului de 6 atomi de carbon din lanțul lateral al colesterolului și oxidarea atomului de carbon C20. Pregnenolona este transformată în progesteron - precursor C 21 al steroizilor - cortizol și aldosteron - și steroizi C 19 - precursori ai androgenilor. Ce fel de steroid va fi produsul final depinde de setul de enzime din celulă și de succesiunea reacțiilor de hidroxilare (Fig. 11.8).
 Orez. 11.8. Sinteza corticosteroizilor majori:
Orez. 11.8. Sinteza corticosteroizilor majori:
1 - conversia colesterolului în pregnenolonă; 2 - formarea progesteronului;
3-hidroxilarea progesteronului (17-21-11) și formarea cortizolului;
4 - hidroxilarea progesteronului (21-11) și formarea aldosteronului;
5 - calea de sinteză a androgenilor
Hidroxilarea primară a progesteronului de către 17-hidroxilază și apoi de către 21- și 11-hidroxilază duce la sinteza cortizolului. Reacțiile de formare a aldosteronului implică hidroxilarea progesteronului mai întâi de către 21-hidroxilază și apoi de către 11-hidroxilază (vezi Fig. 11.8). Viteza de sinteză și secreție a cortizolului este reglată de sistemul hipotalamo-hipofizar printr-un mecanism de feedback negativ (Fig. 11.9).
Hormonii steroizi sunt transportați de sânge în combinație cu proteine de transport specifice.
catabolism hormonii cortexului suprarenal apare în principal în ficat. Reacțiile de hidroxilare, oxidare și
 Orez. 11.9. Reglarea sintezei și secreției de cortizol:
Orez. 11.9. Reglarea sintezei și secreției de cortizol:
1 - stimularea sintezei corticotropinei-liberinei; 2 - corticotropinliberina stimulează sinteza și secreția de ACTH; 3 - ACTH stimulează sinteza și secreția de cortizol; 4 – cortizolul inhibă secreția de ACTH și corticoliberină
recuperare hormonală. Produșii de catabolism ai corticosteroizilor (cu excepția corticosteronului și aldosteronului) sunt excretați în urină sub formă 17-cetosteroizi. Acești produși metabolici sunt excretați în principal sub formă de conjugați cu acizi glucuronic și sulfuric. La bărbați, 2/3 din cetosteroizi se formează din cauza corticosteroizilor și 1/3 din cauza testosteronului (doar 12-17 mg pe zi). La femei, 17-cetosteroizii se formează în principal din cauza corticosteroizilor (7-12 mg pe zi).
TEMA 11.4. REGLAREA SCHIMBULUI DE PURTĂTORI DE ENERGIE DE BAZĂ ÎN RITM NORMAL
ALIMENTE
1. Valoarea energetică a principalelor nutrienți este exprimată în kilocalorii și este: pentru carbohidrați - 4 kcal/g, pentru grăsimi - 9 kcal/g, pentru proteine - 4 kcal/g. O persoană adultă sănătoasă are nevoie de 2000-3000 kcal (8000-12000 kJ) de energie pe zi.
Cu ritmul obișnuit de alimentație, intervalele dintre mese sunt de 4-5 ore cu o pauză de noapte de 8-12 ore. în timpul digestiei și perioada de absorbtie(2-4 ore) principalii purtători de energie utilizați de țesuturi (glucoză, acizi grași, aminoacizi) pot pătrunde în fluxul sanguin direct din tubul digestiv. LA perioada postabsorbtivă(perioada de timp după terminarea digestiei până la următoarea masă) și în timpul înfometării se formează substraturi energetice
în procesul de catabolism al purtătorilor de energie depusi. Rolul principal în reglarea acestor procese îl joacă insulinăși glucagon. Antagoniștii insulinei sunt de asemenea adrenalină, cortizol, iodotironine și somatotropină
(așa-numiții hormoni contrainsulari).
Insulina si hormonii contrainsulari asigura un echilibru intre nevoile si capacitatile organismului in obtinerea energiei necesare functionarii si cresterii normale. Acest echilibru este definit ca homeostazia energetică. Cu un ritm alimentar normal, concentrația de glucoză din sânge se menține la nivelul de 65-110 mg/dl (3,58-6,05 mmol/l) datorită influenței a doi hormoni principali - insulina și glucagonul. Insulina și glucagonul sunt principalii regulatori ai metabolismului în timpul stărilor de schimbare ale digestiei, perioadei postabsorbtive și înfometării. Perioadele de digestie sunt de 10-15 ore pe zi, iar consumul de energie are loc in 24 de ore. Prin urmare, o parte din purtătorii de energie în timpul digestiei este stocată pentru utilizare în perioada postabsorbtivă.
Ficatul, tesutul adipos si muschii sunt principalele organe care asigura modificari metabolice in concordanta cu ritmul de nutritie. Modul de păstrare se activează după masă și este înlocuit cu modul de mobilizare a rezervelor după încheierea perioadei de absorbție.
2. Modificări ale metabolismului principalilor purtători de energie în perioada de absorbțieîn principal din cauza marelui insulina-glucagon index
(Fig. 11.10).
În ficat, consumul de glucoză crește, ceea ce este o consecință a accelerării căilor metabolice în care glucoza este transformată în forme depozitate de purtători de energie: glicogenși grăsimi.
Odată cu creșterea concentrației de glucoză în hepatocite, este activată glucokinaza, care transformă glucoza în glucoză-6-fosfat. În plus, insulina induce sinteza mARN-ului glucokinazei. Ca urmare, crește concentrația de glucoză-6-fosfat în hepatocite, ceea ce determină o accelerare. sinteza glicogenului. Acest lucru este facilitat și de inactivarea simultană a glicogen fosforilazei și activarea glicogen sintetazei. Influențată de insulină din hepatocite accelerează glicoliza ca urmare a creșterii activității și numărului de enzime cheie: glucokinaza, fosfofructokinaza și piruvat kinaza. În același timp, gluconeogeneza este inhibată ca urmare a inactivării fructozo-1,6-bisfosfatazei și a reprimării insulinei a sintezei fosfoenolpiruvat carboxikinazei, enzimele cheie ale gluconeogenezei (vezi Modulul 6).
O creștere a concentrației de glucoză-6-fosfat în hepatocite în perioada de absorbție este combinată cu utilizarea activă a NADPH pentru sinteza acizilor grași, care contribuie la stimularea calea pentozo-fosfatului.
Accelerarea sintezei acizilor grași Este asigurată de disponibilitatea substraturilor (acetil-CoA și NADPH) formate în timpul metabolismului glucozei, precum și de activarea și inducerea enzimelor cheie pentru sinteza acizilor grași de către insulină.
 Orez. 11.10. Modalități de utilizare a principalilor purtători de energie în perioada de absorbție:
Orez. 11.10. Modalități de utilizare a principalilor purtători de energie în perioada de absorbție:
1 - biosinteza glicogenului în ficat; 2 - glicoliză; 3 - biosinteza TAG în ficat; 4 - Biosinteza TAG în țesutul adipos; 5 - biosinteza glicogenului în mușchi; 6 - biosinteza proteinelor în diferite țesuturi, inclusiv în ficat; FA - acizi grași
Aminoacizii care intră în ficat din tractul digestiv sunt utilizați pentru a sintetiza proteine și alți compuși care conțin azot, iar excesul lor fie pătrunde în sânge și este transportat în alte țesuturi, fie este dezaminat, urmat de includerea reziduurilor fără azot în calea generală a catabolismului (vezi Modulul 9).
Modificări metabolice ale adipocitelor. Funcția principală a țesutului adipos este stocarea purtătorilor de energie în formă triacilgliceroli. transportul glucozeiîn adipocite. O creștere a concentrației intracelulare de glucoză și activarea enzimelor cheie ale glicolizei asigură formarea de acetil-CoA și glicerol-3-fosfat, care sunt necesare pentru sinteza TAG. Stimularea căii pentozei fosfat asigură formarea NADPH, care este necesar pentru sinteza acizilor grași. Cu toate acestea, biosinteza acizilor grași de novo în țesutul adipos uman se desfășoară într-un ritm ridicat numai după postul anterior. În timpul unui ritm de hrănire normal, sinteza TAG se bazează în principal pe acizii grași proveniți din chilomicroni și VLDL sub acțiunea Lp-lipazei (vezi Modulul 8).
Deoarece TAG-lipaza sensibilă la hormoni în stare de absorbție este într-o formă defosforilată, inactivă, procesul de lipoliză este inhibat.
Modificări ale metabolismului muscular. Sub influența insulinei se accelerează transportul glucozeiîn celulele musculare. Glucoza este fosforilată și oxidată pentru a furniza energie celulelor și este, de asemenea, folosită pentru a sintetiza glicogenul. Acizii grași proveniți din chilomicroni și VLDL în această perioadă joacă un rol nesemnificativ în metabolismul energetic muscular. Fluxul de aminoacizi în mușchi și biosinteza proteinelor cresc, de asemenea, sub influența insulinei, mai ales după aportul de proteine și în timpul lucrului muscular.
3. Modificări ale metabolismului principalilor purtători de energie atunci când starea de absorbție se transformă în postabsorbtivă.În perioada postabsorbtivă, cu scăderea indicelui de insulină-glucagon, modificările metabolismului vizează în principal menținerea concentrației de glucoză în sânge, care servește ca principal substrat energetic pentru creier și singura sursă de energie pentru eritrocite. Principalele modificări ale metabolismului în această perioadă au loc la nivelul ficatului și țesutului adipos (Fig. 11.11) și vizează completarea glucozei din rezervele interne și utilizarea altor substraturi energetice (grăsimi și aminoacizi).
Modificări metabolice la nivelul ficatului. Sub influența glucagonului se accelerează mobilizarea glicogenului(vezi modulul 6). Rezervele de glicogen din ficat sunt epuizate în timpul unui post de 18-24 de ore. Principala sursă de glucoză pe măsură ce rezervele de glicogen sunt epuizate devine gluconeogeneza, care începe să se accelereze la 4-6 ore după ultima masă. Substraturile pentru sinteza glucozei sunt lactat, glicerolși aminoacizi. Viteza de sinteză a acizilor grași scade din cauza fosforilării și inactivării acetil-CoA carboxilazei în timpul fosforilării, iar viteza de β-oxidare crește. În același timp, crește aportul de acizi grași către ficat, care sunt transportați din depozitele de grăsime ca urmare a lipolizei accelerate. Acetil-CoA, format în timpul oxidării acizilor grași, este utilizat în ficat pentru sinteza corpurilor cetonici.
in tesutul adipos cu rata sintezei TAG scade si este stimulata lipoliza. Stimularea lipolizei este rezultatul activării lipazei adipocitelor TAG sensibile la hormoni sub influența glucagonului. Acizii grași devin surse importante de energie în ficat, mușchi și țesutul adipos.
Astfel, în perioada postabsorbtivă, concentrația de glucoză din sânge se menține la nivelul de 60-100 mg/dl (3,5-5,5 mmol/l), iar nivelul acizilor grași și al corpilor cetonici crește.
 Orez. 11.11. Modalități de a utiliza principalii purtători de energie atunci când se trece de la o stare absorbtivă la una post-absorbtivă:
Orez. 11.11. Modalități de a utiliza principalii purtători de energie atunci când se trece de la o stare absorbtivă la una post-absorbtivă:
I - scăderea indicelui de insulină-glucagon; 2 - descompunerea glicogenului; 3, 4 - transportul glucozei către creier și eritrocite; 5 - catabolismul grăsimilor; 6 - transportul grăsimilor către ficat și mușchi; 7 - sinteza corpilor cetonici în ficat; 8 - transportul corpilor cetonici la muschi; 9 - gluconeogeneza din aminoacizi; 10 - sinteza și excreția ureei;
II - transportul lactatului la ficat și includerea în gluconeogeneză; 12 - gluconeogeneza din glicerol; KT - corpi cetonici; FA - acizi grași
TEMA 11.5. MODIFICĂRI ÎN METABOLISM ÎN TIMPUL HIPO-ȘI HIPER-SECREȚIEI DE HORMONI
O modificare a ratei de sinteza și secreție a hormonilor poate apărea nu numai ca un proces adaptativ care are loc ca răspuns la o schimbare a activității fiziologice a corpului, ci adesea ca urmare a încălcărilor activității funcționale a glandelor endocrine în timpul dezvoltarea proceselor patologice sau dereglarea acestora. Aceste tulburări se pot manifesta fie sub formă hipofuncţie, ducând la o scădere a cantității de hormon, sau hiperfuncție,însoţită de sinteza lui excesivă.
1. Hiperfuncția glandei tiroide(hipertiroidismul) se manifestă sub mai multe forme clinice. Gușă toxică difuză(Boala Graves, boala Graves) este cea mai frecventă boală a glandei tiroide. În această boală, există o creștere a dimensiunii glandei tiroide (gușă), o creștere a concentrației de iodotironine de 2-5 ori și dezvoltarea tireotoxicozei.
Semnele caracteristice ale tireotoxicozei sunt creșterea metabolismului bazal, creșterea frecvenței cardiace, slăbiciune musculară, scădere în greutate (în ciuda apetitului crescut), transpirație, febră, tremor și exoftalmie (ochi bombați). Aceste simptome reflectă stimularea simultană atât a proceselor anabolice (creșterea și diferențierea țesuturilor) cât și a proceselor catabolice (catabolismul glucidelor, lipidelor și spatelui) de către iodotironine. Într-o măsură mai mare, procesele de catabolism sunt intensificate, fapt dovedit de un bilanţ negativ de azot. hipertiroidism poate apărea din diverse motive: dezvoltarea unei tumori, inflamație (tiroidită), aportul excesiv de iod și medicamente care conțin iod, reacții autoimune.
hipertiroidism autoimun apare ca urmare a formării de anticorpi la receptorii hormonilor care stimulează tiroida din glanda tiroidă. Una dintre ele, imunoglobulina (IgG), imită acțiunea tirotropinei prin interacțiunea cu receptorii TSH de pe membrana celulelor tiroidiene. Aceasta duce la creșterea excesivă difuză a glandei tiroide și la producția excesivă necontrolată de T3 și T4, deoarece formarea de IgG nu este reglată de mecanismul de feedback. Nivelul de TSH în această boală este redus datorită suprimării funcției glandei pituitare de către concentrații mari de iodotironine.
2. Hipotiroidismul poate fi rezultatul unui aport insuficient de iod în organism – gușă endemică. Mai rar, hipotiroidismul apare ca urmare a defectelor congenitale ale enzimelor implicate în sinteza (de exemplu, tiroperoxiraza) iodotironinelor sau ca o complicație a altor boli în care hipotalamusul, glanda pituitară sau glanda tiroidă sunt afectate. În unele forme de hipotiroidism, anticorpii împotriva tiroglobulinei se găsesc în sânge. Hipofuncția glandei tiroide în copilăria timpurie duce la o întârziere a dezvoltării fizice și mentale - cretinism. La adulți, hipofuncția se manifestă ca mixedem(edem mucos). Principala manifestare a mixedemului este acumularea excesivă de proteoglicani și apă în piele. Principalele simptome ale hipotiroidismului: somnolență, scăderea toleranței la frig, creșterea în greutate, scăderea temperaturii corpului.
3. Hipercortizolism. Formarea în exces de corticosteroizi, în principal cortizol, - hipercortizolism- adesea rezultatul unei încălcări a mecanismelor de reglementare pentru sinteza cortizolului:
Cu o tumoare hipofizară și creșterea producției de corticotropină (boala Itsenko-Cushing);
Tumori suprarenale care produc cortizol (sindromul Itsenko-Cushing).
Principalele manifestări ale hipercorticismului sunt hiperglucozemia și toleranța redusă la glucoză datorită stimulării gluconeogenezei și hipertensiunii arteriale ca urmare a manifestării activității mineralocorticoide a cortizolului și creșterea concentrației ionilor de Na +.
4. Hipocorticism. Distrofia adrenogenitală ereditarăîn 95% din cazuri este o consecinţă a unui deficit de 21-hidroxilază (vezi Fig. 11.8). Aceasta crește formarea de 17-OH progesteron și producția de androgeni. Simptomele caracteristice ale bolii sunt pubertatea precoce la băieți și dezvoltarea caracteristicilor sexuale masculine la fete. Cu deficit parțial de 21-hidroxilază la femei, ciclul menstrual poate fi perturbat.
Insuficiență suprarenală dobândită se poate dezvolta ca urmare a unei leziuni tuberculoase sau autoimune a celulelor cortexului suprarenal și o scădere a sintezei corticosteroizilor. Pierderea controlului de reglementare de la glandele suprarenale duce la creșterea secreției de corticotropină. În aceste cazuri, pacienții au o pigmentare crescută a pielii și a membranelor mucoase. (Boala Addison) care se datorează producției crescute de corticotropină și alți derivați POMC, în special hormonul de stimulare a melanocitelor (vezi Fig. 11.3). Principalele manifestări clinice ale insuficienței suprarenale: hipotensiune arterială, slăbiciune musculară, hiponatremie, scădere în greutate, intoleranță la stres.
Insuficiența funcției cortexului suprarenal adesea rezultatul utilizării pe termen lung a corticosteroizilor care inhibă sinteza corticotropinei printr-un mecanism de feedback. Absența semnalelor de stimulare duce la atrofia celulelor cortexului suprarenal. Odată cu anularea bruscă a medicamentelor hormonale, se poate dezvolta insuficiența suprarenală acută (așa-numitul sindrom de „sevraj”), ceea ce reprezintă o mare amenințare pentru viață, deoarece este însoțită de decompensarea tuturor tipurilor de metabolism și a proceselor de adaptare. Se manifestă prin colaps vascular, adinamie severă, pierderea conștienței. Această condiție apare din cauza unei încălcări a metabolismului electroliților, care duce la pierderea ionilor Na + și C1 - în urină și la deshidratare din cauza pierderii lichidului extracelular. O modificare a metabolismului carbohidraților se manifestă printr-o scădere a nivelului de zahăr din sânge, o scădere a rezervelor de glicogen din ficat și mușchii scheletici.
1. Transferați-vă în caiet și completați tabelul. 11.1.
Tabelul 11.1. Insulina și principalii hormoni contrainsulari
2. Folosind fig. 11.4, notează etapele sintezei insulinei. Explicați ce cauze pot duce la dezvoltarea deficitului de insulină? De ce este posibil să se determine concentrația de C-peptidă în sânge în aceste cazuri în scopul diagnosticării?
3. Studiați schema pentru sinteza iodotironinelor (Fig. 11.5). Descrieți principalele etape ale sintezei lor și desenați o diagramă a reglarii sintezei și secreției hormonilor tiroidieni. Explicați principalele manifestări ale hipo și hipertiroidismului. De ce este necesar să se monitorizeze constant nivelul de TSH din sânge atunci când se utilizează tiroxina ca medicament?
4. Studiați succesiunea pașilor în sinteza cortizolului (Fig. 11.8). Găsiți pe diagramă etapele catalizate de enzime, al căror defect este cauza sindromului adrenogenital.
5. Descrieţi schema ciclului intracelular al sintezei cortizolului, începând cu interacţiunea ACTH cu receptorul (Fig. 11.12), înlocuind numerele cu denumirile proteinelor implicate în acestea.
6. Desenați o diagramă a reglării sintezei și secreției de corticosteroizi. Explicați cauzele și manifestările sindromului de abstinență a steroizilor.
7. Descrieți succesiunea evenimentelor care duc la creșterea concentrației de glucoză din sânge în prima oră după masă și revenirea ulterioară la valoarea inițială în decurs de 2 ore (Fig. 11.13). Explicați rolul hormonilor în aceste evenimente.
8. Analizați modificările stării hormonale și ale metabolismului la nivelul ficatului, țesutului adipos și mușchilor în perioadele de absorbție (Fig. 11.10) și post-absorbtivă (Fig. 11.11). Numiți procesele indicate prin numere. Indicați enzimele reglatoare și mecanismul de modificare a activității lor, ținând cont de faptul că semnalul primar pentru stimularea acestor procese este modificarea concentrației de glucoză în sânge și modificări reciproce ale concentrației de insulină și glucagon (Fig. 11.11).
 Orez. 11.12. Ciclul intracelular al sintezei cortizolului:
Orez. 11.12. Ciclul intracelular al sintezei cortizolului:
EHS - esteri de colesterol; CS - colesterol
SARCINI DE AUTOCONTROL
1. Alegeți răspunsurile corecte. Hormoni:
A. Își manifestă efectele prin interacțiunea cu receptorii B. Sunt sintetizate în lobul posterior al glandei pituitare
B. Modificarea activității enzimatice prin proteoliză parțială D. Inducerea sintezei enzimatice în celulele țintă
D. Sinteza și secreția sunt reglate printr-un mecanism de feedback
 Orez. 11.13. Dinamica modificărilor concentrației de glucoză (A), insulină (B) și glucagon (C) după consumul unei mese bogate în carbohidrați
Orez. 11.13. Dinamica modificărilor concentrației de glucoză (A), insulină (B) și glucagon (C) după consumul unei mese bogate în carbohidrați
2. Alege răspunsul corect. Glucagonul din țesutul adipos activează:
A. TAG-lipază sensibilă la hormoni B. Glucoză-6-fosfat dehidrogenază
B. Acetil-CoA carboxilază D. LP-lipază
D. piruvat kinaza
3. Alege raspunsurile corecte. Iodotironine:
A. Sintetizată în glanda pituitară
B. Interacționează cu receptorii intracelulari
B. Stimulați activitatea lui Na, Ka-ATPaza
D. În concentrații mari, accelerează procesele de catabolism D. Participa la răspunsul la răcire
4. Meci set:
A. Boala Graves B. Mixedemul
B. Gușă endemică D. Cretinism
D. Tiroidita autoimună
1. Apare cu hipotiroidism la o vârstă fragedă
2. Însoțită de acumularea de proteoglicani și apă în piele
3. Este o consecință a formării imunoglobulinei care imită acțiunea TSH
5. Alege raspunsurile corecte.
Perioada de absorbție se caracterizează prin:
A. Creșterea concentrației de insulină în sânge B. Accelerarea sintezei grăsimilor în ficat
B. Accelerarea gluconeogenezei
D. Accelerarea glicolizei în ficat
D. Creșterea concentrației de glucagon în sânge
6. Alege raspunsurile corecte.
Sub influența insulinei în ficat accelerați:
A. Biosinteza proteinelor
B. Biosinteza glicogenului
B. Gluconeogeneza
D. Biosinteza acizilor graşi D. Glicoliza
7. Stabiliți o potrivire. Hormon:
A. Insulină B. Glucagon
B. Cortizol D. Adrenalina
Funcţie:
1. Stimulează sinteza grăsimilor din glucoză în ficat
2. Stimulează mobilizarea glicogenului muscular
3. Stimulează sinteza iodotironinelor
8. Alege raspunsurile corecte. Hormoni steroizi:
A. Pătrunde în celulele țintă
B. Transportat prin sânge în combinație cu proteine specifice
B. Stimularea reacțiilor de fosforilare a proteinelor
D. Interacționează cu cromatina și modifică rata de transcripție D. Participa la procesul de traducere.
9. Alege raspunsurile corecte. Insulină:
A. Accelerează transportul glucozei către mușchi B. Accelerează sinteza glicogenului în ficat
B. Stimulează lipoliza în țesutul adipos D. Accelerează gluconeogeneza
D. Accelerează transportul glucozei în adipocite
1. A, G, D 6. A, B, D, D
2. DAR 7. 1-A, 2-D, 3-D
3. B, C, D, D 8. A, B, D
4. 1-D, 2-B, 3 - A 9. A, B, D
5. A, B, D
TERMENI ȘI CONCEPTE DE BAZĂ
2. Preprohormon
3. Stimuli pentru sinteza si secretie
4. Celulele țintă
5. Receptorii
6. Ierarhia sistemelor de reglementare
7. Mecanismul de acțiune autocrin
8. Mecanismul de acţiune paracrin
9. Homeostazia
10. Perioada de absorbție
11. Perioada postabsorbtivă
12. Adaptare
13. Hipofuncție
14. Hiperfuncție
15. Hormonii continsulari
Rezolva probleme
1. La examinarea pacienților cu simptome de hipercortizolism, se utilizează un test funcțional cu o „încărcare” de dexametazonă (dexametazona este un analog structural al cortizolului). Cum se va schimba concentrația de 17-cetosteroizi în urina pacienților după administrarea dexametazonei, dacă cauza hipercortizolismului este:
a) hiperproducție de corticotropină;
b) tumoră hormonal activă a glandelor suprarenale.
2. Părinții unei fetițe de cinci ani au mers la centrul medical pentru un consult. În timpul examinării, copilul a prezentat manifestări ale caracteristicilor sexuale masculine secundare: hipertrofie musculară, creștere excesivă a părului și scădere a timbrului vocii. Nivelul de ACTH din sânge este crescut. Medicul a diagnosticat sindrom adrenogenital (disfuncție congenitală a cortexului suprarenal). Justificați diagnosticul medicului. Pentru asta:
a) prezinta schema sintezei hormonilor steroizi; numiți principalii corticosteroizi activi fiziologic și indicați funcțiile acestora;
b) numiți enzimele a căror deficiență este cauza simptomelor descrise mai sus;
c) indicați formarea căror produse ai sintezei corticosteroizilor este crescută în această patologie;
d) Explicați de ce este crescută concentrația de ACTH în sângele copilului.
3. O formă a bolii Addison este o consecință a atrofiei celulelor cortexului suprarenal în timpul tratamentului pe termen lung cu corticosteroizi. Principalele manifestări ale bolii: slăbiciune musculară, hipoglicemie,
modificări distrofice ale mușchilor, scăderea tensiunii arteriale; în unele cazuri, astfel de pacienți au o pigmentare crescută a pielii și a membranelor mucoase. Cum se explică simptomele enumerate ale bolii? Pentru explicatie:
a) prezinta schema sintezei hormonilor steroizi; numiți principalii corticosteroizi activi fiziologic și indicați funcțiile acestora;
b) indicați care deficit de corticosteroizi este cauza hipoglucozemiei și distrofiei musculare în această boală;
c) Numiți cauza creșterii pigmentării pielii în boala Addison.
4. Pentru pacientul N cu hipotiroidism, medicul a prescris tratament, inclusiv tiroxina. La 3 luni de la începerea tratamentului, nivelul de TSH din sânge a scăzut ușor. De ce i-a recomandat medicul acestui pacient o creștere a dozei de tiroxină? Pentru un raspuns:
a) prezinta sub forma unei scheme mecanismul de reglare a sintezei si secretiei hormonilor tiroidieni;
5. O fată de 18 ani care locuiește într-un sat de munte a apelat la un endocrinolog cu plângeri de slăbiciune generală, scăderea temperaturii corpului, înrăutățirea dispoziției. Pacientul a fost îndrumat pentru un test de sânge pentru TSH și iodotironine. Rezultatele analizei au arătat o creștere a concentrației de TSH și o scădere a concentrației de T 4. . Explica:
a) ce boală poate fi asumată la pacient;
b) care poate fi cauza unei astfel de patologii;
c) există o legătură între locul de reședință și apariția acestei boli;
d) ce regim alimentar trebuie respectat pentru a preveni această patologie;
e) schema de reglare a sintezei iodotironinelor și rezultatele unei analize de sânge la subiect.
6. Pentru tratamentul gușii toxice difuze se folosesc medicamente tireostatice din grupa tionamidelor (tiamazol). Mecanismul de acțiune al tionamidelor este că, intrând în glanda tiroida, acestea inhibă activitatea tiroperoxidazei. Explicați rezultatul acțiunii terapeutice a tionamidelor. Pentru asta:
a) numiți principalele cauze și manifestări clinice ale tireotoxicozei;
b) dați o schemă pentru sinteza iodotironinelor și indicați etapele în care acționează medicamentele;
c) indicați modul în care se va modifica concentrația de iodotironine și TSH ca urmare a tratamentului;
d) Descrieţi modificările metabolismului în timpul tratamentului cu tionamide.
Unitate modulară 2 MODIFICĂRI BIOCHIMICE ÎN METABOLISM ÎN TIMPUL POSTULUI ȘI DIABETULUI
Obiective de învățare Pentru a fi capabil să:
1. Interpretați modificările în metabolismul carbohidraților, grăsimilor și proteinelor în timpul înfometării și activității fizice ca urmare a acțiunii hormonilor contrainsulari.
2. Analizați mecanismele moleculare ale cauzelor diabetului zaharat.
3. Explicați mecanismele de apariție a simptomelor diabetului zaharat ca urmare a modificărilor ratelor proceselor metabolice.
4. Interpretați principalele diferențe de metabolism în post și diabet.
Știi:
1. Modificări ale stării hormonale în timpul postului.
2. Modificarea schimbului de purtători de energie principali în timpul înfometării.
3. Modificări ale statusului hormonal și metabolismului energetic în diabetul zaharat.
4. Principalele simptome ale diabetului zaharat și mecanismele de apariție a acestora.
5. Patogenia complicaţiilor acute în diabet.
6. Bazele biochimice ale complicațiilor tardive ale diabetului zaharat.
7. Abordări ale diagnosticului de laborator al diabetului zaharat.
8. Mecanismele moleculare ale principiilor tratamentului diabetului zaharat și direcții promițătoare de tratament.
TEMA 11.6. MODIFICĂRI ALE STADIULUI HORMONAL ȘI AL METABOLISMULUI ÎN TIMPUL POSTULUI ȘI MUNCULUI FIZIC
1. În perioada postabsorbtivă și în post, nivelul glucozei din plasma sanguină scade la limita inferioară a normei. Raportul insulină-glucagon este redus. În aceste condiții, apare o stare, care se caracterizează prin predominanța proceselor de catabolism a grăsimilor, glicogenului și proteinelor pe fondul unei scăderi generale a ratei metabolice. Sub influența hormonilor contrainsulari în această perioadă are loc un schimb de substraturi între ficat, țesutul adipos, mușchi și creier. Acest schimb are două scopuri:
Menținerea concentrației de glucoză în sânge datorită gluconeogenezei pentru a asigura țesuturi dependente de glucoză (creier, globule roșii);
Mobilizarea altor molecule de „combustibil”, în primul rând grăsimilor, pentru a furniza energie tuturor celorlalte țesuturi.
Manifestarea acestor schimbări ne permite să distingem condiționat trei faze ale foametei. Datorită trecerii metabolismului la modul de mobilizare a energiei, chiar și după 5-6 săptămâni de post, concentrația de glucoză în sânge nu este mai mică de 65 mg/dl. Principalele modificări în timpul postului apar la nivelul ficatului, țesutului adipos și mușchilor (Fig. 11.14).
2. Fazele foametei. Foame poate fi pe termen scurt - în timpul zilei (prima fază), durează o săptămână (a doua fază) sau câteva săptămâni (a treia fază).
LA primă fază concentrația de insulină în sânge scade de aproximativ 10-15 ori față de perioada de digestie, iar concentrația de glucagon și cortizol crește. Rezervele de glicogen sunt epuizate, rata de mobilizare a grăsimilor și rata gluconeogenezei din aminoacizi și glicerol cresc, concentrația de glucoză în sânge scade până la limita inferioară a normei (60 mg/dl).
 Orez. 11.14. Modificări ale metabolismului principalilor purtători de energie în timpul postului:
Orez. 11.14. Modificări ale metabolismului principalilor purtători de energie în timpul postului:
1 - scăderea indicelui insulină-glucogon; 2 - mobilizarea glicogenului; 3, 4 - transportul GLA către creier și eritrocite; 5 - mobilizarea TAG; 6 - transportul FA către mușchi; 7 - sinteza corpilor cetonici; 8 - transportul acizilor grași în ficat; 9 - transportul AA la ficat; 10 - gluconeogeneza din AA; 11 - transportul lactatului la ficat; 12 - transportul glicerolului la ficat. Linia punctată indică procesele, a căror viteză scade
În a doua fază mobilizarea grăsimilor continuă, crește concentrația de acizi grași în sânge, crește rata de formare a corpilor cetonici în ficat și, în consecință, crește concentrația lor în sânge; există un miros de acetonă, care este eliberat cu aerul expirat și transpirația de la o persoană înfometată. Gluconeogeneza continuă prin descompunerea proteinelor tisulare.
LA a treia faza scade viteza de descompunere a proteinelor și rata gluconeogenezei din aminoacizi. Ritmul metabolic încetinește. Bilanțul de azot în toate fazele de foamete este negativ. Alături de glucoză, corpii cetonici devin o sursă importantă de energie pentru creier.
3. Modificări ale metabolismului principalilor purtători de energie în timpul înfometării. Schimbul de carbohidrați. Rezervele de glicogen ale organismului sunt epuizate în timpul unui post de 24 de ore. Astfel, datorită mobilizării glicogenului, este asigurată doar înfometarea pe termen scurt. Gluconeogeneza este principalul proces care furnizează țesuturilor glucoză în timpul postului. Gluconeogeneza incepe sa se accelereze la 4-6 ore dupa ultima masa si devine singura sursa de glucoza in timpul postului prelungit. Principalele substraturi ale gluconeogenezei sunt aminoacizii, glicerolul și lactatul.
4. Metabolizarea grăsimilor și a corpiilor cetonici. Principala sursă de energie în primele zile de post sunt acizii grași, care se formează din TAG din țesutul adipos. Sinteza corpilor cetonici este accelerată în ficat. Sinteza corpilor cetonici începe în primele zile de post. Corpii cetonici sunt utilizați în principal în mușchi. Nevoile energetice ale creierului sunt parțial asigurate de corpii cetonici. După 3 săptămâni de post, rata de oxidare a corpilor cetonici din mușchi scade, iar mușchii folosesc aproape exclusiv acizi grași. Concentrația de corpi cetonici în sânge crește. Utilizarea corpilor cetonici de către creier continuă, dar devine mai puțin activă din cauza scăderii ratei de gluconeogeneză și a scăderii concentrației de glucoză.
5. Metabolismul proteinelor.În primele zile de post, proteinele musculare se descompun rapid - principala sursă de substraturi pentru gluconeogeneză. După câteva săptămâni de post, rata gluconeogenezei de la aminoacizi scade, în principal datorită absorbției reduse de glucoză și utilizării corpului cetonic în creier. O scădere a ratei de gluconeogeneză din aminoacizi este necesară pentru conservarea proteinelor, deoarece pierderea a 1/3 din toate proteinele poate duce la moarte. Durata postului depinde de cât timp pot fi sintetizați și utilizați corpii cetonici. Cu toate acestea, oxaloacetatul și alte componente TCA sunt necesare pentru oxidarea corpiilor cetonici. În mod normal, se formează din glucoză și aminoacizi, iar în timpul înfometării numai din aminoacizi.
TEMA 11.7. MODIFICĂRI ÎN STARE HORMONALĂ ŞI METABOLISM ÎN DIABETUL MELLITUS
1. Diabet din cauza deficienței relative sau absolute de insulină. Conform clasificării OMS, se disting două forme principale ale bolii: diabetul de tip I - dependent de insulină (IDDM),și diabet de tip II (INSD)- independent de insulină.
2. IDSD este o consecință a distrugerii celulelor β ale insulelor Langerhans ca urmare a reacțiilor autoimune. Diabetul de tip I poate fi cauzat de o infecție virală care distruge celulele β. Astfel de virusuri includ variola, rubeola, rujeola, citomegalovirusul, oreionul, virusul Coxsackie, adenovirusul. IDDM reprezintă aproximativ 25-30% din toate cazurile de diabet. De regulă, distrugerea celulelor β are loc lent, iar debutul bolii nu este însoțit de tulburări metabolice. Când 80-95% din celule mor, apare o deficiență absolută de insulină și se dezvoltă tulburări metabolice severe. IDDM afectează majoritatea copiilor, adolescenților și adulților tineri, dar poate apărea la orice vârstă (de la un an).
3. NIDSD se dezvoltă ca urmare a încălcării conversiei proinsulinei în insulină, reglarea secreției de insulină, creșterea ratei catabolismului insulinei, deteriorarea mecanismelor de transmitere a semnalului de insulină către celulele țintă (de exemplu, un defect în receptorul de insulină, deteriorarea mediatorilor semnalului de insulină intracelulară etc.), formarea de anticorpi la receptorii de insulină și concentrația de insulină în sânge poate fi normală sau chiar crescută. Factorii care determină dezvoltarea și evoluția clinică a bolii includ obezitatea, alimentația necorespunzătoare, stilul de viață sedentar și stresul. NIDDM afectează persoanele, de obicei mai mari de 40 de ani, se dezvoltă treptat, simptomele sunt ușoare. Complicațiile acute sunt rare.
4. Modificări metabolice în diabetul zaharat.În diabetul zaharat, de regulă, raportul dintre insulină - glucagon este redus. Aceasta slăbește stimularea depunerii de glicogen și grăsimi și crește mobilizarea rezervelor de energie. Ficatul, mușchii și țesutul adipos, chiar și după masă, funcționează în stare post-absorbtivă.
5. Simptomele diabetului. Hiperglucozemie. Toate formele de diabet se caracterizează prin niveluri crescute de glucoză în sânge. hiperglucozemie, atât după mese, cât și pe stomacul gol, precum și glucozurie. După masă, concentrația de glucoză poate ajunge la 300-500 mg/dl și rămâne la un nivel ridicat în perioada post-absorbtivă, adică. toleranță redusă la glucoză.
O scădere a toleranței la glucoză se observă și în cazurile unei forme latente (latente) de diabet zaharat. În aceste cazuri, oamenii nu au plângeri și simptome clinice caracteristice diabetului zaharat, iar concentrația de glucoză din sânge pe stomacul gol corespunde cu limita superioară a normalului. Cu toate acestea, utilizarea unor teste provocatoare (de exemplu, o încărcătură de zahăr) relevă o scădere a toleranței la glucoză (Fig. 11.15).
O creștere a concentrației de glucoză în IDDM în plasma sanguină se datorează mai multor motive. Odată cu scăderea indicelui de insulină-glucagon, efectele hormonilor contrainsulari cresc, numărul de proteine - purtători de glucoză (GLUT-4) pe membranele celulelor dependente de insulină (țesutul adipos și mușchii) scade. În consecință, consumul de glucoză de către aceste celule este redus. În mușchi și ficat, glucoza nu se depune sub formă de glicogen; în țesutul adipos, rata de sinteza și depunerea grăsimilor scade. În plus, acțiunea hormonilor coninsulari, în primul rând glucagonul, activează gluconeogeneza din aminoacizi, glicerol și lactat. O creștere a nivelului de glucoză din sânge în diabetul zaharat peste pragul de concentrație renală de 180 mg/dL determină excretarea glucozei în urină.
Cetonemie este semn distinctiv diabetul zaharat. Cu un raport scăzut de insulină - glucagon, grăsimile nu se depun, catabolismul lor este accelerat, deoarece lipaza sensibilă la hormoni din țesutul adipos este într-o formă activă fosforilată. Concentrația de acizi grași neesterificați în sânge crește. Ficatul preia acizii grași și îi oxidează în acetil-CoA, care la rândul său
 Orez. 11.15. Modificări ale toleranței la glucoză la pacienții cu diabet zaharat latent.
Orez. 11.15. Modificări ale toleranței la glucoză la pacienții cu diabet zaharat latent.
Determinarea toleranței la glucoză este utilizată pentru a diagnostica diabetul zaharat. Subiectul ia o soluție de glucoză la o rată de 1 g la 1 kg de greutate corporală (încărcare de zahăr). Concentrația de glucoză din sânge se măsoară în 2-3 ore la intervale de 30 de minute. 1 - la o persoană sănătoasă, 2 - la un pacient cu diabet zaharat
se transformă în acizi β-hidroxibutiric și acetoacetic, rezultând o creștere a concentrației de corpi cetonici din sânge - cetonemie.În țesuturi, acetoacetatul este parțial decarboxilat în acetonă, al cărui miros vine de la pacienții diabetici și se simte chiar și la distanță. O creștere a concentrației de corpi cetonici în sânge (peste 20 mg/dl, uneori până la 100 mg/dl) duce la cetonurie. Acumularea de corpi cetonici reduce capacitatea de tamponare a sângelui și cauzează acidoză (cetoacidoză).
Hiperlipoproteinemie. Grăsimile alimentare nu se depun în țesutul adipos din cauza slăbirii proceselor de stocare și a activității scăzute a Lp-lipazei, ci intră în ficat, unde sunt transformate în triacilgliceroli, care sunt transportați din ficat ca parte a VLDL.
Azotemie.În diabet, deficiența de insulină duce la o scădere a ratei de sinteză și la o creștere a defalcării proteinelor în organism. Acest lucru determină o creștere a concentrației de aminoacizi din sânge. Aminoacizii intră în ficat și sunt dezaminați. Reziduurile fără azot de aminoacizi glicogeni sunt incluse în gluconeogeneză, ceea ce sporește și mai mult hiperglicemia. Amoniacul rezultat intră în ciclul ornitinei, ceea ce duce la o creștere a concentrației de uree în sânge și, în consecință, în urină - azotemieși azoturia.
poliurie. Este necesară o cantitate mare de lichid pentru a elimina cantități mari de glucoză, corpi cetonici și uree, ceea ce poate duce la deshidratare. Acest lucru se datorează particularităților capacității de concentrare a rinichilor. De exemplu, debitul de urină la pacienți crește de câteva ori și în unele cazuri ajunge la 8-9 litri pe zi, dar cel mai adesea nu depășește 3-4 litri. Acest simptom se numește poliurie. Cauzele pierderii apei sete constantăși consum crescut de apă - polidipsie.
6. Complicații acute ale diabetului. Mecanisme de dezvoltare a comei diabetice. Tulburările în metabolismul carbohidraților, grăsimilor și proteinelor în diabetul zaharat pot duce la dezvoltarea comă (complicatii acute). Coma diabetică se manifestă ca o încălcare accentuată a tuturor funcțiilor corpului, însoțită de pierderea conștienței. Principalii precursori ai comei diabetice sunt acidoza și deshidratarea țesuturilor (Fig. 11.16).
Odată cu decompensarea diabetului, se dezvoltă o încălcare a metabolismului apei și electroliților. Motivul pentru aceasta este hiperglucozemia, însoțită de o creștere a presiunii osmotice în patul vascular. Pentru a menține osmolaritatea, începe mișcarea compensatorie a fluidului din celule și spațiul extracelular în patul vascular. Aceasta duce la pierderea tisulară de apă și electroliți, în primul rând ioni Na+, K+, Cl-, HCO3-. Ca urmare, se dezvoltă o deshidratare celulară severă și deficiența ionilor intracelulari (în primul rând K +), însoțită de deshidratare generală. Aceasta duce la o scădere a circulației periferice, o scădere a fluxului sanguin cerebral și renal și hipoxie. Coma diabetică se dezvoltă lent în câteva zile, dar uneori poate
 Orez. 11.16. Modificări metabolice în diabetul zaharat și cauze de comă diabetică
Orez. 11.16. Modificări metabolice în diabetul zaharat și cauze de comă diabetică
apar în decurs de câteva ore. Primele semne pot fi greață, vărsături, letargie. Presiunea arterială la pacienți este redusă.
Coma în diabetul zaharat se poate manifesta sub trei forme principale: cetoacidotică, hiperosmolară și acidotică lactică.
Coma cetoacidotică se caracterizează prin deficit sever de insulină, cetoacidoză, poliurie și polidipsie. Hiperglucozemia (20-30 mmol/l), cauzată de deficitul de insulină, este însoțită de pierderi mari de lichid și electroliți, deshidratare și hiperosmolaritate plasmatică. Concentrația totală de corpi cetonici ajunge la 100 mg/dl și peste.
La hiperosmolarîn comă, niveluri extrem de ridicate ale glucozei plasmatice, poliurie, polidipsie și deshidratare severă sunt întotdeauna prezente. Se crede că la majoritatea pacienților, hiperglucozemia se datorează insuficienței renale concomitente. Corpii cetonici serici nu sunt de obicei detectați.
La acido lacticîn comă predomină hipotensiunea, scăderea circulaţiei periferice şi hipoxia tisulară, ducând la o schimbare a metabolismului către glicoliză anaerobă, ceea ce determină creşterea concentraţiei de acid lactic în sânge (acidoză lactică).
7. Complicații tardive ale diabetului sunt o consecință a hiperglucozemiei prelungite și conduc adesea la invaliditatea precoce a pacienților. Hiperglucozemia duce la deteriorarea vaselor de sânge și la disfuncția diferitelor țesuturi și organe. Unul dintre principalele mecanisme de afectare a țesuturilor în diabetul zaharat este glucozilare proteine și disfuncția asociată a celulelor țesuturilor, modificări ale proprietăților reologice ale sângelui și ale hemodinamicii (fluiditate, vâscozitate).
Unii compuși conțin în mod normal componente carbohidrate (glicoproteine, proteoglicani, glicolipide). Sinteza acestor compuși are loc ca urmare a reacțiilor enzimatice (glucozilare enzimatică). Cu toate acestea, interacțiunea non-enzimatică a grupării aldehidice a glucozei cu grupele amino libere ale proteinelor (glucozilare non-enzimatică) poate avea loc și în corpul uman. În țesuturile oamenilor sănătoși, acest proces este lent și se accelerează în hiperglucozemie.
Unul dintre primele semne ale diabetului zaharat este o creștere de 2-3 ori a hemoglobinei glucozilate. De-a lungul vieții eritrocitelor, glucoza pătrunde liber în membrana sa și, fără participarea enzimelor, se leagă ireversibil de hemoglobină, în principal prin lanțuri β. În acest caz, se formează o formă glucozilata a hemoglobinei HbA 1c. Această formă de hemoglobină este prezentă în cantități mici la oamenii sănătoși. In conditii de hiperglucozemie cronica creste procentul de HbA 1c in raport cu cantitatea totala de hemoglobina.
Gradul de glucozilare a proteinelor depinde de rata de reînnoire a acestora. În proteinele cu metabolizare lentă, se acumulează mai multe modificări. Proteinele care schimbă lent includ proteinele intercelulare
matricea, membranele bazale, cristalinul ochiului (cristaline). Îngroșarea membranelor bazale este unul dintre semnele precoce și permanente ale diabetului zaharat, manifestat sub forma angiopatiei diabetice.
Modificări, manifestate prin scăderea elasticității arterelor, deteriorarea vaselor mari și medii ale creierului, inimii, extremitati mai joase, sunt numite macroangiopatii diabetice. Ele se dezvoltă ca urmare a glucozilării proteinelor matricei intercelulare - colagen și elastina, ceea ce duce la o scădere a elasticității vaselor de sânge și la afectarea circulației sanguine.
Rezultatul deteriorarii capilarelor și vaselor mici - m icroangiopatie se manifestă sub formă de nefro- și retinopatie. Cauza unor complicații tardive ale diabetului zaharat (cataractă, retinopatie) poate fi o creștere a ratei de conversie a glucozei în sorbitol. Sorbitolul nu este utilizat în alte căi metabolice, iar rata de difuzie a acestuia din celule este scăzută. La pacienții cu diabet zaharat, sorbitolul se acumulează în retina și cristalinul ochiului, celulele glomerulare ale rinichilor, celulele Schwann și în endoteliu. Sorbitolul este toxic pentru celule în concentrații mari. Acumularea sa in neuroni duce la cresterea presiunii osmotice, umflarea celulelor si edem tisular. Opacificarea cristalinului, sau cataracta, se poate dezvolta atât din cauza umflării cristalinului cauzată de acumularea de sorbitol și de perturbarea structurii ordonate a cristalinelor, cât și din cauza glucozilării cristalinelor, care formează agregate multimoleculare care cresc puterea de refracție a cristalinelor. lentilele.
TOME PENTRU MUNCĂ EXTRACURRICULUM
1. Luați în considerare fig. 11.14, desenați diagrame ale proceselor care sunt accelerate în ficat și alte țesuturi în perioada post-absorbție, notați numele căilor metabolice și enzimele de reglare corespunzătoare.
2. Analizați modificările metabolice prezentate în Fig. 11.10 și 11.11 și comparați-le cu modificările prezentate în fig. 11.14. Pentru asta:
a) numiți procesele care sunt activate și inhibate în timpul înfometării prelungite;
b) selectați și scrieți schemele proceselor, datorită cărora se menține concentrația de glucoză în sânge în timpul postului prelungit;
c) pentru fiecare proces selectat, indicați enzimele cheie și
călugării, sub influența cărora sunt activați;
d) selectează și scrie schemele de procese, datorită cărora realizează -
Xia furnizarea de energie a mușchilor în timpul înfometării prelungite.
3. Examinați diagrama modificărilor metabolice în diabetul zaharat (Fig. 11.16).Explicați cauzele hiperglucozemiei.Notați denumirile căilor metabolice care sunt accelerate în aceste condiții.
4. Explicați cauzele și mecanismele cetoacidozei în diabetul zaharat și desenați diagrama corespunzătoare.
5. Comparați modificările stării hormonale și ale metabolismului în diabet și post (Fig. 11.14 și 11.16). Explicați de ce catabolismul grăsimilor și proteinelor are loc pe fondul hiperglicemiei în diabetul zaharat.
6. Enumerați principalele simptome ale diabetului. Justificați valabilitatea expresiei: „diabetul este foamea în mijlocul abundenței”. Pentru asta:
a) numiți manifestările diabetului zaharat, asemănătoare cu modificările metabolismului din timpul înfometării;
b) explicați motivele acestor modificări;
c) numiți principalele diferențe de metabolism în diabet zaharat și înfometare.
7. Continuați să completați tabelul cu complicațiile tardive ale diabetului zaharat (Tabelul 11.2):
Tabelul 11.2. Complicații tardive ale diabetului
SARCINI DE AUTOCONTROL
1. Alege răspunsul corect.
La post:
A. Acetil-CoA carboxilaza este fosforilată și activă B. Lipaza TAG sensibilă la hormoni este inactivă
B. Lp-lipaza este activă în țesutul adipos
D. Piruvat kinaza hepatică este fosforilată și activă E. protein kinaza dependentă de cAMP este activă în adipocite
2. Alege raspunsurile corecte. Cu un post de trei zile:
A. Indicele de insulină-glucagon este redus
B. Creste rata gluconeogenezei din aminoacizi
B. Rata sintezei TAG în ficat scade D. Rata β-oxidării în ficat scade
D. Concentrația corpilor cetonici din sânge este peste normal
3. Alege raspunsurile corecte.
O creștere a ratei de sinteză a corpilor cetonici în timpul înfometării este o consecință a:
A. Niveluri reduse de glucagon
B. Scăderea formării de Acetil-CoA în ficat
B. Creșterea concentrației de acizi grași în plasma sanguină D. Scăderea ratei de β-oxidare în ficat
E. Scăderea activității TAG-lipazei sensibile la hormoni din adipocite
4. Alege raspunsurile corecte.
În diabetul zaharat, ficatul:
A. Accelerarea sintezei glicogenului
B. Creșterea ratei gluconeogenezei
B. Scăderea ratei sintezei grăsimilor
D. Creșterea vitezei de sinteză a acetoacetatului
D. Activitate crescută a acetil-CoA carboxilază
5. Meci set:
A. Nivel inalt insulina B. Alcaloza
B. Hipoglucozemie
D. Niveluri ridicate de cortizol
E. Leziuni autoimune ale celulelor β
1. Doar cu diabet
2. Numai la post
3. Doar cu diabet steroizi
6. Alege raspunsurile corecte.
Cu IDDM, pacienții găsesc cel mai adesea:
A. Hiperglucozemie
B. Rata mare de catabolism a insulinei
B. Concentrația de insulină în sânge este normală sau peste normal D. Anticorpi la celulele β pancreatice
D. Microangiopatie
7. Meci set:
A. Macroangiopatie B. Cataractă
B. Microangiopatie D. Nefropatie
D. Neuropatie
1. Activarea căii sorbitolului în celulele Schwann
2. Glucozilarea cristalinelor
3. Îngroșarea membranelor bazale ale glomerulilor rinichilor
STANDARDE DE RĂSPUNSURI LA „SARCINI DE AUTOCONTROL”
2. A, B, C, D
4. B, C, D
5. 1-D, 2-B, 3-D
6. A, G, D
7. 1-D, 2-B, 3-D
TERMENI ȘI CONCEPTE DE BAZĂ
1. Postul
2. Fazele de post
3. Diabet
6. Hiperglucozemie – glucozurie
7. Cetonemie – cetonurie
8. Azotemie - azoturie
9. Complicații tardive ale diabetului
10. Comă diabetică
11. Comă cetoacidotică
12. Comă hiperosmolară
13. Comă de acid lactic
14. Microangiopatie
15. Macroangiopatie
16. Neuropatie
17. Nefropatie
SARCINI PENTRU MUNCĂ AUDIȚIONALĂ
Rezolva probleme
1. Turiștii nu calculau proviziile de hrană și până au ajuns la prima așezare au fost nevoiți să moară de foame timp de 2 zile. Ce schimbări de metabolism vor avea loc la acești turiști? Pentru explicatie:
a) indicați cum se va modifica concentrația de glucoză din sângele turiștilor până la sfârșitul celei de-a 2-a zile de post;
b) scrieți schemele proceselor, datorită activării cărora se menține o concentrație normală de glucoză în prima zi de post;
c) numiți hormonii care reglează nivelul de glucoză în această perioadă;
d) prezinta sub forma unei diagrame mecanismul de actiune al acestor hormoni;
e) indicați reacțiile de reglare ale acestor căi și modalitățile de activare a acestora.
2. Studiile biochimice ale sângelui și urinei unui pacient cu diabet zaharat de tip 1 au arătat:
Cum se vor schimba acești indicatori cu o singură administrare a unei doze medii zilnice de insulină la un pacient? Ca urmare a activării a ce procese vor avea loc aceste schimbări?
3. Un pacient a venit la terapeut cu plângeri de slăbiciune progresivă, somnolență, amețeli. Simptomele au fost agravate de post, ceea ce l-a determinat pe medic să presupună că pacientul avea hipoglicemie. Un test de sânge a confirmat ipoteza (nivelul de glucoză mai mic de 2,5 mmol/l) și, de asemenea, a arătat un nivel puternic crescut al peptidei C (mai mult de 800 pmol/l). Pacientul nu suferă de diabet și nu ia medicamente pentru scăderea zahărului. Ce boala se poate presupune? Când răspunzi la o întrebare:
a) numiți stimulii care afectează secreția de insulină;
b) descrieți efectul insulinei asupra metabolismului carbohidraților și grăsimilor la nivelul ficatului, țesutului adipos și mușchilor;
c) explicați de ce hipoglucozemia este periculoasă și ce procese din organism împiedică în mod normal dezvoltarea hipoglucozemiei chiar și în timpul înfometării;
d) denumește boala și sugerează o metodă de tratament.
4. Pacientul N s-a plâns de foame constantă, sete, oboseală și oboseală. Determinarea concentrației de glucoză a jeun a arătat 130 mg/dl. Ce studii suplimentare pentru stabilirea diagnosticului ar trebui făcute în acest caz? Ce rezultate pot fi prezise dacă diabetul de tip II este detectat la persoana examinată?
5. Pacient diagnosticat cu IDDM perioadă lungă de timp nu a primit injecții cu insulină. După ce pacientul a mers la medic și o examinare amănunțită, a fost prescrisă terapia cu insulină. După 2 luni, glicemia a jeun a fost de 85 mg/dL, iar hemoglobina glucozilată a fost de 14%. nivel general hemoglobina (normal 5,8-7,2%).
Care sunt posibilele motive pentru concentrația mare de hemoglobină glucozilata la acest pacient, în ciuda tratamentului în curs? Dați exemple de glucozilare a altor proteine. Explicați la ce complicații poate duce.
6. Un pacient de 39 de ani a fost internat cu plângeri de sete intensă, oboseală rapidă. Pierderea în greutate în ultimele 5 săptămâni a fost de 4 kg în ciuda apetitului bun și a exercițiilor normale. Un test de sânge a arătat că concentrația de glucoză la 2 ore după masă este de 242 mg/dL. Ce boală poate fi asumată la acest pacient? Care este cauza setei? Cum se explică oboseala rapidă a pacientului?
Unitate modulară 3 REGLAREA METABOLISMULUI APĂ-SARE. ROLUL VASOPRESINEI, ALDOSTERONULUI ȘI SISTEMULUI RENINA-ANGIOTENSINĂ. REGLEMENTAREA METABOLISMULUI CA 2 + SI FOSFAT
Obiective de învățare Pentru a fi capabil să:
1. Analizați modificările metabolismului care apar cu unele tulburări ale metabolismului apă-sare (hiperaldosteronism, hipertensiune renală).
2. Interpretarea mecanismelor moleculare ale tulburărilor în sinteza și secreția hormonilor care reglează metabolismul calciului.
Știi:
1. Caracteristicile principalelor hormoni ai WOS și etapele reglării acestuia.
2. Principalele funcții ale calciului în organism.
3. Mecanisme de reglare hormonală a schimbului de ioni de calciu și fosfat.
4. Manifestări ale unor încălcări ale sintezei și secreției de hormoni care reglează schimbul de calciu și fosfați (hipo- și hiperparatiroidism, rahitism).
TEMA 11.8. REGLAREA METABOLISMULUI APĂ-SARE
1. Parametrii principali homeostazia apă-sare sunt presiunea osmotică, pH-ul și volumul lichidului intracelular și extracelular. Modificările acestor parametri pot duce la modificări ale tensiunii arteriale, acidoză sau alcaloză, deshidratare și edem. Principalii hormoni implicați în reglarea echilibrului apă-sare sunt hormon antidiuretic (ADH), aldosteronși factorul natriuretic atrial (ANF).
2. Hormon antidiuretic(ADH), sau vasopresina, este o peptidă care conține nouă aminoacizi conectați printr-o punte disulfurică. Este sintetizat ca prohormon în hipotalamus, apoi transferat la terminațiile nervoase ale glandei pituitare posterioare, din care este secretat în fluxul sanguin cu stimulare adecvată. Mișcarea de-a lungul axonului este asociată cu o proteină purtătoare specifică (neurofizina) (Fig. 11.17).
Stimulul care determină secreția de ADH este creșterea concentrației ionilor de sodiu și creșterea presiunii osmotice a lichidului extracelular.
Cele mai importante celule țintă pentru ADH sunt celulele tubilor distali și canalele colectoare ale rinichilor. Celulele acestor canale sunt relativ impermeabile la apă, iar în absența ADH, urina nu este concentrată și poate fi excretată în cantități care depășesc 20 litri pe zi (normal 1-1,5 litri pe zi).
 Orez. 11.17. Secreția și mecanismul de acțiune al hormonului antidiuretic:
Orez. 11.17. Secreția și mecanismul de acțiune al hormonului antidiuretic:
A: 1 - neuron supraoptic; 2 - neuron paraventricular; 3 - lobul anterior al glandei pituitare; 4 - lobul posterior al glandei pituitare; 5 - ADH-neurofizina; B: 1 - ADH se leagă de receptorul membranar V 2, determinând activarea adenilatciclazei (AC) și, ca urmare, formarea cAMP; 2 - AMPc activează protein kinaza, care fosforilează proteinele; 3 - proteinele fosforilate induc transcrierea genei proteinei acvaporinei; 4 - acvaporina este înglobată în membrana celulară a tubului renal
Pentru ADH, există două tipuri de receptori - V1 și V2. receptor V2 găsit doar pe suprafața celulelor epiteliale ale rinichilor. Legarea ADH la V 2 este asociată cu sistemul adenilat-ciclazei și stimulează activarea protein kinazei (PKA), care fosforilează proteinele care stimulează expresia genei proteinei membranare, acvaporina-2. Aquaporin-2 se deplasează în membrana apicală, se integrează în ea și formează canale de apă prin care moleculele de apă difuzează liber în celule.
tubii renali si apoi in spatiul interstitial. Ca rezultat, apa este reabsorbită din tubii renali (vezi Figura 11.17). Receptorii de tip V localizate în membranele musculare netede. Interacțiunea ADH cu receptorul V 1 duce la activarea fosfolipazei C, având ca rezultat eliberarea de Ca 2 + din reticulul endoplasmatic și contracția stratului de mușchi neted vascular.
3. Diabet insipid. Deficiența ADH cauzată de disfuncția glandei pituitare posterioare, precum și o încălcare a sistemului de transmitere a semnalului hormonal, poate duce la dezvoltarea diabet insipid. Principala manifestare a diabetului insipid este poliurie, acestea. excreția de cantități mari de urină cu densitate scăzută.
4. Aldosteron- cel mai activ mineralocorticosteroid - este sintetizat de celulele zonei glomerulare a cortexului suprarenal din colesterol. Sinteza și secreția de aldosteron este stimulată de concentrația scăzută de Na +, concentrația mare de K + și sistemul renină-angiotensină. Hormonul pătrunde în celulele tubilor renali, interacționează cu un receptor specific, citoplasmatic sau nuclear (Fig. 11.18), și induce sinteza proteinelor care asigură reabsorbția ionilor de sodiu și excreția ionilor de potasiu.
În plus, proteinele a căror sinteză este indusă de aldosteron măresc numărul de pompe Na +, K + - ATPază și servesc, de asemenea, ca enzime TCA, care generează molecule de ATP pentru transportul ionilor activi. Rezultatul total al acțiunii aldosteronului este reținerea NaCl în organism.
5. Rolul principal în reglarea echilibrului apă-sare și, prin urmare, în reglarea volumului și a tensiunii arteriale, îl joacă sistemul. renină-angiotensinaldosteron(Fig. 11.19).
enzimă proteolitică renina sintetizat de celulele juxtaglomerulare ale arteriolelor aferente renale. O scădere a tensiunii arteriale în arteriolele aferente, pierderea de lichid sau de sânge și o scădere a concentrației de NaCl stimulează eliberarea de renină. proteine produse în ficat angiotensinogen hidrolizată de renină pentru a forma angiotensină I, care, la rândul său, servește ca substrat pentru ACE (enzima de conversie a angiotensinei carboxipentidil peptidaza). O dipeptidă este scindată din angiotensină I pentru a forma angiotensina II. Prin sistemul inozitol fosfat ngiotensină II stimulează sinteza și secreția de aldosteron. Fiind și un puternic vasoconstrictor, angiotensina II provoacă contracția celulelor musculare netede ale vaselor de sânge, respectiv creșterea tensiunii arteriale și, în plus, provoacă sete.
6. Sistemul renină-angiotensină-aldosteron asigură restabilirea volumului sanguin, care poate scădea ca urmare a sângerării, vărsăturilor abundente, diareei, transpirației - afecțiuni care sunt un semnal pentru
 Orez. 11.18. Mecanismul de acțiune al aldosteronului.
Orez. 11.18. Mecanismul de acțiune al aldosteronului.
Aldosteronul, interacționând cu receptorii intracelulari, stimulează sinteza proteinelor. Aceste proteine pot fi:
1 - componente ale canalelor de sodiu și cresc reabsorbția Na + din urină;
2 - enzime TCA, a căror activitate asigură producerea de ATP; 3 - Na +, K + - ATPaza, o pompă care menține o concentrație intracelulară scăzută de ioni de sodiu și o concentrație mare de ioni de potasiu
eliberare de renină. Acest lucru este, de asemenea, facilitat de o scădere a impulsurilor de la baroreceptorii atriilor și arterelor, ca urmare a scăderii volumului intravascular de lichid. Ca urmare, crește formarea angiotensinei II și, în consecință, crește concentrația de aldosteron în sânge, determinând o retenție a ionilor de sodiu. Aceasta semnalează osmoreceptorii hipotalamici și secreția de la terminațiile nervoase hipofizare anterioare ale ADH, care stimulează reabsorbția apei din canalele colectoare. Angiotensina II, având un efect vasoconstrictiv puternic, crește tensiunea arterială și, de asemenea, crește setea. Apa care vine cu băutură, într-o măsură mai mare decât o face în mod normal, este reținută în organism.
 Orez. 11.19. Sistemul renină-angiotensină-aldosteron.
Orez. 11.19. Sistemul renină-angiotensină-aldosteron.
ACE - enzimă de conversie a angiotensinei (un alt nume pentru carboxipeptidil dipeptidază)
Scăderea volumului de lichid și scăderea tensiunii arteriale activează sistemul renină-angiotensină-aldosteron;
Angiotensina II determină vasoconstricție tranzitorie și creșterea tensiunii arteriale;
Aldosteronul stimulează retenția de sodiu, având ca rezultat eliberarea de vasopresină și creșterea reabsorbției apei;
Angiotensina II provoacă, de asemenea, o senzație de sete, care contribuie la creșterea lichidului din organism.
O creștere a volumului lichidului și o creștere a tensiunii arteriale duce la eliminarea stimulului care a determinat activarea sistemului renină-angiotensină și secreția de aldosteron și, ca urmare, duce la restabilirea volumului sanguin.
7. O scădere a presiunii de perfuzie în glomeruli renali poate apărea, de asemenea, din cauza îngustării (stenozei) arterei renale sau a nefrosclerozei. În acest caz, întregul sistem renină-angiotensină este de asemenea pornit. Dar, deoarece volumul inițial și tensiunea arterială sunt normale, includerea sistemului duce la o creștere a tensiunii arteriale peste norma și la dezvoltarea așa-numitului hipertensiune renală.
8. hiperaldosteronism - este o boală cauzată de hipersecreția de aldosteron de către glandele suprarenale. Cauză hiperaldosteronism primar (sindrom Kohn) este un adenom al glandelor suprarenale sau hipertrofie difuză a celulelor zonei glomerulare care produc aldosteron. În hiperaldosteronismul primar, excesul de aldosteron crește reabsorbția sodiului în tubii renali. O creștere a concentrației de Na + în plasmă servește ca stimul pentru secreția de hormon antidiuretic și retenția de apă de către rinichi. În plus, excreția ionilor de potasiu, magneziu și protoni este îmbunătățită. Ca urmare, se dezvoltă hipernatremia, provocând, în special, hipertensiune arterială, hipervolemie și edem; hipokaliemie care duce la slăbiciune musculară, precum și deficiență de magneziu și alcaloză metabolică. Cauză hiperaldosteronism secundar este un nivel crescut de renină și angiotensină II, aceasta stimulează cortexul suprarenal și duce la sinteza excesivă de aldosteron. Simptomele clinice sunt mai puțin pronunțate decât în aldosteronismul primar. Determinarea simultană a concentrației de aldosteron și a activității reninei plasmatice face posibilă diferențierea în final a hiperaldosteronismului primar (activitatea reninei plasmatice este redusă) și secundar (activitatea reninei plasmatice este crescută).
9. Factorul natriuretic atrial (ANF)- o peptidă care este sintetizată și stocată ca prohormon în cardiocite. Principalul factor care reglează secreția de PNP este creșterea tensiunii arteriale. Principalele celule țintă ale PNP sunt rinichii, glandele suprarenale și arterele periferice. Receptorul PNP al membranei plasmatice este un receptor catalitic cu activitate de guanilat ciclază. Ca urmare
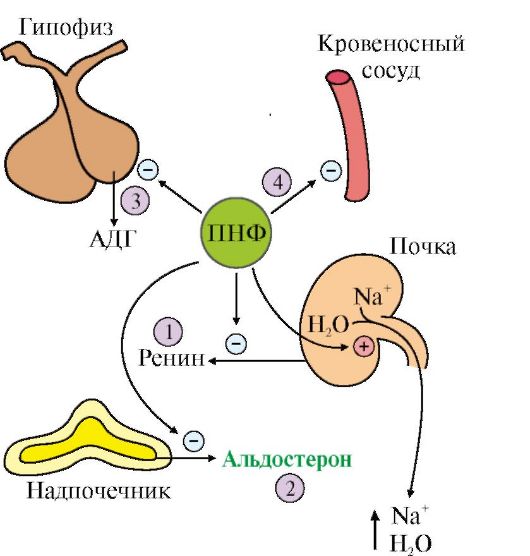 Orez. 11.20. Efectele acțiunii PNF:
Orez. 11.20. Efectele acțiunii PNF:
1 - inhiba eliberarea de renina; 2 - inhiba secretia de aldosteron; 3 - inhiba secretia de ADH; 4 - determină relaxarea vaselor de sânge
legarea PNP la receptor, activitatea guanilat ciclază a receptorului crește și GMP ciclic se formează din GTP. Ca urmare a acțiunii PNP, formarea și secreția de renină și aldosteron este inhibată. Efectul net al PNP este creșterea excreției de Na + și apă și scăderea tensiunii arteriale (Fig. 11.20).
PNP este în general privit ca un antagonist fiziologic al angiotensinei II, deoarece provoacă vasodilatație și pierderea de sare și apă.
TEMA 11.9. REGLAREA METABOLISMULUI CALCIULUI SI FOSFATILOR. STRUCTURA, SINTEZA ȘI MECANISMUL DE ACȚIUNE A PARATHORMONILOR, CALCITRIOLULUI ȘI CALCITONINEI
1. Corpul unui adult conține -1,2 kg de calciu. Principalul fond de calciu din organism este calciul osos (99% din tot calciul din organism). Un alt fond este ionii de calciu dizolvați în fluide sau combinați cu proteine în fluide și țesuturi. Concentrația de calciu în interiorul celulelor depinde de concentrația acestuia în lichidul extracelular. Concentrația de Ca 2 + în sângele oamenilor sănătoși este de 2,12-2,6 mmol / l (9-11 mg / dl), în lichidul intracelular - de o mie de ori mai puțin.
Calciul este principala componentă minerală structurală a țesutului osos. Ionii de calciu sunt implicați în contracția musculară, cresc permeabilitatea membranei celulare pentru ionii de potasiu, afectează conductivitatea sodiului celulelor, funcționarea pompelor ionice, promovează secreția de hormoni, participă la mecanismul în cascadă de coagulare a sângelui și servesc ca cei mai importanți mediatori în transmiterea semnalului intracelular.
Concentrația de Ca 2 + în plasmă este reglată cu mare precizie: modificarea sa cu doar 1% activează mecanismele homeostatice care restabilesc echilibrul. Principalii regulatori ai metabolismului Ca 2+ în sânge sunt hormon paratiroidian, calcitriolși calcitonina.
2. Parathormon sintetizat glande paratiroide sub formă de preprohormon, care este apoi transformat într-un hormon matur prin proteoliză parțială. PTH este secretat ca răspuns la scăderea nivelului de calciu din sânge. Principalele organe țintă pentru hormon sunt oasele și rinichii (Fig. 11.21).
Hormonul inițiază o cascadă de evenimente asociate cu osteoblast adenilat ciclază care stimulează activitatea metabolică a osteoclastelor. Are loc o mobilizare a Ca 2+ din os și intrarea fosfaților în sânge, iar în tubii distali ai rinichilor este stimulată reabsorbția Ca 2+ și scade reabsorbția fosfaților, rezultând restabilirea nivelului normal de calciu. ionii din lichidul extracelular.
3. Calcitriol ca și alți hormoni steroizi, este sintetizat din colesterol. Precursorul imediat al calciferolului este colecalciferolul (vitamina D3). Conține o cantitate mică de vitamina D 3
 Orez. 11.21 Efectele acțiunii PTH:
Orez. 11.21 Efectele acțiunii PTH:
1 - PTH stimulează mobilizarea calciului din os; 2 - PTH stimulează reabsorbția ionilor de calciu în tubii distali ai rinichilor; 3 - PTH activează formarea de 1,25(OH) 2 D 3 în rinichi, ceea ce duce la stimularea absorbției Ca 2 + în intestin
în mâncare, dar majoritatea Vitamina folosită în sinteza calcitriolului se formează în piele din 7-dehidrocolesterol în timpul unei reacții neenzimatice sub acțiunea luminii ultraviolete. Formarea calcitriolului din vitamina D 3 începe în ficat și se termină în rinichi (Fig. 11.22).
În ficat, colecalciferolul este hidroxilat la al 25-lea atom de carbon pentru a forma 25-hidroxicolecalciferol. Hidroxilarea care are loc în rinichi sub acțiunea enzimei 1o-hidroxilaze este o etapă limitatoare de viteză și duce la formarea calcitriolului 1,25(OH) 2 D 3 - forma activă a vitaminei D 3 . Enzima acestei reacții este activată de o concentrație scăzută de ioni de Ca 2 + în sânge și hormonul paratiroidian. O creștere a concentrației de calcitriol, dimpotrivă, inhibă sinteza 1o-hidroxilazei în rinichi, inhibând formarea hormonului. Fiind transportat prin sânge într-un complex cu o proteină purtătoare, calcitriolul se leagă de un receptor intracelular, interacționează cu cromatina și modifică viteza de translație. Ca urmare, proteinele sunt sintetizate în celulele țintă care asigură absorbția calciului și a fosfaților în enterocite.
4. Calcitonina - o polipeptidă constând din 32 de resturi de aminoacizi cu o legătură disulfurică. Hormonul este secretat de parafolicular
 Orez. 11.22 Schema pentru sinteza calcitriolului:
Orez. 11.22 Schema pentru sinteza calcitriolului:
1 - colesterolul este un precursor al calcitriolului; 2 - la nivelul pielii, 7-dehidrocolesterolul este transformat neenzimatic în colecalciferol sub acțiunea iradierii UV; 3 - în ficat, 25-hidroxilaza transformă colecalciferolul în calcidiol; 4 - in rinichi, formarea calcitriolului este catalizata de 1o-hidroxilaza
Celulele K ale glandei tiroide sau celulele C ale glandei paratiroide sub forma unei proteine precursoare cu greutate moleculară mare. Secreția de calcitonină crește odată cu creșterea concentrației de Ca 2 + și scade odată cu scăderea concentrației de Ca 2 + în sânge. Calcitonina inhibă eliberarea de Ca 2 + din os și stimulează excreția acestuia de către rinichi în urină.
5. hipocalcemieși hipercalcemie, când concentrația de calciu în plasma sanguină este mai mică sau mai mare decât în mod normal, indică o patologie. O modificare a nivelului de calciu din sânge afectează concentrația de calciu în interiorul celulelor, ceea ce duce la o modificare a pragului de excitabilitate al celulelor nervoase și musculare, o defecțiune a pompei de calciu, o scădere a activității enzimelor și o încălcare a reglarea hormonală a metabolismului. Cu hipocalcemie, se observă hiperreflexe, convulsii, spasme ale laringelui. Cu hipercalcemie, se observă o scădere a excitabilității neuromusculare, poate apărea o tulburare profundă a funcțiilor nervoase, psihoză, stupoare și comă.
6. Hiperparatiroidism. Secreția excesivă de hormon paratiroidian, rezultată dintr-o tumoră a glandei paratiroide, hiperplazia difuză a glandelor, carcinomul paratiroidian (hiperparatiroidism primar), duce la mobilizarea crescută a calciului și fosfatului din os, reabsorbția crescută a calciului și excreția de fosfat în oase. rinichi. Ca urmare, apare hipercalcemie, care poate duce la o scădere a excitabilității neuromusculare și a hipotensiunii musculare. Pacienții dezvoltă slăbiciune generală și musculară, oboseală și durere în anumite grupe musculare, iar riscul de fracturi ale coloanei vertebrale, femurului și oaselor antebrațului crește. O creștere a concentrației de ioni de fosfat și calciu în tubii renali poate provoca formarea de pietre la rinichi și duce la hiperfosfaturie și hipofosfatemie.
7. Hipoparatiroidismul. Principalul simptom al hipoparatiroidismului datorat insuficienței paratiroidiene este hipocalcemia. O scădere a concentrației ionilor de calciu în sânge poate provoca tulburări neurologice, oftalmice și cardiovasculare, precum și afectarea țesutului conjunctiv. Un pacient cu hipoparatiroidism are o creștere a conducerii neuromusculare, atacuri de convulsii tonice, convulsii ale mușchilor respiratori și ale diafragmei și laringospasm.
8. Rahitism- o boală a copilăriei asociată cu o mineralizare insuficientă a țesutului osos. Încălcarea mineralizării osoase este o consecință a deficienței de calciu și se poate datora următoarelor motive: lipsa vitaminei D 3 în dietă, absorbția afectată a vitaminei D 3 în intestinul subțire, scăderea sintezei precursorilor de calcitriol din cauza timpului insuficient în intestin. soare, un defect în Ια-hidroxilază, un defect al receptorilor de calcitriol în celulele țintă. Toate acestea determină o scădere a absorbției de calciu în intestin și o scădere a concentrației acestuia în sânge, stimularea secreției de hormon paratiroidian și, ca urmare,
Aceasta este mobilizarea ionilor de calciu din os. În cazul rahitismului, oasele craniului sunt afectate, pieptul, împreună cu sternul, iese înainte, oasele tubulare și articulațiile brațelor și picioarelor sunt deformate, iar stomacul se mărește și iese în afară. Principala modalitate de a preveni rahitismul este alimentația adecvată și insolația suficientă.
TOME PENTRU MUNCĂ EXTRACURRICULUM
Rezolva probleme
1. Aflați mecanismele de reglementare a întreținerii echilibrul apei, amintiți-vă de stimulii care provoacă secreția de hormoni și de caracteristicile mecanismului de acțiune a acestora (Fig. 11.19). Desenați o diagramă a succesiunii evenimentelor în restabilirea echilibrului apă-sare după consumul de alimente sărate.
2. Un tânăr de 23 de ani are operatie chirurgicala pentru îndepărtarea unei tumori din hipofiza anterioară superioară a fost afectat istmul hipofizei posterioare. LA perioada postoperatorie Pacientul a dezvoltat poliurie. Cum puteți explica apariția acestui simptom la acest pacient? Pentru a-ți justifica răspunsul:
a) numiți hormonii sintetizați în hipotalamus și secretați de hipofiza posterioară;
b) desenați o diagramă de transmitere a semnalului acestui hormon către celulele țintă;
c) Numiți efectele acestui hormon.
3. Amintiți-vă schema pentru sinteza hormonilor steroizi (Fig. 11.8) și notați secvența pașilor din sinteza aldosteronului într-un caiet.
4. Desenați propria diagramă care ilustrează efectele aldosteronului și mecanismul său de acțiune.
5. Studiați schema de reglare a sintezei și secreției de aldosteron cu participarea sistemului renină-angiotensină (Fig. 11.19) și selectați componentele lipsă indicate în diagramă (Fig. 11.23) după numere.
6. Realizați propria diagramă explicând principalele rezultate ale acțiunii PNF (Fig. 11.20) și răspundeți la întrebarea care este baza efectului hipotensiv
7. Completați tabelul. 11.3.
Tabelul 11.3. Caracteristicile hormonilor care reglează metabolismul apă-sare
 Orez. 11.23. Schema de reglare a homeostaziei apă-sare
Orez. 11.23. Schema de reglare a homeostaziei apă-sare
8. Completați tabelul. 11.4.
Tabelul 11.4. Caracteristicile hormonilor care reglează metabolismul calciului și fosfatului
9. Folosind diagrama din fig. 11.22, indicați toate cauzele posibile ale rahitismului și prezentați o diagramă a mecanismului de transmitere a semnalului calcitriol către celulele țintă.
10. Cu hipovitaminoza D 3, procesul de mineralizare osoasă este întrerupt, conținutul de calciu și fosfați din acestea scade; concentraţia de Ca 2 + în sânge rămâne în limitele normale sau scade uşor. Elaborați o schemă pentru menținerea Ca 2 + homeostaziei în hipovitaminoza D 3 și determinați:
a) din ce surse se menţine concentraţia normală de Ca 2 + în sânge în acest caz;
b) cum se va modifica concentrația calcitoninei și a hormonului paratiroidian din sânge.
11. Excreția crescută a calciului în urină poate fi cauza formării de pietre la rinichi, constând în principal din oxalat de calciu. Care sunt motivele pentru care excreția de Ca 2 poate crește.
SARCINI DE AUTOCONTROL
1. Alege răspunsul corect.
Ca răspuns la o creștere a presiunii osmotice, sinteza și secreția hormonului crește:
A. Aldosteron B. Cortizol
B. Vasopresină D. Adrenalină D. Glucagon
2. Stabiliți o potrivire.
Locul sintezei:
A. Ficat B. Rinichi
B. Hipotalamus D. Glandele suprarenale
D. Pancreasul
Metaboliti:
1. Vasopresina
2. Aldosteron
3. Meci set:
A. Stimulul pentru sinteza si secretie este formarea angiotensinei II B. Stimulul pentru secretie este o crestere a concentratiei ionilor de sodiu
B. Organe țintă – artere periferice
D. Hiperproducția hormonului duce la poliurie D. Locul sintezei – ficat
1. Vasopresina
2. Aldosteron
3. Angiotensinogen
4. Alege raspunsurile corecte. Angiotensina II:
A. Se formează în ficat
B. Este o enzimă proteolitică
B. Este un substrat al reninei
D. Stimulează sinteza aldosteronului D. Stimulează vasoconstricția
5. Alege raspunsurile corecte.
Calcitriol:
A. Stimulează reabsorbția calciului în rinichi
B. Este un precursor al 7-dehidrocolesterolului
B. Stimulează reabsorbția sodiului în rinichi
D. Crește rata de absorbție a calciului în intestin D. Stimulează mobilizarea calciului din oase
6. Alege raspunsurile corecte.
O scădere a concentrației de Ca 2 + în plasma sanguină determină:
A. Secreție crescută de hormon paratiroidian
B. Inhibarea activității celulelor parafoliculare ale glandei tiroide
B. Hidroxilarea metaboliților vitaminei D 3 D. Reducerea excreției de calciu de către rinichi
D. Creșterea ratei de resorbție osoasă
7. Finalizați sarcina „în lanț”:
A) Hormonul produs de hipotalamus este:
A. Vasopresina B. Adrenalina
B. Aldosteron G. Calcitriol
b) Celulele țintă pentru acest hormon sunt:
A. celule JUGA
B. Arterele periferice
B. Celulele canalelor colectoare și ale tubilor distali D. Celulele glomerulului nefron
în) legându-se de receptorii acestor celule, stimulează:
A. Sistemul adenilat ciclază B. Fosfoprotein fosfatază
B. Sistemul inozitol trifosfat D. Sistemul renină-angiotensină.
G) ca urmare a activării acestui sistem, cantitatea de proteine crește:
A. Albumina
B. Transportatori de sodiu
B. Aquaporina-2
G. Transportor de potasiu
e) această proteină asigură o creștere a reabsorbției:
A. Ioni de potasiu B. Ioni de calciu
B. Ioni de sodiu D. Apa
8. Alege raspunsurile corecte. Parathormon:
A. Este transportat prin sânge într-un complex cu o proteină purtătoare B. Secreția este reglată de concentrația de calciu din sânge
B. Deficienta hormonala duce la scaderea concentratiei
D. Pentru manifestarea activității biologice este necesară întreaga moleculă a hormonului D. Crește eficiența absorbției apei în intestin
9. Alege raspunsurile corecte.
Vasopresina:
A. Stimulează o creștere a presiunii osmotice a plasmei sanguine B. Activează protein kinaza C în rinichi
B. Stimulează reabsorbția apei în rinichi
D. Reduce presiunea osmotică a plasmei sanguine D. Stimulează expresia genei aquaporin-2
10. Meci set:
A. Prezinta un efect vasoconstrictiv B. Stimuleaza reabsorbtia Na+
B. Interacționează cu receptorii membranari ai celulelor țintă D. Îmbunătățește secreția de renină
D. Este o enzimă proteolitică
1. Aldosteron
2. Angiotensina II
11. Selectați toate răspunsurile corecte. PNF:
A. Interacționează cu receptorii membranari ai celulelor țintă B. Activează fosfolipaza C
B. Activează guanilat ciclaza
D. Suprimă secreția de aldosteron D. Crește excreția de apă și Na +
12. Meci set:
A. În rinichi B. În piele
B. În ficat D. În creier
D. În intestine
1. Conversia 7-dehidrocolesterolului în vitamina D 3 prin fotoliză neenzimatică
2. Formarea 1,25 (OH)2D 3 într-o reacție de monooxigenază care implică NADPH
3. Inducerea sintezei proteinelor care leagă calciul STANDARDE DE RĂSPUNSURI LA „SARCINI DE AUTOCONTROL”
1. LA 7. a) A, b) C, c) A, d) C, e) D
2. 1-B; 2-D; 3-B 8. B, C
3. 1-B; 2-A; 3-D 9. C, D, D
4. G, D 10. 1-B; 2-A; 3-D
5. A, G, D 11. A, C, D, D
6. A, C, D, D 12 .1 - B; 2 - B; 3 - D
TERMENI ȘI CONCEPTE DE BAZĂ
1. Homeostazia apă-sare
2. Diabet insipid
3. Sistemul renină-angiotensină-aldosteron
4. Hiperaldosteronism
5. Hipercalcemie
6. Hipocalcemie
7. Hipoparatiroidismul
8. Hiperparatiroidism
SARCINI PENTRU MUNCĂ AUDIȚIONALĂ
Rezolva probleme
1. Unele forme de hipertensiune arterială rezultă din diferite afecțiuni renale, cum ar fi compresia arterei renale de către o tumoare. Principala metodă de tratament în astfel de cazuri este îndepărtarea organului afectat (rinichi). Cu toate acestea, se observă o îmbunătățire a stării pacienților atunci când pacienților li se prescriu medicamente care sunt inhibitori ai ECA. Desenați o diagramă care arată modificarea metabolismului apă-sare în timpul compresiei arterei renale. Ca urmare a ce modificări se îmbunătățește starea pacientului?
2. Un pacient a venit la medic cu plângeri de urinare frecventă și un sentiment constant de sete. Examinarea a observat o creștere a volumului zilnic de urină cu o scădere bruscă a densității acesteia. Analiza a arătat că nivelul de insulină a fost în limitele normale, dar a fost relevată o creștere a conținutului de hormon responsabil cu reabsorbția apei. Care este cauza poliuriei la acest pacient? Pentru a răspunde la o întrebare:
a) denumește acest hormon;
b) enumeraţi stimulii care provoacă secreţia acestuia;
c) numiți tipurile de receptori pentru acest hormon și locațiile acestora;
d) dați schema de transmitere a semnalului acestui hormon în rinichi;
e) descrie efectele hormonului în țesuturile țintă;
f) Dați o diagramă a reglarii secreției acestui hormon.
3. Un bărbat de 48 de ani a consultat un medic cu plângeri de slăbiciune, dureri musculare, constipație și accese recente de durere în spate și în timpul urinării. În timpul examinării, pacientul a fost diagnosticat cu hiperparatiroidism primar ca urmare a dezvoltării unei tumori benigne hipersecretorii a lobului stâng al glandei paratiroide.
Explicați de ce se poate dezvolta nefrolitiaza în hiperparatiroidism? Când rezolvați problema, utilizați diagramele pentru sarcina 5.
4. O femeie a apelat la medic pediatru cu plângeri că fiul ei de doi ani a devenit capricios, iritabil și nu a mâncat bine. A apărut transpirație, scaunul era instabil. La examinare s-a stabilit complianța oaselor craniului, deformarea toracelui. LA analiza biochimică nivelul sanguin al calciului total - 1,57 mmol / l (normă 2,3-2,8 mmol / l). Ghiciți de ce boală suferă acest copil. Pentru asta:
a) comparați cantitatea de calciu total din sângele unui copil cu norma, dați un nume acestei afecțiuni;
b) indicați posibilele cauze care pot duce la dezvoltarea acestei boli;
c) dați schema de sinteză a reglării hormonale a metabolismului calciului;
d) indicați mecanismul de acțiune al hormonilor, cauzele și consecințele insuficienței lor în organism;
5. Studiați diagrama:
Cauzele și consecințele hipoparatiroidismului (Fig. 11.24). Faceți diagrame similare pentru:
a) hiperparatiroidism;
b) rahitism
 Orez. 11.24. Cauzele și consecințele hipoparatiroidismului
Orez. 11.24. Cauzele și consecințele hipoparatiroidismului


