31.03.2019
İnflamasyonun klinik ve laboratuvar belirtileri. Lokal inflamasyon belirtileri
Korkmuş bir çocuk, küçük yaşlardan itibaren beyaz önlüklü bir amcasının veya teyzesinin ofisinde şu tuhaf kelimeleri duyar: rinit, sinüzit veya örneğin bademcik iltihabı. Yaşla birlikte, sonu “it” ile biten gizemli teşhisler hemen hemen her insanın tıbbi kayıtlarına eklenir. Tüm bu “it” in tek bir anlama geldiğini biliyor muydunuz: şu veya bu organın iltihaplanması. Doktor, nefritin böbreklerinizin nezle olduğu, artritin ise ekleminizin ağrıdığı anlamına geldiğini söylüyor. Kesinlikle insan vücudundaki her yapı iltihaplanma sürecinden etkilenebilir. Ve vücudunuz size bunu oldukça erken ve aktif bir şekilde anlatmaya başlar. Herhangi bir iltihabın mutlaka görülmesi gereken beş belirtisini öğrenin, böylece tanıyabilirsiniz alarmlar Vücudunuzun.
Vücudunuzdaki beş karakteristik inflamasyon belirtisi
Eski zamanlarda, sadece özel değil, beş iltihaplanma belirtisi tespit edildi. Tıbbi cihazlar Teşhis için hayır yoktu ve basit bir kan testinden bile söz edilmiyordu.
Bununla birlikte, insanlar her zaman hasta olmuştur ve yalnızca hastalığı doğru bir şekilde tanımlamayı değil, aynı zamanda onu tedavi etmeyi de başaran doktorlar her zaman olmuştur.
Enflamasyonun bu beş karakteristik belirtisini bilerek siz de herhangi bir ek yönteme gerek kalmadan hastalığınızı belirleyebilirsiniz:
1. Tümör - şişlik
İnsan vücudundaki herhangi bir inflamatuar süreç, provoke edici bir ajanın içine girmesiyle başlar. Bir bakteri, virüs, yabancı cisim olabilir. Kimyasal madde veya başka bir “provokatör”. Vücut, beklenmedik konuğa hemen tepki verir ve korumalarını ona gönderir - ondan hiç memnun olmayan ve anında savaşa giren lökosit hücreleri. Eksüda birikiminin olduğu yerde bir sızıntı oluşur. İltihaplanma sürecinin olduğu bölgede mutlaka şişlik göreceksiniz.
2. Rubor – kızarıklık
Vücuttaki hasarlı hücrelerin ölümü sonucunda özel maddeler salınır - inflamatuar aracılar. Esas olarak çevre dokularda bulunan kan damarları tarafından reaksiyona sokulurlar. Kan akışını yavaşlatmak için genişlerler, kanla dolarlar ve sonuçta kızarıklık olur. Yani kızarıklık başka bir şey Karakteristik özellik iltihaplanma.
3. Kalor – sıcaklık artışı
Vazodilatasyon herhangi bir inflamatuar sürecin önemli bir bileşenidir, çünkü savaş alanını temizlemek de gereklidir. Kan akışı, oksijeni ve gerekli yapı malzemelerini iltihap bölgesine getirir ve tüm çürüme ürünlerini uzaklaştırır. Bu kadar aktif çalışma sonucunda iltihaplı bölge çok ısınır. Enflamasyonun üçüncü zorunlu belirtisi sıcaklıktaki artıştır.
4. Dolor – acı
Vücudun herhangi bir yerinde zararlıya karşı etkin bir mücadele olduğunun beyne iletilmesi ve en iyi yol bu, parlak ve etkileyici bir sinyalle yapılır. Bu amaçla vücudumuzun hemen her yerinde özel çanlar yani sinir uçları bulunur. Ağrı beyin için en iyi sinyaldir, bunun sonucunda kişi vücudunun belirli bir bölgesinde bir şeylerin ters gittiğini anlar.
5. Functio laesa – işlev bozukluğu
Yukarıdaki iltihaplanma belirtileri bir tane daha ekliyor önemli semptom Bu patolojik süreç, etkilenen yapının işlev bozukluğudur. Savaş alanında hayat her zamanki gibi devam edemez. Bu nedenle inflamasyona her zaman etkilenen organın fonksiyonel başarısızlığı eşlik eder. Bazı durumlarda bu durum vücut için çok tehlikeli olabilir; örneğin; inflamatuar süreçler kalp, böbrekler veya diğer hayati organlar.
Eğer inflamasyonun bu beş belirtisini fark ederseniz acilen bir doktora görünmeniz gerekir.
Enflamatuar sürecin olduğunu unutmayın. ciddi patoloji kendi başınıza tedavi edilemez. Nitelikli bir uzmana danışmak ve etkili bir tedavi rejiminin seçilmesi, vücudunuzun iltihapla mücadelede kazanan olmasına yardımcı olacaktır.
Enflamasyon(iltihap, enlemden itibaren ateşli- vücudun evrim sürecinde oluşan yerel hasara tepkisi, değişiklik, mikro dolaşım bozuklukları (eksüdasyon ve göç ile) ve çoğalma fenomeni ile karakterize edilen, hasar veren ajanın lokalizasyonunu, yok edilmesini ve uzaklaştırılmasını ve aynı zamanda restorasyonunu amaçlayan ( veya bundan zarar gören dokuların değiştirilmesi.
Değişiklik, mikro dolaşım bozuklukları (eksüdasyon ve göç ile) ve proliferasyon, inflamasyonun ana bileşenleri veya iç belirtileridir. Ek olarak, inflamasyonun odağı beş dış (yerel) belirti ile karakterize edilir: kızarıklık (Rubor),şişme (tümör), artan sıcaklık veya ateş (kalori), ağrı veya ağrı (dolor), işlev bozukluğu işlev laesa)(Şekil 10-1). Bu işaretler özellikle inflamasyonun odağı dış deride olduğunda iyi tanımlanır.
Enflamasyon sadece lokal olarak değil, aynı zamanda ciddiyeti sürecin yoğunluğuna ve kapsamına bağlı olan genel semptomlarla da kendini gösterebilir.
Enflamasyonun genel belirtileri arasında ateş, lökositoz gelişimi ile hematopoietik doku reaksiyonları, eritrosit sedimantasyon hızının artması, metabolizmanın hızlanması, immünolojik reaktivitenin değişmesi ve vücudun zehirlenmesi yer alır.
Enflamasyon en yaygın tipik patolojik süreçlerden biridir. Aynı zamanda, organizmanın kendi kısmına zarar verme pahasına tüm organizmayı korumanın bir yolu olarak evrimsel olarak oluşmuş önemli bir koruyucu-adaptif reaksiyonu temsil eder. Enflamasyonun yardımıyla sağlıyoruz
Pirinç. 10-1.İltihap doktrininin eski temelleri (Wiloughby ve Spectre'ye göre). Isı, kızarıklık, şişlik ve ağrı fonksiyon bozukluklarına neden olur
inflamatuar ajanın ve/veya onun etkisi altında hasar gören dokunun lokalizasyonu ve ortadan kaldırılması söz konusudur.
10.1. TEMEL ENFLAMASYON KURAMLARI
İnsan hastalıklarının çoğunun altında yatan patolojik bir süreç olarak inflamasyon, hastalık çalışmalarının tarihi boyunca patolojide merkezi bir sorun olmuştur. Enflamasyonun özüne ilişkin fikirlerin oluşumu, uzun zamandır hastalığın doğası hakkındaki görüşlerin gelişmesiyle yakından bağlantılıdır.
İnflamasyon çalışmasının ilk aşamalarında R. Virchow (1858) ve J. Conheim'ın (1885) teorileri hakim oldu. Buna göre hücresel(cazibe, beslenme) R. Virchow'un teorileri, inflamasyon, tahrişe yanıt olarak hücresel elemanların yaşamsal fonksiyonlarının bozulması, gelişmesidir. distrofik değişiklikler hücrelerde protein taneleri ve topakların ortaya çıkması, besin maddesinin kanın sıvı kısmından çekilmesi (çekilmesi) ve bunun sonucunda iltihaplanmanın özelliği olan sitoplazmanın bulanık şişmesinden oluşur.
 Pirinç. 10-2. I.I. Mechnikov (1845-1916). Ödüllü Nobel Ödülü 1908
Pirinç. 10-2. I.I. Mechnikov (1845-1916). Ödüllü Nobel Ödülü 1908
İle Yu Konheim'ın vasküler teorisi inflamasyon, eksüdasyona ve göçe yol açan ve ardından hücresel (distrofik) değişikliklere neden olan dolaşım bozuklukları ile karakterize edilir. Bununla birlikte, daha sonra belirlendiği gibi, inflamasyon, vasküler ve doku fenomenlerinin eşzamanlı gelişimi ve yakın ilişkisi ile karakterize edilir. Yu Konheim, damar tonusu ve kan akışındaki eksüdasyon ve göçle birlikte tüm değişiklikleri ayrıntılı olarak tanımlayan ilk kişiydi.
Enflamasyon çalışmalarına özellikle önemli bir katkı yapılmıştır. I.I. Mechnikov(1892) (Şekil 10-2). Karşılaştırmalı inflamasyon patolojisinin, hücresel ve humoral bağışıklık teorisinin, fagositoz doktrininin temelini attı ve formüle etti. biyolojik(fagositik) teori iltihaplanma. Buna göre, iltihaplanma sürecinin ana ve merkezi bağlantısı, bakteriler de dahil olmak üzere yabancı parçacıkların fagositler tarafından emilmesidir.
Analiz ettikten sonra inflamatuar reaksiyon en çeşitli türler farklı basamaklarda duran hayvanlar Evrimsel gelişme, I.I. Mechnikov bunun komplikasyonunu filogenezde gösterdi. Filogenezin erken aşamalarında (en basit tek hücreli organizmalarda), yabancı maddelerden korunma fagositoz yoluyla gerçekleştirilir. Aynı zamanda en basit organizmalarda da bazı değişim olayları meydana gelir. sen Çok hücreli organizmalar Vasküler sistem olmadan inflamasyon, hasar bölgesi çevresinde fagositik amipoid hücrelerin (amebosit) birikmesiyle kendini gösterir. Yüksek omurgasızlarda iltihaplanma, hasar bölgesinde kan hücrelerinin - lenfohematositlerin - birikmesiyle ifade edilir. Dolaşım sisteminin (açık tip) varlığına rağmen, omurgalılara özgü vasküler reaksiyonlar meydana gelmez. Aynı zamanda, evrimsel gelişimin bu aşamasında zaten çoğalma fenomeni tespit ediliyor. Omurgalılarda ve insanlarda inflamatuar reaksiyon, eksüdasyon ve göç ile birlikte vasküler olaylar nedeniyle önemli ölçüde karmaşıktır. gergin sistem.
Giderek daha karmaşık koruyucu ve koruyucu önlemlerin dahil olduğunu gösteren karşılaştırmalı patolojik çalışmaların sonuçları
Enflamatuar süreç geliştikçe adaptif fenomenler, I.I. Mechnikov, tüm organizmanın koruyucu-adaptif bir reaksiyonu olarak inflamasyonun önemini gösterecek. I.I. Mechnikov, mekanizmalarında fagositozun da önemli bir rol oynadığı iltihaplanma ve bağışıklık arasında bağlantı kuran ilk kişiydi.
Bu yüzyılın ilk yarısında inflamasyon çalışmaları biyofiziksel ve biyokimyasal yöntemlerin ortaya çıkışıyla bağlantılı olarak gelişmeye başladı. Enflamatuar odağın kapsamlı fiziksel ve kimyasal çalışmalarının sonuçları izin verdi G. Schade(1923) aday göster fiziko-kimyasal, veya moleküler patolojik, hipotez iltihaplanma, buna göre bu sürecin patogenezinde önde gelen faktör, lokal bir metabolik bozukluktur, asidozun gelişmesine ve dokuda ozmotik basınçta bir artışa yol açar, bu da iltihaplanma sırasında dolaşım bozukluklarının ve hücresel olayların temelini oluşturur. Bununla birlikte, yakın zamanda, bir iltihaplanma odağının karakteristik özelliği olan fizikokimyasal değişikliklerin, halihazırda gelişmiş bir inflamatuar reaksiyon sırasında tespit edildiği ve bu nedenle, vasküler ve hücresel fenomenler için bir tetikleyici olamayacağı gösterilmiştir (D.E. Alpern, 1927). Bazı inflamasyon türlerinde (örneğin alerjik) asidoz gelişmez veya zayıf bir şekilde ifade edilir (A.D. Ado, 1935).
Kapsamlı patokimyasal çalışmaların sonuçlarına dayanarak V. Menkin(1938) başrolü tamamladı biyokimyasal değişiklikler inflamasyonun patogenezinde. Çeşitli inflamatuar olaylara aracılık eden, nekrosin, eksüdin, lökotoksin, pireksin, vb. gibi inflamasyona özgü bir dizi madde tanımlamıştır. O zamandan bu yana tespit edildiği gibi, bu rol aslında fizyolojik olarak aktif maddeler - inflamatuar aracılar tarafından oynanmaktadır ve bunların çoğu artık araştırılmıştır. tanımlanmış ve yeterince araştırılmıştır. Bununla birlikte, inflamasyonun tüm patogenezini yalnızca bireysel medyatörlerin izole edilmiş etkilerine indirgemek yanlış olacaktır.
Sinir sisteminin inflamasyon patogenezine katılımının kurulduğu bu yüzyılın başından bu yana, sinir faktörüne - refleks mekanizmalarına, sinir sisteminin trofik fonksiyonunun bozulmasına birincil rol veren hipotezler ortaya çıkmıştır. Evet, göre G. Ricker'in vazomotor (nörovasküler) teorisi(1924) inflamasyonun birincil nedeni vazomotor sinirlerin işlev bozukluğudur. Dereceye bağlı olarak
Tahrişleri ve bunun sonucunda gelişen vasküler reaksiyon, doku ve kan arasında, inflamatuar hiperemi ve stazın ortaya çıkmasına yol açan ve buna bağlı olarak metabolik bozuklukların yoğunluğunu ve doğasını belirleyen bir ilişki gelişir. Bununla birlikte, tüm inflamatuar olaylar dizisi yalnızca kan damarlarının reaksiyonuyla açıklanamaz. mikro damar sistemi.
D.E. Alpern(1959) inflamasyonda lokal ve genelin birliği konusuna özel önem vermiştir. vücut reaktivitesi Bu sürecin geliştirilmesinde. Enflamasyonun özünü, vücudun zararlı bir maddenin etkisine verdiği genel bir tepki olarak vurguladı. Bu haklı nöro-refleks devresiçeşitli vasküler doku reaksiyonlarının sinir ve humoral (esas olarak hipofiz-adrenal) sistemler tarafından düzenlendiği inflamasyonun patogenezi.
10.2. İNFLAMAN ETİYOLOJİSİ
Çoğundan beri yaygın neden iltihaplar bulaşıcı ajanlardır; etiyolojiye göre ayrılırlar: bulaşıcı (septik) Ve bulaşıcı olmayan (aseptik).
10.3. ENFLAMASYONUN DENEYSEL ÜRETİMİ
Kural olarak deney, kimyasal ajanların neden olduğu aseptik inflamasyon modellerini kullanır. Geleneksel
Bunlar, akut pürülan inflamasyonun gelişmesine yol açan tahriş edici flogojenlerdir: terebentin, kroton yağı, lapis, ksilen, formaldehit vb. Kaolin gibi kimyasal açıdan kayıtsız maddeler de kullanılır. Eksüdatif olayların baskın olduğu aseptik inflamasyonu yeniden üretmek için dekstran kullanılır. Son yıllarda en yaygın kullanılan aseptik ajan, İrlanda yosunundan izole edilen sülfatlanmış bir glikozaminoglikan olan carageenan'dır. Chondrus.
Lezyonda flogojenin daha fazla bulunmasını önlemek için termal veya radyasyon (ultraviyole ışınlar, iyonlaştırıcı radyasyon) inflamasyon modelleri kullanılır.
Hipererjik inflamasyon sıklıkla ani veya gecikmiş alerjik reaksiyonların tipine göre modellenir. Bu iltihaplanma, duyarlı organizmanın artan reaktivitesinden kaynaklanan hızlı seyri ve sık görülen nekroz fenomeni nedeniyle ilgi çekicidir.
Patofizyolojik çalışmalarda enfeksiyöz inflamasyon modelleri nispeten nadiren kullanılmaktadır. Bunun nedeni, mikroorganizmaların daha derin etkileşimi nedeniyle bu tür inflamasyonu modellemenin zorluklarından kaynaklanmaktadır. bağışıklık sistemleri ah ortaya çıkışı ve seyri sürecinde. Şu anda bulaşıcı ajanlar esas olarak kullanılan koli, stafilokoklar, Pseudomonas aeruginosa, çünkü bunlar cerahatli inflamatuar hastalıkların en yaygın nedenleridir ve bulaşıcı komplikasyonlar insanlarda. Enfeksiyöz inflamasyona yakın modeller, örneğin dışkı peritoniti gibi modellerdir.
Enflamasyonun odağındaki vasküler olayları incelemek için en uygun nesne kurbağanın mezenteridir (Y. Konheim'ın deneyi), tavşanın kulağı (şeffaf oda yöntemi - E.L. Clark ve E.R. Clark), şişirilmiş bir hamsterin yanak kesesidir. hava ile (G. Selye); Enflamatuar odağın hücresel dinamiklerini incelemek için, eksüdanın mümkün olduğu durumlarda “deri penceresi” yönteminin (J. Riback) veya deri altı “hava kesesi” (G. Selye), peritonit, plörezi gibi modellerin kullanılması tavsiye edilir. kolayca toplanır.
10.4. YANLIŞIN PATOJENİZİ
Herhangi bir iltihaplanma 3 ana bileşenden oluşur:
Değişiklik - hücrelere ve dokulara zarar;
Eksüdasyon ve göç ile mikro dolaşım bozukluğu;
Proliferasyon - hücre çoğalması ve doku bütünlüğünün restorasyonu.
Buna göre şunları ayırt ederler: alternatif inflamasyon, eksüdatif inflamasyon, proliferatif (üretken) inflamasyon ve - ayrı bir değişken olarak - granülomatöz inflamasyon.
İnflamasyonun patogenezi, yukarıdaki fenomeni oluşturan çok sayıda inflamatuar olgunun altında yatan nöral, humoral ve efektör mekanizmaların karmaşık bir kombinasyonudur (Şekil 10-3).
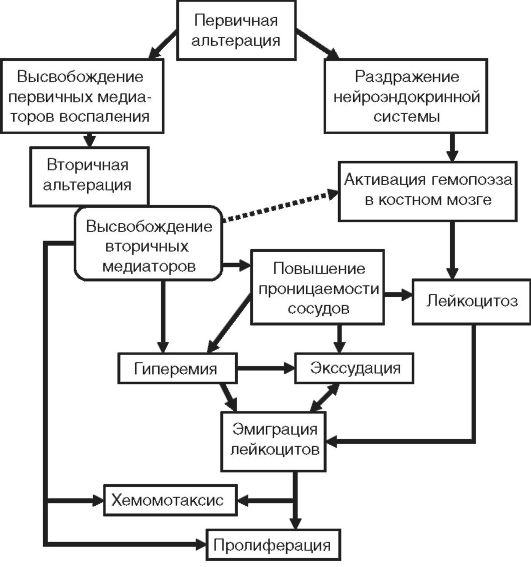 Pirinç. 10-3.İnflamasyonun patogenezinin genel şeması
Pirinç. 10-3.İnflamasyonun patogenezinin genel şeması
10.4.1. İnflamasyonun gelişiminde doku hasarının rolü
Değişiklik(değişiklik, enlemden itibaren başka bir şey- değiştirmek), veya distrofi, doku hasarı, beslenmesinin (trofizm) ve metabolizmasının, yapısının ve fonksiyonunun bozulması. Birincil ve ikincil değişiklikler vardır.
Birincil değişiklik inflamatuar ajanın kendisinin zarar verici etkilerinin bir sonucudur, dolayısıyla şiddeti, diğer şeylerin eşit olması (vücut reaktivitesi, lokalizasyon) flogogenin özelliklerine bağlıdır. Kesin olarak konuşursak, birincil değişiklik iltihaplanmanın bir bileşeni değildir, çünkü iltihaplanma, flogojenin neden olduğu hasara bir tepkidir; birincil değişikliğe. Aynı zamanda, pratik olarak birincil ve ikincil alternatif olguları birbirinden ayırmak zordur.
İkincil değişiklik hücre dışı olarak salınan lizozomal enzimlerin ve aktif oksijen metabolitlerinin bağ dokusu, mikrodamarlar ve kan üzerindeki etkisinin bir sonucudur. Kaynakları kısmen yerleşik hücreler olan aktifleştirilmiş göç etmiş ve dolaşımdaki fagositlerdir. Önceden indüklenmiş lökopenisi olan hayvanlarda iltihaplanma sırasında, değişiklik zayıf bir şekilde ifade edilir. Plazma komplemanının aktivasyonu sırasında oluşan C5b-C9 litik kompleksi ve doku sıvısı.
İkincil değişiklik, inflamatuar ajana bağlı değildir; lezyonda daha fazla flogogenin varlığı, gelişimi için gerekli değildir. Zararlı bir kaynağın halihazırda neden olduğu hasara karşı vücudun tepkisidir. Bu, flogojeni ve (veya) etkisi altında hasar gören dokuyu vücudun geri kalanından hızlı bir şekilde ayırmayı (lokalleştirmeyi) amaçlayan koruyucu-adaptif bir reaksiyon olarak inflamasyonun uygun ve gerekli bir bileşenidir. Hasar pahasına, diğer önemli koruyucu fenomenler elde edilir: lizozomal enzimlerin ve aktif oksijen metabolitlerinin daha belirgin bir mikrobisidal ve litik etkisi, çünkü sadece fagositlerde değil aynı zamanda hücre dışında da gerçekleştirilir; diğer inflamatuar aracıların ve hücrelerin katılımı, artan eksüdasyon, göç ve fagositoz. Sonuç olarak iltihaplanma süreci daha hızlı sona erer. Ancak, yalnızca belirli sınırlar dahilinde değişiklik yapılması tavsiye edilir. Örneğin sistemde bir dengesizlik varsa lizozomal proteinazlar -
inhibitörleri, nekrozun baskın olduğu aşırı değişiklik belirtilerine neden olur.
İnflamasyon sırasındaki alternatif olaylar şunları içerir: doku bozulması Ve gelişmiş metabolizma iltihaplı dokuda bir takım fiziko-kimyasal değişikliklere yol açan maddeler (“metabolik ateş”): asidik ürünlerin birikmesi (asidoz, veya H+-hiperionia), Ozmotik basınçta artış (ozmotik hipertansiyon, veya hiperozmi), kolloid-ozmotik veya onkotik basınçta artış (hiperonki).
Zarar veren maddenin gücüne, inflamasyonun yoğunluğuna ve lokalizasyonuna bağlı olarak morfolojik belirtiler Değişiklikler çok çeşitlidir: zar zor fark edilen yapısal ve işlevsel değişikliklerden, tamamen yıkıma kadar (nekrobiyoz) ve ölüm (nekroz) dokular ve hücreler. Hücre sitoplazmasının bulutlu şişmesi, protein olgusu, yağ ve diğer dejenerasyon türleri tespit edilir. Hücre zarlarının ve hücresel organellerin geçirgenliği keskin bir şekilde artar. Mitokondri, lizozomlar, ribozomlar ve endoplazmik retikulum gibi hücre içi yapılar da değişir. Mitokondri şişer veya küçülür ve kristaları yok olur. Geçirgenliğin artması ve lizozom membranlarındaki hasara, hücre içi yapıların tahrip edilmesinde rol oynayan çeşitli enzimlerin salınması eşlik eder. Sitoplazmada endoplazmik retikulum sarnıçlarının şekli ve boyutu değişir, veziküller, eşmerkezli yapılar vb. Kromatinin marjinal düzeni ve nükleer membrandaki hasar not edilir. Stromada nekroza kadar uzanan mukoid ve fibrinoid şişlikler, kollajen ve elastik liflerde çözünme gözlenir.
Enflamasyon sırasında artan metabolizma esas olarak karbonhidratlardan kaynaklanır. Başlangıçta hem oksidasyon hem de glikoliz artar. Bu fenomen karşılık gelen doku enzimlerinin aktivasyonuna dayanmaktadır. İltihaplı doku tarafından oksijen tüketimi gözle görülür şekilde artar. Lizozomal enzimleri karbonhidratları anaerobik olarak parçalayan lezyonda lökositlerin birikmesi ve ayrıca değişiklik sırasında mitokondri sayısındaki hasar ve azalma ile oksidasyon reaksiyonları gözle görülür şekilde zayıflar ve glikoliz artar. Buna göre, karbonhidratların parçalanması her zaman nihai ürünlere (karbon dioksit ve su) ulaşmaz. Solunum katsayısı azalır. Karbonhidrat metabolizmasının az oksitlenmiş ürünleri - laktik ve trikarboksilik asitler - dokuda birikir.
Ayrıca yağların, proteinlerin metabolizmasındaki bozukluklar ve nükleik asitlerin parçalanması nedeniyle yağ asitleri, keton cisimleri, polipeptitler, amino asitler, nükleotidler (ATP, adenilik asit) ve nükleosidlerin (adenosin) içeriği artar. lezyon. Sonuç olarak asidoz gelişir. Başlangıçta doku tampon sistemleri ve hızlandırılmış kan ve lenf akışı ile telafi edilir. Sen yoruldukça tampon sistemleri kan ve lenf akışının yavaşlaması ile asidoz artar ve telafi edilemez hale gelir. Dokudaki normal hidrojen iyonu konsantrasyonu 0,5?10-7 ise; pH 7.34'tür, iltihaplanma sırasında sırasıyla 25?10 -7 ve 5.6 ve daha düşük olabilir. Enflamatuar süreç ne kadar akut olursa asidoz da o kadar belirgin olur. Yani akut olarak cerahatli iltihaplanma PH 6,5-5,39, kronik pH ise 7,1-6,6'dır. Asidoz damar geçirgenliğinin arttırılmasında rol oynar. Lizozomal enzimlerin, özellikle bağ dokusu matrisinin karbonhidrat bileşenlerini parçalayan glikosidazların yıkıcı etkilerinin uygulanması için uygun koşullar yaratır.
H+-hiperionia ile birlikte lezyondaki diğer iyonların (potasyum, sodyum, kalsiyum iyonları) içeriği de artar. Bunun nedeni hücre tahribatı ve asidik ortamda tuzların artan ayrışmasıdır. Hücre dışı potasyum seviyesindeki hızlı artış nedeniyle potasyum ve kalsiyum iyonlarının oranı bozulur (dizyonia). Ca2+ iyonlarının homeostazisindeki değişiklikler, inflamasyon bölgesindeki hücre ölümünün altında yatan neden olabilir. Ca2+, gen aparatının yanı sıra membran ve hücresel enzim sistemleri arasındaki ikincil habercilerden biridir. Hücre içi Ca2 + seviyesindeki bir artış, mitokondriyal membranlar tarafından emilmesine ve ardından elektron solunum zincirinin bloke edilmesine yol açar. Artan hücre içi Ca2 + içeriği, lizozomal olmayan proteazları aktive ederek hücre iskeletinin parçalanmasına, enzimlerin, membranla ilişkili proteinlerin (iyon kanalları, taşıyıcılar, reseptörler, yapışma molekülleri) bozulmasına yol açar. Hücre dışı Ca2+ düzeyindeki azalmanın hücrenin hayatta kalması için önemli olmasına rağmen, bunun yeni büyümelerine engel olabileceği belirtilmektedir. Enflamasyon bölgesinde moleküler konsantrasyon artar, çünkü doku çürümesi ve artan metabolizma sürecinde büyük moleküller birçok küçük moleküle ayrılır. İyonik ve moleküler konsantrasyonlardaki artışa bağlı olarak hiperosmi gelişir. Yani, eğer hücreler arası sıvının depresyonu normalse
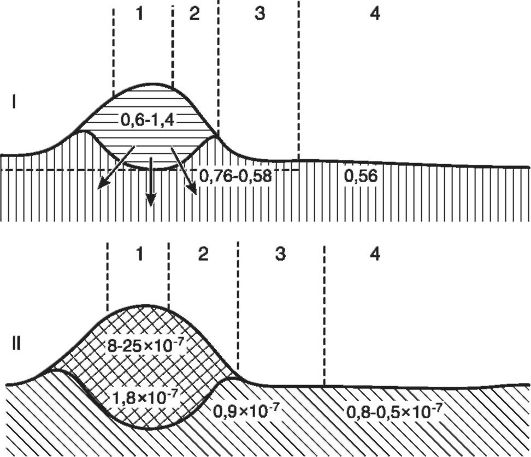 Pirinç. 10-4. Derinin inflamatuar şişmesi yoluyla bir kesitin şematik gösterimi: I - inflamasyonun farklı bölgelerindeki ozmotik basınçtaki (A°C) değişiklikler: 1 - inflamasyonun merkezi, 2 - bolluk bölgesi, 3 - belirgin ödem bölgesi, 4 - gizli ödem bölgesi; II - hidrojen iyonlarının konsantrasyonundaki değişiklikler: 1 - pürülan inflamasyonun merkezi, 2 - inflamatuar sızıntı bölgesi, 3 - periferik ödem bölgesi, 4 - geçiş bölgesi normal durum(Sade'ye göre)
Pirinç. 10-4. Derinin inflamatuar şişmesi yoluyla bir kesitin şematik gösterimi: I - inflamasyonun farklı bölgelerindeki ozmotik basınçtaki (A°C) değişiklikler: 1 - inflamasyonun merkezi, 2 - bolluk bölgesi, 3 - belirgin ödem bölgesi, 4 - gizli ödem bölgesi; II - hidrojen iyonlarının konsantrasyonundaki değişiklikler: 1 - pürülan inflamasyonun merkezi, 2 - inflamatuar sızıntı bölgesi, 3 - periferik ödem bölgesi, 4 - geçiş bölgesi normal durum(Sade'ye göre)
0,62°'dir, yani ozmotik basınç 8 atm'dir, daha sonra cerahatli iltihaplanma ile sırasıyla 0,80° ve 19 atm'dir (Şekil 10-4).
İltihaplı dokudaki fizikokimyasal değişikliklerin bir sonucu olarak, proteinlerin polipeptitlere ve amino asitlere parçalanması ve ikincisinin konsantrasyonunun artması, kolloidlerin dispersiyonunda ve bunların su çekme ve tutma yeteneklerinde bir artış meydana gelir. Hyperonkia gelişir. Ozmotik ve onkotik basınçtaki değişiklikler eksüdasyonda ve buna bağlı olarak inflamatuar ödemde önemli bir faktördür.
10.4.2. Enflamatuar aracılar
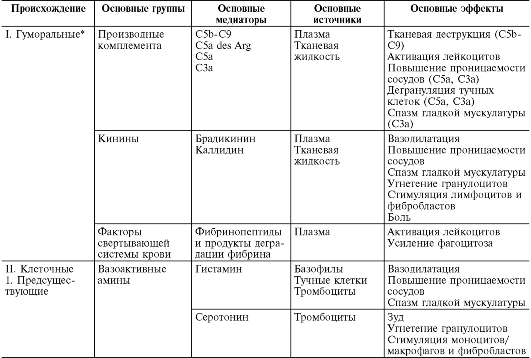
Birincil ve ikincil değişim sırasında büyük miktarlarda çeşitli inflamasyon aracıları ve modülatörleri salınır (Tablo 10-1).
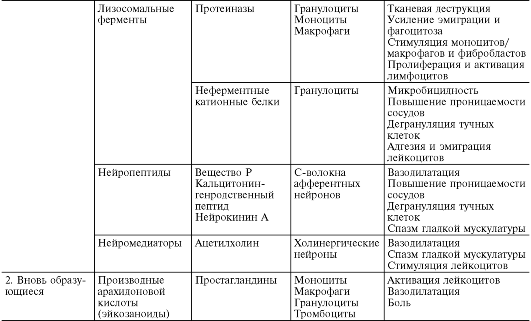
Masa 10-1. Enflamatuar aracılar
 *Hepsi önceden mevcut.
*Hepsi önceden mevcut.
Enflamatuar aracılar, örneğin artan damar geçirgenliği, göç vb. Gibi çeşitli inflamatuar olayların ortaya çıkmasına ve desteklenmesine neden olan biyolojik olarak aktif maddeler olarak anlaşılmaktadır. Normal yaşam sırasında, fizyolojik konsantrasyonlarda bulunan bu aynı maddeler, hücrelerin veya dokuların işlevlerinin düzenlenmesinden sorumludur. Enflamasyon sırasında salınır Büyük miktarlar, yeni bir kalite kazanıyorlar - iltihaplanma aracıları. Hemen hemen tüm aracılar aynı zamanda inflamasyonun modülatörleridir; inflamatuar olayların şiddetini artırabilir veya azaltabilir. Buna göre, bir aracının etkisi katkı (ilave), güçlendirici (sinerjistik) ve zayıflatıcı (antagonistik) olabilir ve aracıların etkileşimi, sentez, salgı veya etkileri düzeyinde mümkündür. Aracı bağlantı inflamasyonun patogenezinde ana bağlantıdır. Pek çok hücrenin etkileşimini (enflamasyonun efektörleri, inflamasyon bölgesindeki hücresel fazların değişimi) koordine eder.
Arabulucular Kökenlerine göre iltihaplar ikiye ayrılır: mizahi(sıvı ortamda oluşur - kan plazması ve doku sıvısı) ve hücresel. Tüm humoral aracılar önceden mevcuttur, onlar. ikincisinin etkinleştirilmesinden önce öncekiler biçiminde mevcuttur; bunlar kompleman türevlerini, kininleri ve kan pıhtılaşma faktörlerini içerir. Arasında hücresel aracılarönceden var olanı vurgula(aktif olmayan bir durumda hücrelerde biriktirilir) - vazoaktif aminler, lizozomal enzimler, nöropeptitler ve yeni oluşmuş(yani uyarı üzerine hücreler tarafından üretilir) - eikosanoidler, sitokinler, lenfokinler, aktif oksijen metabolitleri.
Hücresel aracıların ana kaynakları şunlardır:
1. Nötrofiller, katyonik proteinler salgılayan, trombositlerden ve mast hücrelerinden biyojen aminlerin salınımını uyaran, histamin salınım inhibitörü ve histaminaz içeren. Nötrofil proteazlar kininlerin ve aktif kompleman fragmanlarının (C3a, C3b) oluşumunda rol oynar. Nötrofiller prostaglandin (PG) E2 ve diğer eikosanoidleri üretir. Nötrofil enzimleri hem kanın pıhtılaşmasını hem de fibrinolizi aktive eder.
2. Makrofajlar Bradikinini inaktive eden ve anjiyotensin I'i anjiyotensin P'ye dönüştüren anjiyotensin konvertaz salgılar. PGE2'nin yanı sıra tromboksanlar ve lösemi sentezlerler.
kotrienler (LT). PGE2, hücresel inflamatuar aracıların salınmasını önlediğinden ve trombosit agregasyonunu inhibe ettiğinden, makrofajlar, proinflamatuarın yanı sıra antiinflamatuar bir fonksiyona da sahiptir. Makrofajlar çeşitli tamamlayıcı bileşenleri sentezler ve pıhtılaşma ve fibrinolitik aktiviteye sahiptir.
3. Eozinofiller inflamasyonun negatif modülatörleri olarak görev yapar. Sitotoksik bir işlev gerçekleştiren ve heparini nötralize eden ana alkalin protein olan histaminaz, kininaz, lökotrien C ve D'yi parçalayan enzimler (lisofosfalipaz, arilsülfataz B, fosfolipaz D) içerirler. Böylece eozinofil enzimleri mast hücre ürünlerini nötralize eder ve hücresel kalıntıların yok edilmesini teşvik eder. Eozinofiller, mast hücreleri tarafından salgılanan granülleri fagosite ederek histamin salınımını baskılar. Özellikle ilgi çekici olan, eozinofillerde lisofosfolipazın varlığıdır. Substratı, ölü hücrelerin zarlarında bulunan kısmen parçalanmış fosfolipitlerdir. Lisofosfolipaz, fosfolipidlerden serbest yağ asitlerini serbest bırakarak oluşumunu teşvik eder. arakidonik asit.
4. Mast hücreleri ve bazofiller histamin ve serotonin, heparin, nötrofil ve eozinofil kemotaksis faktörleri, trombosit aktive edici faktör, proteolitik enzimler salgılarlar, peroksidaz, süperoksit ve hidrojen peroksitin yanı sıra kininojeni kinine dönüştüren proteaz üretirler.
5. Trombositler büyüme ve pıhtılaşma faktörlerini, vazoaktif aminleri ve lipitleri, nötr ve asit hidrolazları salgılarlar.
Kompleman türevleri(Şekil 10-5) inflamasyonun humoral aracılarının en önemlileridir. Kompleman aktivasyonu sırasında oluşan yaklaşık 20 farklı protein arasında C5a, C3a, C3b ve C5b-C9 kompleksinin fragmanları doğrudan inflamasyonla ilişkilidir:
C5a ve C3a aracılardır akut inflamasyon ve anafilatoksinler (yani mast hücrelerinden histamin kurtarıcılar), böylece kılcal geçirgenliği hem doğrudan hem de dolaylı olarak histamin yoluyla arttırırlar (Şekil 10-6);
C5a des Arg ve C3a, karboksipeptidaz N'nin etkisi altında plazma ve doku sıvısında C5a'dan oluşur ve postkapiller venüllerin geçirgenliğini arttırır. Etki C5a des Arg
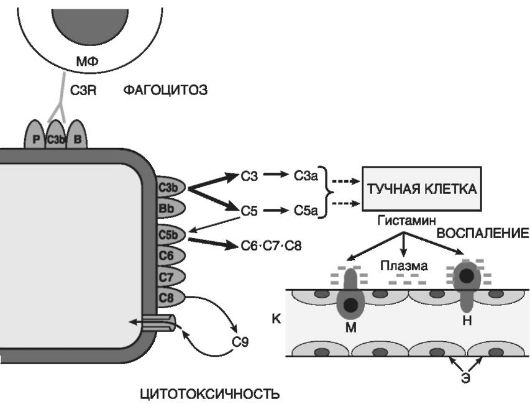 Pirinç. 10-5. Kompleman sistemi bileşenleri: C3b, C5b - membranla ilişkili C3 ve C5 parçaları; C3a ve C5a sırasıyla C3 ve C5'ten ayrılan peptitlerdir; C6-C8 - membran saldırı kompleksinin bileşenleri; C9 - membranda polimerize olan protein; Bb - membranla ilişkili protein B'nin fragmanı; oklar - reaksiyonun kademeli yükseltici bileşenleri; MF - makrofaj; C3R - tamamlayıcı bileşen C3b'ye yönelik reseptör; K - kılcal; E - kılcal damarın endotel astarı; N ve M - nötrofil ve monosit diapedezi
Pirinç. 10-5. Kompleman sistemi bileşenleri: C3b, C5b - membranla ilişkili C3 ve C5 parçaları; C3a ve C5a sırasıyla C3 ve C5'ten ayrılan peptitlerdir; C6-C8 - membran saldırı kompleksinin bileşenleri; C9 - membranda polimerize olan protein; Bb - membranla ilişkili protein B'nin fragmanı; oklar - reaksiyonun kademeli yükseltici bileşenleri; MF - makrofaj; C3R - tamamlayıcı bileşen C3b'ye yönelik reseptör; K - kılcal; E - kılcal damarın endotel astarı; N ve M - nötrofil ve monosit diapedezi
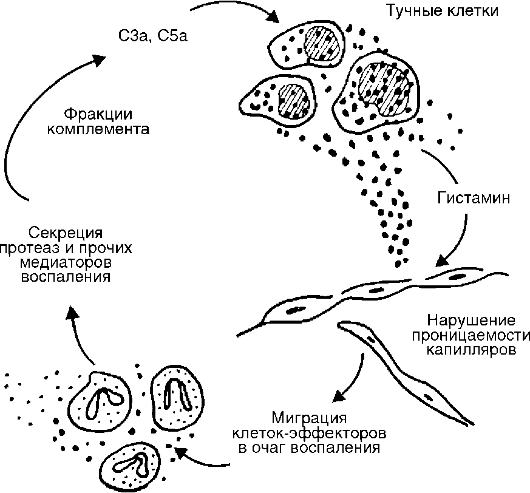 Pirinç. 10-6. Akut inflamasyon bölgesindeki kompleman ve mast hücreleri arasındaki ilişki
Pirinç. 10-6. Akut inflamasyon bölgesindeki kompleman ve mast hücreleri arasındaki ilişki
histamin ile ilişkili değildir ancak nötrofile bağımlıdır; polimorfonükleer granülositlerden - lizozomal enzimler ve enzimatik olmayan katyonik proteinler, aktif oksijen metabolitlerinden salınan geçirgenlik faktörleri nedeniyle gerçekleştirilir. Ayrıca C5a ve C5a des Arg nötrofilleri çeker. Bunun tersine, C3a'nın neredeyse hiç kemotaktik özelliği yoktur;
C3b patojenik ajanı opsonize eder ve buna göre immün yapışmayı ve fagositozu destekler;
C5b-C9 kompleksi, mikroorganizmaların ve patolojik olarak değiştirilmiş hücrelerin parçalanmasından sorumludur.
Kompleman kaynağı kan plazması ve daha az oranda doku sıvısıdır. Plazma komplemanının dokuya girişinin artması eksüdasyonun önemli amaçlarından biridir. Aktif kompleman bileşenleri sadece histamin değil aynı zamanda interlökin (IL) 1, prostaglandinler, lökotrienler, trombosit aktive edici faktör de salgılar ve prostaglandinler ve P maddesi ile sinerjistik olarak etkileşime girer.
Kininler- Plazmadaki (bradikinin) ve doku sıvısındaki (kallidin) kallikreinlerin etkisi altında kininojenlerden (a 2-globulinler) oluşan vazoaktif peptitler. Kallikrein-kinin sisteminin aktivasyonunu tetikleyen faktör, doku hasarı sırasında prekallikreinleri kallikreinlere dönüştüren Hageman faktörünün (XII) aktivasyonudur. Faktör XII kanda bulunur ve negatif yüklü yüzeylere afinitesi vardır. Kanın sıvı fazında kendiliğinden iki parçaya ayrışır: HPa - enzimatik olarak aktif bir parça ve HPb. XIIa, yabancı bir maddenin (flogojen) yüzeyine adsorbe edilir ve burada stabilize edilir. Substratı CP faktörünün kendisi ve başka bir protein olan prekallekrein olan proteolitik aktiviteye sahiptir. Prekallikrein daha sonra CPA'nın etkisi altında proteaz kallikreine dönüştürülür. Kallikrein, CP faktöründen CN oluşumunu keskin bir şekilde arttırır ve aynı zamanda yüksek moleküler ağırlıklı kininojen (HMK) adı verilen yeni bir substrat üzerinde etki eder. Kallikreinin etkisi altında, inflamasyonun ana aracılarından biri olan ICH'den bradikinin oluşur. Bradikinin vasküler endotele etki ederek vasküler endotel hücrelerinin kenarlarının "açılmasına" neden olur ve böylece kan plazmasının iltihap bölgesine giden yolunu açar. Böylece bu sistem yabancı bir cismi negatif yüklü olmasıyla tespit eder.
yüzeyler. Kendi hücrelerinin yüzeyleri, CPA'yı adsorbe etmeyecek, onu stabilize etmeyecek ve dolayısıyla başka bir olay zincirine neden olmayacak şekilde tasarlanmıştır. Bu, "kendine ait olanı" "kendine ait olmayan"dan ayırmanın en basit ve en ilkel yoludur.
Kininler arterioler dilatasyona aracılık eder ve endotel hücrelerini kasarak venüler geçirgenliği arttırır. Damarların düz kaslarını kasarlar ve intrakapiller ve venöz basıncı arttırırlar, nötrofillerin göçünü engellerler, makrofajların dağılımını düzenlerler, T lenfositlerin göçünü ve mitogenezini ve lenfokinlerin salgılanmasını uyarırlar. Ek olarak fibroblast proliferasyonunu ve kollajen sentezini arttırırlar ve bu nedenle kronik inflamasyondaki onarıcı olaylarda önemlidirler. Kininlerin en önemli etkilerinden biri, duyusal sinirlerin uçlarını tahriş ederek inflamatuar ağrının oluşmasına neden olan doğal yetenekleridir. Kininler, mast hücrelerinden histamin salınımını ve birçok hücre tipi tarafından prostaglandinlerin sentezini arttırır, bu nedenle ana etkilerinden bazıları - vazodilatasyon, düz kas kasılması, ağrı - diğer aracıların, özellikle prostaglandinlerin salınımıyla ilişkilidir.
Hageman faktörünün aktivasyonu sadece kinin oluşum sürecini değil aynı zamanda kan pıhtılaşmasını ve fibrinolizi de tetikler. Bu durumda güçlü hemattraktanlar olan fibrinopeptidler ve fibrin bozunma ürünleri gibi aracılar oluşur.
Eikosanoidler(Şekil 10-7), lezyonda uzun süreli üretimleri ve enflamasyonun temel olayı olan lökosit infiltrasyonu ile yakın bağlantılarının yanı sıra inhibitörlerin güçlü anti-inflamatuar etkisi ile kanıtlandığı gibi, inflamatuar reaksiyonun önemli bir aracısıdır. onların sentezi. Enflamasyon bölgesinde, eikosanoidlerin ana üreticileri monositler ve makrofajlardır, ancak bunlar, ikincisinin uyarılması üzerine hemen hemen tüm çekirdekli hücre türleri tarafından oluşturulmaktadır. Enflamasyon bölgesinde baskın olan eikosanoidler şunlardır: prostaglandinler(PGE2), lökotrienler(LTB4) ve 5-hidroperoksieikosatetraenoik asit(5-HPETE). Daha küçük miktarlarda da olsa tromboksan da oluşur. 1(TxA 2), PGF 2a, PGD 2, prostasiklin (PGI 2), LTC 4, LTD 4, LTE 4, diğer HPETE. Eikosanoidlerin ana etkisi lökositler üzerindeki etkileridir; Güçlü hemattraktanlar olarak lökosit infiltrasyonunun kendi kendini sürdürme mekanizmalarında önemli bir rol oynarlar.
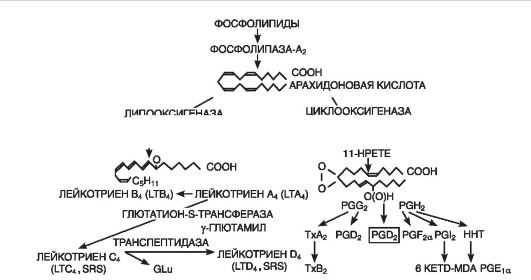
Pirinç. 10-7. Hücre zarından lökotrienlerin ve prostaglandinlerin oluşumu (D. Gemsa ve diğerleri, 1981'e göre): Tx - tromboksan; PG (prostaglandin)- prostaglandin; LT (lökotrien)- lökotrien; HPETE (hidroksiperoksi-eikosatetranoik asit)- hidroperoksieikosatetraenoik asit
Prostaglandinler Kendileri damar geçirgenliğini arttırmazlar, ancak güçlü vazodilatörler olduklarından hiperemiyi ve dolayısıyla eksüdasyonu arttırırlar. Prostaglandinler ve lökotrienler inflamatuar ağrının oluşumunda önemlidir. Aynı zamanda PGE 2, doğrudan ağrı aktivitesine sahip olmadan, afferent ağrı sinir uçları reseptörlerinin bradikinin ve histamine duyarlılığını arttırır. PGE 2 güçlü bir antipiretik ajandır ve ateşin gelişiminde rol oynar. Prostaglandinler, lökositlerin eksüdasyonunu, göçünü ve degranülasyonunu ve ayrıca fagositozu düzenleyerek inflamatuar sürecin modüle edilmesinde önemli bir rol oynar. Örneğin PGE, histamin veya bradikininin neden olduğu ödem gelişimini güçlendirir ve PGF 1a ise tam tersine onu zayıflatır. Benzer şekilde PGE ve PGF 1a lökositlerin göçü üzerinde etki gösterir.
Lökotrienler(eritrositler hariç tüm kan hücrelerinde ve ayrıca kan damarlarının, mast hücrelerinin, akciğerlerin adventisyasında sentezlenir) gastrointestinal sistemin düz kaslarının kasılmasına katkıda bulunur, vazokonstriktör etkiye sahiptir (dahil) Koroner arterler). LTC 4, LTD 4 ve LTE 4, endotel hücrelerinin doğrudan kasılması yoluyla damar geçirgenliğini artırır ve LTB 4, nötrofile bağımlı bir aracı olarak görev yapar. Lökotrienler
bronşların düz kaslarının spazmına yol açar (bronkospazmın etkisi, histaminin neden olduğundan farklı olarak daha yavaş gelişir, ancak daha uzun sürer), ödem gelişimi, eozinofillerin çekilmesi, mukus salgısının artması ve bozulması Ulaşım. Lökotrienlerin hedef organı kalptir. Aşırı miktarda salındıklarında kalp kasının kontraktilitesini (%60 oranında) engeller, koroner kan akışını azaltır ve inflamatuar yanıtı artırır. Lökotrienler diğer inflamatuar medyatörlerle geniş ölçüde etkileşime girer. Histamin, asetilkolin, prostaglandinler ve tromboksanların bronkospastik etkisini arttırırlar ve prostaglandinlerin ve tromboksanların salınımını uyarırlar.
Tromboksanlar(beyin, dalak, akciğer dokusunda ve trombositlerde, inflamatuar granüloma hücrelerinde oluşur) trombositlerin yapışmasına ve toplanmasına neden olur, tromboz gelişimine katkıda bulunur. koroner hastalık kalplerin vazospastik etkisi vardır.
Eikosanoidlerin modülatör işlevi, hücrelerdeki siklik nükleotidlerin oranındaki değişiklikler yoluyla gerçekleştirilir.
Biyojenik aminler - histamin ve serotonin akut inflamasyonun odağında ve artan damar geçirgenliğinin hemen aşamasındaki başlangıçtaki mikro dolaşım bozukluklarının ana aracıları olarak kabul edilir.
Az miktarda nörotransmiter serotonin mast ve enterokromafin hücrelerinde bulunur ancak ana kaynağı trombositlerdir. Serotoninin etkileri belirsizdir ve miktarına bağlı olarak değişir. Normal fizyolojik koşullar altında serotonin bir vazokonstriktördür, uzun süreli damar spazmına neden olur ve tonunu arttırır. İnflamasyon sırasında serotonin miktarı keskin bir şekilde artar. Yüksek konsantrasyonlarda serotonin vazodilatördür, kan damarlarını genişletir, geçirgenliği artırır ve histaminden 100 kat daha etkilidir. Serotonin, venüllerin endotel hücrelerinin doğrudan kasılmasına neden olma yeteneğine sahiptir ve aynı zamanda bir ağrı aracısıdır. Ayrıca serotonin iltihap bölgesindeki monositleri uyarır.
Histamin Kan damarları ve hücrelerle ilgili olarak iki şekilde etki eder. H1 reseptörleri aracılığıyla arteriolleri genişleterek lökositlerin göçünü ve degranülasyonunu engeller, H1 reseptörleri aracılığıyla venülleri daraltarak intrakapiller basıncı artırır ve
lökositlerin göçünü ve degranülasyonunu uyarır. Enflamasyonun normal seyrinde, histamin ağırlıklı olarak nötrofiller üzerindeki H1 reseptörleri aracılığıyla etki ederek fonksiyonel aktivitelerini sınırlandırır ve monositler üzerindeki H1 reseptörleri aracılığıyla onları uyararak etki eder. Böylece damarlarda proinflamatuar etkilerin yanı sıra antiinflamatuar etkilere de sahiptir. Fibroblastların çoğalmasını, farklılaşmasını ve fonksiyonel aktivitesini düzenleme yeteneğine sahip olan histamin, onarım süreçlerinde rol almaktadır. Histaminin modülatör etkilerine ayrıca siklik nükleotidler aracılık eder.
Biyojen aminlerin iltihaplanma bölgesindeki etkileşimlerine gelince, histaminin H1 reseptörleri aracılığıyla prostaglandinlerin sentezini tetikleyebildiği veya artırabildiği ve H2 reseptörleri aracılığıyla onu inhibe ettiği bilinmektedir. Biyojenik aminler hem birbirleriyle hem de bradikinin, nükleotidler ve nükleozidler ve P maddesi ile etkileşime girerek vasküler geçirgenliği arttırır. Histaminin damar genişletici etkisi asetilkolin, serotonin ve bradikinin ile kombinasyon halinde arttırılır.
Lizozomal enzimler Kemotaktik uyarılma, göç, fagositoz, hasar ve ölüm sırasında granülositlerden ve monosit-makrofajlardan iltihaplanma bölgesinde salınır. Nötrofil granülleri, öldürülen mikroorganizmaları parçalayarak antimikrobiyal koruma sağlayan proteinazlar - elastaz, katepsin G ve kollajenazlar içerir. Vasküler geçirgenlik, göç ve fagositoz üzerinde aracı ve modülatör etkileri vardır.
Lizozomal enzimlerin etkisi altında damar geçirgenliğinde bir artış, subendotelyal matrisin parçalanması, endotel hücrelerinin incelmesi ve parçalanması nedeniyle meydana gelir ve buna kanama ve tromboz eşlik eder. Lizozomal enzimler, en önemli kemotaksinleri oluşturarak veya parçalayarak lökosit infiltrasyonunu modüle eder. Konsantrasyona bağlı olarak nötrofil göçünü artırabilir veya engelleyebilirler. Nötr proteinazlar fagositozu modüle etme yeteneğine sahiptir. Örneğin elastaz, parçacıkların nötrofil yüzeyine yapışması için gerekli olan opsonin C3b'yi üretir. Sonuç olarak nötrofilin kendisi fagositozu arttıracak bir mekanizma sağlar. Hem katepsin G hem de elastaz, nötrofil membranı Fc reseptörünün immünoglobulin kompleksleri için afinitesini arttırır ve buna bağlı olarak partikül alımının etkinliğini arttırır.
Lizozomal enzimlerin kompleman, kallikrein-kinin, pıhtılaşma ve fibrinoliz sistemlerini aktive etme, sitokin ve lenfokinleri serbest bırakma yetenekleri nedeniyle inflamasyon gelişir ve uzun süre kendi kendine devam eder.
Enzimatik olmayan katyonik proteinler, Azurofilik ve spesifik nötrofil granüllerinde bulunan, yüksek mikrobisidallik gibi önemli bir özelliğe sahiptir. Bu bakımdan miyeloperoksidaz - hidrojen peroksit sistemi ile sinerjistik etkileşim içindedirler. Katyonik proteinler, elektrostatik etkileşim yoluyla negatif yüklü bakteri hücre zarı üzerinde emilir ve zarın geçirgenliğini ve yapısını bozar. Daha sonra mikroorganizmanın ölümü meydana gelir ve bunu lizozomal proteinazlar tarafından etkili bir şekilde parçalanma takip eder. Ek olarak salınan katyonik proteinler, lökosit yapışması ve göçünün yanı sıra damar geçirgenliğinin artmasına (mast hücre degranülasyonunu ve histamin salınımını teşvik ederek) aracılık eder.
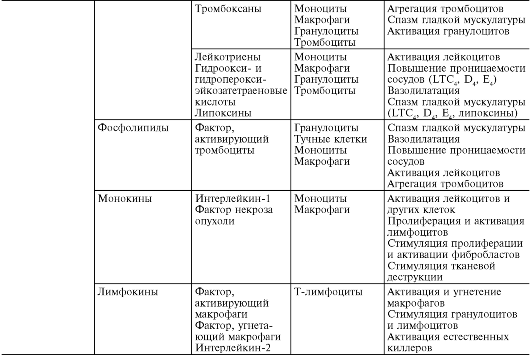
Sitokinler iltihaplanma sırasında esas olarak uyarılmış monositler ve makrofajlar (monokinler) ile nötrofiller, lenfositler, endotel ve diğer hücreler tarafından üretilirler. Sitokinler, damar geçirgenliğini (nötrofil bağımlı bir şekilde), lökositlerin yapışmasını ve göçünü arttırır. Sitokinler, proinflamatuar özelliklerinin yanı sıra vücudun doğrudan korunması için de önemlidir, çünkü nötrofilleri ve monositleri istilacı mikroorganizmaları öldürmeye, absorbe etmeye ve sindirmeye teşvik ederler ve ayrıca patojenik ajanı opsonize ederek fagositozu arttırırlar. Sitokinler, yara temizliğini, hücre çoğalmasını ve farklılaşmasını uyararak onarıcı süreçleri geliştirir. Bununla birlikte doku tahribatına (kıkırdak matrisinin bozulması ve kemik erimesi) aracılık edebilirler ve dolayısıyla özellikle bağ dokusu hastalıklarının patogenezinde rol oynayabilirler. romatizmal eklem iltihabı. Sitokinlerin etkisi ayrıca ateş, uyuşukluk, anoreksi, metabolik değişiklikler, akut faz proteinlerinin artan sentezi için hepatositlerin uyarılması, kan sisteminin aktivasyonu vb. gibi genel inflamasyon belirtilerinin altında yatan bir dizi metabolik etkiye de neden olur. Sitokinler birbirleriyle, prostaglandinler, nöropeptitler ve diğer aracılarla etkileşime girer.
Enflamatuar aracılar (sitokinler) ayrıca bir dizi içerir lenfokinler- uyarılmış lenfositler tarafından üretilen polipeptitler. Lenfokinler nötrofillerin, makrofajların ve lenfositlerin etkileşimini koordine ederek inflamatuar yanıtı bir bütün olarak düzenler.
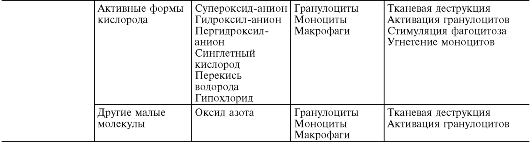
Aktif oksijen metabolitleri, Her şeyden önce, serbest radikaller - süperoksit anyon radikali (O* -), hidroksil radikali (HO*), hidroperoksit radikali (HO*), dış yörüngelerinde bir veya daha fazla eşleşmemiş elektronun varlığı nedeniyle diğerleriyle artan reaktiviteye sahiptir. moleküller ve dolayısıyla inflamasyonun patogenezinde önemli olan önemli yıkıcı potansiyel (Şekil 10-8).
Reaktif oksijen türlerinin kaynağı - oksijen radikalleri, hidrojen peroksit (H 1 O 1), tekli oksijen (1 O 1), hipoklorit (HOCl), vb. - şunlardır: uyarılmaları sırasında fagositlerin solunum patlaması, arakidonik asit kademesi eikosanoid oluşumu sürecinde, endoplazmik retikulum ve peroksizomlarda, mitokondride, sitozolde enzimatik süreçlerin yanı sıra hidrokinonlar, lökoflavinler, katekolaminler vb. gibi küçük moleküllerin otoksidasyonu.
Oksijen radikalleri fagositlerin bakterisidal yeteneğini arttırır, ayrıca aracı ve modülatör fonksiyonlara da sahiptir.
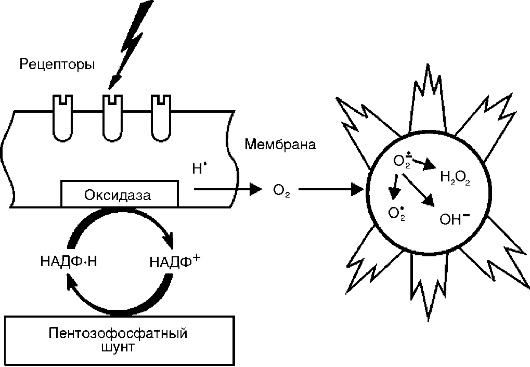 Pirinç. 10-8. Hücre zarının oksidaz sisteminin aktivasyonu üzerine reaktif oksijen türlerinin indüksiyonu
Pirinç. 10-8. Hücre zarının oksidaz sisteminin aktivasyonu üzerine reaktif oksijen türlerinin indüksiyonu
. Enflamasyonun aracıları olarak aktif oksijen metabolitleri, lipit peroksidasyonuna, proteinlerin, karbonhidratların ve nükleik asitlerin hasar görmesine neden olur, bu da vasküler geçirgenliği artırır (endotelyal hücrelere verilen hasar nedeniyle) ve fagositlerin uyarılmasını teşvik eder. Modülatörler olarak, inflamatuar olayları artırabilirler (enzimleri serbest bırakarak ve doku hasar gördüğünde onlarla etkileşime girerek) veya anti-inflamatuar bir etkiye sahip olabilirler (lizozomal hidrolazların ve diğer inflamatuar aracıların etkisizleştirilmesi). Aktif oksijen metabolitleri kronik inflamasyonun sürdürülmesinde büyük önem taşımaktadır.
Enflamasyonun aracıları ve modülatörleri ayrıca şunları içerir: nöropeptidler- birincil afferent (hassas) nöronların terminal dallarında akson reflekslerinin ortaya çıkmasında önemli bir rol oynayan multimodal nosiseptörlerin inflamatuar bir ajanının aktivasyonu sonucu C lifleri tarafından salınan maddeler. En çok araştırılanlar P maddesi, kalsitonin geniyle ilişkili peptid ve nörokinin A'dır. Nöropeptitler vasküler geçirgenliği artırır ve bu yeteneğe büyük ölçüde mast hücrelerinden türetilen aracılar aracılık eder. Miyelinsiz sinirler ile mast hücreleri arasında, merkezi sinir sistemi ile iltihap bölgesi arasındaki iletişimi sağlayan membran temasları vardır. Nöropeptitler, hem kendi aralarında hem de histamin, bradikinin, C5a, trombosit aktive edici faktör, lökotrien B4 ile damar geçirgenliğini arttırmak için sinerjik olarak etkileşime girer; antagonistik olarak - ATP ve adenosin ile. Ayrıca nötrofillerin toplanması ve sitotoksik fonksiyonu üzerinde güçlendirici bir etkiye sahiptirler ve nötrofillerin venüllerin endoteline yapışmasını arttırırlar. Ek olarak nöropeptitler, nosiseptörlerin çeşitli aracıların, özellikle prostaglandin E1 ve prostasiklinin etkisine karşı duyarlılığını arttırır, böylece iltihaplanma sırasında ağrı oluşumuna katkıda bulunur.
Yukarıdaki maddelere ek olarak inflamatuar aracılar ayrıca şunları içerir: asetilkolin ve katekolaminler, Kolin ve adrenerjik yapıların uyarılmasıyla salınır. Asetilkolin vazodilatasyona neden olur ve inflamasyon sırasında arteriyel hipereminin akson-refleks mekanizmasında rol oynar. Norepinefrin ve adrenalin, esas olarak inflamasyon modülatörleri olarak görev yaparak damar geçirgenliğinin büyümesini engeller.
10.4.3. İltihaplı dokuda kan dolaşımı ve mikro dolaşım bozuklukları
Mikrodolaşım bozuklukları. Vasküler olaylar, bir inflamatuar ajanın etkisi sonrasında gelişir, çünkü başlangıçtaki olaylar doğası gereği reflekstir. Yu.Konheim'ın bir kurbağanın mezenteri üzerinde yaptığı klasik deneyinde mikroskop altında açıkça görülebilirler ve birkaç aşama içerirler:
1. Kısa spazm arteriyoller, dokuların ağartılmasıyla birlikte. Vazokonstriktörlerin inflamatuar bir ajana maruz kalma sonucu refleks uyarılmasının sonucudur. Onlarca saniyeden birkaç dakikaya kadar sürer, bu nedenle bunu fark etmek her zaman mümkün değildir.
2. Arteriyel hiperemi, Mekanizması bir yandan vazodilatörlerin akson refleks uyarılmasıyla, diğer yandan inflamatuar aracıların doğrudan vazodilatör etkileriyle ilişkili olan arteriyollerin genişlemesinden kaynaklanır: nöropeptitler, asetilkolin, histamin, bradikinin, prostaglandinler, vb. Arteriyel hiperemi, inflamasyonun iki ana dış lokal belirtisinin temelini oluşturur - kızarıklık ve doku sıcaklığının artması. Ayrıca metabolizmanın artması nedeniyle ocakta ısı üretiminin artması ısının yeniden yaratılmasında önemlidir.
3. Venöz hiperemi. Filojene maruz kaldıktan birkaç dakika sonra gelişebilir ve önemli bir süre ile karakterize edilir - iltihaplanma sürecinin tamamına eşlik eder. Aynı zamanda, ana inflamatuar olayların katılımıyla ortaya çıktığı için, kabul edilir. gerçek inflamatuar hiperemi.
Mekanizmada venöz hiperemi 3 grup faktör vardır: a) Kanın reolojik özelliklerinde bozukluklar ve dolaşımı. Bu, eksüdasyonun neden olduğu kalınlaşma, albümin kaybı, globulin içeriğindeki artış, proteinlerin koloidal durumundaki değişiklikler nedeniyle kan viskozitesindeki artışı içerir; lökositlerin kenarda durması, eritrositlerin şişmesi ve toplanması sonucu kan akışına karşı artan direnç; kan pıhtılaşma sisteminin aktivasyonuna bağlı olarak trombüs oluşumu; kan akışının doğasının ihlali - eksenel bölgedeki kan akışının yavaşlaması, marjinal plazmatik bölgenin azalması;
B) değişiklikler damar duvarı, nöromüsküler damar sisteminin felci nedeniyle damar tonusunun kaybını içerir; damar duvarının esnekliğinin azalması; endotelin şişmesi ve yapışkanlığının artması, bunun sonucunda damarların lümeninin daralması, lökositlerin endotele yapışması için koşullar yaratılması;
V) doku değişiklikleri, venüllerin sıkıştırılmasından oluşur ve lenf damarlarıödemli, sızmış doku; bağ dokusunun esnekliğinin azalması. Listelenen faktörlerin çoğu, venöz hiperemi gelişmesinin hem nedenleri hem de sonuçlarıdır.
Enflamatuar hiperemi, iltihaplı doku damarlarının vazokonstriktörlerin (adrenalin, kafein) etkisine ve tahrişine reaksiyonunun önemli ölçüde zayıflaması veya hatta bozulmasıyla diğer hiperemi türlerinden (örneğin mekanik bir faktörün neden olduğu) farklıdır. sempatik sinirler. Bu fenomen kan damarlarının "duyarsızlaşması" ile ilişkilendirilebilir; Reseptörlerin blokajına bağlı olarak vazokonstriktör uyaranların etkisine karşı azaltılmış veya niteliksel olarak değiştirilmiş hassasiyet. Enflamatuar hiperemideki diğer farklılıklar, bir organ veya dokunun iltihaplı bölgesine daha belirgin kan temini, işleyen kılcal damarların sayısında genişleme ve artış, mikro dolaşımın yoğunluğu, kan akışının doğrusal hızındaki gecikme vb. ile ilişkilidir. bu da inflamatuar hiperemiyi şu şekilde düşünmemizi sağlar: özel Tip mikrodolaşım bozuklukları.
4. Durgunluk.İltihaplı dokunun bazı dallanan damarlarında gelişebilir. Yaygın staz, akut, hızla gelişen, örneğin hipererjik inflamasyonun karakteristiğidir. Kural olarak, inflamatuar staz sırasında kan akışındaki bozukluklar geçicidir, ancak damar duvarında hasar ve birçok mikrodamarda kan pıhtıları meydana gelirse, staz geri döndürülemez hale gelir.
10.4.4. Eksüdasyon ve eksüdalar
Enflamasyon sırasındaki mikro dolaşım bozukluklarına eksüdasyon ve göç olgusu eşlik eder.
Eksüdasyon(eksüdasyon, enlemden itibaren akıntı- ter) - Kanın protein içeren sıvı kısmının damar duvarından dışarı atılması
iltihaplı dokuya. Buna göre iltihaplanma sırasında damarlardan dokuya salınan sıvıya eksuda denir. "Eksüda" ve "eksüdasyon" terimleri yalnızca iltihaplanma ile ilgili olarak kullanılır. Hücreler arası sıvıdan inflamatuar sıvı (ve oluşum mekanizması) ile diğer inflamatuar olmayan ödem sırasında ortaya çıkan transuda - inflamatuar olmayan efüzyon arasındaki farkı vurgulamayı amaçlamaktadırlar. Transüda %2'ye kadar protein içeriyorsa, eksüda 3'ten fazlasını (%8'e kadar) içerir.
Eksüdasyon mekanizması 3 ana faktör içerir:
1) inflamatuar aracılara ve bazı durumlarda inflamatuar ajanın kendisine maruz kalmanın bir sonucu olarak artan damar geçirgenliği (venüller ve kılcal damarlar);
2) hiperemiye bağlı olarak iltihap bölgesinin damarlarındaki kan (filtrasyon) basıncında artış;
3) değişiklik ve eksüdasyonun başlaması sonucu iltihaplı dokuda ozmotik ve onkotik basınçta bir artış ve muhtemelen ağır eksüdasyon sırasında protein kaybına bağlı olarak kanın onkotik basıncında bir azalma (Şekil 10-9). , 10-10).
Eksüdasyonun ana faktörü artan damar geçirgenliği, bu genellikle iki aşaması vardır - acil ve gecikmeli.
 Pirinç. 10-9. İltihaplanma sırasında kurbağa mezenter damarından Evans mavisinin çıkışı, X 35 (A.M. Chernukh'a göre)
Pirinç. 10-9. İltihaplanma sırasında kurbağa mezenter damarından Evans mavisinin çıkışı, X 35 (A.M. Chernukh'a göre)
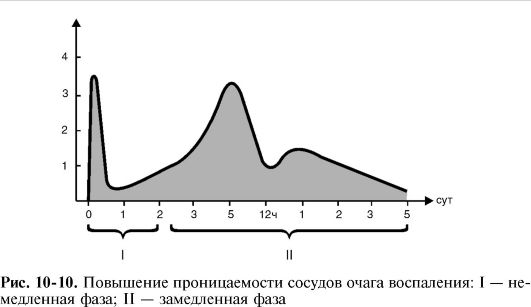 Acil aşama inflamatuar bir ajanın etkisini takiben ortaya çıkar, birkaç dakika içinde maksimuma ulaşır ve geçirgenliğin normale dönebildiği ortalama 15-30 dakika içinde sona erer (filojenin kendisi damarlar üzerinde doğrudan zarar verici bir etkiye sahip değilse). Hemen fazda damar geçirgenliğindeki geçici artış esas olarak venüllerin endotelindeki kasılma fenomeninden kaynaklanmaktadır. Mediatörlerin endotel hücrelerinin zarlarındaki spesifik reseptörlerle etkileşimi sonucunda hücre sitoplazmasının aktin ve miyozin mikrofilamentleri büzülür ve endotel hücreleri yuvarlaklaşır; iki komşu hücre birbirinden uzaklaşır ve aralarında eksüdasyonun meydana geldiği endotelyal bir boşluk belirir.
Acil aşama inflamatuar bir ajanın etkisini takiben ortaya çıkar, birkaç dakika içinde maksimuma ulaşır ve geçirgenliğin normale dönebildiği ortalama 15-30 dakika içinde sona erer (filojenin kendisi damarlar üzerinde doğrudan zarar verici bir etkiye sahip değilse). Hemen fazda damar geçirgenliğindeki geçici artış esas olarak venüllerin endotelindeki kasılma fenomeninden kaynaklanmaktadır. Mediatörlerin endotel hücrelerinin zarlarındaki spesifik reseptörlerle etkileşimi sonucunda hücre sitoplazmasının aktin ve miyozin mikrofilamentleri büzülür ve endotel hücreleri yuvarlaklaşır; iki komşu hücre birbirinden uzaklaşır ve aralarında eksüdasyonun meydana geldiği endotelyal bir boşluk belirir.
Gecikmeli aşama Yavaş yavaş gelişir, 4-6 saat sonra maksimuma ulaşır ve iltihabın türüne ve yoğunluğuna bağlı olarak bazen 100 saate kadar sürer. Sonuç olarak, inflamasyonun eksüdatif fazı, flogojene maruz kaldıktan hemen sonra başlar ve 4 günden fazla sürer.
Yavaş fazda damar geçirgenliğinde kalıcı bir artış, lökosit faktörleri - lizozomal enzimler ve aktif oksijen metabolitleri tarafından venüllerin ve kılcal damarların damar duvarının hasar görmesi ile ilişkilidir.
Damar geçirgenliği ile ilgili olarak inflamatuar aracılar ikiye ayrılır:
1) doğrudan oyunculuk, doğrudan endotel hücrelerini etkileyerek onların kasılmasına neden olur - histamin, serotonin, bradikinin, C5a, C3a, LTC 4 ve LTD 4;
2) nötrofil bağımlı, etkisine lökosit faktörleri aracılık eder. Bu tür aracılar lökopenik hayvanlarda damar geçirgenliğini arttıramaz. Bu bir tamamlayıcı bileşen olan C5a des Arg, LTB 4, interlökinler, özellikle IL-1, kısmen trombosit aktive edici faktördür.
Kanın sıvı kısmının damardan salınması ve dokuda tutulması şu şekilde açıklanır: damar geçirgenliğinin artması, kanın filtrasyon basıncının artması, dokunun ozmotik ve onkotik basıncı, endotel hücrelerindeki mikro gözeneklerden filtrasyon ve difüzyon. kendilerini (hücrelerarası kanallar) pasif bir şekilde; aktif yol - endotel hücreleri tarafından kan plazmasının mikropinositozundan, mikrokabarcıklar (mikroveziküller) şeklinde bazal membrana doğru taşınmasından ve daha sonra dokuya salınmasından (ekstrüzyon) oluşan sözde mikrovesiküler taşımanın kullanılması.
Enflamasyon sırasında damar geçirgenliği artar. daha büyük ölçüde eksüdadaki protein miktarının transüdadaki protein miktarını aştığı inflamatuar olmayan ödemlerden herhangi birine göre. Bu fark, salınan biyolojik olarak aktif maddelerin miktarları ve seti arasındaki farklılıktan kaynaklanmaktadır. Örneğin damar duvarına zarar veren lökosit faktörleri eksüdasyonun patogenezinde önemli rol oynarken, inflamatuar olmayan ödemde daha az önemli bir rol oynar.
Damar geçirgenliğindeki artışın derecesi şu şekilde belirlenir: protein bileşimi sızıntı. Geçirgenlikte nispeten küçük bir artışla, yalnızca ince bir şekilde dağılmış albüminler salınabilir; daha fazla bir artışla globülinler ve son olarak fibrinojen salınabilir.
Niteliksel bileşime bağlı olarak, aşağıdaki eksüda türleri ayırt edilir: seröz, fibrinöz, pürülan, paslandırıcı, hemorajik, karışık (Şekil 10-11, renkli eke bakın).
Seröz eksüda Orta düzeyde bir protein içeriği (%3-5), çoğunlukla ince bir şekilde dağılmış (albümin) ve az sayıda polimorfonükleer lökosit ile karakterize edilir, bunun sonucunda düşük bir spesifik yoğunluğa (1015-1020) sahiptir ve
oldukça şeffaf. Kompozisyon olarak transüdaya en yakın olanıdır. Seröz membranların iltihaplanmasının karakteristiği (seröz peritonit, plörezi, perikardit, artrit, vb.), parankimal organlarda iltihaplanma ile daha az görülür. Mukoza zarının seröz iltihaplanmasıyla birlikte eksüda, büyük miktarda mukus karışımı ile karakterize edilir. Bu iltihaplanmaya nezle denir (Yunancadan. Katarreo- sürü, aşağı akış; nezle rinit, gastrit, enterokolit vb.). Çoğu zaman yanık, viral ve alerjik inflamasyonda seröz eksüda görülür.
Fibrinöz eksüda farklı yüksek içerik damar geçirgenliğinde önemli bir artışın sonucu olan fibrinojen. Hasar görmüş dokularla temas ettiğinde fibrinojen fibrine dönüşür ve villöz kütleler (seröz membranlarda) veya film (mukoza zarlarında) şeklinde düşer, bunun sonucunda eksüda kalınlaşır. Fibrinöz film gevşek, yüzeysel olarak yerleşmişse ve mukozanın bütünlüğünü bozmadan kolayca ayrılıyorsa bu tür iltihaplanmaya lobar adı verilir. Mide, bağırsak, soluk borusu ve bronşlarda görülür. Filmin alttaki dokuya sıkı bir şekilde kaynaşması ve çıkarılmasının ülseratif yüzeyi açığa çıkarması durumunda, difteri iltihabından bahsediyoruz. Bademcikler, ağız boşluğu ve yemek borusu için tipiktir. Bu fark mukozal epitelin doğasından ve hasarın derinliğinden kaynaklanmaktadır. Fibrinöz filmler, lezyon çevresinde gelişen otoliz ve sınır iltihabı nedeniyle kendiliğinden reddedilebilir ve ortaya çıkabilir; enzimatik erimeye veya organizasyona uğramak, yani. bağ dokusu adezyonlarının veya adezyonların oluşumu ile bağ dokusunun çimlenmesi. Difteri, dizanteri ve tüberkülozda fibrinöz eksüda oluşabilir.
Pürülan eksüda esas olarak ölü ve tahrip edilmiş (pürülan cisimler), enzimler, doku otoliz ürünleri, albüminler, globülinler, bazen fibrin iplikleri, özellikle irin yüksek viskozitesine neden olan nükleik asitler olmak üzere çok sayıda polimorfonükleer lökositin varlığı ile karakterize edilir. Sonuç olarak, cerahatli eksüda yeşilimsi bir renk tonuyla oldukça bulanıktır. Kokkal enfeksiyonun, patojenik mantarların veya terebentin, toksik maddeler gibi kimyasal flogojenlerin neden olduğu inflamatuar süreçlerin karakteristiğidir.
Paslandırıcı (koyu) eksüda Kirli yeşil bir renge ve kötü bir kokuya sahip olması sonucunda dokuların çürütücü ayrışma ürünlerinin varlığı ile ayırt edilir. Patojenik anaeroblar birleştiğinde oluşur.
Hemorajik eksüda pembe veya kırmızı rengini veren yüksek miktarda kırmızı kan hücresi ile karakterize edilir. Tüberküloz lezyonlarının karakteristiği (tüberküloz plörezi), veba, şarbon, çiçek hastalığı, toksik grip, alerjik inflamasyon, ör. Son derece öldürücü ajanlara maruz kalma, hızlı iltihaplanma, geçirgenlikte önemli bir artış ve hatta kan damarlarının tahrip edilmesiyle birlikte. Her türlü iltihaplanma hemorajik bir yapıya bürünebilir - seröz, fibrinöz, pürülan.
Karışık eksudalar Vücudun zayıflamış savunmasının arka planında ortaya çıkan iltihaplanma ve bunun sonucunda ikincil bir enfeksiyonun eklenmesi sırasında gözlenir. Seröz-fibrinli, seröz-pürülan, seröz-hemorajik, pürülan-fibrinli eksüdalar vardır.
Eksüdasyonun biyolojik önemi iki şekilde. Önemli bir koruyucu rol oynar: Plazma aracılarının dokuya sağlanmasını sağlar - tamamlayıcının aktif bileşenleri, kininler, pıhtılaşma faktörleri, plazma enzimleri, aktive edilmiş kan hücreleri tarafından salınan biyolojik olarak aktif maddeler. Doku aracılarıyla birlikte mikroorganizmaların öldürülmesi ve parçalanmasına, kan lökositlerinin çekilmesine, patojenik bir maddenin opsonizasyonuna, fagositozun uyarılmasına, yara temizliğine ve onarıcı olaylara katılırlar. Eksüdayla birlikte metabolik ürünler ve toksinler, yani kan dolaşımından lezyona girer. inflamasyonun odağı drenajı ortadan kaldırma işlevini yerine getirir. Öte yandan, lezyonda lenf pıhtılaşması, fibrin kaybı, venöz durgunluğun şiddetlenmesi ve venöz ve lenfatik damarların trombozu nedeniyle eksüda, mikropların, toksinlerin ve metabolik ürünlerin lezyonda tutulmasına katılır.
Patolojik sürecin bir bileşeni olan eksüdasyon komplikasyonlara yol açabilir - plörezi, perikardit, peritonit gelişimi ile eksüdanın vücut boşluğuna girmesi; yakındaki organların sıkıştırılması; apse, ampiyem, flegmon, piyemi gelişimi ile irin oluşumu. Yapışıklıkların oluşması organların yer değiştirmesine ve işlev bozukluğuna neden olabilir. Enflamatuar sürecin lokalizasyonu büyük önem taşımaktadır. Örneğin,
difteri sırasında gırtlak mukozasında fibröz eksüda oluşumu asfiksiye yol açabilir.
Eksüdanın dokuda birikmesi, şişme gibi harici bir lokal iltihaplanma belirtisine neden olur. Ek olarak, bradikinin, histamin, prostaglandinler ve nöropeptitlerin etkisiyle birlikte, eksudanın duyusal sinirlerin uçları üzerindeki basıncı, inflamatuar ağrının ortaya çıkmasında bir miktar öneme sahiptir.
10.4.5. Lökositlerin iltihaplı dokuya salınması (lökosit göçü)
Göç(göç, enlemden itibaren göçmen- taşınmak, taşınmak) - lökositlerin damarlardan dokuya salınması. Esas olarak venüllerin duvarı boyunca diapedez ile gerçekleştirilir. Lökositlerin lezyona göçü inflamasyonun patogenezinde önemli bir olaydır. Lökositler inflamasyonun ana efektörleri olarak görev yapar. Lökosit ürünlerinin ve fagositozun hücre dışı bakterisidal ve litik etkileri, flogojenle mücadelede belirleyici bir rol oynar. Aynı zamanda hücreleri, kan damarlarını ve kanı etkileyen lökosit bileşenleri, kişinin kendi dokularına verdiği hasar da dahil olmak üzere önemli inflamasyon aracıları ve modülatörleri olarak görev yapar. Yara temizliğini gerçekleştiren fagositler, fibroblastların ve diğer hücrelerin çoğalmasını, farklılaşmasını ve fonksiyonel aktivitesini uyardıkları onarıcı olaylar için ön koşulları yaratırlar. Göç mekanizması (I.I. Mechnikov'a göre) kemotaksis olgusundan oluşur.
Lökositlerin aktivasyonunun tetikleyici noktası, çeşitli kemotaktik ajanların hücre zarlarındaki reseptörler (genellikle spesifik) üzerindeki etkisidir. (kimyasal çekiciler), Mikroorganizmalar veya fagositler tarafından salınanların yanı sıra, bir inflamatuar ajanın etkisi sonucu veya fagositlerin kendilerinin etkisi altında dokuda oluşanlar. En önemli kemattraktanlar şunlardır: kompleman fragmanları, fibrinopeptitler ve fibrin bozunma ürünleri, kallikrein, plazminojen proaktivatörü, kollajen fragmanları, fibronektin, araşidonik asit metabolitleri, sitokinler, lenfokinler, bakteriyel peptitler, granülosit parçalanma ürünleri.
Hemattraktanların reseptörlere bağlanması ve plazma zarı enzimlerinin aktivasyonu sonucunda fagositte solunum patlaması gelişir - tüketimde keskin bir artış
oksijenin azaltılması ve aktif metabolitlerinin oluşumu. Bu sürecin fagositlere enerji sağlanmasıyla hiçbir ilgisi yoktur. Mikroorganizmaların daha etkili bir şekilde yok edilmesi için fagositin yüksek oranda reaktif toksik maddelerle ek olarak silahlandırılması amaçlanmaktadır. Solunum patlamasıyla birlikte fagositte başka değişiklikler de meydana gelir: fagositin yapışkanlığını belirleyen özel membran glikoproteinlerinin üretiminde artış; zarın yüzey geriliminde bir azalma ve psödopod oluşumu için gerekli olan sitoplazma bölümlerinin koloidal durumunda bir değişiklik (jelden sol'a geri dönüşümlü geçiş); göçün temeli olan aktin ve miyozin mikrofilamentlerinin aktivasyonu; Lökositlerin endotele bağlanmasını kolaylaştıran maddelerin (laktoferrin, katyonik proteinler, fibronektin, interlökinler) artan salgılanması ve salınımı.
Lökositler eksenel kan akışını plazmatik olana bırakır. Bu, kanın reolojik özelliklerinin ihlali, kan akışında bir yavaşlama, doğasında bir değişiklik, özellikle marjinal plazmatik bölgede bir azalma ile kolaylaştırılır (Şekil 10-12).
Lökositlerin ve endotel hücrelerinin yapışkan özelliklerinin artması nedeniyle lökositler
 Pirinç. 10-12. Kan akış düzeni normaldir ve iltihaplanma sırasında: 1 - normal dolaşım: eksenel akış, bireysel lökositlerle birlikte marjinal plazmatik bölge; 2 - kan akışında yavaşlama: kırmızı kan hücreleri, lökositlerin ve trombositlerin marjinal duruşu görülebilir; 3 - şiddetli kan durgunluğu: lökositlerin ve trombositlerin marjinal konumu, marjinal plazmatik bölgede azalma (D.E. Alpern'e göre)
Pirinç. 10-12. Kan akış düzeni normaldir ve iltihaplanma sırasında: 1 - normal dolaşım: eksenel akış, bireysel lökositlerle birlikte marjinal plazmatik bölge; 2 - kan akışında yavaşlama: kırmızı kan hücreleri, lökositlerin ve trombositlerin marjinal duruşu görülebilir; 3 - şiddetli kan durgunluğu: lökositlerin ve trombositlerin marjinal konumu, marjinal plazmatik bölgede azalma (D.E. Alpern'e göre)
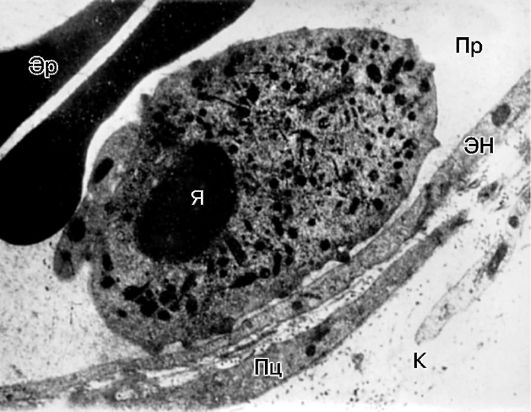 Pirinç. 10-13.İltihaplanma sırasında sıçan mezenterinin venülündeki bir lökositin marjinal konumu: Damarın Pr lümeni; TR - endotel hücresi; PC - perisit; K - kollajen lifleri; Ben çekirdeğim; Er - kırmızı kan hücreleri. Elektron mikroskobu, x10.000 (A.M. Chernukh'a göre)
Pirinç. 10-13.İltihaplanma sırasında sıçan mezenterinin venülündeki bir lökositin marjinal konumu: Damarın Pr lümeni; TR - endotel hücresi; PC - perisit; K - kollajen lifleri; Ben çekirdeğim; Er - kırmızı kan hücreleri. Elektron mikroskobu, x10.000 (A.M. Chernukh'a göre)
endotel - gelişir lökosit kenarı fenomeni
(Şekil 10-13).
Artan endotel yapışkanlığışunlardan kaynaklanabilir: yapışkan glikoproteinlerin (lektinler) ve normalde damar lümeninin yanından endoteli kaplayan fibrin filminde yer alan diğer maddelerin üretiminin artması, kemattraktanların endotel hücrelerine sabitlenmesi, daha sonra spesifik reseptörlerle etkileşime girmesi lökositlerde immünoglobulin G ve kompleman fragmanı C3b için endotel hücre reseptörlerinde ekspresyonun artması, bu da fiksasyonu teşvik eder bağışıklık kompleksleri ve onlar aracılığıyla - immünoglobulin (Ig) G ve C3b için reseptörleri taşıyan lökositler.
Lökositlerin endotele yapışması aşağıdaki faktörlerin aracılık ettiği:
Enflamasyonun başlangıç aşamasındaki lökositler aktive edilir ve agregatlar oluşturur; lökositin aktivasyonunun bir sonucu olarak, negatif yükü azalır, bu da kendisi ile negatif yüklü endotel arasındaki karşılıklı itme kuvvetlerini azaltır;
Lökositler ve endotel arasında kalsiyum köprüleri oluşturulur (Ca2 + ve diğer iki değerlikli iyonlar, lökositlerin yapışmasında anahtar rol oynar);
Aktivasyon sırasında, lökositlerdeki spesifik granüllerin sentezi artar; bunların bazı bileşenleri, örneğin laktoferrin, hücrelerin yapışkan özelliklerini arttırır;
Mac-1 ve LAF-1 sınıflarının yapışkan glikoproteinlerinin ekspresyonu lökosit membranında artar.
Lökositlerin endotel ile ilk teması çok kırılgandır ve kan akışının etkisi altında fibrin filminin yüzeyi üzerinde yuvarlanabilirler, ancak lökositler proteazları yapışma bölgesine salgılayarak lektin benzeri alanları açığa çıkardıkları için temas hızla stabil hale gelir. Endotel hücre zarının güçlendirilmesi ve onlara daha fazla yapışkanlık kazandırılması. Salgıladıkları fibronektin, fagositlerin endotele yapışmasıyla doğrudan ilişkilidir. Marjinal pozisyonu işgal eden lökositler, endotelyal boşluklara nüfuz eden ve böylece endotelyal tabaka boyunca "taşan" psödopodiyi serbest bırakır (Şekil 10-14). Göç, damar geçirgenliğinin artması ve damardan dokuya sıvı akışının artmasıyla kolaylaştırılır, bu da lökosit için damar duvarının geçişini önemli ölçüde kolaylaştırır.
Lökosit, endotel tabakası ile bazal membran arasına girdiğinde, onu çözen lizozomal proteinazların yanı sıra bazal membranın kolloidal durumunu değiştiren katyonik proteinleri (jelden sol'a geri dönüşümlü geçiş) salgılar ve bu da lökosit için geçirgenliğin artmasını sağlar. Göç eden lökositler damar duvarının dış yüzeyinden ayrılır ve amip benzeri hareketlerle inflamasyonun merkezine yönlendirilir (Şekil 10-15), bu da odaktaki kemotaktik maddelerin konsantrasyon gradyanı ile belirlenir. Negatif yüklü lökosit ile H+-hiperiyoni ile karakterize edilen dokunun pozitif yükü arasındaki potansiyel farkının neden olduğu elektrokinetik fenomenler bazı rol oynayabilir.
Başlangıçta, akut inflamasyon bölgesindeki eksudanın lökositleri arasında granülositler, özellikle de nötrofiller baskın hale gelir ve daha sonra monositler/makrofajlar hakim olur. Daha sonra lezyonda lenfositler birikir.
Mikro damar sisteminin bireysel dallarındaki kan akışının yavaşlaması ve lökositlerin marjinal konumu nedeniyle
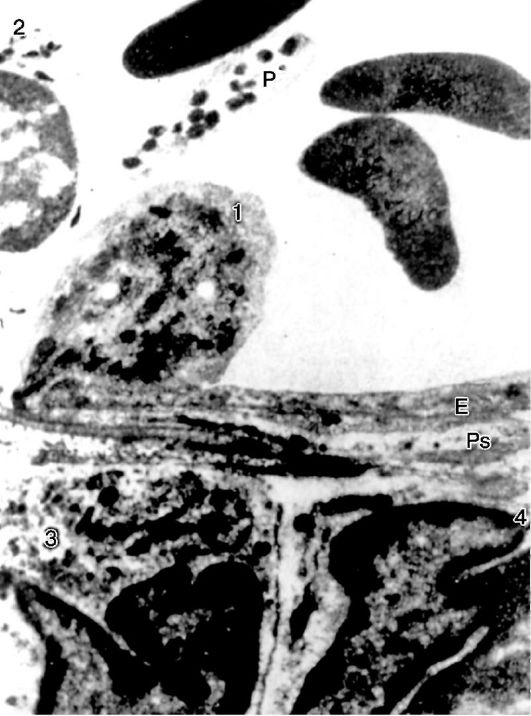 Pirinç. 10-14. Nötrofil göçü: 1 - göç eden nötrofil; E - endotel hücresi; Ps, endotele paralel olarak yerleştirilmiş uzun bir psödopodyumdur; 2 - damarın lümeninde nötrofil; 3, 4 - göç etmiş nötrofiller; P - trombosit. x15.500 (Marchesi'ye göre)
Pirinç. 10-14. Nötrofil göçü: 1 - göç eden nötrofil; E - endotel hücresi; Ps, endotele paralel olarak yerleştirilmiş uzun bir psödopodyumdur; 2 - damarın lümeninde nötrofil; 3, 4 - göç etmiş nötrofiller; P - trombosit. x15.500 (Marchesi'ye göre)
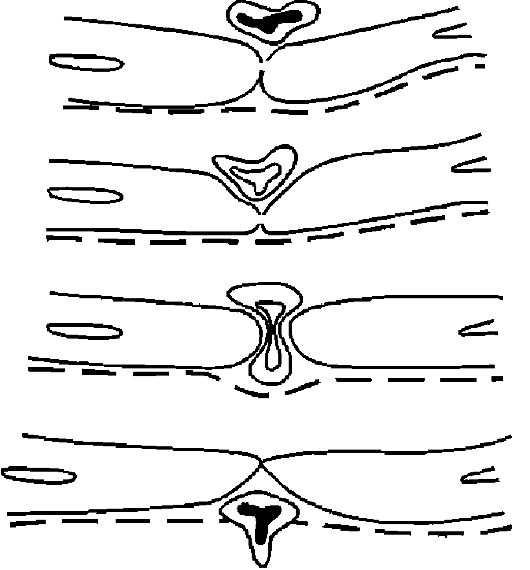 Pirinç. 10-15. Lökosit göç şeması (Marchesi'ye göre)
Pirinç. 10-15. Lökosit göç şeması (Marchesi'ye göre)
çok hızlı gelişir ve göç eden bir nötrofilin endotelden geçmesi 3-12 dakika sürer; lezyondaki granülositlerin görünümü, inflamasyonun başlangıcından itibaren 10. dakikada zaten gözlemlenebilir. Lezyonda nötrofil birikim hızı ilk 2 saatte en yüksek seviyede olup, sonraki saatlerde giderek azalmaktadır. Sayıları 4-6 saat sonra maksimuma ulaşır.Bu süre zarfında lezyonun lökositleri% 90'dan fazla nötrofil ile temsil edilir. Granülositler bakterileri veya diğerlerini fagositoz yabancı vücutlar ve ölmekte olan hücresel elementlerin parçacıkları, eşzamanlı olarak hücre dışı enzimlerin, katyonik proteinlerin ve aktif oksijen metabolitlerinin tedarikini gerçekleştirir. Aynı zamanda, kalıntıları hem nötrofilik hem de monositik infiltrasyonun genişlemesi için önemli bir uyarıcı olan nötrofillerin büyük bir tahribatı meydana gelir. Normal olduğu gibi dokuya salınan granülositlerin çoğu asla kan dolaşımına geri dönmez.
Monositler genellikle 16-24 saat sonra akut inflamasyon bölgesinde baskın hale gelir ve kural olarak üçüncü günde zirveye ulaşır. Ancak monositlerin kandan dokuya göçü, nötrofillerin göçü ile eş zamanlı olarak başlar. Başlangıçta nötrofillerinkinden daha düşük olan monosit birikim hızının, nötrofillerin atık ürünlerinin etkisi altında bu hücrelerin kemotaksisinin, nötrofilin tam ekspresyonu için gerekli olan belirli bir süre boyunca inhibisyonu ile ilişkili olduğu varsayılmaktadır. reaksiyonu ve monositik kontrolünün önlenmesi. Enflamasyon bölgesinde, göç eden monositlerin makrofajlara kademeli bir dönüşümü ve ikincisinin olgunlaşması gözlenir, bu sırada sitoplazmanın ve içindeki organellerin hacmi artar. Özellikle makrofajların lezyondaki fonksiyonlarını tam olarak yerine getirebilmesi için gerekli olan mitokondri ve lizozom sayısı artar. Pinositoz aktivitesi artar, sitoplazmadaki fagolizozom sayısı artar ve filopodia sayısı artar. Monositler/makrofajlar aynı zamanda inflamatuar medyatörlerin (enzimler, oksijen metabolitleri, sitokinler) ve fagositoz bakterilerinin kaynağıdır, ancak ölü hücre kalıntılarının, özellikle de nötrofillerin fagositozunda birincil öneme sahiptirler. Bu nedenle monosit birikiminin önceki nötrofil salınımına bağımlılığı anlaşılabilir. Böylece nötropenili tavşanlarda monositler 16 saat boyunca iltihap bölgesinde görünmezken, doğal iltihaplanma koşullarında 4 saat sonra tespit edilir ve bölgeye enjeksiyon yapılır.
Nötrofillerin lökopenik hayvanlardaki iltihabı, mononükleer hücrelerin normal birikimini geri kazandırır. Nötrofil lizatlarının monositler üzerindeki kemotaktik etkisi, kısmen lizozomal granüllerindeki katyonik proteinlere bağlı olarak bilinmektedir.
Öte yandan nötrofillerin birikimi büyük ölçüde monositlere bağlıdır. Bu özellikle nötrofil infiltrasyonunun artmış hematopoez ile ilişkili kısmı için doğrudur, çünkü ikincisi monosit-makrofaj hematopoietik faktörler, özellikle IL-1 tarafından başlatılır. çeşitli türler koloni uyarıcı faktörler olarak adlandırılanlar - ağırlıklı olarak protein yapısında olan, çoğalma ve farklılaşmadan sorumlu maddeler kemik iliği hematopoietik hücreler. Şu anda, nötrofiller için insan monositlerinden bir dizi kemotaktik peptid izole edilmiştir; bunlar, inflamatuar odağın lökosit reaksiyonunun kendi kendini düzenleme mekanizmasında rol oynayabilir. Bununla birlikte, inflamasyon bölgesindeki hücresel fazların değişim mekanizmaları, inflamatuar reaksiyonun gelişiminden çözünürlüğüne geçiş sorunu, inflamasyon probleminde en az çalışılan konulardan biridir.
Eksüdanın hücresel bileşimi büyük ölçüde iltihaplanma sürecinin doğasına ve seyrine bağlıdır; bu da, iltihaplanma maddesi ve vücudun reaktivite durumu tarafından belirlenir. Bu nedenle, eğer iltihaplanma piyojenik mikroplardan kaynaklanıyorsa, eksüda nötrofiller açısından özellikle zengindir; alerjik inflamasyonda lezyon çok sayıda eozinofil içerir. Kronik inflamatuar süreçler, düşük nötrofil içeriği ve monosit ve lenfositlerin baskınlığı ile karakterize edilir.
Göç eden lökositler, yerel kökenli çoğalan hücrelerle birlikte inflamatuar bir sızıntı oluşturur. Bu durumda eksüda, içerdiği hücrelerle birlikte dokuya nüfuz ederek iltihaplı bölgenin elemanları arasında dağılır ve dokuyu gergin ve yoğun hale getirir. İnfiltrasyon, eksuda ile birlikte şişmeye neden olur ve inflamatuar ağrının oluşmasında önemlidir.
10.4.6. Kurtarma süreçleri iltihaplı dokuda
Enflamatuar proliferasyon altında(çoğalıne, enlemden itibaren proleterler- yavrular, ferre- yaratmak) yerel hücrelerin çoğalmasını anlamak
iltihap bölgesindeki kesin unsurlar. Proliferasyon, inflamasyonun en başından itibaren değişiklik ve eksüdasyon fenomeniyle birlikte gelişir, ancak daha sonraki bir aşamada baskın hale gelir. süreç dönemi Eksüdatif-infiltratif fenomenler azaldıkça. Başlangıçta lezyonun periferinde daha belirgindir. Proliferasyonun ilerlemesi için en önemli koşul, iltihap bölgesini mikroorganizmalardan veya diğer zararlı ajanlardan, doku değişim ürünlerinden, ölü lökositlerden (yara temizliği) temizlemenin etkinliğidir. Bunda başrol, hematojen (monositler) ve doku (histiyositler) kökenli makrofajlara verilir.
Yara temizliği Esas olarak hasarlı dokunun hücre dışı parçalanması ve fagositoz yoluyla meydana gelir. Proteoglikanaz, kollajenaz, jelatinaz gibi enzimlerin yardımıyla sitokinlerin düzenleyici etkisi altında gerçekleştirilir. Bu enzimlerin aktivasyonu, mezenkimal hücrelerden sitokinlerin katılımıyla salınan plazminojen aktivatörünün etkisi altında gerçekleşebilir. Enzimlerle birlikte salınan prostaglandinler proteinazları indükleyebilir ve bozunma süreçlerine katkıda bulunabilir.
Fagositoz I.I. tarafından inflamasyonun ve doğal bağışıklığın temel bir unsuru olarak keşfedildi ve anlaşıldı. 1882'de Mechnikov
I.I. Mechnikov vurgulandı Fagositozun 4 aşaması:
1) yaklaşma aşaması: lökositin damardan çıkışı ve hemattraktanların etkisi altında fagositoz nesnesine yaklaşması;
2) yapışma aşaması(temas etmek);
3) daldırma aşaması: bir nesnenin fagosit içine sarılması ve batırılması; lizozomların biriktiği yerde özel bir vakuol oluşur;
4) sindirim aşaması bunun sonucunda 2 olası sonuç ortaya çıkabilir: a) sadece filojeni yok eden lizozomal enzimlerin yeterli dozda salınması (fagositin kendisi sağlam kalır); b) fagositoz nesnesinin ve fagositin kendisinin tahrip olmasına yol açan lizozomal enzimlerin aşırı salınımı.
Bakterilerle etkileşime giren fagositler aktive edilir, zarları "yapışkan" hale gelir, çünkü üzerindeki farklı reseptörlerin sayısı keskin bir şekilde artar ve bu hücrelerin sitoplazmasının "duygu" hareketliliği artar. Aynı zamanda sitoplazmada peroksizomlar ve granüller birikir.
çok güçlü proteazlar. Böyle bir hücre bir mikroorganizmayla karşılaştığında, bakteri fagositin yüzeyine "yapışır", psödopodisi ile sarılır ve hücrenin içine girerek yok edilir. Makrofajlar, iltihaplanmada özel bir rol oynayan tümör nekroz faktörü (TNF), interferon γ (IFN-γ) ve IL-8'i çevreye salmaya başlar - monositler ve nötrofillerle reaksiyona giren endotel hücrelerinde reseptörlerin ortaya çıkmasına neden olur. afinitesi yüksektir, böylece bu hücreler iltihap bölgesinde bulunan kılcal damarlarda durur. IL-8, fagositik hücrelerin kemotaksisi için bir gradyan oluşturmada en etkilidir. Fagositlerin, kaynağına bakan taraftaki ve karşı taraftaki konsantrasyonundaki farkı "hisseden" ve hareketlerini maksimum fark ekseni boyunca yönlendiren IL-8 reseptörleri vardır. Böylece, fagositik hücreler iltihaplanma bölgesinde birikir, bakterileri ve hücre kalıntılarını aktif olarak emer ve yok eder (hücre içi olarak) ve bağ dokusunun hücreler arası maddesini yok eden enzimler salgılar. Takviye yaparken cilt kaplamaİltihaplanma kaynağını (apse) çevreleyen incelir ve kırılır: flogojenler, hücre döküntüleri ve biriken fagositler vücuttan dışarı atılır. Etkilenen doku alanı yavaş yavaş onarılır. Makrofajlar, lökosit kalıntılarını ve tahrip olmuş dokuları ortadan kaldırarak, kendi kemotaktik uyarılarının en önemli kaynağını ortadan kaldırır ve lokal lökosit reaksiyonunun daha da gelişmesini bastırır. İltihaplanma bölgesi temizlendiğinde, makrofajların kandan beslenmesi azaldığı için sayısı azalır. Kaynaktan, lenf akımının yenilenmesiyle bölgesel lenf düğümlerine taşınırlar ve orada ölürler. Lenfositlerin bir kısmı ölür, bir kısmı da antikor üreten plazma hücrelerine dönüşür ve daha sonra yavaş yavaş yok edilir.
Çoğalma esas olarak stromanın mezenkimal elemanlarının yanı sıra organ parankiminin elemanları nedeniyle gerçekleştirilir. Kambiyal, adventisyal ve endotel hücrelerini içerir. Bağ dokusu kök hücrelerinin (poliblastlar) farklılaşması sonucu lezyonda epiteloid hücreler, fibroblastlar ve fibrositler ortaya çıkar. İnflamasyon bölgesindeki onarıcı süreçlerden sorumlu olan ana hücresel elementler fibroblastlardır. Ana hücrelerarası maddeyi (glikozaminoglikanlar) üretirler ve ayrıca lifli yapıları (kollajen) sentezler ve salgılarlar.
elastin, retikülin. Buna karşılık kolajen, skar dokusunun ana bileşenidir.
Proliferasyonun düzenlenmesi.Çoğalma süreci karmaşık humoral kontrol altındadır. Hayati Burada sahip olmak Tekrar makrofajlar. Bunlar, fibroblast proliferasyonunu ve kollajen sentezini uyaran, termolabil bir protein olan fibroblast büyüme faktörünün ana kaynağıdır. Makrofajlar ayrıca IL-1 ve fibronektin salgılayarak fibroblastların iltihap bölgesine toplanmasını artırır. Makrofajlar, damar duvarındaki, bazal membrandaki endotel ve düz kas hücrelerinin çoğalmasını ve dolayısıyla mikrodamar oluşumunu uyarır. Sistemin inhibisyonu veya uyarılması mononükleer fagositler buna göre cerahatli inflamasyonun odağındaki granülasyon dokusunun gelişimini zayıflatır veya arttırır.
Buna karşılık makrofajlar, fibroblastlar ve T-lenfosit proliferasyonu üzerinde düzenleyici bir etkiye aracılık eder. İkincisi, doku parçalanmasının bir sonucu olarak iltihaplanma bölgesinde oluşan proteinazlar tarafından aktive edilir. Proteinazların hem makrofajlar hem de fibroblastlar üzerinde doğrudan etkisi olabilir. Makrofajlar ve lenfositler, fibroblastları yalnızca uyarmakla kalmayıp aynı zamanda inhibe eden ve fonksiyonlarının gerçek düzenleyicileri olarak görev yapan mono ve lenfokinleri salgılayabilir.
Fibroblastlar aynı zamanda yüksek sistein içeriğine ve 30.000D moleküler ağırlığa sahip, termostabil bir protein olan trombosit kaynaklı büyüme faktörüne de bağlıdır. Fibroblastlar için diğer büyüme faktörleri arasında somatotropin, somatomedinler, insülin benzeri peptitler, insülin ve glukagon bulunur.
Proliferatif olaylarda önemli bir rol oynar Keylon'lar- DNA replikasyonunda yer alan enzimleri etkisiz hale getirerek hücre bölünmesini inhibe edebilen, 40.000 D moleküler ağırlığa sahip termolabil glikoproteinler. Kelonların ana kaynaklarından biri parçalanmış nötrofillerdir. İltihaplanma bölgesindeki nötrofil sayısı azaldıkça kelon içeriği azalır, bu da hücre bölünmesinin hızlanmasına yol açar. Diğer varsayımlara göre, iltihaplanma sırasında, parçalanmış nötrofiller pratikte kelon üretmezler ve yoğun olarak kelon üretirler. anti-keylonlar(fisyon uyarıcıları); Buna bağlı olarak hücre bölünmesi hızlanır ve çoğalma artar.
Diğer hücreler ve aracılar onarıcı süreci düzenleyerek fibroblastların, makrofajların,
Gov ve lenfositler. D.N.'ye göre onarıcı olayların düzenlenmesinde önemli önem taşımaktadır. Mayansky'nin kollajen-kollajenaz sisteminde de karşılıklı ilişkileri, stromal-parenkimal etkileşimleri vardır.
Çoğalma yerini yenilenmeye bırakır.İkincisi, tam anlamıyla inflamatuar fenomenler kompleksine dahil değildir, ancak kesinlikle onları takip eder ve onlardan ayrılması zordur. Bağ dokusunun çoğalmasından, neoplazmadan oluşur. kan damarları, daha az ölçüde - belirli doku elemanlarının çoğaltılmasında. Küçük doku hasarı ile nispeten tam bir yenilenme meydana gelir. Bir kusur oluştuğunda, ilk önce genç, kan damarları açısından zengin granülasyon dokusu ile doldurulur ve daha sonra bunun yerini bir yara oluşumu ile bağ dokusu alır.
10.5. KRONİK İLTİHAP
En başından beri inflamatuar sızıntılarda birikenin polimorfonükleer lökositler değil, monositler, lenfositler ve bunların türevleri olduğu durumlar vardır. Böyle bir mononükleer hücre kümesinin oluşumuna denir "granülom" uzun süreli inflamasyonun ön koşuludur. Kronik inflamasyon, I.I.'nin ifadesinin geçerliliğini göstermektedir. Mechnikov: "İnflamasyon biyolojik özü itibarıyla koruyucu bir reaksiyondur ancak ne yazık ki vücut için her zaman mükemmelliğe ulaşamaz."
Akut inflamasyonun aksine kronik iltihap başlıyor mikrodolaşım bozukluklarından ve damar yatağında daha önce açıklanan olaylardan değil, kritik sayı kümesinden tahriş olmuş (etkinleştirilmiş) makrofajlar Bir yerde.
Makrofajların kalıcı tahrişi çeşitli yollardan kaynaklanabilir.
Bir takım mikroplar makrofajlar tarafından emilir, ancak fagozomlarına girdikten sonra ölmezler ve hücre içinde uzun süre kalabilir ve çoğalabilirler (bunlar tüberküloz, cüzzam, listeriyoz, toksoplazmoz ve diğer birçok hastalığın etken maddeleridir) ). Mikrop içeren makrofajlar içeri girer aktif durum ve inflamatuar mediatörleri salgılamaya başlar.
Makrofajlar, hücrenin parçalayamadığı veya çevreye salamadığı bulaşıcı olmayan parçacıkları emebilir (karmaşık polisakkarit kompleksleri - deniz yosunundan korrageenan, dekstran, fırıncı mayasından zimosan). Sonrasında intravenöz uygulama Farelerde zimosan granülleri, karaciğerdeki yerleşik makrofajlar (Kupffer hücreleri) ve akciğerin interstisyumundaki makrofajlar tarafından yakalanır ve onları aktive eder. 2-3 gün sonra, bu tür makrofajların çevresinde, merkez üssü çevresinde, kana giren monositler birikmeye başlar ve genellikle granülom veya mononükleer sızıntı olarak adlandırılan şey oluşur. Yeni monositlerin/makrofajların aktifleştirilmiş makrofajların lokalizasyon bölgesine çekilmesi, kemotaksiye neden olan maddelerle ilişkilidir. Aktif makrofajlar tarafından bitmiş formda (LTC 4, LTD 4, PGE 2) veya öncüller formunda salgılanırlar: yüksek kemotaktik aktiviteye sahip C3a, C5a, C567 fraksiyonlarına dönüştürülen C2, C4, C5, C6 tamamlayıcı bileşenleri aynı makrofajlar tarafından salgılanan proteazların etkisi altında.
Makrofajlar tarafından salgılanan kolajenaz gibi lizozomal enzimler kolajeni parçalar. Kollajenin kısmi bozunmasının ürünleri, taze monositleri iltihap bölgesine çekme konusunda güçlü bir yeteneğe sahiptir.
Aktive edilmiş makrofajlar, infiltrasyon bölgesindeki diğer hücrelerin zarlarında lipit peroksidasyonunu tetikleyen biyo-oksidanları salgılar. Ancak basit kemotaksinlerde artış Dokunun bazı bölgelerinde henüz kandan yeni inflamatuar efektör hücrelerin akışı anlamına gelmez. Bu maddelerin bir gradyanının oluşmasıyla birlikte, artan geçirgenlik mononükleer lökositlerin tahriş olmuş makrofajların lokalizasyon bölgesine girebileceği mikrodamarlar. Aktive edilmiş makrofajlar, kılcal bağ dokusu bariyerini gevşeten LTC 4, LTD 4, trombosit agregasyon faktörü, O 2 *-, kollajenaz ve plazminojen aktivatörü üreterek mikrovasküler geçirgenliği artırır. Ya kılcal damarların bazal membranını gevşetirler, ya endotel hücrelerini kasıp interendotelyal yarıkları ortaya çıkarırlar ya da her iki şekilde de etki gösterirler. Bunun sonucunda lökositlerin kandan salınması ve bölgeye hareketi kolaylaştırılır. yüksek konsantrasyon kemotaksinler, sızıntıdaki diğer hücrelere katılırlar. Sızıntıya giren monositler salgılar
fibronektin. Bu sayede başta kollajen lifleri olmak üzere bağ dokusu matrisine sıkı bir şekilde bağlanırlar. Görünüşe göre "bağlanmış"lar. İngiliz literatüründe hücrelerin bu şekilde hareketsizleştirilmesine bile deniyordu. "sabitleme"(İngilizceden Çapa- Çapa). Bu çok önemli noktaÇünkü "hareket halindeyken" fagositlerin iltihaplanma bölgesinde önlerinde ortaya çıkan "sorunları çözecek zamanları yoktur".
Fagositoz, monositlerin bağ dokusu yapılarına bağlanıp yayılmasından sonra en etkili şekilde gerçekleşir. Böylece aktif makrofajlar sadece tetiklemekle kalmaz, aynı zamanda kronik inflamasyonun tüm sürecini de belirler. Ancak, gerçek koşullar makrofajlar tek başına değil, inflamatuar sızıntının (granülomlar) parçası olan diğer hücre türleri ile kombinasyon halinde çalışır (Şekil 10-16, renkli eke bakın).
En iyi çalışılan makrofajlar arasındaki fonksiyonel işbirliği Ve lenfositler:
1. Her şeyden önce bu hücreler, bulaşıcı iltihaplanma sırasında gelişen spesifik bağışıklık tepkisinde yakın etkileşime girer. Makrofajlar, fagolizozomlarındaki mikrobiyal antijenleri emer ve kısmen yok eder. Değiştirilmiş bir formda bu antijenler, makrofajın sitoplazmik zarına geri döner ve burada özel proteinlerle karmaşık bir ilişkiye girerler. Yalnızca bu kombinasyonda antijen T lenfositleri tarafından tanınır. Kronik inflamasyonun odağında makrofaj ve T lenfositleri arasındaki bu etkileşime antijen bağımlı denilebilir. Kendini en belirgin şekilde, aşağıdaki durumlarda ortaya çıkan kronik inflamasyon formlarında gösterir: mikrobiyal enfeksiyon ve gecikmiş tip aşırı duyarlılık (DTH) semptomlarıyla ortaya çıkar.
2. Bununla birlikte makrofajlar, lenfositlerle sadece antijenler yoluyla değil aynı zamanda salgıları yoluyla da ilişkilidir. Makrofajlar, lenfositlerin büyümesini artıran ve aktivitelerini artıran maddeler (örneğin IL-1) salgılar.
3. Aynı zamanda, aktif olarak çoğalan lenfositler, makrofajları aktive eden ve kronik inflamasyonun odağındaki efektör fonksiyonlarını keskin bir şekilde artıran lenfokinleri salgılar:
Makrofaj göçünü önleyici faktör, makrofaj membranlarının yapışkanlığını arttırır ve onlara sıkı bir şekilde bağlanma fırsatı verir.
alt tabakaya yapışın. Aynı faktör, makrofajlar tarafından inflamatuar aracıların salgılanmasını engeller;
Makrofajların toplanmasını, çoğalmasını, makrofajların birbirleriyle kaynaşmasını ve çok çekirdekli dev hücrelerin oluşumunu artıran, yani kronik inflamasyon odaklarının karakteristiğini artıran bir faktör. Özellikle akciğerlerdeki tüberküloz sızıntılarında bu türden çok sayıda hücre vardır;
Akut ve kronik inflamasyonun başlamasına ve gelişmesine giden yollar temelde farklı:
1. Akut inflamasyonda süreç “kan damarlarından” başlarken, kronik inflamasyonda aktif makrofajların bulunduğu bağ dokusu bölgesinden başlar.
2. Akut inflamasyonun öncü hücresi - efektör - bir nötrofildir ve kronik inflamasyonun öncü hücresi aktif bir makrofajdır. Diğer tüm mezenkimal hücreler de (mast, lenfositler, eozinofiller) nötrofillerin ve makrofajların reaktivitesini modüle ederek sürece katkıda bulunur.
3. Akut inflamasyon, cerahatli bir boşluk (apse) şeklinde komplikasyonlar ortaya çıkmadıkça, birkaç gün içinde hızla sona erer.
4. Kronik inflamasyon aşağıdaki nedenlerden dolayı hızlı bir şekilde sona eremez:
Birincisi, iltihap bölgesindeki makrofajların haftalar, aylar ve hatta yıllar olarak hesaplanan uzun bir yaşam döngüsü vardır. Başlangıçta, başlangıç aşamasında, granülomaya kanla, lenfositlerle - kan ve lenfle taze monositler gelir. Henüz yeterince yüksek mikrop öldürücü aktiviteye sahip değiller. Daha sonra granülom yavaş yavaş olgunlaşır ve farklılaşmış makrofajlar içinde birikir ve mikropları aktif olarak emer. Son olarak, son aşamada, eski bir granülomda aktif fagositik hücrelerin sayısı azalır, ancak yüzde nispeten artar.
Epiteloid ve dev çok çekirdekli hücrelerin fagositozu anlamında inert; ikincisi, herhangi bir granülom "donmuş" bir oluşum değildir. Kemik iliğinden gelen kanla birlikte giderek daha fazla yeni monosit sürekli olarak içine akıyor. Granülomda çok sayıda aktif makrofaj varsa, giriş, hücrelerin granülomdan çıkışını aşacaktır. Gerçek şu ki, tahriş olmuş makrofajlar yoğun olarak özel hemopoietinler üretir. Kemik iliğinde fagosit oluşumunu uyarırlar. Bunlar Metcalf'ın koloni uyarıcı faktörünü içerir. Bu nedenle, tahriş olmuş makrofajlar "çalışırken" denge, hücrelerin sızıntıya akışına doğru kayacaktır ve emilimi imkansızdır. Makrofajlar yaşam alanlarına çok fazla biyo-oksidan salarlarsa, yalnızca lezyonu temizlemekle kalmazlar, aynı zamanda vücudun kendi hücrelerine de zarar verirler. Aşırı H 2 O 2 ve O 2 * üretimi ile - bu faktörler fagozomlardan makrofajın sitozolüne kaçabilir ve ölümüne yol açabilir. Böyle bir durumu önlemek için makrofajların aşırı biyo-oksidanları nötralize edecek bir acil durum sistemi vardır. Enzimleri içerir: katalaz, glutatyon peroksidaz ve glutatyon redüktaz. Özellikle, glutatyon redüktazın etkisi altında hidrojen peroksit, G'nin glutatyon olduğu 2HN + H202 - G-G + 2H20 reaksiyonunda nötralize edilir. Süperoksit dismutaz enzimi, O2*- + O2*- + 2H+ - H2O2 + O2 reaksiyonunda süperoksit anyon radikalini (O2*-) nötralize eder. Antioksidan savunma sistemleri başarısız olduğunda kalıcı inflamasyona yol açar.
Kronik inflamasyon yaşam boyu devam edebilir. Periyodik olarak, yüksek proinflamatuar aktiviteye sahip nötrofiller ve taze makrofajlar lezyona girdiğinde kötüleşir. Mononükleer infiltrasyonun odağında bağ dokusunun tahribatı meydana gelir. Buna yanıt olarak lifli yapılar büyür. Skleroz sonunda kısmi veya tamamen kapatma organın özel fonksiyonları. Bu granülomda birikimle kolaylaştırılır. Özel sınıf Fibroblast uyarıcı faktörleri salgılayan makrofajlar. Doktorlar viral hepatit sonrası karaciğer sirozu ile bu durumla karşılaşmak zorunda kalıyor, kronik zatürre, kronik glomerülonefrit ve diğer kronik inflamatuar hastalıklar.
10.6. ENFLAMASYONUN GENEL BELİRTİLERİ
Enflamasyonun genel belirtileri, başta inflamatuar aracılar olmak üzere, sürecin kaynağından gelen etkilerden kaynaklanır.
Ateş inflamasyon bölgesinin ve periferik kanın aktive edilmiş lökositleri tarafından salınan endojen pirojenlerin, özellikle IL-1'in termoregülasyon merkezi üzerindeki etkisinin sonucudur.
Hızlandırılmış metabolizmaözellikle monokinlerin etkisi altında katabolik hormonların artan salgılanmasının bir sonucudur ve ateşe ikincil de olabilir. Aynı zamanda kanda da belirtiliyor artan içerik glikoz, globulinler, artık nitrojen.
ESR'yi artırma monokinlerin etkisi altında hepatositler tarafından artan "akut faz proteinleri" üretimi veya eksüdasyon sırasında hızlandırılmış albümin kaybı nedeniyle ortaya çıkan, plazmadaki albüminler üzerinde globülinlerin mutlak veya göreceli baskınlığını yansıtır. Plazmadaki kaba proteinlerin baskınlığı, eritrositlerin negatif yükünü ve buna bağlı olarak karşılıklı itilmelerini azaltır. Bu, eritrosit aglütinasyonunu ve dolayısıyla sedimantasyonu artırır.
Bağışıklık özelliklerindeki değişiklikler organizma, özellikle iltihaplanma sırasında hücresel ve humoral bağışıklığın oluşması nedeniyle, özellikle enfeksiyöz olmak üzere, flogojene tekrar tekrar maruz kalmaya karşı artan dirençle kendini gösterir. Bunda, iltihaplanma bölgesindeki lenfoid hücreler, örneğin antikor üreticileri olan plazma hücrelerine dönüşen B lenfositleri önemli bir rol oynar. Enflamasyon vücudun immünolojik reaktivitesini oluşturur (“hastalık yoluyla bağışıklık”).
Kan sistemi reaksiyonları iltihaplanma sırasında lökositlerin lezyona göçünü ve hematopoietik dokuda ve periferik kanda bir takım değişiklikleri içerir:
1) marjinalleşmeleri ve göçleri nedeniyle kanda dolaşan lökositlerin sayısında başlangıçta geçici bir azalma (geçici lökopeni);
2) kemik iliğinde olgun ve olgunlaşmamış granülositlerin ve monositlerin sayısında, kana sızmalarının artması sonucu bir azalma, bu da bir refleks ve muhtemelen kemik iliğinde kan akışının humoral hızlanması ile sağlanır. Kemik iliğinden gelen kandaki beyaz kan hücrelerinin sayısı
iltihap bölgesine göç edenlerin sayısını aşarsa lökositoz gelişir;
3) kemik iliğinde olgunlaşmamış ve olgun granülositlerin ve monositlerin sayısının daha sonra restorasyonu, hematopoezin aktivasyonunu gösterir;
4) kemik iliğindeki toplam miyelokaryosit ve bireysel hematopoietik mikrop hücrelerinin sayısında (orijinaline karşı) bir artış, bu da hiperplazisinin gelişimini gösterir. Bütün bunlar, iltihap bölgesinin lökosit infiltrasyonunun gelişmesini ve uzun süreli korunmasını sağlar.
Hematopoezin aktivasyonu inflamasyon sırasında, inflamasyon odağındaki lökositler ve inflamasyonun lökosit infiltrasyonunun kendi kendini sürdürme mekanizmasında başlatıcı bağlantı olan kan koloni uyarıcı faktörler, interlökinler vb. tarafından uyarılan hematopoetik maddelerin artan üretimi nedeniyle ortaya çıkar. odak. Lizozomal enzimler, reaktif oksijen türleri ve eikosanoidler, infiltrasyonun kendi kendine düzenlenmesinde esastır.
Akut inflamasyon nötrofilik lökositoz ile karakterizedir. sola kayma (kemik iliği rezervinin katılımı ve hematopoez aktivasyonunun bir sonucu olarak artan sayıda genç, bant ve genç nötrofillerin yanı sıra monositoz), kronik inflamasyon için - monosit lökositoz ve lenfositoz.
Enflamasyon sırasında genel olayların ortaya çıkmasında kaynaktan gelen humoral ve refleks etkiler önemlidir. Bu, örneğin, bir kurbağada karın organlarının iltihaplanması sırasında Goltz refleksindeki bir artışla (mideye hafifçe vurulduğunda kalp atış hızında bir azalma) kanıtlanır.
10.7. ENFLAMASYONDA REAKTİVİTE'NİN ROLÜ
Enflamasyonun ortaya çıkışı, gelişimi, seyri ve sonucu, vücudun reaktivitesine bağlıdır ve bu da öncelikle daha yüksek düzenleyici sistemlerin (sinir, endokrin, bağışıklık) işlevsel durumu tarafından belirlenir.
Sinir sisteminin rolü. Sinir sisteminin inflamasyonun patogenezine katılımı, I.I.'nin araştırması sayesinde belirginleşti. Mechnikov, organizma ne kadar karmaşıksa sinir sisteminin de o kadar farklılaştığını gösteren karşılaştırmalı inflamasyon patolojisi üzerine
sistem, inflamatuar reaksiyonu daha parlak ve daha tam olarak ifade eder. Daha sonra refleks mekanizmalarının inflamasyonun ortaya çıkmasında ve gelişmesinde önemli rolü olduğu belirlendi. Flogogen uygulama bölgesindeki dokunun ön anestezisi, inflamatuar reaksiyonu geciktirir ve zayıflatır. İltihaplanma sırasında refleks arkının afferent kısmının hasar görmesi ve kesintiye uğraması, daha da gelişmesini zayıflatır. Belirtildiği gibi, inflamasyon bölgesindeki kısa süreli iskemi ve arteriyel hiperemi refleks niteliktedir. Refleks reaksiyonların rolü aynı zamanda vücudun simetrik bölgelerinde inflamasyonun kendiliğinden gelişebileceğine dair klinik gözlem verileriyle de kanıtlanmıştır.
Merkezi sinir sisteminin üst kısımlarının önemi, anestezi veya hazırda bekletme sırasında inflamasyonun gecikmiş gelişimi ve zayıflaması ile gösterilir. Filojen (öldürülmüş stafilokokların intraperitoneal uygulaması) kullanılarak şartlandırılmış bir refleksin geliştirilmesinden sonra, yalnızca şartlandırılmış bir uyaranın (karın derisinin kaşınması veya ısıtılması) etkisine yanıt olarak şartlandırılmış refleks iltihabı ve lökositozun yeniden üretilmesinin mümkün olduğu bilinmektedir. koşulsuz bir uyarıcı olarak
Merkezi sinir sisteminin altta yatan kısımlarının rolü, talamik bölgeye kronik hasar sırasında ciltte ve mukoza zarlarında kapsamlı inflamatuar süreçlerin gelişmesine ilişkin verilerle kanıtlanmaktadır. Bunun, dokuların sinirsel trofizminin ihlalinden ve dolayısıyla zararlı ajanlara karşı direncinin azalmasından kaynaklandığına inanılmaktadır.
Otonom sinir sisteminin inflamasyonun gelişimi üzerinde önemli bir etkisi vardır. Sempatik olmayan bir tavşanın kulağında iltihaplanma daha şiddetli meydana gelir, ancak aynı zamanda daha hızlı biter. Tam tersine sempatik sinirlerin tahriş olması inflamasyonun gelişmesini engeller. Asetilkolin vazodilatasyona neden olur ve arteriyel hiperemi gelişimini teşvik ederek göçü artırır. Norepinefrin kısa süreli iskemiye neden olur, vasküler geçirgenliğin ve göçün büyümesini engeller. Böylece parasempatik sinir sistemi proinflamatuar etkiye, sempatik sinir sistemi ise antiinflamatuar etkiye sahiptir.
Endokrin sistemin rolü.İnflamasyonla ilgili olarak hormonlar proinflamatuar ve antiinflamatuar olarak ikiye ayrılabilir. Birincisi somatotropin, mineralokortikoidler, tiroid hormonları, insülin, ikincisi kortikotropin, glukokortikoidler, seks hormonlarını içerir.
Bağışıklık sisteminin rolü. Bağışıklanmış bir vücutta, zararlı bir maddeye karşı artan direncin bir sonucu olarak, iltihaplanma, yoğunluğun azalmasıyla karakterize edilir ve daha hızlı sona erer. İmmünolojik reaktivitenin azalmasıyla (immünolojik eksiklik - kalıtsal ve edinilmiş immün yetmezlikler), yavaş, uzun süreli, sıklıkla tekrarlayan ve tekrarlanan inflamasyon gözlenir. Artan immünolojik reaktivite (alerji) ile iltihaplanma, nekroza kadar değişen olayların baskınlığıyla daha şiddetli ilerler.
Sinir, endokrin ve bağışıklık sistemlerinin efektörleri - nörotransmiterler, nöropeptitler, hormonlar ve lenfokinler, hem doku, kan damarları ve kan, hemo- ve lenfopoez üzerinde doğrudan düzenleyici bir etki gösterirler hem de salınımlarını modüle ettikleri diğer inflamatuar medyatörler aracılığıyla aracılık ederler. spesifik hücre zarı reseptörlerini etkiler ve hücrelerdeki siklik nükleotidlerin konsantrasyonlarını değiştirir.
Vücudun reaktivitesine bağlı olarak inflamasyon normerjik, hipererjik ve hipererjik olabilir.
Normerjik inflamasyon- genellikle normal bir vücutta meydana gelen iltihaplanma.
Hipererjik inflamasyon- hassaslaşmış bir vücutta şiddetli bir şekilde meydana gelen iltihaplanma. Klasik örnekler Arthus fenomeni, Pirquet reaksiyonu vb.'dir. Değişim fenomeninin baskınlığı ile karakterize edilir.
Hipertansif inflamasyon- hafif veya yavaş ilerleyen iltihaplanma. Birincisi, örneğin bağışıklanmış bir organizmada, uyarana karşı artan dirençle gözlenir ve yoğunluğun azalması ve daha hızlı tamamlanmasıyla karakterize edilir. (pozitif hiperji).İkincisi - genel ve immünolojik reaktivitenin azalmasıyla (bağışıklık yetmezlikleri, açlık, tümörler, diyabet vb.) ve zayıf dinamikler, uzun süreli seyir, flogojenin ve bundan zarar gören dokunun gecikmiş eliminasyonu, reaksiyonun çözülmesi ile karakterize edilir. (negatif hiperji).
Enflamasyonun patogenezinde reaktivitenin önemi, onu şu şekilde düşünmeyi mümkün kılar: genel tepki Yerel hasar için vücut.
10.8. İLHAM TÜRLERİ
Vasküler doku reaksiyonunun doğasına bağlı olarak, alternatif, eksüdatif-infiltratif ve proliferatif inflamasyon ayırt edilir.
Enflamasyonun türü vücudun reaktivitesine, sürecin lokalizasyonuna, filojenin türüne, gücüne ve etki süresine bağlıdır.
Alternatif inflamasyon belirli bir distrofi fenomeni şiddeti (nekrobiyoz ve nekroza kadar) ve dolayısıyla eksüdatif-infiltratif ve proliferatif olanlara göre baskınlığı ile karakterize edilir. Çoğu zaman, enfeksiyonlar ve zehirlenmeler sırasında parankimal organ ve dokularda (miyokard, karaciğer, böbrekler, iskelet kasları) alternatif inflamasyon gelişir ve bu nedenle parankimal inflamasyon olarak da adlandırılır. Belirgin nekrobiyotik değişikliklerle, alternatif inflamasyona nekrotik denir, örneğin immün kompleks alerjik inflamasyon (insanlarda deneysel Arthus fenomeni ve Arthus benzeri reaksiyonlar).
Eksüdatif-infiltratif inflamasyon Eksüdasyon ve göç ile birlikte dolaşım bozukluklarının, değişiklik ve proliferasyona göre baskın olması ile karakterize edilir. Eksüdanın doğasına bağlı olarak seröz, fibrinöz, pürülan, çürütücü, hemorajik ve karışık olabilir.
10.9. YANMA SÜRÜŞÜ
Enflamasyonun seyri, vücudun reaktivitesi, filojenin türü, gücü ve etki süresi ile belirlenir. Akut, subakut ve kronik inflamasyon vardır.
Akut inflamasyon oldukça belirgin bir yoğunluk ve nispeten kısa bir süre ile karakterize edilir
Kronik iltihap Düşük yoğunluk ve uzun süre ile karakterize edilir - birkaç aydan uzun yıllara ve on yıllara kadar. Vasküler doku reaksiyonunun doğası çoğunlukla proliferatiftir. Patogenezinde öncü rol monositler-makrofajlar ve lenfositler tarafından oynanır. Kronik inflamasyon birincil ve ikincil olabilir (akut inflamasyonun kronik hale gelmesi nedeniyle). Birincil kronik inflamasyonun gelişimi öncelikle flogojenin (tüberküloz, sifiliz vb.) Özellikleri ile belirlenir ve ikincil kronik inflamasyon, vücudun reaktivitesinin özellikleri ile belirlenir.
Subakut inflamasyon ara bir konumda yer almaktadır. Onun klinik süre- yaklaşık 3-6 hafta.
Akut inflamasyon uzun süreli bir seyir izleyebilir; subakut veya sekonder kronik hale gelir. Sürecin azalma dönemleri alevlenmelerle değiştiğinde, dalga benzeri bir kronik inflamasyon seyri mümkündür. Ayrıca, alevlenme döneminde, polimorfonükleer lökositlerin ve hatta alternatif lökositlerin infiltrasyonuyla birlikte eksüdatif olaylar yoğunlaşır ve baskın hale gelir. Daha sonra proliferatif fenomen yeniden ön plana çıkıyor.
Genel olarak, akut ve uzun süreli inflamasyonun genel mekanizmalarında temel bir farklılık yoktur (iltihaplanma tipik bir süreçtir). Aradaki fark, uzun süreli bir süreçte vücudun değişen reaktivitesi nedeniyle hasar ve koruma birliğinin bozulması ve iltihaplanma sürecinin olumsuz hipoerjik, proliferatif bir karakter kazanmasıdır.
10.10. ENFLAMASYONUN SONUÇLARI
Enflamasyonun sonucu, türüne ve seyrine, lokalizasyonuna ve prevalansına bağlıdır. Aşağıdaki iltihaplanma sonuçları mümkündür:
1. Pratik olarak yapı ve fonksiyonun tamamen restorasyonu(normale dön - restitutio ad integrum). Belirli doku elemanları restore edildiğinde küçük hasarla gözlenir.
2. Skar oluşumu(tamamlanmamış iyileşme ile normale dönüş). İltihaplanma bölgesinde önemli bir kusur olduğunda ve bağ dokusu ile değiştirildiğinde gözlenir. Bir yara izi, işlevleri etkilemeyebilir veya aşağıdakilerin bir sonucu olarak işlev bozukluğuna yol açabilir: a) bir organın veya dokunun deformasyonu (örneğin, kalp kapakçıklarındaki yara izi değişiklikleri); b) organların yer değiştirmesi (örneğin, yapışıklıkların oluşması sonucu akciğerler) Göğüs boşluğu plörezi sonucu).
3. Bir organın ölümü ve tüm vücut - nekrotik iltihaplanma ile.
4. Organizmanın ölümü belirli bir iltihaplanma lokalizasyonu ile - örneğin, gırtlak mukozasında difteritik filmlerin oluşması nedeniyle boğulma nedeniyle. Yaşamsal bölgedeki inflamasyonun lokalizasyonu tehdit edicidir önemli organlar.
5. Komplikasyonların gelişimi inflamatuar süreç: a) karın organlarındaki inflamatuar süreçler sırasında örneğin peritonit gelişmesiyle birlikte eksüdanın vücut boşluğuna girmesi; b) apse, flegmon, ampiyem, piyemi gelişmesiyle birlikte irin oluşumu; c) proliferatif inflamasyon sırasında bağ dokusunun yaygın çoğalmasının bir sonucu olarak organın sklerozu veya sirozu.
6. Akut inflamasyonun kronik hale gelmesi.
İnflamasyonun klinik sonuçlarında büyük önem Enflamasyon odağının (odaklarının) ortaya çıkması onunla ilişkiliyse, altta yatan bir hastalığı vardır.
10.11. İLHAMIN VÜCUT İÇİN ÖNEMİ
Genel biyolojik terimlerle iltihaplanmaönemli koruyucu-adaptif reaksiyon, Evrim sürecinde, kendi kısmına zarar verme pahasına tüm organizmayı korumanın bir yolu olarak oluşmuştur. Bu, vücudun zararlı bir maddeyle fizyolojik olarak ortadan kaldırılması yoluyla baş edemediği ve hasar meydana geldiği durumlarda kullanılan, vücudun acil savunma yöntemidir. Enflamasyon, flogojenin ve (veya) zarar verdiği dokunun lokalizasyonu ve ortadan kaldırılmasının ve doku kusurunun restorasyonunun veya telafisinin sağlandığı bir tür biyolojik ve mekanik bariyerdir. Biyolojik bariyer özellikleri elde edilir
Bakterilerin yapışması, öldürülmesi ve parçalanması, hasarlı dokunun parçalanması yoluyla. Mekanik bariyerin işlevi, fibrin kaybı, lezyonda lenf pıhtılaşması, kan ve lenfatik damarların blokajı, hasarlı ve normal doku sınırındaki bağ dokusu hücrelerinin çoğalması (sınırlama) nedeniyle gerçekleştirilir. Bütün bunlar mikropların, toksinlerin, bozulmuş metabolizma ve çürüme ürünlerinin emilimini ve yayılmasını önler.
Enflamatuar odak sadece bir bariyer değil, aynı zamanda bir drenaj işlevi de gerçekleştirir: bozulmuş metabolizma ürünleri ve toksinler kandan eksüda ile odağa salınır. Daha önce de belirtildiği gibi iltihaplanma, bağışıklık oluşumunu etkiler.
Aynı zamanda, koruyucu-adaptif bir reaksiyon olarak inflamasyonun uygunluğu yalnızca evrimsel ve biyolojik açıdan koşulsuzdur. Ve belli bir lokalizasyon ve yaygınlığa sahip yerel bir süreç olarak inflamasyona genel patolojik bulgular eşlik edebilir(zehirlenme, reaktivite değişiklikleri vb.) ve hatta normal seyirde vücuda zarar verir. Ek olarak, değişen reaktivite nedeniyle, alışılmadık formlar ve iltihaplanma komplikasyonları sıklıkla pratikte ortaya çıkar.
Enflamasyonun ana belirtileri uzun zamandır bilinmektedir. Romalı bilim adamı ansiklopedist A. Celsus bile "Tıp Üzerine" adlı incelemesinde aşağıdaki ana konuları belirledi: yerel semptomlar iltihaplanma: kızarıklık (rubor), şişlik (tümör), ısı (renk) ve ağrı (dolor). Romalı doktor ve doğa bilimci C. Galen, A. Celsus tarafından tanımlanan dört iltihap belirtisine beşincisini ekledi: işlev bozukluğu (functio laesa). Dış kabuğun akut inflamasyonunun karakteristiği olan bu semptomlar 2000 yılı aşkın süredir bilinmesine rağmen günümüzde önemini kaybetmemiştir. Zamanla sadece açıklamaları değişti. Bu beş işaret zamana direnmiş ve modern patofizyolojik ve patomorfolojik özellikler kazanmıştır.
Kızarıklık – parlak klinik işaret inflamasyon, arteriyollerin genişlemesi, arteriyel hiperemi gelişimi ve “arteriyelizasyon” ile ilişkilidir. venöz kan iltihap yerinde.
Enflamasyon sırasında şişme, dokuya kan akışının artması, eksüdasyon ve ödemin gelişmesi nedeniyle bir sızıntının oluşması ve doku elemanlarının şişmesi nedeniyle oluşur.
İltihaplı bölgenin sıcaklığındaki bir artış olan ateş, artan sıcak akışına bağlı olarak gelişir. atardamar kanı metabolizmanın aktivasyonunun bir sonucu olarak, iltihap bölgesinde artan ısı üretimi ve ısı transferi.
Ağrı – duyu sinirlerinin uçlarının çeşitli biyolojik olarak aktif maddeler (histamin, serotonin, bradikinin, bazı prostaglandinler vb.) Tarafından tahriş edilmesi, pH değişiminin bir sonucu olarak ortaya çıkar İç ortam asidik tarafa doğru, reseptörlerin mekanik olarak sıkıştırılması, sinir lifleri inflamatuar ödem.
Kural olarak, iltihaplanmaya bağlı işlev bozuklukları her zaman meydana gelir; Bazen bu, etkilenen dokunun işlev bozukluğuyla sınırlı olabilir, ancak daha sık olarak, özellikle hayati organlarda iltihaplanma meydana geldiğinde tüm vücut zarar görür. İltihaplı organın işlev bozukluğu yapısal hasar, ağrı gelişimi ve nöroendokrin regülasyon bozukluğu ile ilişkilidir.
Kronik inflamasyon ve inflamasyon için iç organlar Bu işaretlerden bazıları mevcut olmayabilir.
Konu hakkında daha fazla bilgi Yerel inflamasyon belirtileri:
- ENFLAMASYON: TANIMI, ÖZÜ, BİYOLOJİK ÖNEMİ. ENFLASYONUN ARACILARI. ENFLAMASYONUN YEREL VE GENEL BELİRTİLERİ. AKUT ENFLAMASYON: ETİYOLOJİ, PATOJENEZ. Eksüdatif inflamasyonun morfolojik tezahürü. AKUT ENFLAMASYONUN SONUÇLARI
- Enflamasyon. Enflamasyonun tanımı, özü, aracıları. Eksüdatif inflamasyonun lokal ve genel belirtileri, eksüdatif inflamasyonun morfolojik belirtileri. Akut faz yanıtı. Enflamasyon sırasında ülseratif-nekrotik reaksiyonlar.
- Tipik patolojik süreçler (iltihap, ateş, tipik lokal dolaşım bozuklukları, karsinojenez). Bağışıklık patolojisi. Alerji.
- Üretken ve kronik inflamasyon. Granülomatoz. Spesifik ve spesifik olmayan inflamasyonun morfolojisi.
Sebeplere, reaktiviteye, seyrine, aşamaların prevalansına bağlı olarak inflamasyon türleri. Enflamasyonun aşamaları. Genel ve lokal inflamasyon belirtileri.
Enflamasyon- Tipik bir patolojik süreç, flogojenik bir ajanın etkisine yanıt olarak gelişen, bu ajanı ortadan kaldırmayı ve lokalize etmeyi ve hasara yol açabilmesine rağmen dokuyu onarmayı amaçlayan koruyucu-adaptif bir reaksiyon.
Enflamasyon, evrimsel olarak geliştirilmiş ve sabitlenmiş, vasküler doku yapılarının (endotel, makrofajlar, lökositler) katılımıyla histohematik bariyerler düzeyinde gelişen tipik bir patolojik süreçtir, yapısal homeostaziyi yeniden sağlamayı amaçlayan evrensel, ağırlıklı olarak koruyucu ve uyarlanabilir bir süreçtir ( D.N. Mayansky).
Enflamasyon, lokal olarak etkili (ekso ve endojen) hasar verici faktörlere yanıt olarak tüm organizmanın evrimsel olarak sabit, ağırlıklı olarak lokal olarak ortaya çıkan histo-vasküler reaksiyonudur (V.A. Vorontsov).
Enflamatuar hastalıklar, herhangi bir uzmanlık doktorunun muayenehanesindeki tüm patolojilerin yaklaşık% 80'ini oluşturur ve en fazla sayıda sakatlığa neden olur.
Enflamasyonun sınıflandırılması Enflamasyonun etiyolojisine göre (flogojenik ajanın türüne bağlı olarak):
Dış faktörler:
Mekanik.
Fiziksel (radyasyon, elektrik enerjisi, ısı, soğuk).
Kimyasal (asitler, alkaliler).
Antijenik (alerjik inflamasyon).
Endojen faktörler:
Doku çürümesi ürünleri - enfarktüs, nekroz, kanama.
Tromboz ve emboli.
Bozulmuş metabolizmanın ürünleri toksik veya biyolojik olarak aktif maddelerdir (örneğin, üremi ile vücutta oluşan toksik maddeler mukoza zarları, cilt, böbrekler tarafından kandan salınır ve bu dokularda inflamatuar bir reaksiyona neden olur).
Tuzların birikmesi veya biyolojik bileşiklerin kristaller halinde çökeltilmesi.
Nörodistrofik süreçler.
Mikroorganizmaların katılımına göre:
Bulaşıcı (septik).
Bulaşıcı olmayan (aseptik).
Reaktiviteye göre:
Hipererjik.
Normerjik.
Hipoerjik.
Akışla birlikte:
Subakut.
Kronik.
Aşama üstünlüğüne göre:
Alternatif parankimal organlarda meydana gelir (son zamanlarda reddedilmiştir).
Eksüdatif doku ve kan damarlarında meydana gelir (gevşek, seröz, fibrinöz, pürülan, paslandırıcı, hemorajik, nezle, karışık).
Proliferatif (üretken) kemik dokusunda meydana gelir.
İnflamasyonun aşamaları
Değişim aşaması (hasar) şu şekilde gerçekleşir:
öncelik,
ikincil.
Eksüdasyon aşaması şunları içerir:
vasküler reaksiyonlar,
gerçek sızıntı,
Lökositlerin marjinasyonu ve göçü,
ekstravasküler reaksiyonlar (kemotaksis ve fagositoz).
Proliferasyon aşaması (hasarlı dokunun onarımı):
Otoktoni- Bu, iltihaplanmanın özelliğidir, bir kez başladıktan sonra tüm aşamalardan mantıksal sonucuna doğru akar, yani. Bir önceki aşama bir sonraki aşamayı oluşturduğunda bir kademeli mekanizma devreye girer.
Yerel işaretler iltihaplanma Romalı ansiklopedist Celsus tarafından anlatılmıştır. İltihaplanmanın 4 belirtisini şöyle sıraladı: kırmızılık(Rubor), şişme(tümör), yerel ateş(renk), ağrı(dolor). Beşinci işaret Galen tarafından adlandırıldı - bu işlev bozukluğu- işlev laesa.
Kırmızılık Arteriyel hipereminin gelişimi ve inflamasyon bölgesinde venöz kanın “arteriyelizasyonu” ile ilişkilidir.
Sıcaklık Sıcak kan akışının artması, metabolizmanın aktivasyonu ve biyolojik oksidasyon süreçlerinin ayrılmasından kaynaklanır.
"tümör" ("şişme") eksüdasyon ve ödem gelişmesi, doku elemanlarının şişmesi ve toplam çaptaki artış nedeniyle oluşur Vasküler yatak iltihap yerinde.
Ağrı çeşitli biyolojik olarak aktif maddeler (histamin, serotonin, bradikinin, vb.) tarafından sinir uçlarının tahrişi, çevrenin aktif reaksiyonunun asidik tarafa kayması, disyoni oluşumu, ozmotik basınçta artış ve dokuların mekanik olarak gerilmesi veya sıkıştırılması.
İltihaplı organın fonksiyon bozukluğu nöroendokrin regülasyon bozukluğu, ağrı gelişimi ve yapısal hasar ile ilişkilidir.
Pirinç. 10.1. Dr. A. A. Willoughby'nin klasik tanımından P. Cull'un karikatürü yerel işaretler iltihaplanma.


