23.03.2018
Protocolul bls al recomandărilor internaționale pentru RCP este consecvent. Consiliul National pentru Resuscitare
rezumat
Articolul a adus modificări recente în algoritmii de resuscitare cardiacă legală și cerebrală adoptați de Consiliul European pentru resuscitare în 2015.
Articolul descrie modificările moderne ale algoritmului de resuscitare cardiopulmonară și cerebrală adoptat de Consiliul European pentru Resuscitare în 2015.
Articolul descrie modificările actuale ale algoritmului de resuscitare cardiopulmonară și cerebrală, adoptat de Consiliul European de Resuscitare în 2015.
Cuvinte cheie
inimă-legeneva și resuscitare cerebrală, circulație sanguină, defibrilare, resuscitare
resuscitare cardiopulmonară și cerebrală, stop circulator, defibrilare, resuscitare
resuscitare cardiopulmonară și cerebrală, stop cardiac, defibrilare, reanimatologie.
Numărul din octombrie 2015 al reanimației a publicat noile linii directoare ale Consiliului European de Resuscitare (ERC-2015), care au introdus o serie de modificări la algoritmul de resuscitare cardiopulmonară și cerebrală (CPCR) prezentat în această revizuire.
Frecvență moarte subitaîn Europa este de 55-113 cazuri la 100.000 de persoane/an sau 350-700 de mii/an. Principiile organizatorice ale îngrijirii se bazează pe „lanțul de supraviețuire”, inclusiv recunoașterea precoce a stopului circulator și comunicarea cu serviciile adecvate, inițierea timpurie a RCP, defibrilarea precoce și asistenta de specialitate timpuriu în perioada post-resuscitare.
Mecanismul primar al stopului circulator în 20-50% din cazuri este dezvoltarea fibrilației ventriculare (FV). Mai mult decât atât, de la utilizarea pe scară largă în SUA și Europa a defibrilației disponibile public folosind defibrilatoare externe automate - AED (Automatic External Defibrillator), frecvența de înregistrare a FV ca mecanism primar de stop circulator în moartea subită a crescut la 76%. Acest fapt subliniază importanța asigurării condițiilor pentru defibrilarea timpurie în locuri aglomerate ( Mall-uri, săli de concert, gări, aeroporturi, avioane etc.), care și-au demonstrat Eficiență ridicată peste tot în lume (fig. 1). Aș dori să sper că defibrilarea disponibilă publicului poate deveni o realitate în Ucraina în viitorul apropiat. Totodată, trebuie subliniat că primul pas în această direcție ar trebui să fie organizarea funcționării serviciului de ambulanță. îngrijire medicală si instruirea medicilor si paramedicilor in deprinderi de RCP cu parcurgerea obligatorie a tuturor ambulantelor cu defibrilatoare automate. Întrucât principalul succes al RCP cu rezultate neurologice bune este atins, conform statisticilor mondiale, tocmai în etapa prespitalicească, următorul pas este formarea dispecerilor medicali de urgență care vor putea să consilieze telefonic persoanele care caută ajutor și să instruiască persoane care nu sunt profesioniști. in CPR pana la sosirea ambulantei.ingrijiri medicale, deoarece a fost deja implementata in strainatate.
Complexul modern CPR (A - căi respiratorii, B - respirație, C - circulație), pornind de la recomandările ERC-2010, a fost modificat în Algoritmul C-A-B, în legătură cu care prima etapă după diagnosticul de stop circulator este începerea imediată a compresiunilor toracice și abia apoi restabilirea permeabilității tractului respiratorși respiratie artificiala.
Conform noilor recomandări, accentul principal în formarea neprofesioniştilor ar trebui pus pe astfel de semne. condiție critică, ca lipsă de conștiență și respirație externă afectată, care ar trebui folosite ca markeri ai debutului stopului circulator. De remarcat faptul că respirația agonală (gafare) se observă în primele minute de stop circulator la 40% dintre pacienți și se asociază cu o rată de supraviețuire mai mare.
I. Etapa suportului vital elementar (BASIC LIFE SUPPORT - BLS)
C. Bypass cardiopulmonar
compresie toracică. problema fundamentala întreținere artificială sistemul circulator este un nivel foarte scăzut (mai puțin de 30% din normal) al debitului cardiac creat de compresiile toracice. Compresia efectuată corespunzător asigură menținerea tensiunii arteriale sistolice la nivelul de 60-80 mm Hg, în timp ce tensiunea arterială diastolică depășește rar 40 mm Hg. și, ca urmare, cauze nivel scăzut fluxul sanguin cerebral (30-60% din normă) și coronarian (5-20% din normă). În timpul compresiunilor toracice, presiunea de perfuzie coronariană crește doar treptat și, prin urmare, cu fiecare pauză succesivă necesară respirației gură la gură, scade rapid. Este necesar un minim de 20 de compresii pentru a atinge cel mai înalt nivel posibil de hemodinamică sistemică. În acest sens, s-a demonstrat că raportul dintre numărul de compresiuni și frecvența respiratorie, egal cu 30: 2, este cel mai eficient.
Un studiu la pacienții intubați a arătat că, cu compresia toracică efectuată corespunzător, volumul curent este de numai 40 ml, ceea ce este insuficient pentru o ventilație adecvată. Această prevedere este motivul pentru care nu se permite ca așa-numita RCP neventilata să fie inclusă în noile recomandări și se recomandă totuși ca persoanele care nu sunt profesioniști să fie instruite într-un set standard de RCP, inclusiv compresiile toracice și gură la gură. resuscitare. Cu toate acestea, în cazurile în care salvatorul nu poate sau nu dorește să efectueze resuscitarea gură la gură, este necesară o singură compresie toracică.
Nou în recomandările ERC-2015 a fost o schimbare a frecvenței de compresie, care ar trebui să fie 100-120 pe 1 minut, iar adâncimea compresiei ar trebui să fie de cel puțin 5 cm, dar nu mai mult de 6 cm. Un studiu realizat în rândul 9136 pacienții au arătat că adâncimea de compresie în intervalul 4 -5,5 cm a fost asociată cu o rată de supraviețuire mai bună. Adâncimi mai mari de 6 cm au fost asociate cu mai multe complicații. Comparativ, la 13.469 de pacienți cu stop circulator diverse opțiuni frecvența compresiunilor toracice utilizate (> 140/min, 120-139/min,< 80/мин,
80-90/min), ca urmare, cea mai mare rată de supraviețuire a fost observată la pacienții care au suferit compresii cu o frecvență de 100-120/min.
Obiectivul principal al ghidurilor actuale este la minimizarea oricăror pauze care opresc compresiile toracice deoarece compresiile toracice administrate corect sunt cheia unei resuscitari reusite.
În general, regulile pentru efectuarea compresiilor toracice sunt prezentate în următoarele prevederi:
1. Adâncimea de compresie nu este mai mică de 5 cm, dar nu mai mare de 6 cm.
2. Frecvența compresiunilor trebuie să fie de 100-120 în 1 minut cu minimizarea, pe cât posibil, a pauzelor.
3. Asigurarea decompresiei complete a toracelui dupa compresie, fara a permite rezistenta cu mainile, in timp ce mainile nu trebuie sa se desprinda de pe piept.
4. Raportul dintre numărul de compresiuni și frecvența respiratorie fără protecție a căilor respiratorii sau cu protecție prin mască laringiană sau Combitube atât pentru unul cât și pentru două resuscitatoare trebuie să fie de 30: 2 și să se efectueze cu o pauză pentru ventilație mecanică (risc de aspirație! ).
5. La pacienții intubați, compresia toracică trebuie efectuată cu o frecvență de 100-120/min, ventilație - cu o frecvență de 10/min (în cazul utilizării pungii Ambu - 1 respirație la 5 secunde), fără un pauză în timpul ventilației mecanice (deoarece compresia toracică cu umflarea simultană a plămânilor crește presiunea de perfuzie coronariană).
Conform rezultatelor unui număr de studii, cele mai frecvente complicații în timpul compresiei toracice au fost identificate: fracturile coastelor (13-97%) și fractura sternului (1-43%). În același timp, frecvența fracturilor a fost semnificativ mai mare cu o adâncime de compresie mai mare de 6 cm, deteriorarea a fost observată mai rar. organe interne(plămâni, inimă, organe cavitate abdominală) .
De asemenea, aș dori să prezint date interesante obținute din analiza a 345 de cazuri de compresii toracice neprofesionale la pacienți care erau inconștienți, dar care nu au avut stop circulator. Autorii au evidențiat o incidență scăzută a complicațiilor sub formă de fracturi ale coastelor și claviculei (1,7%), dureri în zona toracică la locul compresiei (8,7%). Nu au fost identificate complicații mai grave. Aceste date, aparent, pot servi drept justificare pentru explicarea neprofesioniştilor semnele care ar trebui să fie alerte cu privire la un posibil stop circulator, cum ar fi lipsa de conştienţă şi respiraţia externă afectată, de la supradiagnostic. moarte clinicăîncă mai bine decât să nu-l recunoști și, în consecință, să nu faci RCP la pacienții pentru care este literalmente vital.
Utilizarea dispozitivelor mecanice de compresie toracică nu s-a dovedit a fi superioară compresiei manuale standard și, prin urmare, nu este recomandată pentru utilizarea de rutină. Cu toate acestea, compresia mecanică poate fi utilă într-o serie de cazuri, facilitând RCP, de exemplu, în timpul transportului sau scoaterii pacientului din cameră, când este incomod să se aplice compresia manuală, precum și în cazurile de RCP prelungită.
A. Restaurarea permeabilității căilor respiratorii
Standardul de aur pentru managementul căilor respiratorii este intubația traheală. De menționat că, conform studiului, intubația traheală la pacienții cu stop circulator este asociată cu o întârziere a compresiei toracice cu o durată medie de 110 secunde (de la 113 la 146 secunde), iar în 25% din cazuri, intubația a durat mai mult. mai mult de 3 minute. Se recomandă predarea intubației traheale fără a opri compresiile toracice. O scurtă pauză în compresiuni este permisă în timp ce tubul endotraheal este trecut corzi vocale, în timp ce această pauză nu trebuie să depășească 5 secunde.
Cu toate acestea, intubația traheală este o abilitate destul de complexă, care necesită o învățare îndelungată și o practică constantă. Deci, într-unul dintre studii s-a arătat că numai după ce stagiari-anestezisti au efectuat aproximativ 125 de intubații în sala de operație, nivelul de intubații reușite a început să ajungă la 95%.
Ca alternativă la intubarea endotraheală, se recomandă utilizarea unor metode mai simple din punct de vedere tehnic decât intubarea traheală, dar în același timp fiabile de protecție a căilor respiratorii, precum o mască laringiană. Cu toate acestea, trebuie amintit că, în comparație cu intubația traheală, riscul de aspirație este crescut. În acest sens, pentru a reduce riscul de aspirație, este necesară o pauză pentru compresia toracică în timpul ventilației mecanice (ALV) prin laringomască. Pe langa laringomastile standard, se recomanda folosirea laringomascului I-gel, care are forma laringelui, o manșeta negonflabila din gel elastomer termoplastic, care necesita abilitati elementare de montaj. Se poate folosi un Combitube cu dublu lumen. La aceasta metoda permeabilitatea căilor respiratorii va fi garantată în orice locație a tubului căilor respiratorii, atât în esofag, cât și în trahee.
B. Suport respirator
La efectuarea ventilației prin metoda gură la gură, fiecare respirație artificială trebuie efectuată timp de 1 secundă (nu forțat), observând excursia toracelui, pentru a obține un volum curent optim și pentru a preveni intrarea aerului în stomac. În acest caz, durata a două respirații artificiale gură la gură nu trebuie să depășească 10 secunde, după care este necesar să se continue imediat compresia toracică. Volumul curent trebuie să fie de 500–600 ml (6–7 ml/kg) și ritmul respirator de 10/min pentru a preveni hiperventilația. Studiile au arătat că hiperventilația în timpul RCP, prin creșterea presiunii intratoracice, scade întoarcerea venoasă către inimă și scade debitul cardiac, asociat cu o supraviețuire slabă la acești pacienți.
II. Stadiul de susținere a vieții ulterioare (SUPORT AVANSAT DE VIAȚĂ - ALS)
Calea de administrare medicamente . Ca în recomandări anterioare, pentru administrarea medicamentelor sunt utilizate două accese principale:
1. Intravenos, în venele centrale sau periferice. Calea optimă de administrare este venele centrale - subclavia și jugulara internă, deoarece este asigurată livrarea medicamentului administrat în circulația centrală. Pentru a obține același efect atunci când sunt injectate în vene periferice, medicamentele trebuie diluate în 20 ml. ser fiziologic salin.
2. Calea intraosoasă - injectarea intraosoasă a medicamentelor în umăr sau tibiei asigură o concentrație plasmatică adecvată, comparabilă în timp cu introducerea medicamentelor în vena centrală. Utilizarea dispozitivelor mecanice pentru administrarea intraosoasă a medicamentelor asigură simplitatea și accesibilitatea acestei căi de administrare.
Suportul farmacologic al resuscitarii
1. Adrenalina:
A) cu activitate electrică fără puls/asistolă (EABP/asistolă) - 1 mg la fiecare 3-5 minute intravenos;
B) cu FV/VT fără puls, adrenalina se administrează numai după a treia descărcare ineficientă a defibrilației electrice în doză de 1 mg. Ulterior, această doză este administrată intravenos la fiecare 3-5 minute (adică înainte de fiecare secundă de defibrilare) atât timp cât FV/VT rămâne fără puls. Trebuie remarcat faptul că, după restabilirea circulației spontane, chiar și dozele mici de adrenalină (50-100 mcg) pot provoca dezvoltarea tahicardiei, ischemiei miocardice, FV/VT fără puls. Așadar, în perioada de postresuscitare precoce nu se mai administrează epinefrină și, dacă este necesar, se utilizează suport vasopresor, noradrenalina sau mezaton.
Am dori să subliniem încă un punct practic, care nu este discutat în recomandările ERC-2015, dar ni se pare important. Deci, în practica noastră, din momentul în care se începe RCP și se asigură accesul venos, conectăm imediat suport vasopresor (de obicei cu mezaton). După restabilirea unui ritm independent eficient hemodinamic, în acest caz există o susținere a rezistenței vasculare periferice totale, care nu permite stopul circulator repetat din cauza hipotensiunii critice. Și dat fiind faptul că în mai mult de jumătate din cazurile la pacienții aflați în stop circulator este necesar suport vasopresor în perioada de postresuscitare precoce, această abordare poate crește eficacitatea RCP.
2. Amiodarona este un medicament antiaritmic de primă linie pentru FV/TV fără puls, refractar la terapie cu electropuls, se administrează după a 3-a descărcare ineficientă la o doză inițială de 300 mg (diluată în 20 ml soluție de glucoză 5% sau alt solvent), iar după a cincea descărcare ineficientă se reintroduce o dată încă 150 mg.
3. Lidocaină - în absența amiodaronei (nu trebuie utilizat ca adjuvant la amiodarona) - doza inițială de 100 mg (1-1,5 mg / kg) IV, dacă este necesar, se administrează un bolus suplimentar de 50 mg ( cu doza totală nu trebuie să depăşească 3 mg/kg în prima oră).
4. Bicarbonat de sodiu - Nu se recomandă utilizarea de rutină în timpul RCP sau după ROSC.
Stopul circulator este o combinație de respirație și acidoza metabolica. Metoda optimă de corectare a acidemiei în timpul stopului circulator este compresia toracică, un efect pozitiv suplimentar este asigurat de ventilație.
Administrarea de rutină a bicarbonatului de sodiu în timpul RCP datorită generării de CO2 care se difuzează în celule provoacă o serie de efecte adverse:
- Câștigă acidoza intracelulara;
- efect inotrop negativ asupra miocardului ischemic;
- încălcarea circulației sângelui în creier din cauza prezenței sodiului cu osmolar ridicat;
- deplasarea curbei de disociere a oxihemoglobinei spre stânga, ceea ce poate reduce livrarea de oxigen către țesuturi.
Indicațiile pentru introducerea bicarbonatului de sodiu sunt cazuri de hiperkaliemie care pune viața în pericol, precum și stop circulator asociat cu hiperkaliemie sau supradozaj de antidepresive triciclice în doză de 50 mmol (50 ml - soluție 8,4%) sau 1 mmol / kg IV.
5. Clorura de calciu - in doza de 10 ml solutie intravenoasa 10% (6,8 mmol Ca2+) pentru hiperkaliemie, hipocalcemie, supradozaj de blocante ale canalelor de calciu.
Defibrilare
Efectuarea defibrilației precoce în primele 3-5 minute de la momentul stopului circulator asigură o rată de supraviețuire de până la 50-70%, care poate fi realizată numai cu introducerea defibrilației disponibile publicului. Totodată, fiecare minut de întârziere în defibrilare reduce cu 10-12% supraviețuirea pacienților în perioada post-resuscitare în stadiul de externare din spital. În același timp, trebuie remarcat faptul că o serie de studii efectuate cu privire la utilizarea DEA de către echipele medicale într-un cadru spitalicesc, comparativ cu utilizarea defibrilatoarelor profesionale, au arătat o scădere a supraviețuirii pacientului.
Se distinge un model trifazic dependent de timp al dezvoltării fibrilației ventriculare, care include faze de dezvoltare secvențială:
- electric (primele 4-5 minute), timp în care metoda eficienta eliminarea lui este defibrilarea electrică;
- circulator (următoarele 5-10 minute - FV prelungit), o metodă eficientă de eliminare a acesteia este compresia toracică preliminară și numai defibrilarea electrică ulterioară;
- metabolic - este necesară terapia metabolică.
Trebuie subliniat faptul că compresiile toracice continue pot fi benefice în primele etape FV, în faza electrică și circulatorie, în timp ce ventilația suplimentară devine mai semnificativă în faza metabolică târzie a FV. De asemenea, s-a constatat că administrarea compresiilor toracice timp de 180 de secunde înainte de defibrilare poate fi benefică (perioadele mai scurte de 30-60 s, precum și perioadele mai lungi > 180 s, sunt ineficiente).
Dacă pe monitor/defibrilator este detectată o FV/VT fără puls, trebuie aplicat imediat un singur șoc de defibrilare electrică. Imediat după aplicarea unei descărcări de defibrilare, se continuă compresiile toracice și alte componente ale RCP timp de 2 minute și abia apoi se evaluează ritmul pe ECG și, dacă ritmul sinusal este restabilit, se evaluează eficiența hemodinamică a acestuia prin prezența unui puls la artera carotida. Pentru că, chiar dacă defibrilarea este eficientă și se recuperează conform datelor ECG ritmul sinusal, este extrem de rar imediat după defibrilare ca acesta să fie eficient din punct de vedere hemodinamic (adică, capabil să genereze un puls și, prin urmare, circulație sanguină). De obicei, este nevoie de ≥ 1 minut de compresii toracice pentru a restabili circulația spontană (puls). În același timp, trebuie subliniat că în cazul restabilirii unui ritm eficient hemodinamic, compresia suplimentară a toracelui nu va duce la redezvoltarea FV. Dimpotrivă, în cazul restaurării doar a activității bioelectrice organizate a inimii, dar ineficientă din punct de vedere hemodinamic, încetarea compresiei toracice va duce inevitabil la refibrilarea ventriculară.
Faptele de mai sus justifică începerea imediată a compresiilor toracice după aplicarea unei descărcări de defibrilare timp de 2 minute și numai evaluarea ulterioară a ritmului ECG, iar în cazul restabilirii ritmului sinusal, evaluarea pulsației carotidei.
Intervalul dintre descărcarea prin defibrilare și continuarea compresiunilor toracice nu trebuie să depășească 10 secunde.
Evaluarea ritmului/pulsului nu trebuie, de asemenea, să depășească 10 secunde - dacă VF/VT este salvat pe ECG
Fără puls, trebuie aplicat un al doilea șoc de defibrilare, urmat de compresii toracice și componente RCP timp de 2 minute. În cazul restabilirii ritmului sinusal conform monitorizării ECG, dar în absența pulsului, este necesar să se continue imediat compresiile toracice timp de 2 minute, urmate de o evaluare a ritmului și a pulsului: Soc RCP timp de 2 minute → Evaluarea ritmului/pulsului → Soc RCP timp de 2 minute...
Defibrilarea monofazică nu mai este luată în considerare din cauza faptului că defibrilatoarele de acest tip nu se mai produc, iar principiul în sine, implementat în modelele vechi de defibrilatoare, este ineficient și provoacă leziuni pronunțate post-defibrilare la nivelul miocardului. Rezultatele cercetărilor au arătat că defibrilarea bifazică, folosind mai puțină energie, este semnificativ mai eficientă și provoacă mai puține leziuni și disfuncție post-resuscitare a miocardului în comparație cu energia echivalentă a unui puls monofazic.
Nivelul inițial de energie pentru defibrilatoarele bifazice ar trebui să fie de 150 J, urmat de o escaladare a energiei cu șocuri repetate. În general, este necesar să ne ghidăm după recomandările fabricilor - producători de defibrilatoare bifazice.
Atunci când se efectuează defibrilarea electrică, este obligatoriu să se îndeplinească trei condiții de bază: amplasarea corectă a electrozilor (unul în dreapta de-a lungul liniei parasternale de sub claviculă, celălalt în stânga de-a lungul liniei media-axilare în proiecția apexului). din inimă). Pentru electrozii standard (neadezivi) în momentul aplicării descărcării, este necesar să se asigure că forța de aplicare pe electrozi este în limita a 8 kg și este imperativ să se folosească un gel conductor special sau, în lipsa acestuia, tampoane umezite cu o soluție conductivă. Utilizarea electrozilor uscați este inacceptabilă, deoarece aceasta reduce semnificativ eficacitatea defibrilării (reducerea acesteia la aproape zero) și provoacă arsuri. piele.
Noile linii directoare recomandă utilizarea electrozilor adezivi (autoadezivi) peste electrozii standard, deoarece s-au dovedit a fi mai confortabili, eliberează mâinile și reduc la minimum pauzele înainte de defibrilare. Toate modelele moderne de defibrilatoare, împreună cu electrozii standard, sunt echipate cu electrozi autoadezivi.
În timpul defibrilării, niciunul dintre participanții la resuscitare nu trebuie să atingă pacientul și/sau patul acestuia.
Daca pacientul are un stimulator cardiac implantat, electrozii defibrilatorului trebuie plasati la cel putin 8 cm distanta de pacient.In aceasta situatie se recomanda si amplasarea electrodului anterior-posterior.
Încă o dată, trebuie subliniat că în FV/TV fără puls, 1 mg epinefrină și 300 mg amiodarona IV trebuie administrate numai după al treilea șoc ineficient al defibrilației electrice. Ulterior, în cazul FV persistente, epinefrina se injectează la fiecare 3-5 minute pe toată perioada RCP. Amiodarona este reintrodusă ca doză unică de 150 mg după al cincilea șoc de defibrilare ineficient.
Monitorizare în timpul RCP
În noile recomandări, se acordă multă atenție monitorizării, ceea ce face posibilă evaluarea calității și eficacității activităților de resuscitare în curs. În acest sens, au fost propuse o serie de tehnologii pentru utilizare în procesul de RCP.
1. Utilizarea unui senzor care evaluează calitatea compresiilor toracice din punct de vedere al frecvenței și adâncimii compresiilor, precum și a ventilației din punct de vedere al frecvenței și volumului. Această tehnologie este implementată într-un număr de defibrilatoare moderne și este un dispozitiv care se află pe toracele pacientului și pe care se efectuează compresia în timpul RCP, cu afișarea ulterioară a parametrilor de compresie și ventilație de mai sus pe monitorul cardiac al defibrilatorului, în timp ce există posibilitatea de feedback cu un prompt vocal pentru desfășurarea corectă a activităților de resuscitare. Acest dispozitiv vă permite să controlați adâncimea optimă (nu mai puțin de 5 și nu mai mult de 6 cm) și frecvența compresiei și să preveniți hiperventilația (Fig. 2).
2. Senzor de capnografie, care este și o opțiune de defibrilator. Capnografia în timpul RCP vă permite să verificați poziția tubului endotraheal, să evaluați calitatea RCP și este un indicator precoce al restabilirii circulației sanguine independente eficiente hemodinamic.
3. Examenul cu ultrasunete în timpul RCP permite identificarea cauzelor potențial reversibile ale stopului circulator conform algoritmului „patru G - patru T” (tamponada cardiacă, PE, pneumotorax), precum și identificarea activității pseudoelectrice fără puls.
Cauze potențial reversibile ale RCP
Probabilitatea unui rezultat favorabil al RCP în PAPA/asistolă (ca și în FV/TV refractară) poate fi crescută numai dacă există cauze potențial reversibile, tratabile de stop circulator. Ele sunt prezentate sub forma unui algoritm universal „patru T - patru T” (Fig. 3).
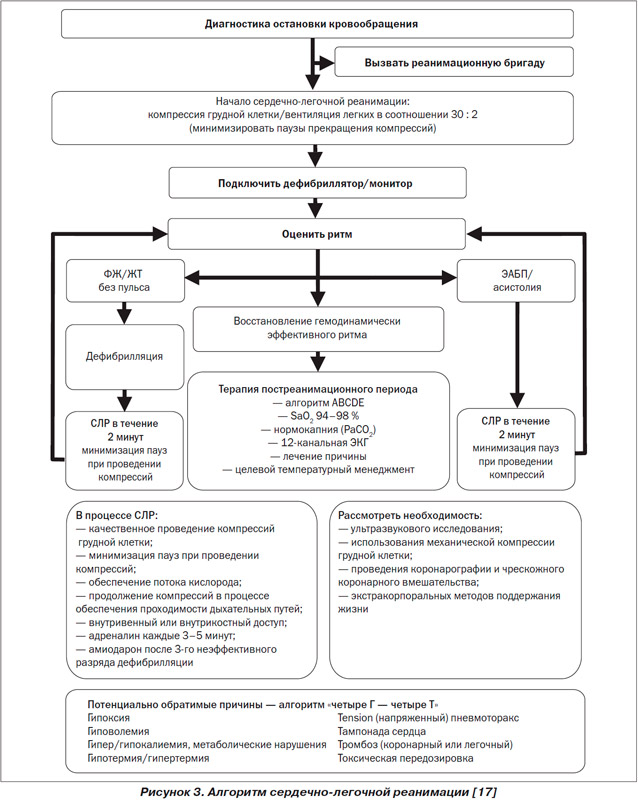
Încetarea resuscitarii
RCP trebuie efectuată atât timp cât fibrilația ventriculară persistă pe ECG, deoarece metabolismul miocardic minim este menținut, permițând potențial restabilirea ROSC.
În cazul stopului circulator prin mecanismul EALD/asistoliei, în absența unei cauze potențial reversibile (conform algoritmului „patru G – patru T”), RCP se efectuează timp de 30 de minute, iar dacă este ineficientă, se oprește .
RCP pentru mai mult de 30 de minute se efectuează în cazuri de hipotermie, înec în apă cu gheață și supradozaj cu medicamente.
Momentul de încetare a resuscitarii este înregistrat ca momentul decesului pacientului.
Suport extracorporeal al vieții. Cercetările în curs extind din ce în ce mai mult capacitățile sistemelor de resuscitare cu perfuzie de urgență (EPR) (Fig. 4). Aceste sisteme sunt aparate portabile inimă-plămân care oferă suport circulator extracorporeal la pacienții decedați clinic la care RCP standard este ineficientă, dar există o cauză potențial reversibilă care poate fi afectată de terapii specifice. Cauzele potențial reversibile pentru care este indicată EPR sunt: tromboza coronariană acută pentru intervenția coronariană percutanată (PCI), EP masivă pentru trombectomie, hipotermia generală severă pentru reîncălzirea extracorporală a pacientului. Trebuie subliniat că aceste dispozitive, pe lângă încălzirea extracorporală, pot asigura inducerea hipotermiei terapeutice.

III. etapa de intretinere pe termen lung
În Marea Britanie a fost realizat un studiu epidemiologic care a implicat 24.132 de pacienți resuscitați, rata mortalității în perioada post-resuscitare a fost de 71%. De remarcat că dintre supraviețuitori, doar 15-20% și-au recăpătat rapid un nivel adecvat de conștiență, restul de 80% dintre pacienți au trecut prin boală de post-resuscitare (PRI). Cauzele decesului în perioada de postresuscitare sunt: 1/3 - cardiace (cel mai mare risc în primele 24 de ore ale perioadei de postresuscitare), 1/3 - disfuncția diferitelor organe extracerebrale și 1/3 - neurologice (sunt cauza). de deces în perioada de lungă durată a PRP).
În 1972, un articol de V.A. Negovsky „Al doilea pas în resuscitare - tratamentul bolii post-resuscitare”, în care a introdus pentru prima dată însuși conceptul de boală post-resuscitare. În ciuda faptului că termenul „boală post-resuscitare” a fost înlocuit de consens internațional în 2008 cu „sindrom post-resuscitare”, ca un tribut adus V.A. Negovsky în 2012, lucrarea sa clasică a fost republicată în revista Resuscitation.
Potrivit lui V.A. Negovsky, „boala postresuscitare este caracterizată de propria sa etiologie specială – o combinație inseparabilă de ischemie globală cu reoxigenare și reperfuzie. Deoarece reoxigenarea și reperfuzia după stopul circulator nu numai că elimină consecințele efectului patologic primar, ci provoacă și o cascadă de noi modificări patologice. Este important ca cauza acestor modificări să nu fie ischemia globală în sine, ci combinația ei cu reoxigenarea și reperfuzia.
PRP este o combinație de procese fiziopatologice cu 4 componente cheie:
- leziuni cerebrale post-resuscitare;
- disfuncție miocardică post-resuscitare;
- reactii sistemice de ischemie-reperfuzie;
- persistent patologie concomitentă.
Prevalența leziunilor cerebrale postresuscitare se datorează complexității structurii sale morfologice, funcțiilor pe care le îndeplinește, precum și toleranței scăzute la ischemie și hipoxie. Nicio celulă din organism nu este la fel de dependentă de nivelul de oxigen și glucoză precum neuronul. Perioada maximă de timp a morții clinice (adică anoxie) în condiții normoterme, în care este posibilă supraviețuirea neuronilor, nu este mai mare de 5 minute.
Leziunile neuronale în PRB sunt de natură multifactorială și se dezvoltă în momentul stopului circulator, în timpul RCP, precum și în perioada de restabilire a circulației spontane.
1. Perioada de ischemie - anoxie în momentul lipsei circulației sanguine în timpul morții clinice (no-flow).
2. Perioada de hipoperfuzie - hipoxie în timpul suportului circulator artificial în timpul RCP (low-flow), întrucât nivelul maxim posibil al debitului cardiac atinge doar 25% din cel inițial.
3. Perioada de reperfuzie, constând în faze de dezvoltare succesivă: no-reflow, urmată de o fază de hiperemie și ulterior hipoperfuzie globală și multifocală.
În perioada de postresuscitare, după restabilirea circulației sanguine spontane, se disting următoarele etape ale perfuziei cerebrale afectate:
1. Dezvoltarea inițială a lipsei de reperfuzie multifocale (fenomenul no-reflow).
2. Stadiul de hiperemie globală tranzitorie – se dezvoltă la minutul 5-40 din momentul restabilirii circulației spontane. Mecanismul dezvoltării sale este asociat cu vasodilatația vaselor cerebrale datorită creșterii concentrației intracelulare de Na + și adenozină, precum și scăderii pH-ului intracelular și a nivelurilor de Ca2 +. Durata ischemiei cerebrale determină ulterior durata etapei de hiperemie, care, la rândul său, este eterogenă în diferite regiuni ale creierului, ducând la scăderea perfuziei și umflarea astrocitelor.
3. Etapa de hipoperfuzie globală și multifocală prelungită – se dezvoltă de la 2 la 12 ore din perioada de postresuscitare. Rata metabolismului glucozei cerebrale este redusă la 50% din valoarea inițială, dar consumul global de oxigen al creierului revine la normal (sau mai mare) decât era înainte de momentul stopului circulator. PO2 venoasă cerebrală poate fi extrem de scăzută (mai puțin de 20 mmHg), reflectând deficiența livrării și consumului de oxigen. Motivul pentru aceasta este dezvoltarea vasospasmului, edemului, slugingul eritrocitelor și producția excesivă de endoteliine.
4. Această etapă se poate dezvolta în mai multe direcții:
4.1. Normalizarea fluxului sanguin cerebral și a consumului de oxigen de către țesutul cerebral, urmată de restabilirea conștienței.
4.2. Persistența comei persistente atunci când atât fluxul sanguin cerebral total, cât și consumul de oxigen rămân scăzute.
4.3. Re-dezvoltarea hiperemiei cerebrale asociată cu scăderea consumului de oxigen și dezvoltarea morții neuronale.
Evaluarea prognostică a stării în perioada de postresuscitare
Coma timp de 48 de ore sau mai mult este un predictor al unui rezultat neurologic slab. Dacă la 72 de ore după stopul circulator, deficitul neurologic este ≤ 5 puncte pe Scala de Comă Glasgow, nu există nicio reacție motorie ca răspuns la stimularea durerii sau reflexul pupilar, acesta este un predictor al dezvoltării unei stări vegetative persistente la toți pacienții.
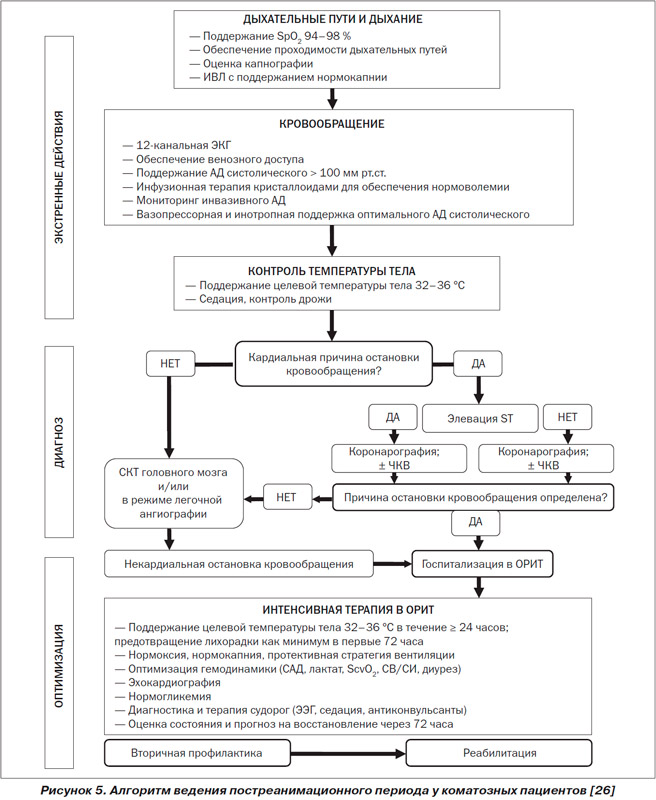
Principii terapie intensivă perioada de postresuscitare
1. Homeostazia extracerebrala
LA lucrare interesantă K. Sunde și colab. s-a demonstrat că introducerea unui protocol standardizat de terapie intensivă – perioada post-resuscitare îmbunătățește semnificativ supraviețuirea și calitatea recuperării după suferirea unui stop circulator. În general, terapia intensivă în perioada de postresuscitare vizează cauzele care au determinat stopul circulator și afectarea de reperfuzie a organelor.
Recomandările actuale sunt axate pe tratamentul agresiv al cauzelor stopului circulator. Deci, dacă cauza stopului circulator este infarct acut miocardului, angiografia coronariană urgentă urmată de angioplastie este recomandată ca îngrijire primară la această categorie de pacienți (și în prezența celei mai mici suspiciuni de infarct miocardic). Alte cauze ale stopului circulator, conform algoritmului „four G-four T” al cauzelor potențial reversibile, ar trebui diagnosticate rapid, iar pacienții ar trebui să primească terapie specializată.
Următoarele puncte de terapie intensivă vizează leziunile de reperfuzie ale organelor și includ:
1.1. Optimizare hemodinamică precoce: deoarece există o întrerupere a autoreglării fluxului sanguin cerebral, nivelul presiunii de perfuzie cerebrală (CPP) devine dependent de nivelul mediei tensiune arteriala(SBP): CPP = SBP - ICP.
Prin urmare, este foarte important să se mențină normotensiunea - PAS 70-90 mm Hg. În general, ADsist. trebuie să fie mai mare de 100 mm Hg. Mai mult, hipotensiunea arterială severă, precum hipertensiunea arterială, trebuie corectată.
Disfuncția miocardică postresuscitare poate fi cauza instabilității hemodinamice. În mod similar, sistemic răspuns inflamator in perioada de postresuscitare, reducerea rezistentei vasculare periferice totale, determina si o scadere a hemodinamicii. În acest sens, se recomandă utilizarea norepinefrinei și/sau a dobutaminei, în funcție de situația clinică.
1.2. Controlul precoce al ventilației și oxigenării: hiperoxia arterială ar trebui exclusă, nivelul FiO2 ar trebui să furnizeze SaO2 94-98%, deoarece s-a demonstrat că ventilația mecanică cu FiO2 1,0 în prima oră a perioadei de postresuscitare este asociată cu un rezultat neurologic slab din cauza creării de suplimentare. stresul oxidativ asupra neuronilor postischemici. Trebuie întreținut nivel normal PaO2 (normoxemie) și PaCO2 (normocapnie), deoarece vasoconstricția cauzată de hiperventilație, precum și hipoventilația duc la creșterea presiune intracraniană exacerba ischemia cerebrală. Astfel, hipoxia, hiperoxia și hiperventilația trebuie excluse din cauza posibilității de exacerbare a leziunii de reperfuzie.
1.3. Menținerea normoglicemiei— hiperglicemia persistentă este asociată cu un rezultat neurologic slab. Valoarea țintă a glicemiei este ≤ 10 mmol/L. Hipoglicemia ar trebui, de asemenea, exclusă.
1.4. Controlul activității convulsive- sindromul convulsiv, și mai ales epistatus precoce, este un predictor al unui rezultat nefavorabil. Se recomandă introducerea de benzodiazepine (clonazepam), fentoină, valproat și cu epiactivitate constantă - propofol sau tiopental de sodiu.
2. Homeostazia intracerebrala
Menține normotermia corpului. Riscul unui rezultat neurologic slab crește pentru fiecare grad > 37°C. Potrivit unui număr de lucrări publicate, o creștere a temperaturii corpului > 39 ° C în primele 72 de ore crește semnificativ riscul de a dezvolta moarte cerebrală.
Au fost aduse modificări ghidurilor actuale privind managementul țintit al temperaturii la pacienții supuși stopului circulator. Toți pacienții inconștienți care au suferit stop circulator trebuie ținuți la o temperatură corporală de 32-36°C. Orientările actuale se concentrează în primul rând pe menținerea normotermiei și evitarea hipertermiei, în special în primele 24 de ore ale perioadei de postresuscitare. În același timp, hipotermia terapeutică a organismului folosind tehnologii neinvazive și invazive pentru inducerea hipotermiei până la 32-34 °C timp de 12-24 de ore poate fi eficientă la un număr de pacienți. O lucrare publicată anterior este dedicată caracteristicilor managementului temperaturii. S-a remarcat, de asemenea, că hipotermia terapeutică prespitalicească la pacienții aproape de moarte este asociată cu o serie de complicații și în prezent nu este recomandată.
Metodele farmacologice de neuroprotecție în perioada de postresuscitare nu au primit încă o fundamentare bazată pe dovezi. În acest sens, combinația de hipotermie terapeutică și gaz inert xenon este considerată cea mai promițătoare direcție de neuroprotecție, care face obiectul unui număr de studii în curs.
În concluzie, ni se pare necesar să subliniem că este extrem de importantă introducerea unui protocol SLCR modern în practica clinica instituţiile medicale şi pregătirea pe baza acestora personal medical, precum și un protocol standardizat de terapie intensivă pentru perioada post-resuscitare în conformitate cu caracteristicile și capacitățile locale.
Bibliografie
1. Berdowski J., Berg R.A., Tijssen J.G., Koster R.W. Incidența globală a stopului cardiac în afara spitalului și ratele de supraviețuire: revizuirea sistematică a 67 de studii prospective // Resuscitare. - 2010. - V. 81.- P. 1479-1487.
2. Grasner J.T., Herlitz J., Koster R.W., Rosell-Ortiz F., Stamatakis L., Bossaert L. Quality management in resuscitation - towards a European cardiac stop registry (EuReCa) // Resuscitation. - 2011. - V. 82.-P. 989-994.
3. Grasner J.T., Bossaert L. Epidemiology and management of cardiac stop: what registres are revealing // Best Pract. Res. Clin. Anesteziol. - 2013. - V. 27. - P. 293-306.
4. Perkins G.D., Handley A.J., Koster R.W. et al. Ghidurile Consiliului European de Resuscitare pentru resuscitare 2015. Secțiunea 2. Suport vital de bază pentru adulți și defibrilare externă automată // Resuscitare. - 2015. - V. 95. - P. 81-99.
5. Bobrow B.J., Zuercher M., Ewy G.A. et al. Gâfâirea în timpul stopului cardiac la om este frecventă și asociată cu o supraviețuire îmbunătățită // Circulația. - 2008. - V. 118.-P. 2550-2554.
6. Koster R.W., Bauhin M.A., Bossaert L.L. et al. Ghidurile Consiliului European de Resuscitare pentru Resuscitare 2010. Secțiunea 2. Suport vital de bază pentru adulți și defibrilatoare externe automate // Resuscitare. - 2010. - V. 81.- P. 1277-1292.
7. Deakin C.D., O’Neill J.F., Tabor T. Resuscitarea cardiopulmonară numai prin compresie generează o ventilație pasivă adecvată în timpul stopului cardiac? // Reanimare. - 2007. - V. 75.-P. 53-59.
8. Stiell I.G., Brown S.P., Nichol G. et al. Care este adâncimea optimă de compresie toracică în timpul resuscitării în afara spitalului de stop cardiac a pacienților adulți? // Circulație. - 2014. - V. 130.-P. 1962-1970.
9. Vadeboncoeur T., Stolz U., Panchal A. et al. Adâncimea compresiei toracice și supraviețuirea în stopul cardiac în afara spitalului // Resuscitation. - 2014. - V. 85. - P. 182-188.
10. Hellevuo H., Sainio M., Nevalainen R. et al. Compresie mai profundă a pieptului - mai multe complicații pentru pacienții cu stop cardiac? // Reanimare. - 2013. - V. 84.- P. 760-765.
11. Idris A.H., Guffey D., Pepe P.E. et al. Ratele de compresie toracică și supraviețuirea după stop cardiac în afara spitalului // Crit. Care Med. - 2015. - V. - 43. P. 840-848.
12. Idris A.H, Guffey D., Aufderheide T.P. et al. Relația dintre ratele de compresie toracică și rezultatele stopului cardiac // Circulația. - 2012. - V. 125.-P. 3004-3012.
13. Usenko L.V. Tsarev A.V., Kobelyatsky Yu.Yu. Resuscitare cardiopulmonară și cerebrală. Ghid practic. - Dnepropetrovsk, 2013. - 69 p.
14. White L., Rogers J., Bloomingdale M. et al. Resuscitare cardiopulmonară asistată de dispecer: riscuri pentru pacienţii care nu se află în stop cardiac // Circulaţie. - 2010. - V. 121.- P. 91-97.
15. Haley K.B., Lerner E.B., Pirrallo R.G., Croft H., Johnson A., Uihlein M. Frecvența și consecințele resuscitarii cardiopulmonare efectuate de spectatori asupra pacienților care nu sunt în stop cardiac // Prehosp. Emerg. îngrijire. - 2011. - V. 15. - P. 282-287.
16. Moriwaki Y., Sugiyama M., Tahara Y. et al. Complicaţiile resuscitării cardiopulmonare ale observatorului la pacienţii fără stop cardiorespirator // J. Emerg. Șoc traumatic. - 2012. - V. 5. - P. 3-6.
17. Soar J., Nolan J.P., Bottiger B.W. et al. Ghidurile Consiliului European de Resuscitare pentru resuscitare 2015. Secțiunea 3. Suport vital avansat pentru adulți // Resuscitation. - 2015. - V. 5. - P. 99-146.
18. Deakin C.D., Nolan J.P., Soar J., Sunde K., Koster R.W., Smith G.B., Perkins G.D. Ghidurile Consiliului European de Resuscitare pentru Resuscitare 2010. Secțiunea 4. Suport de viață avansat pentru adulți // Resuscitare. - 2010. - V. 81.- P. 1305-1352.
19. Weistfeldt M.L., Becker L.B. Resuscitarea după stop cardiac - un model în 3 faze sensibil la timp // JAMA. - 2002. - V. 288.-P. 3035-3038.
20. Aversano T. Leziunea de reperfuzie în stopul cardiac și resuscitarea cardiopulmonară // Arestul cardiac: Știința și practica medicinei de resuscitare / Eds. N. Paradis et al. – Cambridge University Press, 2007. — P. 282-297.
21. Usenko L.V., Maltseva L.A., Panchenko G.V. Tsarev A.V. Principii moderne defibrilarea electrică a inimii și cardioversia. - Dnepropetrovsk, 2006. - 44 p.
22. Nolan J.P., Wenmar R.W., Adrie C. et al. Sindromul de stop cardiac: epidemiologie, fiziopatologie, tratament și prognostic. O declarație științifică a ILCOR; Comitetul de îngrijire cardiovasculară de urgență AHA; Consiliul pentru Chirurgie Cardiovasculară și Anestezie; Consiliul Cardiopulmonar Perioperator și Îngrijire Critică; Consiliul pentru Cardiologie Clinică; Consiliul pentru AVC // Resuscitare. - 2008. - V. 79.- P. 350-379.
23. Negovsky V.A. Retipărire a: Al doilea pas în resuscitare — tratamentul bolii post-resuscitare // Resuscitare. - 2012. - V. 83. - P. 1187-1190.
24. Negovsky V.A., Gurvich A.M. Boala postresuscitare este o nouă entitate nosologică. Realitate și sens // Probleme experimentale, clinice și organizatorice ale resuscitarii. - M., NIIOR, 1996. - S. 3-10.
25. Nolan J.P., Soar J., Cariou A. European Resuscitation Council și European Society of Intensive Care Medicine Guidelines for Post-resuscitation Care 2015. Secțiunea 5 din European Resuscitation Council Guidelines for Resuscitation 2015 // Resuscitation. - 2015. - V. 95. - P. 202-222.
26. Cerchiari E.L. Sindromul de postresuscitare // Stop cardiac: Știința și practica medicinei de resuscitare. — Ed. a II-a. /Ed. de N.A. Paradis, A.R. Halperin, K.B. Kern, V. Wenzel, D.A. şambelan. — Cambridge University Press, 2007, pp. 817-828.
27. Usenko L.V., Tsarev A.V., Yarovenko V.V. Boala post-resuscitare: departe de potențialul realizat // Medicină conditii de urgenta. - 2008. - Nr. 4. - S. 9-16.
28. Sunde K., Pytte M., Jacobsen D. et al. Implementarea unui protocol de tratament standardizat pentru îngrijirea post resuscitare după stop cardiac în afara spitalului // Resuscitare. - 2007. - V. 73.-P. 29-39.
29. Tsarev A.V. Managementul temperaturii țintă în practica clinică a terapiei intensive de terapie intensivă // Medicină de urgență. - 2014. - Nr. 7. - S. 186-191.
 Numărul din octombrie 2015 al reanimației a publicat noile linii directoare ale Consiliului European de Resuscitare (ERC-2015), care au introdus o serie de modificări la algoritmul de resuscitare cardiopulmonară și cerebrală (CPCR) prezentat în această revizuire.
Numărul din octombrie 2015 al reanimației a publicat noile linii directoare ale Consiliului European de Resuscitare (ERC-2015), care au introdus o serie de modificări la algoritmul de resuscitare cardiopulmonară și cerebrală (CPCR) prezentat în această revizuire.
Frecvența morții subite în Europa este de 55-113 cazuri la 100.000 de persoane/an, sau 350-700 de mii/an. Principiile organizatorice ale îngrijirii se bazează pe „lanțul de supraviețuire”, inclusiv recunoașterea precoce a stopului circulator și comunicarea către serviciile corespunzătoare, inițierea precoce a RCP, defibrilarea precoce și îngrijirea specializată în perioada de post-resuscitare timpurie.
Mecanismul primar al stopului circulator în 20-50% din cazuri este dezvoltarea fibrilației ventriculare (FV). Mai mult decât atât, de la utilizarea pe scară largă în SUA și Europa a defibrilației disponibile public cu ajutorul defibrilatoarelor externe automate - AED (Automatic Extemal Defibrillator), frecvența de înregistrare a FV ca mecanism primar de stop circulator în moartea subită a crescut la 76%.
Acest fapt subliniază importanța asigurării condițiilor pentru defibrilarea timpurie în locuri aglomerate (centre comerciale, săli de concerte, gări, aeroporturi, avioane etc.), ceea ce și-a demonstrat eficiența ridicată în întreaga lume.
Totodată, trebuie subliniat că primul pas în această direcție ar trebui să fie organizarea funcționării serviciului de ambulanță și pregătirea medicilor și paramedicilor în deprinderi de RCP cu dotarea obligatorie a tuturor ambulanțelor cu defibrilatoare automate.
Întrucât principalul succes al RCP cu rezultate neurologice bune este atins, conform statisticilor mondiale, tocmai în etapa prespitalicească, următorul pas este formarea dispecerilor medicali de urgență care vor putea să consilieze telefonic persoanele care caută ajutor și să instruiască persoane care nu sunt profesioniști. în RCP înainte de sosirea echipei de ambulanță.asistență medicală, așa cum a fost deja implementată în străinătate.
Complexul modern CPR (A - căi respiratorii, B respirație, C - circulație), pornind de la recomandările ERC-2010, a fost modificat în algoritmul C-A-B și, prin urmare, primul pas după diagnosticul de stop circulator este începerea imediată a toracelui. compresiuni și abia apoi restabilirea permeabilității căilor respiratorii și a respirației artificiale.
Conform noilor recomandări, accentul principal în formarea persoanelor neprofesioniste ar trebui să fie pus pe semnele unei stări critice precum lipsa de conștiență și respirația externă afectată, care ar trebui folosite ca markeri ai debutului stopului circulator. De remarcat faptul că respirația agonală (gafare) se observă în primele minute de stop circulator la 40% dintre pacienți și se asociază cu o rată de supraviețuire mai mare.
Etapa suportului vital elementar (SUPORT DE BAZĂ VIAȚĂ - BLS)
C. Bypass cardiopulmonar
compresie toracică. Problema fundamentală a suportului circulator artificial este nivelul foarte scăzut (mai puțin de 30% din normal) al debitului cardiac creat de compresiile toracice.
Compresia efectuată corespunzător asigură menținerea tensiunii arteriale sistolice la nivelul de 60-80 mm Hg, în timp ce tensiunea arterială diastolică depășește rar 40 mm Hg. și, ca urmare, provoacă un nivel scăzut al fluxului sanguin cerebral (30-60% din normă) și coronarian (5-20% din normă).
În timpul compresiunilor toracice, presiunea de perfuzie coronariană crește doar treptat și, prin urmare, cu fiecare pauză succesivă necesară respirației gură la gură, scade rapid. Este necesar un minim de 20 de compresii pentru a atinge cel mai înalt nivel posibil de hemodinamică sistemică. În acest sens, s-a demonstrat că raportul dintre numărul de compresiuni și frecvența respiratorie, egal cu 30: 2, este cel mai eficient.
Un studiu la pacienții intubați a arătat că, cu compresia toracică efectuată corespunzător, volumul curent este de numai 40 ml, ceea ce este insuficient pentru o ventilație adecvată.
Această prevedere este motivul pentru care nu se permite ca așa-numita RCP neventilata să fie inclusă în noile recomandări și se recomandă în continuare ca profanilor să li se învețe RCP standard, care include compresiile toracice și resuscitarea gură la gură. Cu toate acestea, în cazurile în care salvatorul nu poate sau nu dorește să efectueze resuscitarea gură la gură, este necesară o singură compresie toracică.
Un studiu pe 9136 de pacienți a arătat că o adâncime de compresie în intervalul 4-5,5 cm a fost asociată cu o rată de supraviețuire mai bună. Adâncimi mai mari de 6 cm au fost asociate cu mai multe complicații. La 13.469 de pacienți cu stop circulator, au fost comparate diferite rate de compresie toracică (>140/min, 120-139/min,< 80/мин, 80-90/мин), в результате максимально высокий уровень выживаемости наблюдался у пациентов, которым проводилась компрессия с частотой 100- 120/мин.
Principalul obiectiv al recomandărilor actuale este de a minimiza orice pauze care opresc compresiile toracice, deoarece compresiile toracice administrate corect sunt cheia pentru resuscitarea cu succes.
În general reguli pentru compresiile toracice prezentat în următorii termeni:
- Adâncimea de compresie nu este mai mică de 5 cm, dar nu mai mare de 6 cm.
- Frecvența compresiunilor ar trebui să fie de 100-120 într-un minut cu minimizarea, pe cât posibil, a pauzelor.
- Asigurarea decompresiei complete a pieptului dupa compresia toracica, fara a permite rezistenta cu mainile, in timp ce mainile nu trebuie sa se desprinda de pe piept.
- Raportul dintre numărul de compresiuni și frecvența respiratorie fără protecție a căilor respiratorii sau cu protecție prin mască laringiană sau Combitube atât pentru unul cât și pentru două resuscitatoare trebuie să fie de 30: 2 și efectuată cu o pauză de ventilație (risc de aspirație!).
- La pacienții intubați, compresiile toracice trebuie efectuate la o frecvență de 100-120 / min, ventilație - la o frecvență de 10 / min (în cazul utilizării pungii Ambu - 1 respirație la fiecare 5 secunde), fără pauză în timpul ventilație mecanică (deoarece compresia toracică cu umflarea simultană a plămânilor crește presiunea de perfuzie coronariană).
Conform rezultatelor unui număr de studii, cele mai frecvente complicații în timpul compresiei toracice au fost identificate: fracturile coastelor (13-97%) și fractura sternului (1-43%). În același timp, frecvența fracturilor a fost semnificativ mai mare la o adâncime de compresie mai mare de 6 cm, leziunile organelor interne (plămâni, inimă, organe abdominale) au fost observate mai puțin frecvent.
De asemenea, aș dori să prezint date interesante obținute din analiza a 345 de cazuri de compresii toracice neprofesionale la pacienți care erau inconștienți, dar care nu au avut stop circulator. Autorii au evidențiat o incidență scăzută a complicațiilor sub formă de fracturi ale coastelor și claviculei (1,7%), dureri în zona toracică la locul compresiei (8,7%). Nu au fost identificate complicații mai grave.
Aceste date, aparent, pot servi drept justificare pentru explicarea persoanelor neprofesioniste a semnelor care ar trebui să alerteze în legătură cu un posibil stop circulator, cum ar fi lipsa de conștiență și respirația externă afectată, deoarece supradiagnosticarea morții clinice este încă mai bună decât lipsa acestuia. -recunoașterea și, în consecință, RCP neefectuată.la pacienții pentru care este literalmente vitală.
Utilizarea dispozitivelor mecanice de compresie toracică nu s-a dovedit a fi superioară compresiei manuale standard și, prin urmare, nu este recomandată pentru utilizarea de rutină. Cu toate acestea, compresia mecanică poate fi utilă într-o serie de cazuri, facilitând RCP, de exemplu, în timpul transportului sau scoaterii pacientului din cameră, când este incomod să se aplice compresia manuală, precum și în cazurile de RCP prelungită.
A. Restaurarea permeabilității căilor respiratorii
Standardul de aur pentru managementul căilor respiratorii este intubarea traheală. În același timp, trebuie menționat că, conform studiului, intubația traheală la pacienții cu stop circulator este asociată cu o întârziere a compresiei toracice care durează în medie 110 secunde (de la 113 la 146 secunde), iar în 25% din cazuri, intubația a durat mai mult de 3 minute.
Se recomandă predarea intubației traheale fără a opri compresiile toracice. O scurtă pauză a compresiunilor este permisă în momentul trecerii tubului endotraheal prin corzile vocale, în timp ce această pauză nu trebuie să fie mai mare de 5 secunde.
Cu toate acestea, intubația traheală este o abilitate destul de complexă, care necesită o învățare îndelungată și o practică constantă. Astfel, într-unul dintre studii s-a arătat că numai după ce stagiari-anestezisti au efectuat circa 125 de intubații în sala de operație, nivelul intubațiilor reușite a început să ajungă la 95%.
Ca alternativă la intubarea endotraheală, se recomandă utilizarea unor metode mai simple din punct de vedere tehnic decât intubarea traheală, dar în același timp fiabile de protecție a căilor respiratorii, precum masca laringiana.
Cu toate acestea, trebuie amintit că, în comparație cu intubația traheală, riscul de aspirație este crescut. În acest sens, pentru a reduce riscul de aspirație, este necesară o pauză pentru compresia toracică în timpul ventilației mecanice (ALV) prin laringomască.
Se poate folosi lumen dublu conducta Combitube. Prin această metodă, permeabilitatea căilor respiratorii va fi garantată în orice locație a tubului căilor respiratorii, atât în esofag, cât și în trahee.
B. Suport respirator
La efectuarea ventilației prin metoda gură la gură, fiecare respirație artificială trebuie efectuată timp de 1 secundă (nu forțat), observând excursia toracelui, pentru a obține un volum curent optim și pentru a preveni intrarea aerului în stomac.
În acest caz, durata a două respirații artificiale gură la gură nu trebuie să depășească 10 secunde, după care este necesar să se continue imediat compresia toracică.
Volumul curent trebuie să fie de 500-600 ml (6-7 ml/kg), frecvența respiratorie - 10/min pentru a preveni hiperventilația. Studiile au arătat că hiperventilația în timpul RCP, prin creșterea presiunii intratoracice, reduce întoarcerea venoasă către inimă și scade debitul cardiac, asociat cu o supraviețuire slabă la acești pacienți.
Stadiul de susținere a vieții ulterioare (SUPORT AVANSAT DE VIAȚĂ - ALS)
Calea de administrare a medicamentului
- Intravenos, în venele centrale sau periferice. Calea optimă de administrare este venele centrale - subclavie și jugulară internă, deoarece este asigurată livrarea medicamentului administrat în circulația centrală. Pentru a obține același efect atunci când sunt administrate în vene periferice, medicamentele trebuie diluate în 20 ml de ser fiziologic.
- Calea intraosoasă - injectarea intraosoasă a medicamentelor în humerus sau tibie asigură o concentrație plasmatică adecvată, comparabilă în timp cu introducerea medicamentelor în vena centrală. Utilizarea dispozitivelor mecanice pentru administrarea intraosoasă a medicamentelor asigură simplitatea și accesibilitatea acestei căi de administrare.
Suportul farmacologic al resuscitarii
Adrenalină:
- cu activitate electrică fără puls / asistolă (EABP / asistolă) - 1 mg la fiecare 3-5 minute intravenos;
- în FV/TV fără puls, epinefrina se administrează numai după a treia descărcare ineficientă a defibrilației electrice la o doză de 1 mg. Ulterior, această doză este administrată intravenos la fiecare 3-5 minute (adică înainte de fiecare secundă de defibrilare) atât timp cât FV/VT rămâne fără puls.
Trebuie remarcat faptul că, după restabilirea circulației spontane, chiar și dozele mici de adrenalină (50-100 mcg) pot provoca dezvoltarea tahicardiei, ischemiei miocardice, FV/VT fără puls. Așadar, în perioada de postresuscitare precoce nu se mai administrează epinefrină și, dacă este necesar, se utilizează suport vasopresor, noradrenalina sau mezaton.
Amiodarona- un medicament antiaritmic de primă linie pentru FV/TV fără puls, refractar la terapia cu impuls electric, se administrează după a 3-a descărcare ineficientă la o doză inițială de 300 mg (diluat în 20 ml soluție de glucoză 5% sau alt solvent), iar după a cincea descărcare ineficientă se mai administrează încă 150 mg.
Lidocaina- în absența amiodaronei (nu trebuie utilizat ca adjuvant la amiodarona) - o doză inițială de 100 mg (1-1,5 mg/kg) IV, dacă este necesar, se administrează un bolus suplimentar de 50 mg (cu un total total). doza nu trebuie să depășească 3 mg/kg în prima oră).
Bicarbonat de sodiu- Nu se recomandă utilizarea de rutină în timpul RCP sau după restabilirea circulației spontane.
Stopul circulator este o combinație de acidoză respiratorie și metabolică. Metoda optimă de corectare a acidemiei în timpul stopului circulator este compresia toracică, un efect pozitiv suplimentar este asigurat de ventilație.
Administrarea de rutină a bicarbonatului de sodiu în timpul RCP datorită generării de CO2 care se difuzează în celule provoacă o serie de efecte adverse:
- creșterea acidozei intracelulare;
- efect inotrop negativ asupra miocardului ischemic;
- încălcarea circulației sângelui în creier din cauza prezenței sodiului cu osmolar ridicat;
- deplasarea curbei de disociere a oxihemoglobinei spre stânga, ceea ce poate reduce livrarea de oxigen către țesuturi.
Indicațiile pentru introducerea bicarbonatului de sodiu sunt cazuri de hiperkaliemie care pune viața în pericol, precum și stop circulator asociat cu hiperkaliemie sau supradozaj de antidepresive triciclice în doză de 50 mmol (50 ml - soluție 8,4%) sau 1 mmol / kg IV.
Clorura de calciu- in doza de 10 ml solutie intravenoasa 10% (6,8 mmol Ca2+) pentru hiperkaliemie, hipocalcemie, supradozaj de blocante ale canalelor de calciu.
Defibrilare
Efectuarea defibrilației precoce în primele 3-5 minute de la momentul stopului circulator asigură o rată de supraviețuire de până la 50-70%, care poate fi realizată numai cu introducerea defibrilației disponibile publicului. Totodată, fiecare minut de întârziere în defibrilare reduce cu 10-12% supraviețuirea pacienților în perioada post-resuscitare în stadiul de externare din spital.
În același timp, trebuie remarcat faptul că o serie de studii efectuate cu privire la utilizarea DEA de către echipele medicale într-un cadru spitalicesc, comparativ cu utilizarea defibrilatoarelor profesionale, au arătat o scădere a supraviețuirii pacientului.
Se distinge un model trifazic dependent de timp al dezvoltării fibrilației ventriculare, care include faze de dezvoltare secvențială:
- electric (primele 4-5 minute), timp în care o metodă eficientă de eliminare este defibrilarea electrică;
- circulator (ulterior 5-10 minute FV prelungit), o metodă eficientă de eliminare a acesteia este compresia toracică preliminară și numai defibrilarea electrică ulterioară;
- metabolic - terapia metabolică este necesară.
Trebuie subliniat faptul că compresia toracică continuă poate fi benefică în stadiile incipiente ale FV, în timpul fazelor electrice și circulatorii, în timp ce ventilația suplimentară devine mai importantă în faza metabolică târzie a FV. De asemenea, s-a constatat că administrarea compresiilor toracice timp de 180 de secunde înainte de defibrilare poate fi benefică (perioadele mai scurte de 30–60 s, precum și perioade mai lungi > 180 s, sunt ineficiente).
De asemenea, evaluarea ritmului/pulsului nu trebuie să depășească 10 secunde - dacă FV/VT rămâne fără puls pe ECG, este necesar să se aplice un al doilea șoc de defibrilare urmat de compresii toracice și componente RCP timp de 2 minute.
Dacă ritmul sinusal este restabilit conform monitorizării ECG, dar nu există puls, compresiile toracice trebuie continuate imediat timp de 2 minute, urmate de evaluarea ritmului și pulsului: șoc RCP timp de 2 minute -> evaluare ritm/puls -> șoc RCP timp de 2 minute. minute.
Defibrilarea monofazică nu mai este luată în considerare din cauza faptului că defibrilatoarele de acest tip nu mai sunt produse, iar principiul în sine, implementat în modelele mai vechi de defibrilatoare, este ineficient și provoacă leziuni severe post-defibrilare a miocardului.
Rezultatele studiilor au arătat că defibrilarea bifazică folosind mai puțină energie este semnificativ mai eficientă și provoacă mai puține leziuni și disfuncție post-resuscitare a miocardului în comparație cu energia echivalentă a unui puls monofazic.
Nivelul inițial de energie pentru defibrilatoarele bifazice ar trebui să fie de 150 J, urmat de o escaladare a energiei cu șocuri repetate. În general, este necesar să ne ghidăm după recomandările fabricilor - producători de defibrilatoare bifazice.
Atunci când se efectuează defibrilarea electrică, este obligatoriu să se îndeplinească trei condiții de bază: amplasarea corectă a electrozilor (unul în dreapta de-a lungul liniei parasternale de sub claviculă, celălalt în stânga de-a lungul liniei media-axilare în proiecția apexului). din inimă).
Pentru electrozii standard (neadezivi) în momentul aplicării descărcării, este necesar să se asigure că forța de aplicare pe electrozi este în limita a 8 kg și este imperativ să se folosească un gel conductor special sau, în lipsa acestuia, tampoane umezite cu o soluție conductivă. Utilizarea electrozilor uscați este inacceptabilă, deoarece aceasta reduce semnificativ eficacitatea defibrilării (reducerea acesteia la aproape zero) și provoacă arsuri pielii.
Noile linii directoare recomandă utilizarea electrozilor adezivi (autoadezivi) peste electrozii standard, deoarece s-au dovedit a fi mai confortabili, eliberează mâinile și reduc la minimum pauzele înainte de defibrilare. Toate modelele moderne de defibrilatoare, împreună cu electrozii standard, sunt echipate cu electrozi autoadezivi.
În timpul defibrilării, niciunul dintre participanții la resuscitare nu trebuie să atingă pacientul și/sau patul acestuia.
Daca pacientul are un stimulator cardiac implantat, electrozii defibrilatorului trebuie plasati la cel putin 8 cm distanta de pacient.In aceasta situatie se recomanda si amplasarea electrodului anterior-posterior.
Încă o dată, trebuie subliniat că în FV/TV fără puls, 1 mg epinefrină și 300 mg amiodarona IV trebuie administrate numai după al treilea șoc ineficient al defibrilației electrice. Ulterior, în cazul FV persistente, epinefrina se injectează la fiecare 3-5 minute pe toată perioada RCP. Amiodarona este reintrodusă ca doză unică de 150 mg după al cincilea șoc de defibrilare ineficient.
Monitorizare în timpul RCP
În noile recomandări, se acordă multă atenție monitorizării, ceea ce face posibilă evaluarea calității și eficacității activităților de resuscitare în curs. În acest sens, au fost propuse o serie de tehnologii pentru utilizare în procesul de RCP.
Aplicație senzor care evaluează calitatea compresiei torace în ceea ce privește frecvența și adâncimea compresiilor, precum și ventilația în ceea ce privește frecvența și volumul. Această tehnologie este implementată într-un număr de defibrilatoare moderne și este un dispozitiv care se află pe toracele pacientului și pe care se efectuează compresia în timpul RCP, cu afișarea ulterioară a parametrilor de compresie și ventilație de mai sus pe monitorul cardiac al defibrilatorului, în timp ce există posibilitatea de feedback cu un prompt vocal pentru corectitudinea activităților de resuscitare. Acest dispozitiv vă permite să controlați adâncimea optimă (nu mai puțin de 5 și nu mai mult de 6 cm) și frecvența compresiei și să preveniți hiperventilația.
Senzor capnografic, care este și o opțiune de defibrilator. Capnografia în timpul RCP vă permite să verificați poziția tubului endotraheal, să evaluați calitatea RCP și este un indicator precoce al restabilirii circulației sanguine independente eficiente hemodinamic.
Procedura cu ultrasuneteîn timpul RCP, permite identificarea cauzelor potențial reversibile ale stopului circulator conform algoritmului „patru G - patru T” (tamponada cardiacă, PE, pneumotorax), precum și identificarea activității pseudoelectrice fără puls.
Cauze potențial reversibile ale RCP
Probabilitatea unui rezultat favorabil al RCP în PAPA/asistolă (ca și în FV/TV refractară) poate fi crescută numai dacă există cauze potențial reversibile, tratabile de stop circulator. Ele sunt prezentate sub forma unui algoritm universal „patru G - patru T”.
Încetarea resuscitarii
RCP trebuie efectuată atât timp cât fibrilația ventriculară persistă pe ECG, deoarece metabolismul miocardic minim este menținut, permițând potențial restabilirea ROSC.
În cazul stopului circulator prin mecanismul EABP/asistolă, în absența unei cauze potențial reversibile (conform algoritmului „patru G - patru T”), RCP se efectuează timp de 30 de minute, iar dacă este ineficientă, se efectuează este oprit.
RCP pentru mai mult de 30 de minute se efectuează în cazuri de hipotermie, înec în apă cu gheață și supradozaj cu medicamente.
Momentul de încetare a resuscitarii este înregistrat ca momentul decesului pacientului.
Suport extracorporeal al vieții. Cercetările în curs extind din ce în ce mai mult capacitățile sistemelor de resuscitare cu perfuzie de urgență (EPR - Emergency Perfusion Resuscitation). Aceste sisteme sunt aparate portabile inimă-plămân care oferă suport circulator extracorporeal pacienților care sunt decedați clinic, la care RCP standard este ineficientă, dar există o cauză potențial reversibilă care poate fi afectată de terapii specifice.
Cauzele potențial reversibile pentru care este indicată EPR sunt:
- tromboză coronariană acută - pentru intervenția coronariană percutanată (PCI),
- PE masiv - pentru trombectomie,
- hipotermie generală severă - pentru încălzirea extracorporală a pacientului.
Trebuie subliniat faptul că aceste dispozitive, pe lângă încălzirea extracorporală, pot asigura inducerea hipotermiei terapeutice.
etapa de intretinere pe termen lung
În Marea Britanie a fost realizat un studiu epidemiologic care a implicat 24.132 de pacienți resuscitați, rata mortalității în perioada post-resuscitare a fost de 71%. De remarcat că dintre supraviețuitori, doar 15-20% și-au recăpătat rapid un nivel adecvat de conștiență, restul de 80% dintre pacienți au trecut prin boală de post-resuscitare (PRI).
Cauzele decesului în perioada de postresuscitare sunt: 1/3 - cardiace (cel mai mare risc în primele 24 de ore ale perioadei de postresuscitare), 1/3 - disfuncția diferitelor organe extracerebrale și 1/3 - neurologice (sunt cauza). de deces în perioada de lungă durată a PRP).
În 1972, un articol de V.A. Negevsky „Al doilea pas în resuscitare - tratamentul bolii post-resuscitare”, în care a introdus pentru prima dată însuși conceptul de boală post-resuscitare. În ciuda faptului că termenul „boală post-resuscitare” a fost înlocuit de consens internațional în 2008 cu „sindrom post-resuscitare”, ca un tribut adus V.A. Negevskii în 2012 în revista „Resuscitation” a fost republicată lucrarea sa clasică.
Potrivit lui V.A. Negevsky, „boala postresuscitare se caracterizează prin propria sa etiologie specială - o combinație inseparabilă de ischemie globală cu reoxigenare și reperfuzie. Deoarece reoxigenarea și reperfuzia după un stop circulator nu numai că elimină consecințele efectului patologic primar, ci provoacă și o cascadă de noi modificări patologice. Este important ca cauza acestor modificări să nu fie ischemia globală în sine, ci combinația ei cu reoxigenarea și reperfuzia.”
PRP este o combinație de procese fiziopatologice cu 4 componente cheie:
- leziuni cerebrale post-resuscitare;
- disfuncție miocardică postresuscitare;
- reacții sistemice de ischemie-reperfuzie;
- comorbidități persistente.
Prevalența leziunilor cerebrale postresuscitare se datorează complexității structurii sale morfologice, funcțiilor pe care le îndeplinește, precum și toleranței scăzute la ischemie și hipoxie. Nicio celulă din organism nu este la fel de dependentă de nivelul de oxigen și glucoză precum neuronul. Perioada maximă de timp a morții clinice (adică anoxie) în condiții normoterme, în care este posibilă supraviețuirea neuronilor, nu este mai mare de 5 minute.
Leziunile neuronale în PRB sunt de natură multifactorială și se dezvoltă în momentul stopului circulator, în timpul RCP, precum și în perioada de restabilire a circulației spontane.
- Perioada de ischemie - anoxie în momentul lipsei circulației sanguine în timpul morții clinice (fără flux).
- Perioada de hipoperfuzie - hipoxie în timpul menținerii artificiale a circulației sanguine în timpul RCP (low-flow), deoarece nivelul maxim posibil al debitului cardiac atinge doar 25% din cel inițial.
- Perioada de reperfuzie, constând din faze de dezvoltare succesive: no-reflow, urmată de o fază de hiperemie și ulterior hipoperfuzie globală și multifocală.
În perioada de postresuscitare, după restabilirea circulației sanguine spontane, se disting următoarele etape ale perfuziei cerebrale afectate:
- Dezvoltarea inițială a lipsei de reperfuzie multifocală (fenomenul fără reflux).
- Etapa de hiperemie globală tranzitorie - se dezvoltă la 5-40 de minute după restabilirea circulației spontane. Mecanismul dezvoltării sale este asociat cu vasodilatația vaselor cerebrale datorită creșterii concentrației intracelulare de Na + și adenozină, precum și scăderii pH-ului intracelular și a nivelurilor de Ca2 +. Durata ischemiei cerebrale determină ulterior durata etapei de hiperemie, care, la rândul său, este eterogenă în diferite regiuni ale creierului, ducând la scăderea perfuziei și umflarea astrocitelor.
- Etapa de hipoperfuzie globală și multifocală prelungită se dezvoltă de la 2 la 12 ore din perioada de postresuscitare. Rata metabolismului glucozei cerebrale este redusă la 50% din valoarea inițială, dar consumul global de oxigen al creierului revine la normal (sau mai mare) decât era înainte de momentul stopului circulator. P02 venoasă cerebrală poate fi la un nivel critic scăzut (mai puțin de 20 mmHg), reflectând deficiența livrării și consumului de oxigen. Motivul pentru aceasta este dezvoltarea vasospasmului, edemului, slugingul eritrocitelor și producția excesivă de endoteliine.
Această etapă se poate dezvolta în mai multe direcții:
- Normalizarea fluxului sanguin cerebral și a consumului de oxigen de către țesutul cerebral, urmată de restabilirea conștienței.
- Persistența comei persistente atunci când atât fluxul sanguin cerebral total, cât și consumul de oxigen rămân scăzute.
- Re-dezvoltarea hiperemiei cerebrale asociată cu scăderea consumului de oxigen și dezvoltarea morții neuronale.
Evaluarea prognostică a stării în perioada de postresuscitare
Coma timp de 48 de ore sau mai mult este un predictor al unui rezultat neurologic slab. Dacă, la 72 de ore după stopul circulator, deficitul neurologic este< 5 баллов по шкале комы Глазго, отсутствует двигательная реакция в ответ на болевое раздражение или зрачковый рефлекс, это является предиктором развития персистирующего вегетативного состояния у всех больных.
Principii de terapie intensivă a perioadei de postresuscitare
Homeostazia extracerebrala
Într-o lucrare interesantă, K. Sunde et al. S-a demonstrat că introducerea unui protocol standardizat de terapie intensivă pentru perioada post-resuscitare îmbunătățește semnificativ supraviețuirea și calitatea recuperării după suferirea unui stop circulator. În general, terapia intensivă în perioada de postresuscitare vizează cauzele care au determinat stopul circulator și afectarea de reperfuzie a organelor.
Recomandările actuale sunt axate pe tratamentul agresiv al cauzelor stopului circulator. Așadar, dacă cauza stopului circulator este infarctul acut de miocard, angiografia coronariană urgentă urmată de angioplastie este recomandată ca îngrijire primară la această categorie de pacienți (și dacă există cea mai mică suspiciune de infarct miocardic).
Alte cauze ale stopului circulator, conform algoritmului cauzelor potențial reversibile „patru G – patru T”, ar trebui diagnosticate rapid, iar pacienții trebuie să primească terapie de specialitate.
Următoarele puncte de terapie intensivă vizează leziunile de reperfuzie ale organelor și includ:
Optimizarea hemodinamică precoce: deoarece există o întrerupere a autoreglării fluxului sanguin cerebral, nivelul presiunii de perfuzie cerebrală (CPP) devine dependent de nivelul presiunii arteriale medii (MAP): CPP = SBP - ICP. Prin urmare, este foarte important să se mențină normotensiunea - PAS 70-90 mm Hg. În general, BPsyst ar trebui să fie mai mare de 100 mm Hg. Mai mult, hipotensiunea arterială severă, precum hipertensiunea arterială, trebuie corectată.
Disfuncția miocardică postresuscitare poate fi cauza instabilității hemodinamice. În mod similar, răspunsul inflamator sistemic în perioada de postresuscitare, reducând rezistența vasculară periferică totală, determină și o scădere a hemodinamicii. În acest sens, se recomandă utilizarea norepinefrinei și/sau a dobutaminei, în funcție de situația clinică.
Controlul precoce al ventilației și oxigenării: trebuie exclusă hiperoxia arterială, nivelul FiO2 ar trebui să furnizeze SaO2 94-98%, deoarece s-a demonstrat că ventilația mecanică cu FiO2 1,0 în prima oră a perioadei de postresuscitare este asociată cu un rezultat neurologic slab din cauza creării de stres oxidativ suplimentar asupra neuronilor postischemici.
Este necesar să se mențină nivelurile normale de PaO2 (normoxemie) și PaCO2 (normocapnie), deoarece vasoconstricția cauzată de hiperventilație, precum și hipoventilația care duce la creșterea presiunii intracraniene, exacerba ischemia cerebrală. Astfel, hipoxia, hiperoxia și hiperventilația trebuie excluse din cauza posibilității de exacerbare a leziunii de reperfuzie.
Menținerea normoglicemiei- hiperglicemia persistentă este asociată cu un rezultat neurologic slab. Valoarea țintă a glicemiei este nivelul<10 ммоль/л. Гипогликемия также должна быть исключена.
Controlul activității convulsive- sindromul convulsiv, și mai ales epistatus precoce, este un predictor al unui rezultat nefavorabil. Se recomandă introducerea de benzodiazepine (clonazepam), fentoină, valproat și cu epiactivitate constantă - propofol sau tiopental de sodiu.
homeostaziei intracerebrale
Menține normotermia corpului. Riscul unui rezultat neurologic slab crește pentru fiecare grad > 37°C. Potrivit unui număr de lucrări publicate, o creștere a temperaturii corpului > 39 °C în primele 72 de ore crește semnificativ riscul de moarte cerebrală.
Au fost aduse modificări ghidurilor actuale privind managementul țintit al temperaturii la pacienții supuși stopului circulator. Toți pacienții inconștienți care au suferit stop circulator trebuie ținuți la o temperatură corporală de 32-36°C.
Orientările actuale se concentrează în primul rând pe menținerea normotermiei și evitarea hipertermiei, în special în primele 24 de ore ale perioadei de postresuscitare. În același timp, hipotermia terapeutică a organismului folosind tehnologii neinvazive și invazive pentru inducerea hipotermiei până la 32-34 °C timp de 12-24 de ore poate fi eficientă la un număr de pacienți.
O lucrare publicată anterior este dedicată caracteristicilor managementului temperaturii. S-a remarcat, de asemenea, că hipotermia terapeutică prespitalicească la pacienții aproape de moarte este asociată cu o serie de complicații și în prezent nu este recomandată.
Metodele farmacologice de neuroprotecție în perioada de postresuscitare nu au primit încă o fundamentare bazată pe dovezi. În acest sens, combinația de hipotermie terapeutică și gaz inert xenon este considerată cea mai promițătoare direcție de neuroprotecție, care face obiectul unui număr de studii în curs.
În concluzie, ni se pare necesar să subliniem că este extrem de importantă introducerea unui protocol modern de RCP în practica clinică a instituțiilor medicale și pregătirea personalului medical pe baza acestora, precum și un protocol standardizat de terapie intensivă pentru perioada post-resuscitare. în conformitate cu caracteristicile și capacitățile locale.
Usenko A.V., Tsarev O.V., Kobelyatsky Yu.Yu.
Asociația Americană a Inimii (AHA), cea mai veche și cea mai mare asociație cardiovasculară voluntară din Statele Unite, a publicat o actualizare a ghidurilor sale pentru resuscitare cardiopulmonara(CPR) și îngrijire de urgență la boli cardiovasculare. Organizația pregătește acum peste 17 milioane de oameni în fiecare an în RCP și alte aspecte ale primului ajutor.
Documentul a fost publicat pe 15 octombrie 2015. în Circulație: Journal of the American Heart Association. Subliniază din nou că pornire rapidă resuscitare, educația de calitate, utilizarea tehnologiei, inclusiv a comunicațiilor mobile și coordonarea eforturilor pot crește șansele de supraviețuire ale victimei.
Stop cardiac, de obicei cauzat de încălcări grave ritmul este principala cauză de deces în SUA. Probabilitatea de supraviețuire în aceste cazuri depinde de inițierea imediată a RCP și de alte măsuri de către cei din jur.
Stopul cardiac în afara spitalului are loc la peste 326.000 de oameni în Statele Unite în fiecare an și aproximativ 90% dintre aceștia mor și adesea motivul este incapacitatea celor din jur de a efectua RCP sau teama că vor face ceva greșit. Noul document ne spune că instruirea de înaltă calitate în RCP este esențială nu numai pentru profesioniștii medicali, ci și pentru toți cei care ar putea fi la fața locului. Acest lucru le va permite să acționeze cu mai multă încredere și să ofere victimelor mai mult îngrijire de calitate. Această actualizare a ghidului prevede că toți trecătorii unui incident ar trebui să acționeze rapid și în paralel Telefoane mobile pentru a apela serviciile de urgență. Un obiectiv pentru care să lupți. experții organizației consideră inițierea imediată a RCP la absolut toate victimele stopului cardiac în afara spitalului.
Președintele AHA, profesorul Mark A. Krieger, explică: „În lanțul de supraviețuire, toată lumea are un rol de jucat, de la trecători la dispeceri, lucrători de urgență și profesioniști medicali. Dacă toată lumea își cunoaște rolul, știe cum să efectueze RCP și să coopereze, putem îmbunătăți dramatic șansele de supraviețuire ale victimelor stopului cardiac.”
Ghidurile AHA, care se bazează pe cele mai recente informații științifice privind îngrijirea urgențelor cardiovasculare, au fost publicate din 1966. și luați în considerare separat tacticile la adulți, copii, sugari și nou-născuți. Procesul ghidului implică sute de experți în domeniul resuscitării din diferite țări, care analizează mii de publicații în reviste evaluate de colegi.
Comunicatul de presă emis de organizație enumeră următoarele puncte cheie care pot ajuta la îmbunătățirea lucrului în echipă între toate părțile implicate:
- Acei martori ai incidentului care nu au primit instruire specială ar trebui să sune ambulanță(adică în SUA, sunați la 911) și efectuați RCP numai cu ajutorul mâinilor, adică nu încercați respirația artificială și limitați-vă la apăsări frecvente și puternice pe centrul pieptului la o frecvență de 100- 120 compresii pe minut. Dacă martorul este instruit în RCP și este capabil să administreze respirație artificială, atunci se adaugă compresiilor într-un raport de 30 de compresii la 2 respirații.
- Martorii trebuie să folosească telefoanele mobile pentru a chema o ambulanță, în timp ce formează 911 trebuie să pornească difuzorul de pe dispozitiv, astfel încât dispeceratul să le poată oferi sprijin consultativ și, dacă este necesar, să obțină coordonate mai precise ale locului.
- Controlorii trebuie să primească antrenament special pentru a putea ajuta trecătorii de la distanță să verifice respirația și să suspecteze stop cardiac. Dispeceratul ar trebui să fie, de asemenea, conștient de faptul că convulsii generalizate scurte pot fi semn precoce stop cardiac.
- Sistemele de expediere mobile care alertează toți potențialii salvatori din apropiere despre suspectarea unui stop cardiac pot crește frecvența RCP pentru stopul cardiac în afara spitalului și pot reduce timpul până la inițierea compresiilor. Autoritățile locale pot decide să lanseze un astfel de serviciu într-o anumită localitate, iar acest lucru poate optimiza salvarea.
Separat, documentul discută pregătirea RCP pentru lucrătorii medicali, care este esențial importantă pentru salvarea vieții pacientului dacă stopul cardiac are loc în timpul spitalizării. Conform statisticilor din Statele Unite ale Americii, în fiecare an, în spitale apar aproximativ 200.000 de cazuri de stop cardiac. În același timp, studiile arată că, fără practică, abilitățile CPR se deteriorează pe parcursul mai multor luni, adică cu mult înainte de sfârșitul a doi ani (în prezent, standardele americane necesită evaluarea abilităților lucrătorilor medicali în domeniul CPR la doi ani). intervale de ani). Formarea mai frecventă va permite spitalelor să obțină mai mult Calitate superioarăîngrijiri de urgență pentru pacienții cu boli cardiovasculare.
Recomandările actualizate solicită crearea unor sisteme integrate de îngrijire în care toate verigile să participe la programe de îmbunătățire continuă a calității și să formeze o singură rețea de servicii medicale de urgență și servicii comunitare de salvare. Pe lângă considerentele de optimizare organizațională, lucrarea prezintă următoarele recomandări noi pentru profesioniștii din domeniul sănătății:
- S-au adăugat limite superioare pentru ratele și adâncimile de compresie recomandate, deoarece noi dovezi au apărut prea mult frecventa inalta iar raportul de compresie poate fi mai puțin eficient. Salvatorii ar trebui să aplice acum compresii cu o rată de 100-120 pe minut și la o adâncime de cel puțin 2 inchi (aproximativ 5 cm), evitând în același timp compresiile mai mari de 2,4 inchi (aproximativ 6,1 cm), care sunt considerate excesive.
- Hipotermia controlată poate reduce afectarea creierului după stopul cardiac și poate îmbunătăți rezultatele neurologice, dovezile recente sugerând că o gamă mai largă de temperaturi este acceptabilă decât se credea anterior. Acum este recomandat să alegeți o temperatură țintă în intervalul 32-36 de grade Celsius și să o mențineți timp de cel puțin 24 de ore.
- Lucrătorii din domeniul sănătății sunt încurajați să facă acest lucru acțiunile necesare(de exemplu, verificarea respirației și a pulsului) în același timp pentru a începe compresiile mai repede).
- În prezent, nu există dovezi suficiente pentru beneficiul intubării de rutină la nou-născuții cu tonus respirator și muscular slab care au meconiu în sânge. lichid amniotic. În schimb, noul document recomandă plasarea copilului sub un radiator cu infraroșu și începerea RCP, astfel încât să primească oxigen mai repede.
Pentru ca Actualizarea Ghidului aflată în discuție să fie mai practică și adaptabilă unei varietăți de public, au fost produse trei versiuni ale documentului: o versiune integrală a actualizării Ghidului, un rezumat de sine stătător al mesajelor principale și o altă versiune scurtă. postat pe un site web dedicat cu vizualizare pe interfața dispozitivelor mobile.
I. Etapa suportului vital elementar (Basic Life Support - BLS)
A. Restaurarea permeabilității căilor respiratorii
Admisia triplă P. Safar și intubația traheală rămân standardul de aur pentru managementul căilor respiratorii. În același timp, trebuie remarcat faptul că, conform studiului, intubația traheală la pacienții cu stop circulator este asociată cu o întârziere a compresiei toracice care durează în medie 110 secunde (de la 113 la 146 secunde), iar în 25% din cazuri, intubația traheală a durat mai mult de 3 minute. Ca alternativă la intubația endotraheală, se recomandă utilizarea unor metode mai simple din punct de vedere tehnic decât intubația traheală, dar în același timp fiabile de protecție a căilor respiratorii:
a) utilizarea unei măști laringiene, totuși, trebuie amintit că, în comparație cu intubația traheală, riscul de aspirație este crescut. În acest sens, pentru a reduce riscul de aspirație, este necesară o pauză pentru compresia toracică în timpul ventilației mecanice (ALV) prin laringomască. Pe langa laringomastile standard, este permisa folosirea laringomascului I-gel, care are o manșeta negonflabila din gel elastomer termoplastic care repeta forma laringelui, iar la fixare sunt necesare abilitati elementare;
b) utilizarea unei conducte de aer cu dublu lumen Combitube; cu aceasta metoda de management al cailor respiratorii se va garanta in orice locatie a tubului cailor respiratorii - atat in esofag cat si in trahee.
B. Suport respirator
Atunci când se efectuează ventilația prin metoda gură-la-gură, fiecare respirație artificială trebuie efectuată timp de 1 secundă (nu forțat), în timp ce se observă excursia toracică pentru a obține un volum curent optim și a preveni intrarea aerului în stomac. Volumul curent trebuie să fie de 400–600 ml (6–7 ml/kg) și ritmul respirator de 10/min pentru a evita hiperventilația. Studiile au arătat că hiperventilația în timpul RCP, prin creșterea presiunii intratoracice, reduce întoarcerea venoasă către inimă și scade debitul cardiac, asociat cu o supraviețuire slabă la acești pacienți.
C. Bypass cardiopulmonar
Șocul precordial se efectuează atunci când resuscitatorul observă direct debutul fibrilației ventriculare/tahicardiei ventriculare (VF/VT) fără puls pe monitorul cardiac, iar defibrilatorul nu este disponibil în prezent. Are sens doar în primele 10 secunde de stop circulator. Conform rezultatelor lucrării, bătaia precordială elimină uneori VF/VT fără puls (în principal TV), dar cel mai adesea este ineficientă și, dimpotrivă, poate transforma ritmul în asistolă. Prin urmare, dacă medicul are un defibrilator gata de utilizare, este mai bine să se abțină de la șoc precordial.
Compresia toracică. Problema fundamentală a suportului circulator artificial este nivelul foarte scăzut (mai puțin de 30% din normal) al debitului cardiac (CO) creat de compresiile toracice. Compresia efectuată corespunzător asigură menținerea tensiunii arteriale sistolice la 60-80 mmHg, în timp ce tensiunea arterială diastolică depășește rar 40 mmHg. și, ca rezultat, determină un nivel scăzut al fluxului sanguin cerebral (30–60% din normal) și coronarian (5–20% din normal).
În timpul compresiunilor toracice, presiunea de perfuzie coronariană crește doar treptat și, prin urmare, cu fiecare pauză succesivă necesară respirației gură la gură, scade rapid. Totuși, câteva compresii suplimentare duc la restabilirea nivelului inițial de perfuzie cerebrală și coronariană. În acest sens, s-a demonstrat că raportul dintre numărul de compresii și frecvența respiratorie, egal cu 30: 2, este cel mai eficient:
a) raportul dintre numărul de compresiuni și frecvența respiratorie fără protecție a căilor respiratorii sau cu protecție prin mască laringiană sau Combitube atât pentru unul cât și pentru două resuscitatoare trebuie să fie de 30: 2 și efectuată cu o pauză pentru ventilație mecanică (risc de aspirație! );
b) cu protecție a căilor respiratorii (intubare traheală) - compresia toracică trebuie efectuată la o frecvență de 100 / min, ventilație - la o frecvență de 10 / min (în cazul utilizării pungii Ambu - 1 respirație la fiecare 5 secunde) fără o pauză în timpul ventilației mecanice (adică j. compresia toracică cu umflarea pulmonară concomitentă crește presiunea de perfuzie coronariană).
II. Etapa de susținere a vieții ulterioare (Suport de viață avansat - ALS)
Calea de administrare a medicamentului. Conform ghidurilor ERC din 2010, calea endotraheală de administrare a medicamentului nu mai este recomandată Studiile au arătat că în timpul RCP, doza de epinefrină administrată endotraheal, care este echivalentă cu doza din timpul RCP. administrare intravenoasă, ar trebui să fie de 3 până la 10 ori mai mare. Cu toate acestea, o serie de studii experimentale arată acest lucru concentratii scazute epinefrina administrată pe cale endotraheală poate provoca efecte b-adrenergice tranzitorii care duc la dezvoltarea hipotensiunii arteriale și la scăderea presiunii de perfuzie coronariană, care, la rândul său, afectează eficacitatea RCP. În plus, un volum mare de lichid injectat endotraheal poate afecta schimbul de gaze. În acest sens, noile recomandări folosesc două abordări principale pentru administrarea medicamentelor:
a) intravenos, în venele centrale sau periferice. Calea optimă de administrare este venele centrale - subclavie și jugulară internă, deoarece este asigurată livrarea medicamentului administrat în circulația centrală. Pentru a obține același efect atunci când sunt injectate în vene periferice, medicamentele trebuie diluate în 20 ml de ser fiziologic;
b) cale intraosoasă - injectarea intraosoasă a medicamentelor în humerus sau tibie, asigură o concentrație plasmatică adecvată, comparabilă în timp cu introducerea medicamentelor în vena centrală. Utilizarea dispozitivelor mecanice pentru administrarea intraosoasă a medicamentelor asigură simplitatea și accesibilitatea acestei căi de administrare.
Suportul farmacologic al resuscitarii
1. Adrenalina:
a) cu activitate electrică fără puls/asistolă (EABP/asistolă) - 1 mg la fiecare 3-5 minute intravenos;
b) cu FV/TV fără puls, adrenalină se administrează numai după a treia descărcare ineficientă de defibrilare electrică în doză de 1 mg. După aceea, această doză este administrată intravenos la fiecare 3 până la 5 minute (adică înainte de fiecare secundă de defibrilare) atât timp cât FV/VT rămâne fără puls.
2. Amiodarona este un medicament antiaritmic de primă linie pentru FV/TV fără puls, refractar la terapia cu electropuls după al 3-lea șoc ineficient, în doză inițială de 300 mg (diluat în 20 ml soluție salină sau glucoză 5%), dacă este necesar , se reintroduce 150 mg. După restabilirea circulației spontane, este necesar să se furnizeze picurare intravenoasă de amiodarona în doză de 900 mg în primele 24 de ore ale perioadei de post-resuscitare pentru a preveni refibrilația.
3. Lidocaină - în absența amiodaronei (și nu trebuie utilizată ca adjuvant la amiodarona) - o doză inițială de 100 mg (1–1,5 mg / kg) IV, dacă este necesar, un bolus suplimentar de 50 mg (cu doza totală nu trebuie să depășească 3 mg/kg timp de 1 oră).
4. Bicarbonat de sodiu – nu se recomandă utilizarea de rutină în timpul RCP sau după restabilirea circulației spontane.
Stopul circulator este o combinație de acidoză respiratorie și metabolică. Metoda optimă de corectare a acidemiei în timpul stopului circulator este compresia toracică, un efect pozitiv suplimentar este asigurat de ventilație.
Administrarea de rutină a bicarbonatului de sodiu în timpul RCP datorită generării de CO2 care se difuzează în celule provoacă o serie de efecte adverse:
Creșterea acidozei intracelulare;
Efect inotrop negativ asupra miocardului ischemic;
Încălcarea circulației sângelui în creier din cauza prezenței sodiului osmolar ridicat;
Deplasarea curbei de disociere a oxihemoglobinei spre stânga, ceea ce poate reduce livrarea de oxigen către țesuturi.
Indicațiile pentru introducerea bicarbonatului de sodiu sunt cazurile de stop circulator asociat cu hiperkaliemie sau supradozaj de antidepresive triciclice în doză de 50 mmol (50 ml - soluție 8,4%) IV.
5. Clorura de calciu - in doza de 10 ml solutie intravenoasa 10% (6,8 mmol Ca2+) pentru hiperkaliemie, hipocalcemie, supradozaj de blocante ale canalelor de calciu.
Utilizarea atropinei în timpul RCP nu mai este recomandată.
Studiile nu au arătat niciun efect al atropinei în stopul circulator prin mecanismul EABP/asistolă.
Stadiul F poate precede etapele A, B, C în caz de fibrilație, reluarea imediată a masajului câmpului de șoc duce adesea la transformarea asistoliei sau a EMD în ritm hemodinamic eficient sau chiar sinusal.
Doze de epinefrină 1 mg la fiecare 3-5 minute
Raport de ventilație 30:2 și masaj indirect inimi cu 1 sau 2 salvatori
COMPLICAȚII ALE REANIMĂRII:
COMPLICAȚII ALE REANIMĂRII PULMONARE
COMPLICAȚIILE RESUSCITĂRII CARDIACĂ
COMPLICAȚIILE TERAPIEI PULSOARE ELECTRICE (EIT)
COMPLICAȚII ALE REANIMĂRII PULMONARE:
Obstrucție URT, Aspirație, regurgitare, vărsături, sindrom de aspirație Mendelssohn
Complicații ale traheostomiei (infecțioase - laringită, traheobronșită, pneumonie, flegmon, tiroidită purulentă; neinfecțioase - sângerare, hemoaspirație, emfizem mediastin și grăsime subcutanată).
COMPLICAȚII ALE REANIMĂRII CARDIACĂ: Leziuni ale scheletului toracic
Fractura coastelor, sternului; afectarea inimii, plămânilor, ficatului, splinei; hemotorax, pneumotorax; ruptura capsulei hepatice, sângerare/
COMPLICAȚII ALE EIT: Arsuri ale pielii, energie selectată incorect, electrozii nu se potrivesc bine, fibrilație întârziată, nerespectarea măsurilor de siguranță.
INDICAȚII PENTRU MASAJUL INIMA DESCHISĂ (TORACOTOMIE REANIMATIONALĂ):
deschis cutia toracică(intraoperator), embolie pulmonară, fracturi multiple de coaste, leziuni cardiace.
ÎNCETAREA MĂSURILOR DE RESUSCITAREA.
(Ordinul nr. 73 din 4 martie 2003 Instrucțiuni pentru stabilirea criteriilor și procedurii de stabilire a momentului decesului unei persoane, încetarea resuscitarii)
Când măsurile de resuscitare sunt recunoscute ca nepromițătoare sau constatatoare moartea biologică:
Atunci când se constată decesul unei persoane pe baza morții cerebrale, inclusiv pe fondul utilizării ineficiente a întregii game de măsuri care vizează menținerea vieții. Cu ineficacitatea resuscitarii în 30 de minute
NU SE REALIZEAZĂ MĂSURI DE REANIMARE:
În prezența semnelor de moarte biologică, cu debutul unei stări de moarte clinică pe fondul progresiei bolilor incurabile stabilite în mod fiabil sau a consecințelor incurabile ale unei leziuni acute incompatibile cu viața.
MONITORIZARE CONTINUA
Prin urmare, măsurile obligatorii sunt: monitorizarea ECG, monitorizarea constantă a stării pacientului, menținerea accesului fiabil la venă, disponibilitatea personalului medical de a relua RCP, terapie intensivă care vizează prevenirea și corectarea tulburărilor circulatorii, respiratorii, ale SNC și a altor tulburări vitale. . organe importanteși sisteme.
Utilizarea timpurie a măsurilor eficiente de resuscitare, în funcție de tipul și mecanismul stopului circulator, monitorizarea atentă a stării pacientului în perioada post-resuscitare, prevenirea stopului circulator repetat și corectarea în timp util a complicațiilor apărute - conditiile necesare pentru un rezultat favorabil în tratamentul pacienţilor care au suferit deces clinic.
rezumat
Articolul descrie modificările moderne ale algoritmului de resuscitare cardiopulmonară și cerebrală adoptat de Consiliul European pentru Resuscitare în 2010.
Cuvinte cheie
Resuscitare cardiopulmonară și cerebrală, stop circulator, defibrilare, resuscitare.
Bibliografie
1. Usenko L.V., Maltseva L.A., Tsarev A.V. Resuscitare cardiopulmonară și cerebrală: noi recomandări Consiliul European privind resuscitarea în 2005 și probleme nerezolvate de resuscitare în Ucraina // Medicina condițiilor de urgență. - 2006. - Nr 4. - S. 17-22.
2. Deakin C.D., Nolan J.P., Soar J., Sunde K., Koster R.W., Smith G.B., Perkins G.D. Ghidurile Consiliului European de Resuscitare pentru Resuscitare 2010. Secțiunea 4. Suport de viață avansat pentru adulți // Resuscitare. - 2010. - V. 81. - P. 1305-1352.
3. Nolan J.P., Wenmar R.W., Adrie C. et al. Sindromul de stop cardiac: epidemiologie, fiziopatologie, tratament și prognostic. O declarație științifică a ILCOR; Comitetul de îngrijire cardiovasculară de urgență AHA; Consiliul pentru Chirurgie Cardiovasculară și Anestezie; Consiliul Cardiopulmonar Perioperator și Îngrijire Critică; Consiliul pentru Cardiologie Clinică; Consiliul pentru AVC // Resuscitare. - 2008. - V. 79. - P. 350-379.
4. Wang H.E., Simeone S.J., Weaver M.D., Callaway C.W. Întreruperi în resuscitarea cardiopulmonară din intubația endotraheală paramedică // Ann. Emerg. Med. - 2009. - V. 54. - P. 645e1-652e1.
5. Koster R.W., Bauhin M.A., Bossaert L.L. et al. Ghidurile Consiliului European de Resuscitare pentru Resuscitare 2010. Secțiunea 2. Suport vital de bază pentru adulți și defibrilatoare externe automate // Resuscitare. - 2010. - V. 81. - P. 1277-1292.
6. Handley A.J., Koster R., Monsieurs K., Perkins G.P., Davies S., Bossaert L. Adult basic life support and use of automated external defibrillators // European Resuscitation Council Guidelines for Resuscitation 2005 / J.P. Nolan, P. Baskett (Ed.). - Elsevier, 2005. - S7-S23.
7. Vaknin Z., Manisterski Y., Ben-Abraham R. şi colab. Adrenalina endotraheală este dăunătoare din cauza efectului beta adrenergic? // Anesth. Analg. - 2001. - V. 92. - P. 1408-1412.
8. Elizur A., Ben-Abraham R., Manisterski Y. și colab. Epinefrină traheală sau norepinefrină precedată de beta-blocare la un model de câine. Blocarea beta poate oferi beneficii? // Reanimare. - 2003. - V. 59. - P. 271-276.
9. Engdahl J., Bang A., Lindqvist J., Herlitz J. Putem defini pacienții fără și pe cei cu o anumită șansă de supraviețuire atunci când sunt găsiți în asistolie în afara spitalului? // Am. J. Cardiol. — 2000. -V. 86. - P. 610-614.
10. Engdahl J., Bang A., Lindqvist J., Herlitz J. Factorii care afectează prognosticul pe termen scurt și lung printre 1069 de pacienți cu stop cardiac în afara spitalului și activitate electrică fără puls // Resuscitation. - 2001. - V. 51. - P. 17-25.
11. Deakin C.D., Nolan J.P., Sund K., Koster R.W. Ghidurile Consiliului European de Resuscitare pentru Resuscitare 2010. Secțiunea 3. Terapii electrice: Defibrilatoare externe automate, defibrilare, cardioversie și stimulare // Resuscitare. - 2010. - V. 81. - P. 1293-1304.
12. Tsarev A.V., Ussenko L.V. Comparație între formele de undă bifazice cvasizinozoidale și trunchiate într-un model porcin de FV // Resuscitare. - 2010. - V. 81S-S54.
13. Ussenko L.V., Tsarev A.V., Leschenko Y.A. Naum L. Gurvich: Un pionier al defibrilației // Resuscitation Greats / P. Baskett, T. Baskett (eds.). - Clinical Press, 2007. - P. 200-202.
14. Usenko L.V., Tsarev A.V. Resuscitarea cardiopulmonară și cerebrală: un ghid practic. — Ed. a II-a, corectată. si suplimentare - Dnepropetrovsk, 2008. - 47 p.
15. Nadkarni V.M., Larkin G.L., Peberdy M.A. et al. Primul ritm documentat și rezultatul clinic al stopului cardiac în spital în rândul copiilor și adulților // JAMA. - 2006. - V. 295. - P. 50-57.
16. Nolan J.P., Laver S.R., Welch C.A., Harrison D.A., Gupta V., Rowan K. Rezultatul după admiterea în unitățile de terapie intensivă din Regatul Unit după stop cardiac: o analiză secundară a bazei de date a programului ICNARC Care Mix // Anestezie. - 2007. - V. 62. - P. 1207-1216.
17. Negovsky V.A., Gurvich A.M. Boala postresuscitare este o nouă entitate nosologică. Realitate și sens // Probleme experimentale, clinice și organizatorice ale resuscitarii. — M.: NIIOR, 1996. — S. 3-10.
18. Cerchiari E.L. Sindromul de postresuscitare // Stop cardiac: știința și practica medicinei de resuscitare (ed. a II-a) / Ed. de N.A. Paradis, A.R. Halperin, K.B. Kern, V. Wenzel, D.A. şambelan. - Cambridge University Press, 2007. - P. 817-828.
19. Usenko L.V., Tsarev A.V., Yarovenko V.V. Boala post-resuscitare: departe de potențialul realizat // Medicina condițiilor de urgență. - 2008. - Nr 4. - S. 9-16.
20. Usenko L.V., Tsarev A.V. Hipotermia artificială în resuscitarea modernă // Resuscitarea generală. - 2009. - Nr 1. - S. 21-23.


