31.07.2019
Enflamatuar hücreler. Büyük petrol ve gaz ansiklopedisi
En önemli süreç inflamasyon, lökositlerin koruyucu bir işlev görmesi için damarlardan flogojen tarafından zarar gören dokuya lökositlerin göç etmesidir. Bununla birlikte, lökositler iltihap bölgesinde belirir ve ikincil bir değişiklik gerçekleştirir; aynı zamanda düzenleyici bir işlevi de yerine getirir.
Lökositlerin göçü şu şekilde gerçekleştirilir: lökositler, önce plazma katmanının sınırına kadar eksenel akıştan çıkar ve ardından damarın endotel hücrelerine yapışmaya başlar. Lökositlerin yapışmasında (Latince adhaesio - yapışma) önemli bir rol endotel-lökosit yapışma moleküllerine atanır. selektinler ve integrinler. Sitokinler IL-1.8, PAF, TNF-a ve kompleman bileşenlerinin etkisi altında, lökosit ve endotel membranlarında konformasyonel değişiklikler meydana gelir ve adezyon molekülleri eksprese edilir.
Göç aşamaları:
· Aşama I – lökositlerin geri dönüşümlü yapışması, yuvarlanması veya kayması;
· Aşama II – endotele geri dönüşümsüz yapışma ve ardından transendotelyal migrasyon;
· Aşama III- kemotaksis - iltihap bölgesinde yönlendirilmiş hareket.
Lökositlerin endotele yapışması damar ligand-reseptör mekanizması prensibine göre oluşur. Lökosit adezyonu için uyarıcı faktörler inflamatuar aracılardır: eikosanoidler, biyojen aminler, interlökin-1, interlökin-8, PAF, TNF-a, kompleman bileşenleri.
Yuvarlanma fazı (lökosit kayması) moleküller - selektinler tarafından sağlanır.Selektinlerin 3 alt grubu vardır:
- L-selektinler (LAM-1) lökositler tarafından sentezlenir
- P-selektin - glikoprotein ligandı (GMP-140)
- E-selektin(ELAM-1) endotel hücreleri tarafından sentezlenir
Pirinç. 6. Endotel üzerindeki yapışma moleküllerinin ifadesi
Sıkı yapışma aşaması - lökositler ve vasküler endotel arasındaki etkileşimin daha sonraki bir aşaması, ICAM-1 molekülü (hücreler arası adezyon molekülü –1 veya hücreler arası adezyon molekülü-1) (Şekil 6) ve VCAM-1 (damar hücresel adezyon molekülü-1 veya adezyon molekülü) tarafından sağlanır. birinci tip vasküler endotelyumun) (Şekil 7).
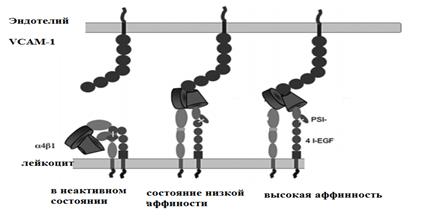
Pirinç. 7. Hücre yapışma moleküllerinin farklı afiniteleri için seçenekler
Transendotelyal göç Dokudaki lökositler, doğuştan gelen ve kazanılmış bağışıklığın önemli bir unsurudur. Bu sürecin iki olası yollar uygulama. Bodrum zarının üstesinden gelmek damar duvarı muhtemelen endotelyal temas yoluyla (hücrelerarası göç). Parçalı çekirdeğe sahip tüm granülositler, nötrofillerin parçalanmış çekirdekleri dar aralıklardan geçebildiği için endotel hücreleri arasından interendotelyal bağlantılardan geçebilir. PECAM molekülünün rolü lökositlerin transendotelyal göçünde önemlidir ( trombosit/endotel hücre yapışma molekülü).
Lökosit ve endotel üzerindeki PECAM molekülleri arasında yapışmanın oluşması, lökosit göçünün tüm sürecindeki en hassas adımdır. PECAM'a bağlı göç mekanizması sonraki süreç: Lökositler hücrenin bazal membranına doğru ilerledikçe endotelyal temas alanında psödopodyum oluştururlar. Lökositin endotele bağlanma süreci sonunda hücrenin tamamı endotel altı katmana doğru hareket eder.
Mononükleer hücreler Monositler ve lenfositler gibi endotel hücreleri arasında da endotelin önemli ölçüde aktivasyonu ve şeklinde bir değişiklik ile geçiş yapabilirler.
Lökositlerin iltihap bölgesine hareketi.
Lökositlerin (mikrofajlar, makrofajlar) iltihap bölgesine yönlendirilmiş hareketi sürecine denir. kemotaksis, Hücrelerin bu yönlendirilmiş hareketine neden olan maddelere denir. kemoatraktanlar ve eksojen ve endojen olarak ikiye ayrılır. Eksojen kemoattraktanlar, diğer yabancı maddelerin yanı sıra atık ürünleri veya mikroorganizmaların yapısal elemanlarını içerir.
Lökosit kemotaksisinin uyarılmasındaki ana rol, spesifik olmayan ve spesifik olabilen endojen kemoattraktanlara aittir. Biyolojik olarak aktif maddelerin çoğu, ayrıca hücre hasarı ürünleri ve inflamatuar aracılar (histamin, serotonin, ATP, DNA, fibrin bozunma ürünleri (FDP), kollajen bozunma ürünleri, fibronektin, trombin) spesifik olmayan kemoatraktanlar olarak işlev görür. Bazı maddeler kemotaksis için temel öneme sahiptir ve bunların oluşumunun bozulması lökositlerin damarlardan salınmasını önemli ölçüde etkiler. Bu maddelere spesifik kemoattraktanlar denir. Bunlar şunları içerir: lökotrien B4 ve kompleman (C5a, C3a) (nötrofillerin, eozinofillerin ve monositlerin kemotaksisini belirlerler); trombosit aktive edici faktör (nötrofillerin ve eozinofillerin kemotaksisini etkiler)
LtB 4, PAF, tamamlayıcı bileşenler C5a ve C3a'nın özgüllüğü oldukça koşulludur, çünkü bu maddelerin birçok başka etkisi vardır ve bunların en önemlilerinden biri kemotaksiyi uyarmaktır. Enflamasyon sırasında büyük miktarlarda oluşurlar ve ağırlıklı olarak nötrofil granülositlerini inflamasyon bölgesine çekerler.
Kemotaksis mekanizmalarında özel bir rol, kemotaksiyi düzenleyen sitokinler olan kemokinlere aittir. Bunların arasında özellikle aktif bir kemo-çekici etkisi vardır. interlökin-8 (IL-8). Endotoksin, TNF-a ve IL-1'e yanıt olarak çoğu hücre tarafından üretilebilir. Ek olarak kemokinler arasında epitelyal hücre nötrofil aktive edici peptid (ENA-78), nötrofil aktive edici peptit-2 (NAP-2) ve makrofaj inflamatuar protein a ve β (MIP-1), makrofaj inflamatuar protein α ve β ( MIP-2) yer alır. ), monosit kemotaksis proteini (MCP-1, 2 ve 3), eotaksin.
Kemokinler, çeşitli lökositlerin damarlardan çıkışının daha iyi düzenlenmesinden sorumludur, bu da lökosit göçünün doğru sırasına katkıda bulunur. Kan damarlarından lökosit çıkış sırasının düzenlenmesi önemlidir biyolojik önemi. Herhangi bir inflamasyonun ilk savunma hattı, spesifik olmayan bağışıklığa ait olan nötrofilik lökositlerdir. Antijeni hızlı bir şekilde yok etmek mümkün değilse, spesifik bağışıklık aktif olarak aktive edilir ve önce antijen sunan hücreler (kan monositler) ve ardından lenfositler ve eozinofiller iltihaplanma bölgesine girer.
Organlar ve dokular ayrıca lokal inflamatuar yanıtın başlatılmasında anahtar rol oynayan kendi artık makrofaj popülasyonuna da sahiptir. Nötrofil alımı sırasında artık makrofaj popülasyonu azalır. Bu fenomene denir makrofajların kaybolma reaksiyonları. Nötrofiller gibi kan monositleri de iltihaplanma bölgesine göç eder ve bir süreliğine makrofajlara dönüşür, ancak dokudaki maksimum sayıları nötrofillerden biraz sonra gözlenir.
Nötrofiller güçlü histotoksik özelliklere sahiptir. Bu nedenle, diğer lökositler toplandıkça nötrofillerin apoptoz veya nekroz yoluyla ölmesi gerekir. Ayrıca bazı nötrofiller lenfatik drenaj sistemi yoluyla iltihap bölgesini terk edip tekrar kan dolaşımına girebilirler.
FAGOSİTOZ
Ilya Ilyich Mechnikov, 1883'te fagositozu tek hücreli ve canlıların yaşamındaki genel bir biyolojik fenomen olarak tanımladı. Çok hücreli organizmalar, diğer hücrelerin hücreler tarafından emilmesinden oluşur.
Fagositoz, parçacıkların bir hücre tarafından reseptör endositozu yoluyla alınması işlemidir. Fagositlerin maksimum aktivitesi, çapı 1 mikrondan büyük parçacıklara göre gözlenir. Ancak çapı 100 nm'ye kadar olan daha küçük parçacıkların fagositozu da mümkündür. İltihaplanma bölgesindeki fagositoz, "profesyonel" fagositler olan makrofajlar tarafından gerçekleştirilir. Fagositoz birkaç aşamada meydana gelir: 1 - yaklaşım (kemotaksis), 2 - fagositoz nesnesine bağlılık (çekim, yapışma), 3 - fagositoz nesnesinin daldırılması (reseptör endositozu), 4 - öldürme (öldürme), 5 - hücre içi sindirim.
3.6.1. Bir lökositin fagositoz nesnesine yapışması Reseptör aracılı süreç. Lökositlerin zarında, "birincil bağışıklık" reseptörlerine ait olan birçok mikroorganizma antijeni için reseptörler bulabilirsiniz. Bununla birlikte, bir lökositin bir antijene bağlanmasına ilişkin bu mekanizma sınırlıdır ve tam teşekküllü bir bağışıklık tepkisine izin vermez. Bu nedenle, çoğu durumda, bir lökositin fagositoz nesnesine yapışması, immünoglobulinler (esas olarak IgG) ve kompleman sistemi (C3b) olan evrensel "aracılar" yardımıyla gerçekleştirilir. Fagositoz nesnesini daha sonraki fagositoz için bu tür proteinlerle bağlama işlemine denir. opsonizasyon ve bu işlevi yerine getiren proteinlerin kendileri opsoninler. Fagositoz nesnesinin opsonizasyonundan sonra, lökosit, mikroorganizmanın antijeniyle değil, immünoglobulinin Fc fragmanı için karşılık gelen reseptör aracılığıyla veya C3b için reseptör aracılığıyla immünoglobulin ile etkileşime girer. İmmünoglobulinler G1 ve G3, opsoninler olarak en aktif olanlardır ve daha az ölçüde M ve E'dir. Fcγ veya diğer Fc reseptörleri tarafından tanınırlar. Kompleman faktörü C3b ve onun kararsız formu iC3b, hem fagositoz nesneleri tarafından doğrudan aktive edildiğinde hem de immünoglobulinler ve immün kompleksler tarafından aktive edildiğinde CR1-CR3 reseptörleri yoluyla opsonizasyonda rol oynar. Opsonizasyon yapışma aktivitesini birkaç kez artırır. C-reaktif protein aynı zamanda bir ko-opsonindir, çünkü pnömokokların ve diğer mikropların C-proteinine bağlanır ve tamamlayıcı faktörlerin ve fagositlerin bunlara bağlanmasına aracılık eder.
Bazen opsonizasyonun olumsuz bir etkisi olabilir. Bazı mikroorganizmalar (örneğin, Stafilokok aureus) ve evrim sürecindeki virüsler (örneğin, herpes virüsü), Fcγ reseptörlerinin protein analoglarını kullanarak opsonizasyondan kaçmalarına izin veren yetenekler geliştirmişlerdir. Opsonin antikorlarını bloke ederek fagositlerin kendilerine sahip olan nesneye yapışmasını engellerler. Antikorlara yalnızca Fab ile değil aynı zamanda Fc fragmanı ile bağlanma kabiliyetine sahip patojenler, birkaç immünoglobulin molekülü ve mikrobiyal cisim (viral parçacıklar) içeren büyük komplekslerin oluşumunu tetikleyebilir.
Başlangıçta vücutta, bir mikroorganizmanın belirli bir antijeniyle temas kurabilen yetersiz miktarda immünoglobulin bulunur, bu nedenle, belirli bir antijene özgü yeterli miktarda immünoglobulin oluşmadan maksimum fagositoz aktivitesi imkansızdır. Antijenin tanınmasından ve antijene özgü immünoglobulinlerin üretilmesinden sonra, opsonizasyon süreci yoğunlaşır, böylece fagositoz da dahil olmak üzere mikroorganizmanın yok edilmesi sağlanır.
3.6.2 Daldırma aşaması Fagositozun amacı bir fagozom oluşumuyla sona erer. Bu süreç enerjiye bağlıdır ve opsonize edilmiş mikroorganizmanın fagosit zarı üzerindeki karşılık gelen reseptörlerle etkileşiminden sonra ortaya çıkan fagositin kasılabilir proteinlerinin çalışmasıyla ilişkilidir. Daldırma sonucunda nesne kendisini fagosit sitoplazmasında bulur ve hücre zarının bir bölümünün istila edilmesi ve kapanmasıyla oluşturulan bir fagozomla tamamen çevrelenir.
3.6.3.Sindirim aşaması hücre iskeleti mikrofilamentlerinin ve fagosojen proteinlerin katılımıyla oluşur. Fagozom, lizozomlar ve spesifik fagosit granülleri (iç degranülasyon) ile birleşerek fagositozun son aşamasının meydana geldiği bir fagolizozom oluşturur. Tüm bu işlemler, kalsiyum iyonlarının hücreye girmesi ve protein kinaz C'nin aktivasyonu ile başlatılır.
Fagositoz nesnelerinin yok edilmesi (öldürülmesi) çeşitli mekanizmalar kullanılarak gerçekleşir. Oksijene bağımlı ve oksijenden bağımsız olarak ikiye ayrılırlar:
Oksijene bağlı öldürme halojenasyon ve peroksidasyon reaksiyonunda oluşan bileşenler, yani hipoklorit, hidrojen peroksit, tekli oksijen, hidroksil radikalleri ve diğer reaktif oksijen türleri tarafından fagozom içeriğinin yok edilmesinden oluşur.
Oksijenden bağımsız mekanizmalara lizozim, elastaz, kollajenaz, katepsinler, laktoferrin, katyonik proteinler gibi maddelerin etkilerini içerir (defensinler, protegrinler).
Mikroorganizmanın ölümünden sonra yapılarının fagosit enzimleri tarafından son sindirimi gerçekleşir. Mikroorganizmanın yok edilmesi ve fagositoz nesnesinin sindirimi ile sonuçlanan fagositoz denir. tamamlanmış.
3.6.3.3. Eksik fagositoz.
1. Virüslerde (örneğin influenza virüsü), bakterilerde (mikobakteriler) ve protozoalarda (toksoplazma) bulunan fagozomal-lizozomal füzyonun bloke edilmesi.
2. Lizozomal enzimlere (gonokok ve stafilokok) karşı direnç.
3. Patojenik mikroorganizmaların emildikten sonra fagozomlardan hızla ayrılma ve sitoplazmada uzun süre kalma (rickettsia) yeteneği.
4. Mikroorganizmaların yok edilmesini ve fagositin antijen sunma fonksiyonunu bloke eden hidrojen peroksiti (stafilokok, aspergillus) yok eden katalaz üretme yeteneği.
ÇOĞALMA
İnflamasyon bağlamında proliferasyon şu anlama gelir: hasardan birkaç saat sonra ortaya çıkan hasarlı doku yapısının restorasyon süreci. Çoğalma hedefine ancak daha fazla doku hasarı oluşmazsa ulaşılabilir, aksi takdirde yeni hücreler zarar verici faktörler tarafından yok edilir. Çoğalma sürecinde 3 aşama vardır:
Hasarlı dokuyu temizleme hücresel elementler, mikroorganizmalar ve diğer yabancı elementler
Hasarlı dokuda damar büyümesinin uyarılması
· Doku bütünlüğünün restorasyonu.
Hasarlı dokunun çoğalması ve restorasyonu süreci ancak birincil ve ikincil hasarın ana süreçleri tamamlandığında anlamlı hale gelir. Enflamasyon sırasında onarıcı sürecin başarılı bir şekilde ilerlemesinin temel koşulu, akut alteratif ve eksüdatif değişikliklerin zayıflamasıdır. Bu ancak flogojenik ajanın tamamen ortadan kaldırılmasıyla başarılabilir. Flogojenik ajan tamamen ortadan kaldırılmazsa iltihap kronikleşebilir. Onarıcı süreçlere geçişin ikinci koşulu, anti-inflamatuar aracıların etkisini gerektirir.
Temizleme kumaşı Hasar görmüş hücrelerden ve mikroorganizmalardan arındırma, ana hücreler olan nötrofil lökositler ve makrofajlar tarafından gerçekleştirilir. akut inflamasyon. Nötrofilik lökositler iltihap bölgesini çevreleyerek hasarlı bölge ile sağlıklı doku arasında bir bariyer oluşturur. Venöz staz, benzer bir işlevi yerine getirerek, filojenin damarlardan yayılmasını önler.
Anjiyogenez - hasarlı dokudaki damar ağının restorasyonu meydana gelir Büyüme faktörlerinin etkisi altında. Bunlar arasında fibroblast büyüme faktörü (FGF), trombosit türevli büyüme faktörü (PDGF), vasküler endotelyal büyüme faktörü (VEGF), dönüştürücü büyüme faktörü (TGF a ve β), epidermal büyüme faktörü (EGF) yer alır. Etkileri altında endotel hücreleri bölünür; bunların bir kısmı doğrudan iltihaplanma bölgesinden gelir ve bir kısmı da endotel hücre öncüleri formunda gelir. kemik iliği ve gelecekteki kılcal tüpün oluşumu (anjiyogenez). Yeni oluşan kılcal damarlardaki endotel hücreleri işlevsel olarak yetersizdir ve bu damarlar oldukça geçirgendir. Daha sonra endotel hücreleri "olgunlaşır", bazal membran oluşumu meydana gelir ve yeni oluşan damarlar normal kılcal damarların özelliklerini kazanır.
Yenilenme kaybolan hücrelerin aynı türdeki hücrelerle değiştirilmesidir. Örneğin, bölünemeyen hücresel elemanların kaybı nedeniyle parankimal hücrelerin tam kantitatif restorasyonu imkansızsa, parankim defekti bağ dokusu ile yenilenir. Yenileyici, yüksek geçirgen damarlar açısından zengin genç granülasyon dokusu oluşur, ardından bağ dokusu ve bir yara izi oluşur. Enflamasyon bölgesindeki onarıcı süreçler sırasında, hücre yenilenmesi ve bağ dokusu büyümesi, çoğalmanın artmasıyla sağlanır. Proliferasyon uyarıcıları büyüme faktörleri de etkilidir. Farklı hücreler için önde gelen büyüme faktörleri farklılık gösterebilir. Bu nedenle, endotel hücreleri için ana faktör vasküler endotelyal büyüme faktörü (VEGF) olarak adlandırılabiliyorsa, fibroblastlar için bu fibroblast büyüme faktörüdür (FGF), epitel hücreleri için ise epidermal büyüme faktörüdür (EGF).
Akut inflamasyonun sonuçları
Akut inflamasyonun sonuçları şunlara bağlıdır: etiyolojik faktör ikincil hasarın derecesini ve yenilenme derecesini belirleyen vücudun reaktivitesinin yanı sıra birincil hasara neden olur.
Enflamasyonun olumlu sonucu -yapı ve fonksiyonun tamamen restorasyonu Kan damarlarının büyümesiyle eş zamanlı olarak meydana gelen bağ dokusu ve parankimin büyümesi nedeniyle nispeten küçük miktarda hasarlı doku olması koşuluyla, iyi yenilenen dokularda iltihaplanma sırasında meydana gelir. Proliferatif aktivitelerine bağlı olarak dokular 3 tipe ayrılır: yüksek proliferatif aktiviteye sahip (kemik iliği, deri epitelyumu ve mukoza zarları); hasar koşulları altında olası proliferatif aktivite ile (hepatositler); çoğalmayan dokular (sinir, kas).
Proliferasyon süreçlerinde sadece uyarıcı değil aynı zamanda engelleyici düzenleme mekanizmaları da vardır ki bu da çok önemlidir. Böylece doku yenilenmesinde görev alan fibroblastlar yavaş yavaş proliferatif aktivitelerini kaybederler ve bu da onların aşırı çoğalmasını engeller. Bu durumda büyüme faktörlerinin ve bunlara yönelik reseptörlerin ifadesi engellenir. Hücre proliferatif aktivitesinin düzenlenmesi mekanizmasındaki önemli bir amaç, yalnızca hücreler arası temaslar oluşturmakla kalmayıp aynı zamanda hücrelerin proliferatif aktivitesini etkileyen kalsiyum iyonlarının ve cAMP'nin nüfuz ettiği kanalları oluşturan konneksinlerdir. Hücre proliferatif aktivitesinin inhibisyonu, belirli bir hücre teması yoğunluğuna ulaşıldığında, hücre genomu regülasyonu seviyesinde proliferatif aktivitenin inhibisyonu başladığında, "temas inhibisyonu" adı verilen olay kullanılarak gerçekleştirilir.
Enflamasyonun nispeten olumlu sonucu – Yapının tamamlanmamış restorasyonu(yara izi), belirgin hücre ölümü olan herhangi bir dokuda veya olası proliferatif aktiviteye sahip veya çoğalmayan dokularda (mekanik travma veya yanıklar nedeniyle ciltte yara izleri, enfarktüs sonrası kardiyoskleroz) herhangi bir hasarla meydana gelir. Fibroblastların proliferatif aktivitesinde bir artış ve yetersiz inhibitör düzenleme ile hipertrofik ve keloid skarlar şeklinde kendini gösteren aşırı çoğalmaları mümkündür. Bu tür yara izlerinin ortaya çıkması kısmen HLA sistemindeki belirli genlerle (HLA BW16, HLA BW21) ilişkili genetik bir yatkınlığa sahiptir. Hipertrofik ve keloid skarlardaki fibroblastların daha aktif olduğu, daha fazla kolajen, fibronektin ve proteoglikan ürettiği, ayrıca düzenleyici mekanizmalara duyarlılığın bozulduğu kanıtlanmıştır.
Doku defekti oluşumu– inflamasyonun nispeten olumlu sonucu için başka bir seçenek. Kronik doku hipoksisinin arka planına karşı proliferatif süreçlerin yetersiz aktivitesi durumunda, örneğin diyabetik mikroanjiyopatide veya kronik mikrovasküler patolojide damar yetersizliğiçoğalma süreçleri önemli ölçüde gecikebilir. Ve hücrelerin doğal kaybı ile restorasyonları arasındaki tutarsızlık, doku defektinin (ülser) oluşmasına yol açabilir.
İnflamasyonun olumsuz sonuçları:
Bir organın ölümü veya doku, aşırı derecede şiddetli birincil hasar olduğunda ve örneğin dolaşım bozukluklarının (kangren) arka planında vücudun reaktivitesi bozulduğunda meydana gelir.
İnflamasyonun genelleştirilmesi(sepsis), çok sayıda sitokinin (IL-1b, IL-6, TNF-a) kana girmesi ve "sistemik inflamatuar yanıt sendromu"nun gelişimi ile ilişkilidir. Enfeksiyonun inflamasyon odağının ötesinde genelleşmesi, lenfatik ve kan damarları yoluyla gerçekleşir.
Kronik iltihap birçok yaygın hastalığın temelini oluşturur: romatizmal eklem iltihabı ve tüberkülozdan pnömokonyoz ve ateroskleroza kadar. Asıl sebep Akut inflamasyonun kronik hale gelmesi, enfeksiyöz veya enfeksiyöz olmayan faktörlerden kaynaklanan uzun süreli kalıcı doku hasarıdır. Kronik enfeksiyöz inflamasyon iki durumda ortaya çıkar: 1 – immün yetmezlik gelişmesiyle birlikte, bağışıklık sistemi vücut enfeksiyonla baş edemiyor; 2 – spesifik bir enfeksiyonun neden olduğu bir hastalık ve patojene (mikoplazma, spiroketler, klamidya, protozoa, vb.) karşı bağışıklığın başlangıçtaki başarısızlığı için. Kronik bulaşıcı olmayan inflamasyon da iki nedenden dolayı gelişir: 1 – ne zaman uzun vadeli eylem yabancı endo veya eksojen zarar verici faktörlerin dokusunda (toz bileşenleri, dokudaki yabancı cisim); 2 – geliştirme sırasında otoimmün süreç otoantikorlardan veya duyarlılaşmış lenfositlerden kalıcı doku hasarı meydana geldiğinde.
Mekanizmalar kronik iltihap Akut inflamasyonun mekanizmalarından farklı olduğu gibi hücresel bileşimleri de farklıdır. Akut inflamasyonda ana efektör hücreler nötrofil granülositleri ise, kronik inflamasyonda bunlar monositler/makrofajlar ve lenfositlerdir. Kronik inflamasyonun bir özelliği, etkilenen dokuların lenfositler ve makrofajlar tarafından mononükleer infiltrasyonudur. Makrofajların birikmesi ve uzun süreli aktif işleyişi sıklıkla inflamasyon alanlarında meydana gelir. Bu, makrofaj göçünü - oksitlenmiş lipitleri ve ayrıca T lenfositleri (MIF) tarafından salgılanan peptitleri inhibe eden faktörlerle kolaylaştırılır.
Enfeksiyonla ilişkili kronik inflamasyon, gecikmiş tip hipererjik reaksiyon (DTH) mekanizması ile karakterize edilir. Makrofaj-lenfosit infiltrasyonu sırasında salınan sitokinler, lenfositleri ve makrofajları karşılıklı olarak aktive ederek, özellikle monosit kemotaktik protein-1 (MCP-1) ve makrofaj inflamatuar protein-beta (MIP-1β) olmak üzere inflamasyonu sürdüren bir kısır döngü oluşturur.
Kronik inflamasyon bölgesinde anjiyogenez: Kronik inflamasyona, vasküler duvar bileşenlerinin yüksek proliferatif aktivitesi ve fibroblast büyüme faktörü (a-FGF ve β-FGF) gibi büyüme faktörlerine bağlı olarak vasküler büyüme (anjiyogenez) eşlik eder. Pro-anjiyojenik etkiye sahip olan dönüştürücü büyüme faktörü (TGF-β), düz kas hücrelerinin farklılaşmasını ve vasküler bazal membran oluşumunu uyarır.
Akut inflamasyona sistemik yanıtlar
Akut inflamasyona karşı vücudun sistemik tepkisine ne ad verilir? inflamasyonun akut fazının reaksiyonu . Enflamasyona kural olarak sadece yerel değil aynı zamanda sistemik reaksiyonlar da eşlik eder. Vücudun iltihaplanmaya karşı sistemik reaksiyonları ağırlıklı olarak sitokinlerin kana salınmasıyla ilişkilidir. Sistemik tepkiye neden olan ana sitokinler interlökin-1 β (Il-1b), interlökin-6 (Il-6) ve tümör nekroz faktörü alfadır (TNF-a).
· Akut iltihaplanma, iştah kaybına, sağlığın bozulmasına, uyuşukluğa ve fiziksel ve zihinsel strese karşı toleransın azalmasına neden olur. Sitokinler (öncelikle TNF-a ve IL-1 ) Hipotalamusun ve merkezi sinir sisteminin uykudan sorumlu diğer yapılarını etkileyerek uyarılmalarına neden olur. Bu nedenle, akut inflamasyonda hastalar genellikle "zehirlenme" belirtileri olarak adlandırılan genel uyuşukluk ve halsizlik yaşarlar. IL-1 gibi bazı sitokinler, proinflamatuar uyaranların etkisi altında mikroglia tarafından üretilir. Sitokinlerin hipotalamustaki termoregülasyon merkezi üzerindeki etkisi ateşin gelişmesine yol açar. Sitokinler ayrıca nörotransmiterlerin oluşumunu etkileyerek hipotalamik çekirdeklerin fonksiyonel aktivitesini de değiştirir.
· Hipotalamik-hipofiz-adrenal sistemin aktivasyonu sonucu katekolaminler ve glukokortikoidlerin düzeyi artar.
· Kemik iliği yanıtı akut inflamasyon, kandaki lökosit sayısında artışa (lökositoz) ve daha az ölçüde trombosit üretiminde artışa yol açan lökopoez aktivasyonunu içerir. Lökosit ve trombositlerdeki bu tür değişikliklerin arka planına karşı, aneminin eşlik ettiği bir miktar eritropoez inhibisyonu meydana gelir.
· Karaciğerin protein sentez fonksiyonu: Sitokinler, özellikle de interlökin-6, karaciğerde akut faz proteinlerinin oluşumunu arttırır. “Akut faz proteinleri”, iltihaplanma sırasında karaciğerde üretilen ve koruyucu işlevi olan proteinlerin genel adıdır. Antimikrobiyal, antioksidan, antitoksik korumada görev alırlar ve hemostaz sisteminin bir parçasıdırlar.
Gastrointestinal sistem: azalmış salgı mide suyu gastrointestinal sistemin hareketliliği engellenir.
Sayfa 1
Korneada meydana gelen inflamatuar bir odak, sinir uçlarının tahriş olmasına neden olur ve bu da tipik bir tepkiyi gerektirir: fotofobi, gözyaşı, blefarospazm, duygu yabancı cisim göz kapağının altında. Bu öznel belirtilerin kombinasyonuna genellikle kornea sendromu denir. Eğer böyle bir sendrom mevcutsa korneanın dikkatli bir şekilde incelenmesi gerekir. Korneadaki inflamatuar bir sızıntıya gözde kızarıklık eşlik eder. Bu durumda perilimbal bölgenin derin damarları sürece dahil olur. Bu damarların kanla dolması ve genişlemesi, korneayı çevreleyen korolla şeklinde parlak mor bir renklenmeye neden olur. Gözün bu tür lokal hiperemisine peri-korneal enjeksiyon denir.
Taze inflamatuar odak ile eski skar opasitelerinin ayrımı tanı ve tedavi yöntemi seçiminde çok önemlidir. Tekrarlayan hastalıklar durumunda eski bir lezyonu yenisinden, gözdeki konjonktiviti keratitten, iridosikliti keratitten kornea skarlarının varlığında ayırt etmek için bunu hatırlamak özellikle önemlidir.
Anterior osteoperiostitin kaynağı, göz kapaklarının yörüngesine, periorbital bölgeye, lakrimal organlara, yüz derisine bitişik dokulardaki inflamatuar odaklardır, ancak çoğu zaman bunlar paranazal sinüsler ikincisinin ampiyemi olan burun, çürük dişlerden ve 3 aylıktan küçük çocuklarda - ilkelerinden. Enflamatuar süreç, birincil odaktan devam boyunca veya tromboflebitte venöz damarlar yoluyla yayılır. Şu tarihte: yaygın enfeksiyonlar yörüngenin kemik duvarlarındaki inflamatuar süreç hematojen-metastatik yolla meydana gelebilir.
Kolloidal boyaların inflamatuar lezyonlarda lokalizasyonu, bu boyaların radyoaktif türevlerinin iç apseleri tespit etmek için kullanılmasına yol açmıştır. Dibromotripan bu amaçla sentezlendi. Tavşanlarda lezyonlara, deri altı dokuda jelatinleşmiş bir agar kütlesinin yakınına öldürücü stafilokokların enjeksiyonu neden olmuştur.
İyileşme ilaçlarının reçetesi, klinik iyileşme ve akciğerlerdeki inflamatuar odağın kaybolmasından sonra mümkündür. Önleme amacıyla hastaneden taburcu olduktan sonra kalan etkiler ve hastalığın tekrarlama olasılığı 1 – 2 yıl klinik muayene gerektirir.
Açıkçası, gözdeki inflamatuar odağın aktivitesi ile hastanın genel immünbiyolojik durumu arasında bir miktar etkileşim olduğunu kabul etmemiz gerekir. Ve gözde şiddetli bir tüberküloz sürecinin ortaya çıkma olasılığı büyük ölçüde vücudun genel immünobiyolojik durumuna bağlıysa, o zaman inflamatuar göz lezyonunun kendisi de genel duyarlılığı bir dereceye kadar etkileyebilir. Benzer bir soru birkaç kez gündeme getirildi, ancak henüz yeterince ikna edici bir çözüme ulaşılamadı. Her halükarda, Lohlein'in (1950) oküler inflamatuar odağın boyutunun, tüm organizmanın bağışıklık durumu üzerinde gözle görülür bir etkiye sahip olamayacak kadar küçük olduğu yönündeki düşünceleri ikna edici görünmüyor. Bilindiği gibi, tüberküloz da dahil olmak üzere inflamatuar bir lezyona vücudun tepkisi, ikincisinin büyüklüğüne göre değil, içerdiği patojenik mikroorganizmaların sayısı ve virülansına göre belirlenir. Ve eğer kornea veya gözün diğer dokularında kan damarlarından fakir olan herhangi bir akut inflamatuar hastalık gerçekten de genellikle belirgin bir şekilde ortaya çıkmazsa genel reaksiyonlar o zaman bu, göz lezyonunun küçük boyutuna değil, ondan izolasyonuna bağlıdır. ortak sistem kan dolaşımı Oküler lezyonun uveal lokalizasyonu ile gözdeki inflamatuar süreç ile hastanın genel immünobiyolojik durumu arasındaki aktif etkileşim koşulları elbette kıyaslanamayacak kadar daha elverişlidir. Bu, tüberküloz etiyolojisinin ön ve arka üveiti olan hastalarda akut inflamatuar oküler süreç sakinleştikçe intradermal tüberkülin enjeksiyonuna reaksiyonun yoğunluğunda kademeli bir azalma olduğunu gösteren çok sayıda klinik gözlemle açıkça doğrulanabilir. Dinamik olarak uveal kanalın arka kısımlarında oküler sürecin yoğunluğunda paralel bir düşüş gözlemlemek özellikle ilginçtir; burada koroid iltihabının azalması, çevredeki retinanın şişmesindeki bir azalma ve buna karşılık gelen bir artıştan hemen etkilenir. görme keskinliğinde ve intradermal tüberkülin enjeksiyonu bölgesinde ortaya çıkan hiperemi ve papüllerin boyutunda ve yoğunluğunda kademeli bir azalma.
Bilindiği gibi dokudaki inflamatuar odakta tripan mavisinin hızlandırılmış ve arttırılmış salınımı geçirgenliğin bozulmasından kaynaklanmaktadır. kan damarları. Kullanılan teste göre, asetoksanın eklenmesinden sonra geçirgenlik daha az bozulduğu için, asetoksanın iltihap bölgesindeki bozuklukları önleyerek geçirgenlik üzerinde bilinen bir normalleştirici etkiye sahip olduğu sonucuna varılmalıdır.
Modern fikirler, lenfositlerin çoğalma ve farklılaşma süreçlerini doğrudan inflamatuar odağa dahil etme olasılığını dışlamaz. Her durumda, gerekli tüm hücre popülasyonları burada mevcuttur: T yardımcı hücreleri, B hücreleri ve antijen sunucuları olarak makrofajlar.
Klinik gözlemler sıklıkla bize, hastalıklı gözün uveal kanalında aktif olarak gelişen tüberküloz inflamatuar odağının hastanın genel immünbiyolojik durumu üzerindeki açık etkisine dair eşit derecede şüphe götürmez kanıtlar sağlayabilir.
Elbette, gözün uveal kanalında inflamatuar odağı olan bir hastada intradermal Mantoux tüberkülin testinin pozitif sonucu, oküler sürecin tüberküloz doğasının kanıtı olarak kabul edilemez. Bununla birlikte, eğer bu vaka, en kapsamlı ve kapsamlı muayenede bile, gözde hızla gelişen bir iltihap odağı dışında, vücudunda başka herhangi bir aktif iltihap odağının ortaya çıkmadığı bir kişiyle ilgiliyse, o zaman o zaman pozitif sonuçlar Mantoux testlerine belirli bir dikkatle yaklaşılmalıdır. Bu konuda bazı istatistiklerden de bahsetmek gerekiyor.
Yukarıdaki hususların tümü elbette yalnızca gözde aktif bir inflamatuar odağın olduğu durumlar için geçerlidir. Eğer uzun süredir devam eden bir iltihabın sadece sikatrisyel kalıntıları orada kalırsa, o zaman ne röntgen ne de cilt tüberkülin testleri artık tüm bu değişiklikleri geride bırakan sürecin etiyolojisini çözmemize yardımcı olamayacak.
Araştırma materyali fistüllerden ve ülseratif lezyonlardan gelen irin, ülser kenarlarından kazıntılar, kapalı inflamatuar odakların delinmeleri ve etkilenen dokuların biyopsi örnekleridir.
Zamanında tedavi ile 2-3 gün sonra iyileşme meydana gelir: sıcaklık düşer, zehirlenme belirtileri azalır ve inflamatuar odaklar ters gelişmeye uğrar. Ancak çoğu durumda bir antibakteriyel tedavi yeterli değildir ve bu nedenle patojenik tedavi yapılmalıdır: spesifik gama globulin, kortikosteroidler (günde 70 - 100 mg) 5 - 6 gün boyunca ağızdan.
Herpetik keratitin karmaşık tedavisi: kullanım antiviral ajanlar, immünoterapi, korneanın yenilenmesini ve trofizmini uyaran yöntemler, korneadaki inflamatuar odağa fiziksel etki ve cerrahi tedavi.
Klorun solunması keskin bir öksürüğe ve boğulmaya, mukoza zarının iltihaplanmasına neden olur solunum sistemi, akciğer ödemi ve ardından akciğerlerde inflamatuar odakların oluşumu.
Bilindiği gibi akut inflamasyon belirli bir sıra ile karakterize edilir. damar değişiklikleri vazospazm gelişimi ile kendini gösteren arteriyel, venöz hiperemi ve durağanlık.
Vazospazm kısa süreli bir reaksiyondur. Spazm birkaç saniye kadar sürebilir ( hafif hasar doku) birkaç dakikaya kadar (ciddi hasar durumunda). İltihaplanma bölgesinde böyle bir vasküler reaksiyon kesinlikle gerekli değildir ve bazı durumlarda parankimal organların hasar gördüğü durumlarda kendini göstermez. Enflamasyon bölgesinde vasküler spazmın ortaya çıkması, kan damarlarının düz kas elemanlarının hasarlarına yanıt olarak kasılmasının yanı sıra güçlü, hızlı etkili bir değiştirici faktörün etkisi altında vazokonstriktörlerin uyarılmasından kaynaklanır. Bu aşamanın kısa süresi, monoamin oksidazın etkisi altında vazokonstriktör aracıların - norepinefrin, adrenalinin hızlı inaktivasyonuyla belirlenir. Trombositlerden ve mast hücrelerinden doku hasar gördüğünde büyük miktarlarda salınan serotoninin, iltihap bölgesindeki damar spazmının mekanizmalarında rol alması mümkündür. Vasküler spazmın dışsal bir tezahürü, iltihaplanma sürecinin geliştiği doku alanının beyazlaşmasıdır.
Arteriyel hiperemi aşaması, küçük arterlerin, arteriollerin, kılcal damarların, venüllerin orta derecede genişlemesi ve ayrıca yedek kılcal damarların işleyişi (yeni kılcal damar oluşumu olgusu) ile karakterize edilir. Vazodilatasyon dokuya kan akışının artmasına, lenf oluşumunun ve lenf drenajının artmasına neden olur. Kan akışı, çıkışını biraz aşabilir, bu da damarlardaki hidrodinamik basınçta bir artışa, doğrusal bir artışa ve hacimsel hız kan hareketi, arteriyovenöz oksijen farkını azaltır. Bu aşamada böyle dış işaretler kızarıklık ve ateş gibi iltihaplanma. Artan doku oksijenasyonu, hücrelerdeki metabolizmayı harekete geçirir, bir yandan sağlam hücreler ve bağ dokusu üzerinde zarar verici bir etkiye sahip olabilen, diğer yandan da vücudu bulaşıcı patojenlerden koruyan faktörler haline gelen reaktif oksijen türlerinin ortaya çıkmasını teşvik eder. ajanlar ve daha sonra inflamatuar bölgedeki proliferasyon süreçleri üzerinde uyarıcı bir etkiye sahiptir. Arteriyel hiperemi geliştikçe, humoral koruyucu faktörlerin inflamasyon bölgesine akışı artar - kompleman, propdin, fibronektin, interferon, seruloplazmin, vb. Yoğun kan akışı, toksik metabolik ürünlerin, mikroorganizmalar tarafından üretilen patojenite faktörlerinin ve biyolojik olarak aktif olanların yıkanmasını sağlar. maddeler. Bazı durumlarda yoğun kan akışı nedeniyle vücudun reaktivitesinin azalmasıyla birlikte enfeksiyonun yayılması ve septik bir durumun gelişmesi meydana gelebilir. Arteriyel hiperemi birkaç saat ve gün sürebilir; en çok alterasyon bölgesinin çevresi boyunca belirgindir. Arteriyel hipereminin gelişimi çeşitli mekanizmalara dayanmaktadır:
1. Nörojenik - akson refleksinin aktivasyonu, kolinerjik ve histaminerjiklerin güçlendirilmesi nedeniyle sinirsel etkiler damar duvarında ve ayrıca duyusal peptiderjik hasarda sinir lifleri, duyusal nöropeptitlerin - P maddesi, kalsitoninle ilişkili gen peptidi, protein gen peptidi - nosisepsiyon ve salınımında rol oynar. Bu nöropeptitler belirgin bir damar genişletici etkiye sahiptir.
2. Nöroparalitik - sempatik vazokonstriktörlerin parezi ve vasküler adrenerjik reseptörlerin duyarlılığının azalması nedeniyle.
3. Miyoparalitik - orta derecede vazoaktif bileşik konsantrasyonlarının (histamin, kininler, lökotrienler, vb.) etkisi altında bazal vasküler tonda bir azalmaya ve ayrıca H+ ve K+ hipereriyona bağlı olarak. Arttıkça inflamatuar süreç Arteriyel hipereminin yerini venöz hiperemi alır.
Venöz hiperemi, kan damarlarının daha fazla genişlemesi, kan akış hızının azalması, doku bolluğu, lökositlerin marjinal duruşu ve bunların göçü olgusu, kanın reolojik özelliklerinin ihlali ve artan eksüdasyon süreçleri ile karakterize edilir.
Arteriyel hipereminin venöz hiperemiye geçişini etkileyen faktörler iki gruba ayrılabilir: intravasküler ve ekstravasküler.
İntravasküler faktörlere, gelişmeye neden olmak venöz hiperemi, endotel hücrelerinin şişmesi, lökositlerin kenarda durması, hemostaz sisteminin aktivasyonu, eritrosit çamuru, kanın kalınlaşması, viskozitesinin artması, mikrotrombi oluşumunu içerir.
Ekstravasküler faktörlerden doku şişmesi ve venüllerin, küçük damarların sıkışması, lenf damarları sızıntı. Venöz hiperemi, vazodilatasyon etkisi olan aracıların, lizozomal enzimlerin ve iltihaplanma bölgesinde hidrojen iyonlarının aşırı birikmesinin yanı sıra birincil ve ikincil değişiklik bölgesindeki perikapiller bağ dokusu iskeletinin ve desmozomların bozulmasıyla artar.
Venöz hipereminin dış belirtileri doku şişmesi, siyanoz, metabolik süreçlerin azalması ve bunun sonucunda iltihap bölgesinde sıcaklığın azalmasıdır. Artan hipoksi ve asidoz, inflamatuar odağın çevresi boyunca bağ dokusu elemanlarının gelişimini uyarır ve böylece inflamatuar odağı sağlıklı dokudan ayıran bir bariyer oluşumunu sağlar. Nötrofiller ve mononükleer hücreler de bariyerin oluşumunda rol alır.
Venöz hiperemi bölgesinde kan akışının kısıtlanması ve bariyerlerin oluşması, çürüme ürünlerinin ve toksik faktörlerin iltihaplanma bölgesinden emilimini azaltmaya yardımcı olur ve ayrıca bulaşıcı ajanların yayılma riskini azaltır. Bununla birlikte, parankimal organlarda inflamasyonun gelişmesiyle birlikte, uzun süreli venöz hiperemi, özel fonksiyonlarında azalmaya ve hücre sklerozunun gelişmesine yol açabilir.
Venöz hipereminin sonucu stazdır - damarlardaki kan akışının tamamen durması. Yaygın staz, akut, hızla gelişen inflamasyonun (hipererjik) karakteristiğidir. Stazın süresi ve sonucu değişebilir. Durağanlık birkaç saatten birkaç güne kadar sürebilir; geri döndürülebilir veya geri döndürülemez olabilir.
Lökosit göçünün mekanizmaları. Lökositlerin inflamasyon odağındaki rolü
Daha önce belirtildiği gibi, venöz hipereminin en önemli belirtisi lökositlerin damarlardan iltihaplı dokuya göçüdür. Lökosit salınım sırasına Mechnikov yasası denir; buna göre, değişen faktörün etki anından itibaren birkaç saat (1.5-2 saat) sonra, nötrofiller ve diğer bölümlenmiş lökositler yoğun bir şekilde göç eder ve ardından monositler ve lenfositler.
Göç sürecinden önce, damar içindeki kanın eksenel akışının ihlali gelir. Kan akışının yavaşladığı koşullar altında, eritrositler "madeni para sütunları" halinde birleşerek damarın orta kısmını işgal eder ve daha düşük özgül ağırlığa sahip olan lökositler, önce plazma katmanının sınırına kadar eksenel akışı terk eder ve sonra damarın endotel hücrelerine yapışmaya başlar. Lökositlerin yapışmasında (Latince adhaesio - yapışma) önemli bir rol, lökositlerin, endotel hücrelerinin ve hücreler arası matrisin makromoleküllerinin yüzeyinde ifade edilen endotel-lökosit yapışma molekülleri (ELAM) tarafından oynanır. iltihaplanma. Enflamatuar bölgedeki lökositler ve endotelyal hücreler üzerindeki ELAM ekspresyonunun aktivatörleri biyolojik olarak aktif maddelerdir - sitokinler, örneğin IL-1, IL-8, LT B4, PAF, TNF-a, a-interferon, kompleman fraksiyonları C5a ve Bb, kemotaktik faktörler, bakteriyel lipopolisakkaritler vb. Bu aracıların etkisi altında, lökositlerde ve vasküler endotel hücrelerinde membranda konformasyonel değişiklikler meydana gelir, adezyon molekülleri salınır ve eksprese edilir. Çoğu sitokin, lökositlerin ve endotelin yapışkanlığını eşit derecede etkiler, ancak aracıların çeşitli hücreler üzerindeki seçici etkisi de not edilir. Böylece LT B4, nötrofiller üzerinde adezyon moleküllerinin, vasküler endotel üzerinde IL-1'in ve monositler ve granülositler üzerinde kompleman bileşenlerinin ortaya çıkmasına neden olur.
Şu anda, hücre yapışma moleküllerinin çeşitli sınıfları bilinmektedir:
1. Selektinler, en çok aracılık eden lektin hücre yapışma molekülleridir. erken aşama Lökositler ve damar duvarı arasındaki etkileşim. Selektinler erken eksprese edilir ve lökositlerin vasküler endotele güçlü bir şekilde bağlanmasını sağlamaz. Üç tip selektin vardır: L-selektinler tüm lökositler tarafından sentezlenir.
E-selektinler endotel hücreleri tarafından sentezlenir. Bu selektinler lökositlerin marjinal duruşu olgusunu sağlar. Kaynak
P-selektinler trombositler ve vasküler endoteldir; lökosit marjinasyonu işlemlerine katılmanın yanı sıra trombosit yapışmasını da desteklerler.
2. İntegrinler, çeşitli lökositler ve hematopoietik hücreler tarafından ifade edilen heterodimerik proteinlerdir. Endotel sadece bazı integrinleri eksprese eder. Şu anda beş tip integrin tanımlanmıştır. Göç ve fagositik süreç için en önemlileri üç heterodimerdir. Bu integrinler şunlardan sorumludur: geç aşamalar lökositler, trombositler ve damar endotelinin etkileşimi.
3. İmmünoglobulin süper ailesi yapışma molekülleri (ICAM'ler), ağırlıklı olarak endotel tarafından eksprese edilen beş hücre dışı alana sahip transmembran proteinleridir. Bu moleküllerin bazıları aktive edilmemiş hücreler tarafından sentezlenir ve lökositlerin fizyolojik göçünün yoğunluğunu belirler. Enflamasyon alanında, IL-1, TNF, interferon gama etkisi altında, ICAM moleküllerinin sentezi ve ekspresyonu aktive edilir, bu da gecikmiş bir yapışma ve lökosit göçü fazını sağlar. İmmünoglobulinlere benzer protein grubu, lenfosit reseptörlerini içerir - CD2, CD58 (LFA-3). Bunlar T lenfositleri ve antijen sunan hücreler üzerinde eksprese edilirler ve antijen sunumunda ve sitotoksik lenfositlerin hedef hücrelerle temasında rol oynarlar.
4. Adressinler, lenfoid organların venüllerinin endotel hücrelerinin proteinleridir. Sahip olmak büyük önem Lenfositlerin kronik ve otoimmün inflamasyon odaklarına göçünde. Akut inflamasyonda adresler daha az önemlidir.
5. Kıkırdaklı bağ proteinleri. Tanınan tüm lökosit türleri tarafından ifade edilir hiyalüronik asit Bağ dokusunun ana maddesindeki lökositlerin hareketini sağlar.
Selektin ve integrinlerin yetersiz oluşumu veya membran reseptörlerine karşı antikor üretimi ile lökositlerin yapışkan özellikleri azalır, göç etme, iltihaplanma ve fagositoz alanında birikme yetenekleri bozulur, bu da sık sık katkıda bulunabilir. cerahatli enfeksiyonlar ve sepsis gelişimi.
Yapışma ve göç süreçlerinde önemli bir rol, iltihaplanma bölgesinde tek değerlikli ve iki değerlikli iyonların (H, K, Ca, Mn, Mg) birikmesi nedeniyle endotel hücrelerinin ve lökositlerin negatif yükünün ortadan kaldırılmasına aittir. lökositler tarafından salgılanan katyonik proteinlerin yanı sıra. Lökositlerin damar duvarına yapışmasını başlatan faktörler kompleman (C5a), lökotrienler, fibronektin, immünoglobulinler (IgG'nin Fc fragmanı), histamindir.
Yapışmadan sonra lökosit, endotel hücresinin yüzeyi boyunca iltihaplanma bölgesinde önemli ölçüde genişleyen interendotelyal yarığa doğru hareket eder ve daha sonra bir psödopod oluşumu ve lökositin interendotelyal yarıktan subendotelyal boşluğa hareketi ve damarın taban zarı. Böylece lökositler damar dışına çıkar.
Çoğu akut inflamasyon vakasında lökositlerin intravasküler hareketleri ve göçleri birkaç saat sürer. Kural olarak, nötrofiller iltihap bölgesine ilk girenlerdir, iltihaplı dokuda 6-24 saat içinde bulunurlar. Monositler ve lenfositler bir süre sonra (24-48 saat) göç ederler. Hücre göçünün bu asenkronisi, farklı lökositlere özgü adezyon moleküllerinin ve kemotaktik faktörlerin eşzamanlı olmayan görünümünden kaynaklanmaktadır.
Lökositlerin göçüne ilişkin zaman aralıklarının ve bunların salınma sırasının çok göreceli olduğu ve damar tipine, iltihaplanma tipine ve iltihaplanma aşamasına göre belirlendiğine dikkat edilmelidir.
Böylece, tüberküloz, listeriosis, klamidya, toksoplazmoz patojenleri tarafından başlatılan inflamatuar süreç bölgesinde, viral enfeksiyon Başlangıçta inflamasyon bölgesinde mononükleer hücreler baskındır; alerjik reaksiyonlarda eozinofiller baskındır.
Lökositlerin yönlendirilmiş hareketi, iltihaplanma bölgesinde ikincil değişiklik geliştikçe konsantrasyonu artan kemo-çekici maddeler ve ayrıca lökositlerin yüzeyinde çeşitli kemo-çekici maddeler için reseptörlerin varlığı ile sağlanır.
Reseptörler ve kemoattraktanlar etkileşime girdiğinde, lökosit zarının hiperpolarizasyonu meydana gelir, Ca iyonlarına geçirgenliği artar, fonksiyonel olarak aktif fosfolipidlerin ve siklik nükleotidlerin sentezi başlatılır ve işleyişi lökositin hareketini sağlayan hücre içi organellerin sayısı artar. ve granül içeriklerinin salgılanması. Lökositlerin yönlendirilmiş hareketine ek olarak kemoattraktanlar, lökositlerin endotele yapışmasını indükler, lökositlerin kenarda durmasını ve mikrodamarların lümeninde toplanmasını teşvik eder. Kemotaksiye çeşitli madde grupları aracılık eder:
1. Kemoattraktan olmasa da kemotaksis faktörleri üreten sitotoksijenler.
2. Lökositler üzerinde doğrudan etkisi olan sitotaksinler. Bazı sitotoksinler nötrofillere spesifiktir (örneğin, E. coli kültür ekstraktı), diğer sitotoksinler ise granülositlerin ve monositlerin göçünü indükler.
Kemoattraktanlar endojen veya eksojen kökenli olabilir. Eksojen kemoattraktanlar bakteriyel peptitlerdir, özellikle N-formil grupları içerenler. Kompleman bileşenleri, immünoglobulinler, bağışıklık kompleksleri, lenfokinler ve monokinler, kininler, lökotrien B4, lipoksijenaz yolunun ürünleri arakidonik asit, trombosit aktive edici faktör, Hageman faktörü, lizozomal enzimler ve diğerleri.
Lökositlerin inflamasyon odağındaki rolü
İnflamasyon bölgesine göç eden nötrofiller, inflamasyon bölgesini temizleyen aktif fagositlerdir. bulaşıcı ajanlar. Nötrofillerin fagositoz nesnesine yapışması, nesneye bağlanan ve nesnenin fagositik hücreler tarafından tanınmasını kolaylaştıran aktif protein molekülleri olan opsoninler sayesinde hızlandırılır. Lökositlerin yönlendirilmiş hareketi ve fagositoz süreçleriyle eşzamanlı olarak, içlerinde bir solunum patlaması meydana gelir - bakterisidal serbest oksijen radikallerinin (tekli oksijen, hidroksil radikali, hidrojen peroksit, süperoksit anyonu) oluşumu için oksijen tüketiminde keskin bir artış. Reaktif oksijen türlerinin oluşumu miyeloperoksidaz, süperoksit dismutaz ve katalaz enzimlerinin katılımıyla gerçekleşir. İltihap bölgesinde salınan reaktif oksijen türleri bakteri, mantar, mikoplazma, virüs, klamidya ve diğer patojenler için oldukça toksik faktörler olup, mikrobiyal hücre zarlarının yapısını ve fonksiyonunu bozar, yaşamsal aktivitelerini sınırlandırır veya mikroorganizmaların ölümüne neden olurlar. Antimikrobiyal aktiviteye ek olarak, artan serbest radikal süreçleri, iltihaplanma bölgesindeki sağlam parankimal hücrelere, vasküler endotelyal hücrelere ve bağ dokusu elemanlarına zarar verir ve bu da daha fazla doku değişikliğine katkıda bulunur.
Nötrofil granülleri, oksidatif sistemin yeni sentezlenen faktörlerine ek olarak, lizozim, laktoferrin, katyonik proteinler, alkalin ve asit fosfatazlar, ribonükleaz, deoksiribonükleaz, hiyalüronidaz, b-glukuronidaz, elastaz, kollajenaz, PAF, kininler, lökosit pirojen, kemotaktik faktörleri içerir.
Böylece nötrofillerin iltihaplanma odağında birikmesi ve bu biyolojik olarak aktif maddelerin salınması, mikroorganizmaların ölümüne veya yaşamsal aktivitesinin kısıtlanmasına, ölü dokunun tahrip edilmesine ve parçalanmasına, hasarlı bölgenin temizlenmesine neden olur. Nötrofiller nedeniyle, iltihaplanma kaynağı çevresinde, hasar alanını (monosit ve fibroblastik ile birlikte) sağlıklı dokudan sınırlayan ve enfeksiyonun ve toksik zarar verici faktörlerin yayılmasını önleyen bir nötrofil koruyucu bariyer oluşur.
Oldukça aktif nötrofil aracıları, ikincil değişimin geliştirilmesinde rol oynar, biyolojik olarak aktif maddelerin diğer hücrelerden salınmasını uyarır, vazodilatasyonu teşvik eder, geçirgenliklerini, plazma eksüdasyonunu ve lökosit göçünü arttırır. Sistemik kan dolaşımına girerek, iltihaplanma sürecinin bazı sistemik etkilerinin ortaya çıkmasına neden olurlar.
İnflamasyon bölgesine göç eden eozinofiller ayrıca bakterileri, mantarları ve immün kompleksleri fagositoz yapma yeteneğine de sahiptir. Nötrofillerle yaklaşık olarak aynı enzim setini içerirler (lizozim hariç). Ancak eozinofillerin daha küçük bir yüzdesi fagositoza katılır ve nötrofillerinkinden daha az yoğundur.
Eozinofil degranülasyon sürecini uyaran ana faktörler immünoglobulinler, immün kompleksler ve komplemandır. Eozinofil salgılama ürünleri, mast hücreleri tarafından histamin salınımını inhibe eder ve histaminaz nedeniyle inaktivasyonuna katılır; eozinofil katyonik proteini, heparini bağlar ve nötralize eder, yüksek konsantrasyonlar Arilsülfatazlar, kemotaktik proteinleri ve yavaş reaksiyona giren anafilaksi maddesi olan fosfolipaz B ve D'yi, trombosit aktive edici faktörü etkisiz hale getirir. Endotoksinlerin etkisi altında ve fagositoz süreci sırasında eozinofiller, iltihaplanma sürecine eşlik eden ateşli bir reaksiyonun gelişmesini sağlayan endojen pirojen üretir ve salgılar.
Nötrofillerin yanı sıra eozinofillerin aracıları da doku hasarı reaksiyonlarında ve ikincil değişikliklerin yayılmasında rol oynayabilir.
Bazofilik lökositler de diğer granülositler gibi fagositoz yapma yeteneğine sahiptir ancak fagositik aktiviteleri oldukça düşüktür. Enfeksiyöz ve alerjik inflamasyon bölgesinde, histamin, heparin, trombosit aktive edici faktör, lökotrienler, kallikrein, eozinofil kemotaktik faktör, enzimler gibi inflamatuar aracıların salınmasıyla bazofil degranülasyon reaksiyonu meydana gelir.
Granülositlerin ardından mononükleer hücreler inflamasyon bölgesinde birikir. Dokulara göç eden monositler doku makrofajlarına dönüşür. İnflamasyon alanında makrofajlar, monositlerin kan dolaşımından göç etmesi ve ayrıca doku makrofajlarının mobilizasyonu nedeniyle birikir. Makrofajlar, yalnızca iltihaplanma sürecinin enfeksiyöz patojenlerinin değil, aynı zamanda hücresel döküntülerin de fagositozunu sağlar, böylece değişim bölgesini temizler ve onu sonraki rejenerasyon ve onarım için hazırlar. Mononükleer fagositler Fagositoz, lizozim, a-interferon, TNF ve kompleman bileşenleri gibi humoral faktörlerin salgılanması yoluyla vücudun spesifik olmayan savunmasının sağlanmasına katılırlar. Enflamasyon bölgesinde makrofajlar, nötrofiller (miyeloperoksidaz ve katyonik proteinler) tarafından üretilen antimikrobiyal bileşenlerin fagositozu nedeniyle daha belirgin antimikrobiyal özellikler kazanır. Böylece makrofajlar proteinleri halojenleştirme yeteneği kazanır. Makrofajların mikrobisidal işlevi, “solunum patlaması” ürünleri, monokinlerin salgılanması ve lizozomal enzimler yoluyla gerçekleştirilir. Oksidatif reaksiyonlar Bunlara, iltihap bölgesinde oldukça toksik lipid peroksidasyon ürünlerinin birikmesi eşlik eder ve bu da hücrelerin, kan damarlarının ve bağ dokusu elemanlarının daha fazla tahrip olmasına neden olur.
Bakteriyel patojen şeklinde bir etiyolojik ajanın varlığında monositler/makrofajlar, vücudun bağışıklık tepkisini tetikleyen antijen sunan hücrelerdir. Antijen sunumu sırasında aktive makrofajlar, TNF, interlökinler (IL-1, IL-3, IL-6, IL-8, IL-10, IL-12, IL-15), kompleman bileşenleri, kemotaktik faktörler gibi sitokinleri salgılar ve serbest bırakır. . İnterlökinlerin olgun formlarının hücrelerden salınması, antijenik uyarıdan sonraki 2 saat içinde başlar ve 24-48 saat devam eder. İltihaplanma bölgesindeki monositler/makrofajlar, lizozomal proteazların kaynağıdır - kollajenaz, elastaz, anjiyotensin konvertaz, plazminojen aktivatörü; yapışkan maddeler - fibronektin, trombospondin, proteoglikanlar; büyüme faktörleri - koloni uyarıcı faktörler, fibroblast büyüme faktörü; endojen pirojenler.
Makrofaj tetikleyici aracıların etkisi altında inflamasyon bölgesinde aktivasyon meydana gelir. çeşitli türler lökositler, bağ dokusu hücreleri, damar endotelyumu, parankimal hücreler gibi zararlı, koruyucu ve sistemik etkileri olan biyolojik olarak aktif bileşiklerin sentezine ve salgılanmasına yol açar.
Çoğu durumda lenfositlerin iltihap bölgesine yoğun göçü, nötrofillerin ve monositlerin göçünden sonra meydana gelir. Uyarılmış lenfositler biyolojik olarak aktif maddeler salgılar - bağışıklık tepkisinin gelişmesini sağlayan lenfokinler, alerjik reaksiyonlar, çoğalma ve onarım süreçleri.
Enflamasyon bölgesindeki tüm lökositler hızla yağ dejenerasyonuna uğrar, cerahatli cisimlere dönüşür ve irinle birlikte uzaklaştırılır. Enflamasyon bölgesinde lökosit ölümünün iki olası yolu vardır.
Birincisi, zarda büyük hasar, hücrenin bütünlüğünün ihlali ve nekrozudur; bu, zarar veren ajanın kendisinin ve çeşitli sitotoksik inflamatuar aracıların etkisi altında birincil ve ikincil değişikliklerin odağında mümkündür.
İkincisi ise daha hafif, programlanmış bir hücre ölümü veya apoptoz yoludur. Apoptoz sırasında lökosit çekirdeğinde azalma, nükleer kromatin yoğunlaşması, DNA fragmantasyonu, transkripsiyonun baskılanması, ribozomal RNA ve proteinlerin sentezinde azalma gözlenir. Yaşlanan nötrofiller, lizozomal enzimleri salgılama yeteneğini kaybeder ve bu, daha fazla doku hasarını önler. Makrofajlar aktif olarak apoptotik nötrofilleri fagosite eder. Apoptotik nötrofillerin alımına, makrofaj ve nötrofil reseptörleri tarafından salgılanan trombospondinin etkileşimi aracılık eder. Apoptoz ile sadece nötrofiller değil aynı zamanda eozinofiller ve lenfositler de inflamasyon bölgesinden uzaklaştırılabilir.
Makrofajlar. Aktive edilmiş makrofajların interlökin-1 (IL-1) adı verilen özel bir maddeyi sentezlediği tespit edilmiştir. Makrofajlar tarafından çevreye salınır ve miyosit, sinoviyosit, hepatosit, kemik hücresi, lenfosit ve nörositlerden oluşan hedeflerini bulduğu vücudun her yerine yayılır. Görünüşe göre, bu hücrelerin zarlarında, IL-1'in diğer hücrelere değil, özellikle onlara etki etmesi sayesinde spesifik reseptörler vardır. Bu etki uyarıcıdır ve en çok hepatositler ve lenfositlerle ilişkili olarak incelenmiştir. IL-1'in etkisi evrenseldir, yani. herhangi bir bulaşıcı (iltihaplı) hastalığı tetikler ve en başında bu organlara iltihabi (bulaşıcı) sürece katılmaları için bir sinyal verir. Semptomların hastalığın erken evrelerine özgü olduğuna inanmak için nedenler var ( baş ağrısı, kaslarda ve eklemlerde ağrı, uyuşukluk, ateş, lökositoz ve immünoglobulinler dahil protein içeriğinde artış) tam olarak IL-1'in etkisiyle açıklanmaktadır (Şekil 12.3).
Makrofajların rolü IL-1'in salgılanmasıyla sınırlı değildir. Bu hücreler, her biri iltihaplanmaya kendi katkısını sağlayan çok sayıda biyolojik olarak aktif maddeyi sentezler. Bunlar şunları içerir: esterazlar, proteazlar ve antiproteazlar; lizozomal hidrolazlar - kollajenaz, alastaz, lizozim, a-makroglobulin; monokinler - IL-1, koloni uyarıcı faktör, fibroblast büyümesini uyarıcı faktör; anti-enfektif ajanlar - interferon, transferrin, transkobalamin; tamamlayıcı bileşenler: C1, C2, C3, C4, C5, C6; Araşidonik asit türevleri: prostaglandin E2, tromboksan A2, lökotrienler. Makrofajların en önemli işlevi olan fagositozu da unutmamalıyız.
Mast hücreleri. Bu hücrelerin iltihaplanmadaki rolü, hasar gördüklerinde granüllerinde bulunan histamin ve heparini serbest bırakmalarıdır. Ve bu hücreler damarların kenarlarında çok sayıda yer aldığından, bu maddelerin etkisi öncelikle damarlar üzerinde kendini gösterecektir (hiperemi).
Makrofajlar ve mast hücreleri dokularda (yerleşik hücreler) sürekli olarak bulunur. Diğer inflamatuar hücreler, inflamatuar bölgeye dışarıdan (göçmen hücreler) nüfuz eder. Bunlar arasında polimorfonükleer nötrofiller, eozinofiller ve lenfositler bulunur.
Nötrofiller. Bu hücrelerin ana işlevi fagositozdur. Kemik iliğinden kana karışırlar, damarlardan göç ederler ve iltihaplı dokuda büyük miktarlarda birikirler. Hem aktif üremeleri, göçleri hem de fagositozları biyolojik olarak aktif maddelerin (doku, sistemik, organizma) düzenleyici etkisine tabidir. Bununla birlikte, etkileri yalnızca hücrelerin bir inflamatuar aracıyla spesifik olarak reaksiyona giren reseptörlere sahip olması durumunda ortaya çıkar: histamin, adrenalin, glukokortikoidler, gama globülinler, vb.
Nötrofillerin sitoplazmasında iki tür granül vardır: birincil azurofilik (daha büyük) - sıradan lizozomlar, ikincil veya spesifik granüller daha küçüktür ve en önemlisi farklı bir enzimatik ve enzimatik olmayan madde seti içerirler. Birincil granüller asit hidrolazların yanı sıra lizozim, miyeloperoksidaz ve katyonik proteinleri içerir. İkincil granüller spesifiktir; içermek alkalin fosfataz, laktoferrin ve lizozim. Bütün bunlar nötrofillerin iltihaplanmadaki rolünü anlamak için önemlidir (aşağıya bakınız).
Trombositler. Trombositlerin (kan trombositlerinin) iltihaplanmadaki rolü esas olarak mikro dolaşımla yakından ilişkili olmasıdır. Bunlar muhtemelen iltihaplanmanın en kalıcı ve en evrensel katılımcılarıdır. Damar geçirgenliğini, kontraktilitesini, hücre büyümesini ve çoğalmasını ve en önemlisi kanın pıhtılaşmasını etkileyen maddeler içerirler.
Lenfositler. Bu hücreler herhangi bir iltihaplanmada, özellikle de bağışıklık iltihabında rol oynar.
Fibroblastlar. Fibroblastların etkisi, sürecin son aşamasında, iltihap bölgesindeki bu hücrelerin sayısının artması ve içlerindeki kolajen ve glikozaminoglikanların sentezinin yeniden canlanmasıyla ortaya çıkar.
İltihaplanma bölgesindeki mikrodolaşım bozukluklarının özellikleri, ortaya çıkma nedenleri. Eksüdasyon, gelişme mekanizmaları. Enflamasyondaki rolü. Enflamasyonun eksüda türüne göre sınıflandırılması.


