31.07.2019
Inflamatorne ćelije. Velika enciklopedija nafte i gasa
Najvažniji proces upala je migracija leukocita iz krvnih žila u tkivo oštećeno flogogenom za provođenje zaštitne funkcije leukocita. Međutim, leukociti se pojavljuju u žarištu upale i vrše sekundarnu alteraciju, tj. također obavljaju regulatornu funkciju.
Emigracija leukocita se provodi na sljedeći način: leukociti napuštaju aksijalni tok, prvo do granice sloja plazme, a zatim počinju da se prianjaju na endotelne ćelije žile. Važnu ulogu u adheziji (lat. adhaesio - lijepljenje) leukocita imaju endotelno-leukocitni adhezioni molekuli. selektini i integrini. Pod uticajem citokina IL-1,8, FAT, TNF-α, komponenata komplementa dolazi do konformacionih promena u leukocitnoj i endotelnoj membrani i ekspresije adhezionih molekula.
Faze emigracije:
Faza I - reverzibilna adhezija, kotrljanje ili klizanje leukocita;
Faza II - ireverzibilna adhezija na endotel i kasnija transendotelna migracija;
III stadijum - kemotaksa - usmjereno kretanje u žarištu upale.
Adhezija leukocita na endotel posuda se odvija po principu ligand-receptorskog mehanizma. Stimulativni faktori adhezije leukocita su posrednici upale: eikozanoidi, biogeni amini, interleukin-1, interleukin-8, FAT, TNF-α, komponente komplementa.
Rolling fazu (klizanje leukocita) obezbeđuju molekuli - selektini.Postoje 3 podgrupe selektina:
- L-selektini (LAM-1) sintetiziraju leukociti
- P-selektin - glikoproteinski ligand (GMP-140)
- E-selektin(ELAM-1) sintetiziraju endoteliociti
Rice. 6. Ekspresija adhezionih molekula na endotelu
Faza čvrste adhezije - kasniju fazu interakcije između leukocita i vaskularnog endotela osiguravaju molekula ICAM-1 (međućelijska adheziona molekula -1 ili intercelularna adheziona molekula-1) (slika 6) i VCAM-1 (molekula ćelijske adhezije posuda-1 ili vaskularni endotel adhezioni molekul prvog tipa) (slika 7).
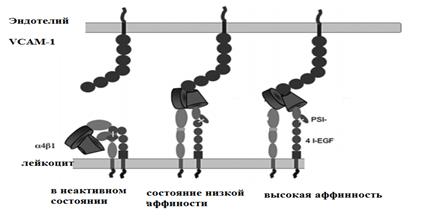
Rice. 7. Varijante različitih afiniteta molekula ćelijske adhezije
Transendotelna migracija leukociti u tkivu su ključni element urođenog i adaptivnog imuniteta. Ovaj proces ima dva mogući načini implementacija. Probijanje bazalne membrane vaskularni zid moguće kroz interendotelni kontakt (paracelularna migracija). Svi granulociti koji imaju segmentirano jezgro mogu proći između endotelnih ćelija kroz interendotelne spojeve, budući da segmentirana jezgra neutrofila mogu proći kroz uske praznine. Uloga PECAM molekula je važna u transendotelnoj migraciji leukocita ( adhezioni molekul trombocita/endotelnih ćelija).
Stvaranje veze između PECAM molekula na leukocitu i endotelu je najranjiviji korak u cjelokupnom procesu transmigracije leukocita. PECAM-ovisni mehanizam transmigracije je sljedeći proces: kako se leukociti kreću prema bazalnoj membrani ćelije, formiraju pseudopodije na interendotelnim spojevima. Na kraju procesa povezivanja leukocita sa endotelom, cijela stanica prelazi u subendotelni sloj.
mononuklearne ćelije, kao što su monociti i limfociti, također mogu proći između endotelnih stanica uz značajnu aktivaciju endotela i promjenu njegovog oblika.
Kretanje leukocita do žarišta upale.
Proces usmjerenog kretanja leukocita (mikrofaga, makrofaga) do žarišta upale naziva se hemotaksa, a tvari koje uzrokuju ovo usmjereno kretanje stanica nazivaju se hemoatraktanti i dijele se na egzogene i endogene. Egzogeni kemoatraktanti uključuju otpadne proizvode ili strukturne elemente mikroorganizama, kao i druge strane tvari.
Glavnu ulogu u stimulaciji kemotakse leukocita imaju endogeni kemoatraktanti, koji su nespecifični i specifični. Većina biološki aktivnih supstanci, kao i produkti oštećenja stanica i posrednici upale (histamin, serotonin, ATP, DNK, proizvodi razgradnje fibrina (PDF), proizvodi razgradnje kolagena, fibronektin, trombin) djeluju kao nespecifični kemoatraktanti. Neke tvari su od fundamentalnog značaja za kemotaksiju, a kršenje njihovog stvaranja značajno utječe na oslobađanje leukocita iz krvnih žila. Ove supstance se nazivaju specifičnim hemoatraktantima. To uključuje: leukotrien B4 i komplement (C5a, C3a) (oni određuju hemotaksiju neutrofila, eozinofila i monocita); faktor aktiviranja trombocita (utječe na kemotaksu neutrofila i eozinofila)
Specifičnost LtB 4 , FAT, komponenti komplementa C5a i C3a je prilično uslovna, jer ove supstance imaju mnoge druge efekte, od kojih je stimulacija hemotakse jedan od najvažnijih. Tokom upale nastaju u velikom broju i privlače uglavnom neutrofilne granulocite na mjesto upale.
Posebnu ulogu u mehanizmima hemotakse imaju hemokini, citokini koji regulišu hemotaksiju. Među njima, najaktivniji kemoatraktantni učinak ima interleukin-8 (IL-8). Može ga proizvesti većina ćelija kao odgovor na izlaganje endotoksinu, TNF-α i IL-1. Osim toga, hemokini uključuju peptid koji aktivira neutrofile epitelnih stanica (ENA-78), peptid koji aktivira neutrofile-2 (NAP-2) i inflamatorni protein makrofaga α i β (MIP-1), inflamatorni protein makrofaga-2 α i β (MIP-2), protein hemotakse monocita (MCP-1, 2 i 3), eotaksin.
Hemokini su odgovorni za bolju regulaciju izlaza iz krvnih žila različitih leukocita, što doprinosi pravilnom slijedu emigracije leukocita. Važna je regulacija redoslijeda oslobađanja leukocita iz krvnih žila biološki značaj. Prva linija odbrane kod svake upale su neutrofilni leukociti, koji pripadaju nespecifičnom imunitetu. Ako je nemoguće brzo uništiti antigen, aktivno se povezuje specifična imunost i na mjesto upale ulaze najprije ćelije koje predstavljaju antigen (krvni monociti), a zatim limfociti i eozinofili.
Organi i tkiva također imaju svoju populaciju rezidualnih makrofaga, koji igraju ključnu ulogu u pokretanju lokalnog upalnog odgovora. Tokom regrutacije neutrofila, populacija rezidualnih makrofaga se smanjuje. Ovaj fenomen je imenovan reakcije nestanka makrofaga. Poput neutrofila, monociti krvi također migriraju u žarište upale i neko vrijeme se pretvaraju u makrofage, međutim, njihov maksimalni broj u tkivu se opaža nešto kasnije od neutrofila.
Neutrofili imaju snažna histotoksična svojstva. Stoga, kako se regrutuju drugi leukociti, neutrofili moraju umrijeti apoptozom ili nekrozom. Osim toga, dio neutrofila može napustiti mjesto upale kroz sistem limfne drenaže i ući natrag u krvotok.
FAGOCITOZA
Ilja Iljič Mečnikov opisao je fagocitozu 1883. godine kao opšti biološku pojavu u životu jednoćelijskih i višećelijskih organizama, koji se sastoji u apsorpciji ćelija drugih ćelija.
Fagocitoza je proces hvatanja čestica od strane ćelije endocitozom receptora. Maksimalna aktivnost fagocita se opaža u odnosu na čestice prečnika većeg od 1 mikrona. Međutim, moguća je i fagocitoza manjih čestica, do 100 nm u prečniku. Fagocitozu u žarištu upale provode makrofagi, koji su "profesionalni" fagociti. Fagocitoza se odvija u nekoliko faza: 1 - približavanje (kemotaksa), 2 - adhezija na objekt fagocitoze (privlačenje, adhezija), 3 - uranjanje objekta fagocitoze (endocitoza receptora), 4 - ubijanje (ubijanje), 5 - intracelularno varenje.
3.6.1. prianjanje leukocita na objekt fagocitoze je proces posredovan receptorima. Na membrani leukocita mogu se naći receptori za mnoge antigene mikroorganizama, koji pripadaju receptorima "primarnog imuniteta". Međutim, ovaj mehanizam vezivanja leukocita za antigen je ograničen i ne dozvoljava punopravni imunološki odgovor. Stoga se u većini slučajeva adhezija leukocita na objekt fagocitoze provodi uz pomoć univerzalnih "medijatora", a to su imunoglobulini (uglavnom IgG) i sistem komplementa (C3b). Proces vezivanja objekta fagocitoze sa takvim proteinima za naknadnu fagocitozu naziva se opsonizacija, dok su proteini koji obavljaju ovu funkciju opsonins. Nakon opsonizacije objekta fagocitoze, leukocit stupa u interakciju ne sa antigenom mikroorganizma, već sa imunoglobulinom preko odgovarajućeg receptora za Fc fragment imunoglobulina ili preko receptora za C3b. Kao opsonini najaktivniji su imunoglobulini G1 i G3, u manjoj mjeri Μ i Ε. Prepoznaju ih Fcγ ili drugi Fc receptori. Faktor komplementa C3b i njegov nestabilni oblik iC3b također su uključeni u opsonizaciju preko CR1-CR3 receptora, kako kada se direktno aktiviraju objektima fagocitoze, tako i kada se aktiviraju imunoglobulinima i imunološkim kompleksima. Opsonizacija povećava aktivnost prianjanja za nekoliko puta. C-reaktivni protein je također koopsonin, jer veže C-protein pneumokoka i drugih mikroba i posreduje u vezivanju faktora komplementa i fagocita za njih.
Ponekad opsonizacija može imati negativan učinak. Neki mikroorganizmi (npr. Staphylococcus aureus) i virusi (na primjer, herpes virus) su u procesu evolucije razvili sposobnosti koje im omogućavaju da izbjegnu opsonizaciju uz pomoć proteinskih analoga Fcγ receptora. Oni blokiraju opsoninska antitijela i sprječavaju da se fagociti zalijepe za objekat koji ih posjeduje. Patogeni koji imaju sposobnost da se vežu za antitijela ne samo na Fab, već i na Fc fragment, mogu izazvati stvaranje velikih kompleksa koji sadrže nekoliko molekula imunoglobulina i mikrobnih tijela (virusne čestice).
U početku tijelo ima nedovoljnu količinu imunoglobulina koji se može vezati za određeni antigen mikroorganizma, pa je maksimalna aktivnost fagocitoze nemoguća bez stvaranja dovoljne količine imunoglobulina specifičnih za ovaj antigen. Nakon prepoznavanja antigena i proizvodnje antigen-specifičnih imunoglobulina, proces opsonizacije se intenzivira, što rezultira uništenjem mikroorganizma, uključujući i fagocitozom.
3.6.2 Faza ronjenja objekt fagocitoze završava formiranjem fagosoma. Ovaj proces je energetski ovisan i povezan je s radom kontraktilnih proteina fagocita, koji nastaje nakon interakcije opsoniziranog mikroorganizma s odgovarajućim receptorima na membrani fagocita. Kao rezultat uranjanja, predmet se nalazi u citoplazmi fagocita, potpuno okružen fagosomom nastalim invaginacijom i zatvaranjem dijela stanične membrane.
3.6.3.Faza probave javlja se uz učešće mikrofilamenata citoskeleta i proteina fagozogena. Fagosom se spaja sa lizosomima i specifičnim granulama fagocita (unutrašnja degranulacija), formirajući fagolizosom, gdje se javlja završni stupanj fagocitoze. Svi ovi procesi pokreću se ulaskom kalcijevih jona u ćeliju i aktivacijom protein kinaze C.
Uništavanje (ubijanje) objekata fagocitoze događa se kroz različite mehanizme. Dijele se na zavisne i nezavisne od kiseonika:
Ubijanje ovisno o kisiku sastoji se u uništavanju sadržaja fagosoma komponentama koje nastaju u reakciji halogenacije i peroksidacije, a to su hipoklorit, vodikov peroksid, singletni kisik, hidroksilni radikali i druge reaktivne kisikove vrste.
Za mehanizme neovisne o kisiku uključuje izlaganje supstancama kao što su lizozim, elastaza, kolagenaza, katepsini, laktoferin, kationski proteini (defenzini, protegrini).
Nakon smrti mikroorganizma dolazi do konačne probave njegovih struktura enzimima fagocita. Fagocitoza, koja je završila uništenjem mikroorganizma i probavom objekta fagocitoze, naziva se završeno.
3.6.3.3. nepotpuna fagocitoza.
1. Blokada fagozomsko-lizosomske fuzije koja se nalazi kod virusa (na primjer, virus gripe), bakterija (mikobakterija) i protozoa (toksoplazma).
2. Otpornost na lizozomske enzime (gonokoke i stafilokoke).
3. Sposobnost patogenih mikroorganizama da nakon apsorpcije brzo napuste fagozome i ostanu u citoplazmi duže vrijeme (rikecije).
4. Sposobnost proizvodnje katalaze, koja uništava vodikov peroksid (stafilokok, aspergil), koja blokira uništavanje mikroorganizama i antigen-prezentirajuću funkciju fagocita.
PROLIFERATION
Proliferacija u kontekstu upale se odnosi na proces obnavljanja strukture oštećenog tkiva, koji se javlja nekoliko sati nakon oštećenja. Cilj proliferacije može se postići samo ako ne dođe do daljeg oštećenja tkiva, inače će nove ćelije biti uništene štetnim faktorima. U procesu proliferacije razlikuju se 3 faze:
čišćenje tkiva od oštećenja ćelijskih elemenata, mikroorganizmi i drugi strani elementi
stimulacija vaskularnog rasta u oštećenom tkivu
obnavljanje integriteta tkiva.
Proces proliferacije i popravke oštećenog tkiva postaje značajan tek kada se završe glavni procesi primarnog i sekundarnog oštećenja. Glavni uvjet za uspješan tok reparativnog procesa kod upale je slabljenje akutnih alterativnih i eksudativnih promjena. To je moguće postići samo ako se flogogeni agens potpuno eliminiše (eliminiše). Ako se flogogeni agens ne eliminira u potpunosti, upala može postati kronična. Drugi uvjet za prijelaz na reparativne procese zahtijeva djelovanje protuupalnih medijatora.
Čišćenje tkanine neutrofilni leukociti i makrofagi, koji su glavne ćelije, prenose se iz oštećenih ćelija i mikroorganizama akutna upala. Neutrofilni leukociti okružuju žarište upale, stvarajući barijeru između oštećenog područja i zdravog tkiva. Sličnu funkciju obavlja venska staza, sprječavajući širenje flogogena kroz krvne žile.
Angiogeneza - dolazi do obnove vaskularne mreže u oštećenom tkivu pod uticajem faktora rasta. To uključuje faktor rasta fibroblasta (FGF), faktor rasta izveden iz trombocita (PDGF), faktor rasta vaskularnog endotela (VEGF), transformirajući faktor rasta (TGF α i β), epidermalni faktor rasta (EGF)). Pod njihovim utjecajem dolazi do diobe endotelnih stanica, od kojih neke dolaze direktno iz žarišta upale, a neke dolaze u obliku prekursora endoteliocita iz koštana srž, i formiranje cijevi buduće kapilare (angiogeneza). Endotelne ćelije u novonastalim kapilarama su funkcionalno nesposobne, a ovi sudovi su visoko propusni. Tada endotelne ćelije „sazrevaju“, formira se bazalna membrana, a novonastali krvni sudovi dobijaju svojstva normalnih kapilara.
Regeneracija je zamjena izgubljenih ćelija ćelijama istog tipa. Ako je potpuna kvantitativna obnova parenhimskih stanica nemoguća, na primjer, gubitkom ćelijskih elemenata nesposobnih za diobu, tada se parenhimski defekt nadopunjuje vezivnim tkivom. Formira se mlado granulaciono tkivo bogato regenerirajućim, visoko propusnim sudovima, zatim vezivno tkivo i ožiljak. Tokom reparativnih procesa u žarištu upale, povećanom proliferacijom postiže se regeneracija ćelija i rast vezivnog tkiva. Stimulansi proliferacije su takođe faktori rasta. Vodeći faktori rasta za različite ćelije mogu varirati. Dakle, ako se za endotelne ćelije glavni može nazvati vaskularni endotelni faktor rasta (VEGF), onda je za fibroblaste to faktor rasta fibroblasta (FGF), a za epitelne ćelije epidermalni faktor rasta (EGF).
Ishodi akutne upale
Ishodi akutne upale zavise od etiološki faktor koja uzrokuje primarno oštećenje, kao i reaktivnost organizma, koja određuje stepen sekundarnog oštećenja i stepen regeneracije.
Povoljan ishod upale -potpuna obnova strukture i funkcije nastaje prilikom upale u dobro regenerirajućim tkivima, s tim da je volumen oštećenog tkiva relativno mali zbog rasta vezivnog tkiva i parenhima, koji se javljaju istovremeno sa rastom krvnih žila. Prema svojoj proliferativnoj aktivnosti, tkiva se dijele na 3 tipa: sa visokom proliferativnom aktivnošću (koštana srž, epitel kože i sluzokože); sa mogućom proliferativnom aktivnošću u uslovima oštećenja (hepatociti); neproliferirajuća tkiva (nervi, mišići).
Procesi proliferacije imaju ne samo mehanizme stimulativne, već i inhibitorne regulacije, što je takođe veoma važno. Tako fibroblasti uključeni u regeneraciju tkiva postepeno gube svoju proliferativnu aktivnost, što sprječava njihovu pretjeranu proliferaciju. U ovom slučaju se inhibira ekspresija faktora rasta i receptora za njih. Važan objekt u mehanizmu regulacije proliferativne aktivnosti ćelija su koneksini, molekuli koji formiraju ne samo međućelijske kontakte, već formiraju i kanale kroz koje prodiru ioni kalcija i cAMP, utičući na proliferativnu aktivnost ćelija. Inhibicija proliferativne aktivnosti ćelije postiže se takozvanim fenomenom "kontaktne inhibicije", kada nakon postizanja određene gustine ćelijskih kontakata počinje inhibicija proliferativne aktivnosti na nivou regulacije ćelijskog genoma.
Relativno povoljan ishod upale – Nepotpuna restauracija strukture(ožiljak) se javlja u bilo kom tkivu sa teškom ćelijskom smrću, ili sa bilo kojim oštećenjem tkiva sa mogućom proliferativnom aktivnošću ili neproliferirajućim tkivima (ožiljci na koži zbog mehaničke traume ili opekotina, postinfarktna kardioskleroza). Uz povećanje proliferativne aktivnosti fibroblasta i nedovoljnu inhibitornu regulaciju, moguća je njihova prekomjerna proliferacija, koja se manifestira u obliku hipertrofičnih i keloidnih ožiljaka. Pojava ovakvih ožiljaka djelimično ima genetsku predispoziciju povezanu sa nekim genima u HLA sistemu (HLA BW16, HLA BW21). Dokazano je da su fibroblasti u hipertrofičnim i keloidnim ožiljcima aktivniji, proizvode više kolagena, fibronektina i proteoglikana, a imaju i poremećenu osjetljivost na regulatorne mehanizme.
Formiranje defekta tkiva- Još jedna opcija za relativno povoljan ishod upale. Uz nedovoljnu aktivnost proliferativnih procesa na pozadini kronične hipoksije tkiva, na primjer, u patologiji mikrožila kod dijabetičke mikroangiopatije ili kod kronične venska insuficijencija procesi proliferacije mogu biti značajno odloženi. A nesklad između prirodnog gubitka stanica i njihovog oporavka može dovesti do stvaranja defekta tkiva (čira).
Nepovoljni ishodi upale:
Smrt organa ili tkivo se javlja s izuzetno teškim primarnim oštećenjem i s kršenjem reaktivnosti tijela, na primjer, u pozadini poremećaja cirkulacije (gangrene).
Generalizacija upale(sepsa) je povezana sa ulaskom u krv velikog broja citokina (IL-1b, IL-6, TNF-a) i razvojem "sindroma sistemskog inflamatornog odgovora". Generalizacija infekcije izvan žarišta upale odvija se kroz limfne i krvne žile.
hronična upala leži u osnovi mnogih uobičajenih bolesti: od reumatoidnog artritisa i tuberkuloze do pneumokonioze i ateroskleroze. glavni razlog tranzicija akutne upale u kroničnu je dugotrajno trajno oštećenje tkiva infektivnim ili neinfektivnim faktorima. Hronična infektivna upala javlja se u dva slučaja: 1 - s razvojem imunodeficijencije, kada imuni sistem tijelo se ne može nositi s infekcijom; 2 - u slučaju bolesti uzrokovane specifičnom infekcijom i početnim neuspjehom imuniteta protiv patogena (mikoplazme, spirohete, klamidija, protozoe itd.). Hronična neinfektivna upala nastaje i iz dva razloga: 1 - uz produženo djelovanje stranih endo- ili egzogenih štetnih faktora na tkivo (komponente prašine, strano tijelo u tkivu); 2 - sa razvojem autoimuni proces kada postoji trajno oštećenje tkiva autoantitijelima ili senzibiliziranim limfocitima.
Mehanizmi hronična upala razlikuju od mehanizama akutne upale, kao i njihov ćelijski sastav. Ako su kod akutne upale glavne efektorske stanice neutrofilni granulociti, onda su to kod kronične upale monociti/makrofagi i limfociti. Posebnost kronične upale leži u mononuklearnoj infiltraciji zahvaćenih tkiva limfocitima i makrofagima. Često dolazi do nakupljanja i produženog aktivnog funkcioniranja makrofaga u žarištima upale. Tome doprinose faktori koji inhibiraju migraciju makrofaga - oksidiranih lipida, kao i peptida koje luče T-limfociti (MIF).
Za kronične upale povezane s djelovanjem infekcije karakterističan je mehanizam hiperergijske reakcije odgođenog tipa (DTH). Citokini koji se oslobađaju tokom infiltracije makrofaga i limfocita međusobno aktiviraju limfocite i makrofage, stvarajući začarani krug koji održava upalu, posebno hemotaktički protein monocita-1 (MCP-1) i inflamatorni protein-beta makrofaga (MIP-1β).
Angiogeneza u zoni hronične upale: Hronična upala je praćena visokom proliferativnom aktivnošću komponenti vaskularnog zida i vaskularnog rasta (angiogeneza) usled faktora rasta kao što je faktor rasta fibroblasta (α-FGF i β-FGF). Transformirajući faktor rasta (TGF-β), koji ima proangiogenu prirodu djelovanja, stimulira diferencijaciju glatkih mišićnih stanica i formiranje bazalne membrane krvnih žila.
Sistemske reakcije kod akutne upale
Sistemske reakcije tijela na akutnu upalu nazivaju se reakcija akutne faze . Upalu, u pravilu, prate ne samo lokalne, već i sistemske reakcije. Sistemske reakcije tijela na upalu uglavnom su povezane s oslobađanjem citokina u krv. Glavni citokini koji izazivaju sistemsku reakciju su interleukin-1 β (Il-1b), interleukin-6 (Il-6) i faktor nekroze tumora alfa (TNF-a).
· Akutna upala uzrokuje gubitak apetita, loše zdravlje, pospanost, smanjenu toleranciju na fizički i psihički stres. Citokini (prvenstveno TNF-a i IL-1 ) utiču na zone hipotalamusa i druge strukture centralnog nervnog sistema odgovorne za san, izazivajući njihovu stimulaciju. Stoga, s akutnom upalom, pacijenti u pravilu doživljavaju opću pospanost i malaksalost, koji se često nazivaju znakovima "otrovanja". Neki citokini, kao što je IL-1, proizvodi mikroglija pod dejstvom proupalnih stimulusa. Utjecaj citokina na termoregulacijski centar u hipotalamusu dovodi do razvoja groznice. Citokini također mijenjaju funkcionalnu aktivnost jezgara hipotalamusa, utječući na stvaranje neurotransmitera.
Kao rezultat aktivacije hipotalamus-hipofizno-nadbubrežnog sistema, povećava se nivo kateholamina i glukokortikoida.
· Odgovor koštane srži akutna upala je aktivacija leukopoeze, što dovodi do povećanja broja leukocita u krvi (leukocitoza) i, u manjoj mjeri, povećane proizvodnje trombocita. U pozadini takvih promjena u leukocitima i trombocitima, postoji određena inhibicija eritropoeze, koja je praćena anemijom.
· Proteinsko-sintetička funkcija jetre: citokini, prvenstveno interleukin-6, povećavaju stvaranje proteina akutne faze u jetri. "Proteini akutne faze" je opšti naziv za proteine koji nastaju u jetri tokom upale, a koji imaju zaštitnu funkciju. Učestvuju u antimikrobnoj, antioksidativnoj, antitoksičnoj zaštiti i dio su sistema hemostaze.
Gastrointestinalni: smanjena sekrecija želudačni sok, motilitet gastrointestinalnog trakta je inhibiran.
Stranica 1
Inflamatorno žarište koje se javlja u rožnici izaziva iritaciju nervnih završetaka, što povlači tipičnu reakciju: fotofobija, suzenje, blefarospazam, osjećaj strano tijelo ispod kapka Kombinacija ovih subjektivnih znakova naziva se kornealni sindrom. U prisustvu takvog sindroma potrebno je pažljivo pregledati rožnicu. Upalni infiltrat u rožnjači je praćen crvenilom oka. Istovremeno, duboke žile perilimbalne regije su uključene u proces. Opskrba krvlju i širenje ovih žila uzrokuje svijetlu ljubičastu boju u obliku vjenčića koji okružuje rožnicu. Takva lokalna hiperemija oka naziva se perio-kornealna injekcija.
Razlikovanje svježeg inflamatornog žarišta i starog cicatricijalnog opacifikacije vrlo je važno u dijagnozi i izboru liječenja. Ovo je posebno važno zapamtiti kod rekurentnih bolesti kako bi se razlikovalo staro žarište od novog, konjuktivitis na oku s trnom od keratitisa, iridociklitis u prisustvu ožiljaka rožnice od keratoiritisa.
Izvor prednjeg osteoperiostitisa su upalna žarišta u tkivima uz orbitu očnih kapaka, periorbitalnoj regiji, suznim organima, koži lica, ali najčešće dolaze iz paranazalnih sinusa nos sa empijemom potonjeg, iz karijesnih zuba, a kod djece mlađe od 3 mjeseca - iz njihovih rudimenata. Upalni proces se širi iz primarnog žarišta duž nastavka ili duž venskih žila s tromboflebitisom. At uobičajene infekcije upalni proces u koštanim zidovima orbite može nastati na hematogeno-metastatski način.
Lokalizacija koloidnih boja u žarištima upale dovela je do upotrebe radioaktivnih derivata ovih boja za otkrivanje unutrašnjih apscesa. U tu svrhu sintetiziran je dibromtripan. Kod zečeva, lezije su izazvane injekcijom virulentnih stafilokoka u blizini agar mase želatinirane u potkožnom tkivu.
Otpust rekonvalescenta je moguć nakon kliničkog oporavka i nestanka žarišta upale u plućima. Nakon otpusta iz bolnice radi profilakse rezidualni efekti i mogućnost recidiva, klinički pregled je neophodan u roku od 1 do 2 godine.
Očigledno, moramo priznati da postoji određena interakcija između aktivnosti žarišta upale u oku i općeg imunobiološkog stanja pacijenta. I ako mogućnost nasilnog izbijanja tuberkuloznog procesa u oku u velikoj mjeri ovisi o općem imunobiološkom stanju organizma, onda je sam upalni žarište oka, sa svoje strane, u stanju u određenoj mjeri utjecati na opću osjetljivost. Ovo pitanje je već više puta postavljano, ali još nije dobilo dovoljno uvjerljivo rješenje. U svakom slučaju, malo uvjerljivim se čini razmišljanje Leleina (Lohlein, 1950) da je veličina očnog inflamatornog žarišta premala da bi imala ikakav primjetan učinak na stanje imuniteta cijelog organizma. Kao što je poznato, reakcija tijela na žarište upale, uključujući tuberkulozu, nije određena veličinom ovog drugog, već brojem i virulentnošću patogenih mikroorganizama koji se nalaze u njemu. A ako bilo koje akutne upalne bolesti rožnice ili drugih tkiva oka koje su siromašne krvnim sudovima zaista ne daju obično izražene opšte reakcije, onda to ne ovisi toliko o maloj veličini fokusa oka, koliko o njegovoj izolaciji od zajednički sistem cirkulacija. Sa uvealnom lokalizacijom očnog žarišta, uslovi za aktivnu interakciju između upalnog procesa u oku i opšteg imunobiološkog stanja pacijenta su, naravno, neuporedivo povoljniji. Jasna potvrda toga mogu poslužiti brojna klinička opažanja koja pokazuju postupno smanjenje intenziteta reakcije na intradermalnu primjenu tuberkulina kako se akutni upalni proces oka smiri u bolesnika s prednjim i stražnjim uveitisom tuberkulozne etiologije. Posebno je zanimljivo u dinamici promatrati paralelni pad intenziteta očnog procesa u stražnjim dijelovima uvealnog trakta, gdje spuštanje upale koroida odmah utiče na oticanje okolne mrežnice i odgovarajuće povećanje vidne oštrine i postepeno smanjenje veličine i intenziteta hiperemije i papule koje se javljaju na mjestu intradermalne injekcije tuberkulina.
Kao što je poznato, ubrzano i pojačano oslobađanje tripan plavog unutar žarišta upale u tkivu nastaje zbog narušavanja permeabilnosti. krvni sudovi. Budući da je, sudeći po primijenjenom testu, permeabilnost manje narušena nakon primjene acetoksana, treba zaključiti da acetoksan ima poznat normalizujući učinak na permeabilnost, sprečavajući njeno narušavanje u žarištu upale.
Moderne ideje ne isključuju mogućnost uključivanja procesa proliferacije i diferencijacije limfocita direktno u žarište upale. U svakom slučaju, ovdje su prisutne sve potrebne populacije stanica: T-pomoćnici, B-ćelije i makrofagi kao antigen-prezentujući.
Klinička opažanja nam često mogu pružiti jednako nesumnjiv dokaz o jasnom utjecaju aktivnog razvoja tuberkuloznog upalnog žarišta u uvealnom traktu bolesnog oka na opće imunobiološko stanje pacijenta.
Naravno, sam po sebi pozitivan rezultat intradermalnog Mantoux tuberkulinskog testa kod pacijenta s upalnim žarištem u uvealnom traktu oka ne može se smatrati dokazom tuberkulozne prirode očnog procesa. Međutim, ako se peckanje u ovom slučaju odnosi na osobu kod koje ni najtemeljitijim i sveobuhvatnijim pregledom nisu otkrivena druga aktivna žarišta upale u organizmu, pored samo jednog brzo razvijajućeg žarišta upale u oku, onda pozitivni rezultati Uzorci Mantouxa moraju se tretirati s određenom pažnjom. S tim u vezi treba spomenuti i neke statističke podatke.
Sva gore navedena razmatranja primjenjuju se, naravno, samo na one slučajeve gdje postoji aktivno žarište upale u oku. Ako su tu sačuvani samo cicatricialni ostaci upale koja je odavno prestala postojati, onda ni radiografija ni koža tuberkulinski testovi ne može nam više pomoći da razotkrijemo etiologiju procesa koji je iza sebe ostavio sve ove promjene.
Materijal za studiju je gnoj iz fistula i ulcerativnih lezija, struganje s rubova ulkusa, punkcije zatvorenih upalnih žarišta, biopsije zahvaćenih tkiva.
Uz pravodobno liječenje, poboljšanje se javlja nakon 2-3 dana: temperatura se smanjuje, simptomi intoksikacije se smanjuju, upalna žarišta podliježu obrnutom razvoju. Međutim, u većini slučajeva jedan antibiotska terapija nije dovoljno i stoga treba sprovesti patogenetski tretman: specifični gama globulin, kortikosteroidi (70-100 mg dnevno) oralno 5-6 dana.
Liječenje kompleksa herpetičnog keratitisa: upotreba antivirusna sredstva, imunoterapija, metode koje stimuliraju regeneraciju i trofizam rožnice, fizički utjecaj na žarište upale u rožnici i kirurško liječenje.
Udisanje hlora izaziva oštar kašalj i gušenje, upalu sluzokože respiratornog trakta, plućni edem, a kasnije i stvaranje upalnih žarišta u plućima.
Kao što znate, akutnu upalu karakterizira određeni niz vaskularne promjene, koji se manifestuje razvojem vazospazma, arterijskog, venska kongestija i zastoj.
Vasospazam je kratkotrajna reakcija. Grč može trajati nekoliko sekundi (sa mala oštećenja tkiva) do nekoliko minuta (u slučaju teškog oštećenja). Takva vaskularna reakcija u žarištu upale nije strogo neophodna i ne manifestira se u nekim slučajevima kada su parenhimski organi oštećeni. Pojava vazospazma u području upale je posljedica kontrakcije glatkih mišićnih elemenata krvnih žila kao odgovora na njihovo oštećenje, kao i ekscitacije vazokonstriktora pod utjecajem jakog, brzodjelujućeg promjenjivog faktora. Kratkotrajnost ove faze određena je brzom inaktivacijom vazokonstriktornih medijatora - noradrenalina, adrenalina pod utjecajem monoamin oksidaze. Moguće je da je serotonin uključen u mehanizme vazospazma u području upale, koji se oslobađa u velikim količinama kada su tkiva oštećena od trombocita i mastocita. Vanjska manifestacija vazospazma je blanširanje područja tkiva gdje se razvija upalni proces.
Stadij arterijske hiperemije karakterizira umjereno širenje malih arterija, arteriola, kapilara, venula, kao i funkcioniranje rezervnih kapilara (fenomen kapilarne neoformacije). Proširenje krvnih žila uzrokuje povećanje dotoka krvi u tkivo, pojačano stvaranje limfe i odliv limfe. Dotok krvi može malo premašiti njen odliv, što doprinosi povećanju hidrodinamičkog pritiska u žilama, povećanju linearnog i volumetrijska brzina protok krvi, smanjujući arteriovensku razliku kisika. U ovoj fazi, takav spoljni znaci upala poput crvenila i groznice. Povećana oksigenacija tkiva aktivira metabolizam ćelija, pospješuje pojavu reaktivnih kisikovih vrsta, koje s jedne strane mogu štetno djelovati na intaktne stanice i vezivno tkivo, as druge strane, postati faktori zaštite organizma od infektivnih patogena. , a nakon toga imaju stimulativni učinak na procese proliferacije u području upale. Razvojem arterijske hiperemije do žarišta upale povećava se priliv humoralnih zaštitnih faktora - komplementa, properdina, fibronektina, interferona, ceruloplazmina itd. Intenzivan protok krvi osigurava ispiranje toksičnih metaboličkih produkata, faktora patogenosti koje proizvode mikroorganizmi, i biološki aktivne supstance. U nekim slučajevima, uz smanjenje reaktivnosti tijela, zbog intenzivnog krvotoka, može doći do širenja infekcije i razvoja septičkog stanja. Arterijska hiperemija može trajati nekoliko sati i dana, a najizraženija je na periferiji alteracijske zone. Razvoj arterijske hiperemije zasniva se na nekoliko mehanizama:
1. Neurogeni - zbog aktivacije aksonskog refleksa, jačanja holinergičkog i histaminergičkog nervni uticaji na vaskularnom zidu, kao i oštećenje senzornih peptidergičnih nervnih vlakana uključenih u nocicepciju i oslobađanje senzornih neuropeptida – supstance P, genskog peptida srodnog kalcitoninu, proteinskog genskog peptida. Ovi neuropeptidi imaju izražen vazodilatacijski efekat.
2. Neuroparalitički - zbog pareze simpatičkih vazokonstriktora i smanjenja osjetljivosti vaskularnih adrenoreceptora.
3. Mioparalitički - zbog smanjenja bazalnog vaskularnog tonusa pod uticajem umerenih koncentracija vazoaktivnih jedinjenja (histamin, kinini, leukotrieni i dr.), kao i zbog H + - i K + -hiperionije. Kako se diže upalni proces arterijska hiperemija se zamjenjuje venskom.
Vensku hiperemiju karakterizira daljnja vazodilatacija, smanjenje brzine protoka krvi, pletora tkiva, fenomen marginalnog stajanja leukocita i njihova emigracija, narušavanje reoloških svojstava krvi i povećanje procesa eksudacije.
Faktori koji utječu na prijelaz arterijske hiperemije u vensku hiperemiju mogu se podijeliti u dvije grupe: intravaskularne i ekstravaskularne.
Za intravaskularne faktore, izazivanje razvoja venska hiperemija, uključuje oticanje endotelnih ćelija, marginalno stajanje leukocita, aktivaciju sistema hemostaze, lupanje eritrocita, zgušnjavanje krvi, povećanje njenog viskoziteta i stvaranje mikrotromba.
Od ekstravaskularnih faktora, edem tkiva i kompresija venula, malih vena, limfnih sudova eksudat. Prekomjerna akumulacija medijatora sa vazodilatacijskim djelovanjem, enzima lizosoma i vodikovih jona, kao i povreda perikapilarnog vezivnog skeleta i dezmosoma u zoni primarne i sekundarne alteracije u žarištu upale povećavaju vensku hiperemiju.
Vanjske manifestacije venske hiperemije su edem tkiva, cijanoza, smanjenje metaboličkih procesa i, kao rezultat, smanjenje temperature u žarištu upale. Jačanje hipoksije i acidoze stimuliše razvoj elemenata vezivnog tkiva duž periferije žarišta upale i na taj način osigurava stvaranje barijere koja odvaja žarište upale od zdravog tkiva. Neutrofili i mononuklearne ćelije takođe učestvuju u formiranju barijere.
Ograničenje protoka krvi u području venske hiperemije i stvaranje barijera pomažu u smanjenju resorpcije produkata raspadanja i toksičnih čimbenika iz žarišta upale, a također smanjuju rizik od širenja infektivnih agenasa. Međutim, s razvojem upale u parenhimskim organima, produžena venska hiperemija može dovesti do smanjenja njihovih specijaliziranih funkcija i razvoja stanične skleroze.
Ishod venske hiperemije je staza - potpuno zaustavljanje krvotoka u žilama. Rasprostranjena staza je karakteristična za akutnu upalu koja se brzo razvija (hiperergijska). Trajanje i ishod zastoja mogu biti različiti. Staza može trajati od nekoliko sati do nekoliko dana; može biti reverzibilan i nepovratan.
Mehanizmi emigracije leukocita. Uloga leukocita u upali
Kao što je već napomenuto, najvažniji znak venske hiperemije je emigracija leukocita iz krvnih žila u upaljeno tkivo. Redoslijed oslobađanja leukocita naziva se Mečnikov zakon, prema kojem nakon nekoliko sati (1,5-2 sata) nakon djelovanja promjenjivog faktora, neutrofili i drugi segmentirani leukociti intenzivno emigriraju, a zatim monociti i limfociti.
Procesu emigracije prethodi kršenje aksijalnog protoka krvi unutar žile. U uslovima usporavanja krvotoka, eritrociti, spajajući se u „novčiće“, zauzimaju centralni deo žile, a leukociti, koji imaju manju specifičnu masu, napuštaju aksijalnu struju, prvo do granice sloja plazme, a zatim počinju da prianjaju na endotelne ćelije krvnog suda. Važnu ulogu u adheziji (lat. adhaesio – lijepljenje) leukocita imaju takozvani endotelno-leukocitni adhezivni molekuli (ELAM), koji se eksprimiraju na površini leukocita, endotelnih ćelija i makromolekula intercelularnog matriksa u žarištu. upale. Aktivatori ekspresije ELAM-a na leukocitima i endotelnim ćelijama u području upale su biološki aktivne supstance - citokini, kao što su IL-1, IL-8, LT B4, FAT, TNF-a, a-interferon, frakcije komplementa C5a i Bb, hemotaktički faktori, bakterijski lipopolisaharidi itd. Pod uticajem ovih medijatora dolazi do konformacionih promena u membrani u leukocitima i vaskularnim endotelnim ćelijama, oslobađaju se i eksprimiraju adhezioni molekuli. Većina citokina podjednako utiče na adhezivnost leukocita i endotela, ali postoji i selektivni efekat medijatora na različite ćelije. Dakle, LT B4 inducira pojavu adhezionih molekula na neutrofilima, IL-1 na vaskularnom endotelu, komponenti komplementa na monocitima i granulocitima.
Trenutno je poznato nekoliko klasa molekula stanične adhezije:
1. Selektini su molekuli adhezije lektinskih ćelija koji najviše posreduju rana faza interakcije između leukocita i vaskularnog zida. Selektini se eksprimiraju rano i ne obezbjeđuju snažno vezivanje leukocita za vaskularni endotel. Postoje tri vrste selektina: L-selektine sintetiziraju svi leukociti,
E-selektine sintetiziraju endoteliociti. Ovi selektini obezbeđuju fenomen marginalnog stajanja leukocita. izvor
P-selektini su trombociti i vaskularni endotel; osim što učestvuju u procesima marginacije leukocita, pospješuju adheziju trombocita.
2. Integrini su heterodimerni proteini izraženi različitim leukocitima i hematopoetskim ćelijama. Endotel izražava samo nekoliko integrina. Do sada je identifikovano pet tipova integrina. Najvažnija za migracijski i fagocitni proces su tri heterodimera. Ovi integrini su odgovorni za kasnijim fazama interakcije između leukocita, trombocita i vaskularnog endotela.
3. Adhezivni molekuli superfamilije imunoglobulina (ICAM) su transmembranski proteini sa pet ekstracelularnih domena, izraženi pretežno endotelom. Neke od ovih molekula sintetiziraju neaktivirane stanice i određuju brzinu fiziološke migracije leukocita. U zoni upale pod uticajem IL-1, TNF, gama-interferona aktivira se sinteza i ekspresija ICAM molekula, što obezbeđuje odloženu fazu adhezije i emigracije leukocita. Grupa proteina sličnih imunoglobulinima uključuje limfocitne receptore - CD2, CD58 (LFA-3). Ekspresiraju se na T-limfocitima i antigen-prezentirajućim ćelijama, učestvuju u prezentaciji antigena i kontaktu citotoksičnih limfocita sa ciljnim ćelijama.
4. Adresini - proteini endotelnih ćelija venula limfoidnih organa. Imati veliki značaj u migraciji limfocita u žarišta kronične i autoimune upale. Kod akutne upale adresani su manje značajni.
5. Hrskavični vezivni proteini. Izražen svim vrstama leukocita, prepoznajte hijaluronska kiselina, koji osigurava kretanje leukocita u glavnoj tvari vezivnog tkiva.
Nedovoljnim stvaranjem selektina i integrina ili stvaranjem antitijela na membranske receptore, smanjuju se adhezivna svojstva leukocita, smanjuje se njihova sposobnost emigriranja, akumulacije u žarištu upale i fagocitoze, što može doprinijeti čestim gnojne infekcije i razvoj sepse.
Važna uloga u procesima adhezije i emigracije pripada eliminaciji negativnog naboja endotelnih ćelija i leukocita zbog nagomilavanja u žarištu upale jednovalentnih i dvovalentnih jona (H, K, Ca, Mn, Mg), kao što su kao i kationski proteini koje luče leukociti. Faktori koji iniciraju adheziju leukocita na zid krvnih sudova su komplement (C5a), leukotrieni, fibronektin, imunoglobulini (IgG Fc fragment), histamin.
Nakon adhezije, leukocit se pomiče duž površine endotelne ćelije do interendotelnog jaza, koji je značajno proširen u žarištu upale, a zatim formiranje pseudopoda i kretanje leukocita kroz interendotelni jaz u subendotelni prostor i bazalnu membranu krvnog suda. Dakle, leukociti su izvan žile.
U većini slučajeva akutne upale, intravaskularno kretanje leukocita i njihova emigracija traje nekoliko sati. U pravilu, neutrofili prvi ulaze na mjesto upale, nalaze se u upaljenom tkivu nakon 6-24 sata. Nešto kasnije, monociti i limfociti emigriraju (24-48 sati). Takva asinhronizacija ćelijske emigracije nastaje zbog neistovremenog pojavljivanja adhezionih molekula i hemotaktičkih faktora specifičnih za različite leukocite.
Treba napomenuti da su vremenski intervali emigracije leukocita i redoslijed njihovog oslobađanja vrlo relativni i određeni su tipom krvnog suda, vrstom upale i stadijumom upale.
Dakle, u zoni upalnog procesa izazvanog uzročnicima tuberkuloze, listerioze, klamidije, toksoplazmoze, virusna infekcija, u žarištu upale u početku dominiraju mononuklearne ćelije, kod alergijskih reakcija - eozinofili.
Usmjereno kretanje leukocita osiguravaju kemoatraktanti čija koncentracija raste s razvojem sekundarne alteracije u žarištu upale, kao i prisustvom receptora za različite kemoatraktante na površini leukocita.
Prilikom interakcije receptora i kemoatraktanata dolazi do hiperpolarizacije membrane leukocita, povećava se njena permeabilnost za ione Ca, pokreće se sinteza funkcionalno aktivnih fosfolipida i cikličkih nukleotida, povećava se broj unutarćelijskih organela čije funkcioniranje osigurava kretanje leukocita i izlučivanje sadržaja granula. Osim usmjerenog kretanja leukocita, kemoatraktanti indukuju adheziju leukocita na endotel, potiču marginalno stajanje leukocita i njihovu agregaciju u lumenu mikrosula. Hemotaksu posreduju različite grupe supstanci:
1. Citotaksigeni, koji, budući da nisu hemoatraktanti, stvaraju faktore hemotakse.
2. Citotaksini, koji imaju direktan uticaj na leukocite. Neki citotaksini su specifični za neutrofile (na primjer, ekstrakt kulture E. coli), dok drugi citotaksini indukuju migraciju granulocita i monocita.
Hemoatraktanti mogu biti endogenog i egzogenog porijekla. Egzogeni hemoatraktanti su bakterijski peptidi, posebno oni koji sadrže N-formil grupe. Svojstva endogenih hemoatraktanata poseduju komponente komplementa, imunoglobulini, imuni kompleksi, limfokini i monokini, kinini, leukotrien B4, produkti lipoksigenaznog puta transformacije arahidonska kiselina, faktor aktiviranja trombocita, Hageman faktor, lizozomalni enzimi i drugi.
Uloga leukocita u upali
Neutrofili koji su emigrirali u područje upale su aktivni fagociti koji čiste područje upale od infektivnih agenasa. Adheziju neutrofila na objekt fagocitoze ubrzavaju opsonini, aktivni proteinski molekuli koji se vežu za objekt i fagocitnim stanicama olakšavaju prepoznavanje objekta. Istovremeno s procesima usmjerenog kretanja leukocita i fagocitoze, u njima dolazi do respiratorne eksplozije - naglog povećanja potrošnje kisika za stvaranje baktericidnih slobodnih kisikovih radikala (single kisik, hidroksilni radikal, vodikov peroksid, superoksidni anion). Stvaranje reaktivnih vrsta kisika događa se uz sudjelovanje enzima mijeloperoksidaze, superoksid dismutaze i katalaze. Reaktivne vrste kisika koje se oslobađaju u žarištu upale su visokotoksični faktori za bakterije, gljivice, mikoplazme, viruse, klamidiju i druge patogene, narušavaju strukturu i funkciju mikrobnih staničnih membrana, ograničavaju njihovu vitalnu aktivnost ili uzrokuju smrt mikroorganizama. Osim antimikrobnog djelovanja, povećanje procesa slobodnih radikala uzrokuje oštećenje intaktnih parenhimskih stanica, vaskularnih endotelnih stanica i elemenata vezivnog tkiva u žarištu upale, što doprinosi daljoj izmjeni tkiva.
Pored novosintetizovanih faktora oksidativnog sistema, granule neutrofila sadrže lizozim, laktoferin, katjonske proteine, alkalne i kisele fosfataze, ribonukleazu, dezoksiribonukleazu, hijaluronidazu, b-glukuronidazu, elastazu, kolagenasi P lemokotapiju, faktore kolagenaze i lemotapiju, .
Dakle, nakupljanje neutrofila u žarištu upale i oslobađanje ovih biološki aktivnih supstanci od njih uzrokuje smrt ili ograničavanje vitalne aktivnosti mikroorganizama, uništavanje i lizu mrtvih tkiva i čišćenje oštećenog područja. Zbog neutrofila oko žarišta upale formira se zaštitna neutrofilna barijera koja omeđuje zonu oštećenja (zajedno sa monocitnim i fibroblastičnim) od zdravog tkiva i sprječava širenje infekcije i toksičnih štetnih faktora.
Visoko aktivni medijatori neutrofila su uključeni u razvoj sekundarne alteracije, stimuliraju oslobađanje biološki aktivnih tvari iz drugih stanica, potiču vazodilataciju, povećavaju njihovu permeabilnost, eksudaciju plazme i migraciju leukocita. Ulaskom u sistemsku cirkulaciju izazivaju ispoljavanje nekih sistemskih efekata upalnog procesa.
Eozinofili koji su emigrirali u područje upale također imaju sposobnost fagocitiranja bakterija, gljivica i imunoloških kompleksa. Sadrže približno isti skup enzima kao i neutrofili (osim lizozima). Međutim, fagocitoza uključuje manji postotak eozinofila i odvija se manje intenzivno od neutrofila.
Glavni faktori koji stimulišu proces degranulacije eozinofila su imunoglobulini, imuni kompleksi, komplement. Produkti lučenja eozinofila inhibiraju oslobađanje histamina mastocitima i učestvuju u njegovoj inaktivaciji zbog histaminaze, eozinofilni kationski protein veže i neutralizira heparin, visoke koncentracije arilsulfataze inaktiviraju hemotaktičke proteine i supstancu koja sporo reaguje anafilakse, fosfolipaze B i D inaktiviraju faktor aktiviranja trombocita. Pod utjecajem endotoksina iu procesu fagocitoze, eozinofili proizvode i luče endogeni pirogen, koji osigurava razvoj grozničave reakcije koja prati upalni proces.
Eozinofilni medijatori, kao i neutrofili, mogu sudjelovati u reakcijama oštećenja tkiva i širenju sekundarne alteracije.
Bazofilni leukociti, kao i drugi granulociti, imaju sposobnost fagocitoze, ali je njihova fagocitna aktivnost prilično niska. U zoni infektivne i alergijske upale javlja se reakcija degranulacije bazofila s oslobađanjem upalnih medijatora - histamina, heparina, faktora aktivacije trombocita, leukotriena, kalikreina, eozinofilnog kemotaktičkog faktora, enzima.
Nakon granulocita, mononuklearne ćelije se akumuliraju u žarištu upale. Monociti koji su emigrirali u tkiva postaju tkivni makrofagi. U zoni upale dolazi do nakupljanja makrofaga zbog emigracije monocita iz krvotoka, kao i zbog mobilizacije makrofaga tkiva. Makrofagi obezbeđuju fagocitozu ne samo infektivnih patogena upalnog procesa, već i ćelijskog detritusa, čime se čisti zona alteracije i priprema za kasniju regeneraciju i popravku. Mononuklearni fagociti učestvuju u obezbeđivanju nespecifične zaštite organizma kroz fagocitozu, lučenje humoralnih faktora kao što su lizozim, interferon-alfa, TNF, komponente komplementa. U žarištu upale, makrofagi dobijaju izraženija antimikrobna svojstva zbog fagocitoze antimikrobnih komponenti koje proizvode neutrofili (mijeloperoksidaza i kationski proteini). Tako makrofagi stiču sposobnost halogeniranja proteina. Mikrobicidna funkcija makrofaga ostvaruje se kroz produkte "respiratorne eksplozije", lučenja monokina, lizosomalnih enzima. Oksidativne reakcije su praćene nakupljanjem visokotoksičnih produkata peroksidacije lipida u žarištu upale, što uzrokuje daljnje uništavanje stanica, žila i elemenata vezivnog tkiva.
U prisustvu etiološkog agensa u obliku bakterijskog patogena, monociti/makrofagi su ćelije koje predstavljaju antigen i pokreću imunološki odgovor organizma. Tokom prezentacije antigena, aktivirani makrofagi luče i oslobađaju citokine kao što su TNF, interleukine (IL-1, IL-3, IL-6, IL-8, IL-10, IL-12, IL-15), komponente komplementa, hemotaktički faktori . Oslobađanje zrelih oblika interleukina iz ćelija počinje u roku od 2 sata nakon antigenske stimulacije i nastavlja se 24-48 sati. Monociti/makrofagi u području upale su izvor lizosomalnih proteaza - kolagenaze, elastaze, angiotenzin konvertaze, aktivatora plazminogena; adhezivne supstance - fibronektin, trombospondin, proteoglikani; faktori rasta - faktori stimulacije kolonija, faktor rasta fibroblasta; endogeni pirogeni.
Pod dejstvom triger medijatora makrofaga u žarištu upale aktiviraju se različite vrste leukocita, ćelije vezivnog tkiva, vaskularni endotel, parenhimske ćelije, što dovodi do sinteze i lučenja biološki aktivnih jedinjenja koja imaju štetno, zaštitno i sistemsko dejstvo. .
Intenzivna emigracija limfocita u područje upale u većini slučajeva nastaje nakon emigracije neutrofila i monocita. Stimulirani limfociti luče biološki aktivne tvari - limfokine, koji osiguravaju razvoj imunološkog odgovora, alergijske reakcije, procesi proliferacije i popravke.
Svi leukociti u području upale brzo prolaze kroz masnu degeneraciju, pretvaraju se u gnojna tijela i uklanjaju se zajedno s gnojem. U žarištu upale moguća su dva načina odumiranja leukocita.
Prvi je grubo oštećenje membrane, narušavanje integriteta ćelije i njena nekroza, koja je moguća u žarištu primarne i sekundarne alteracije pod uticajem samog oštećujućeg agensa i različitih citotoksičnih inflamatornih medijatora.
Drugi je blaži, programirani put ćelijske smrti ili apoptoze. Tokom apoptoze, uočava se smanjenje jezgra leukocita, kondenzacija nuklearnog hromatina, fragmentacija DNK, supresija transkripcije i smanjenje sinteze ribosomske RNK i proteina. Senescentni neutrofili gube sposobnost da luče lizozomske enzime, a to onemogućava dalje oštećenje tkiva. Makrofagi aktivno fagocitiraju apoptotske neutrofile. Unos apoptotičkih neutrofila je posredovan interakcijom trombospondina koji luče receptori makrofaga i neutrofila. Apoptozom se iz žarišta upale mogu ukloniti ne samo neutrofili, već i eozinofili i limfociti.
makrofagi. Utvrđeno je da aktivirani makrofagi sintetiziraju posebnu supstancu zvanu interleukin-1 (IL-1). Makrofagi ga oslobađaju u okolinu i širi se po cijelom tijelu, gdje nalazi svoje mete, a to su miociti, sinoviociti, hepatociti, koštane ćelije, limfociti i neurociti. Očigledno, na membranama ovih ćelija postoje specifični receptori, zbog kojih IL-1 djeluje specifično na njih, a ne na druge stanice. Djelovanje je stimulativno i ponajviše proučavano u odnosu na hepatocite i limfocite. Djelovanje IL-1 je univerzalno, tj. djeluje kod bilo koje infektivne (upalne) bolesti, i to na samom početku i tako daje signal naznačenim organima da se uključe u upalni (infektivni) proces. Postoji razlog za vjerovanje da su simptomi karakteristični za ranu fazu bolesti ( glavobolja, bol u mišićima i zglobovima, pospanost, groznica, leukocitoza i povećanje sadržaja proteina, uključujući imunoglobuline) objašnjava se upravo djelovanjem IL-1 (slika 12.3).
Uloga makrofaga nije ograničena na lučenje IL-1. U tim ćelijama se sintetizira niz biološki aktivnih supstanci, od kojih svaka daje svoj doprinos upali. To uključuje: esteraze, proteaze i antiproteaze; lizozomalne hidrolaze - kolagenaza, alastaza, lizozim, α-makroglobulin; monokini - IL-1, faktor koji stimuliše kolonije, faktor koji stimuliše rast fibroblasta; antiinfektivni agensi - interferon, transferin, transkobalamin; komponente komplementa: C1, C2, C3, C4, C5, C6; derivati arahidonske kiseline: prostaglandin E2, tromboksan A2, leukotrieni. Ne treba zaboraviti ni najvažniju funkciju makrofaga – fagocitozu.
mastociti. Uloga ovih stanica u upali je da, kada su oštećene, oslobađaju histamin i heparin sadržane u njihovim granulama. A budući da se te ćelije nalaze u velikom broju uz rubove krvnih žila, djelovanje ovih supstanci će se očitovati prvenstveno na žilama (hiperemija).
Makrofagi i mastociti su trajno prisutni u tkivima (rezidentne ćelije). Ostale upalne stanice prodiru u područje upale sa strane (emigrantske stanice). To uključuje polimorfonuklearne neutrofile, eozinofile i limfocite.
Neutrofili. Glavna funkcija ovih stanica je fagocitoza. Izbacuju se iz koštane srži u krv, emigriraju iz krvnih žila i nakupljaju se u velikim količinama u upaljenom tkivu. I njihova aktivna reprodukcija, i migracija, i fagocitoza podliježu regulatornom utjecaju biološki aktivnih tvari (tkivnih, sistemskih, organskih). Njihovo djelovanje se očituje, međutim, tek kada na stanicama postoje receptori koji specifično reagiraju sa medijatorom upale: histamin, adrenalin, glukokortikoidi, gama globulini itd.
U citoplazmi neutrofila postoje dvije vrste granula: primarne azurofilne (veće) - obični lizosomi, sekundarne ili specifične granule su manje, i što je najvažnije, sadrže različit skup enzimskih i neenzimskih supstanci. Primarne granule sadrže kisele hidrolaze, a osim toga, lizozim, mijeloperoksidazu i kationske proteine. Sekundarne granule su specifične; sadrže alkalne fosfataze, laktoferin i lizozim. Sve ovo je važno za razumijevanje uključenosti neutrofila u upalu (vidi dolje).
trombociti. Uloga trombocita (trombocita) u upali je uglavnom u tome što su usko povezane s mikrocirkulacijom. Vjerojatno su to najstalniji i najuniverzalniji učesnici upale. Sadrže tvari koje utječu na propusnost krvnih žila, njihovu kontraktilnost, rast i reprodukciju stanica, i što je najvažnije, zgrušavanje krvi.
Limfociti. Ove ćelije igraju ulogu u svakoj upali, a posebno u imunološkoj upali.
fibroblasti. Djelovanje fibroblasta očituje se u posljednjoj fazi procesa, kada se u žarištu upale povećava broj ovih stanica, oživljava se sinteza kolagena i glikozaminoglikana u njima.
Karakteristike poremećaja mikrocirkulacije u žarištu upale, uzroci njihovog nastanka. Eksudacija, mehanizmi razvoja. Njegova uloga u nastanku upale. Klasifikacija upale prema vrsti eksudata.


