28.06.2019
Upala - sažetak - patološka anatomija i fiziologija - sažetak o medicini. Opći patološki značaj
Opći obrasci tijeka upalnog procesa. Reakcija krvi na upalu.
Upala– tipično patološki proces, nastala u evoluciji kao zaštitna i adaptivna reakcija organizma na utjecaj patogenih faktora, usmjerena na lokalizaciju, uništavanje i uklanjanje patogenog agensa, kao i otklanjanje posljedica njegovog djelovanja, a karakterizirana je izmjenom, eksudacijom i proliferacijom.
1. Izmjena- oštećenje strukture ćelija, tkiva i organa, praćeno kršenjem njihove vitalne aktivnosti.
Distrofija je metabolički poremećaj u tkivima.
Inflamatorni medijatori su biološki aktivne supstance koje se oslobađaju u tkivima tokom upale.
2. Eksudacija- eksudacija tečnog dijela krvi koji sadrži proteine kroz vaskularni zid u upalno tkivo.
Emigracija - oslobađanje leukocita iz krvi kroz zid malih žila u tkivo ili serozne šupljine tijekom upale (dijapedezom).
Fagocitoza - apsorpcija, probava i neutralizacija mikroba, oštećenih ćelija i stranih čestica od strane fagocita.
3. Proliferacija- neoplazma ćelija njihovom reprodukcijom deobom radi nadoknade oštećenog tkiva, učestvuju različiti elementi tkiva. Je sastavni dio regeneracija tkiva.
Vaskularne reakcije kod upale- patofiziološke promjene u mikrocirkulaciji (cirkulacija krvi i limfe) u tkivima koje se manifestuju ishemijom, arterijskom i venskom hiperemijom, eksudacijom, migracijom leukocita, stazom.
Upala je jedan od temeljnih patoloških procesa koji čine patofiziološku osnovu mnogih ljudskih bolesti (npr. encefalitis, miokarditis, upala pluća, stomatitis, gripa, difterija itd.). Klasični znakovi upale su bol, crvenilo, vrućina, oteklina i oštećena funkcija tkiva i organa.
Mehanizmi upalnog procesa su univerzalni, a obrasci razvoja su uobičajeni bez obzira na strukturne i funkcionalne razlike u tkivima.
Upalni proces karakterizira razvoj tri vrste reakcije vaskularnog tkiva: alterativno-distrofične, vaskularne i proliferativne.
Alterativno-distrofični reakcije se manifestuju lokalnim oštećenjem tkiva (alteracijom) i poremećajem metabolizma tkiva (distrofija). Primarna promjena nastaje kao rezultat direktnog bolnog djelovanja na ćelijske strukture organ. Kao odgovor na oštećenje, povećava se propusnost staničnih i subcelularnih membrana. Mastociti luče medijatore upale (histamin, serotonin, heparin, itd.). Lizozomalni (glikolitički, litolitički i proteolitički) enzimi se oslobađaju iz različitih ćelija, aktivirajući reakcije glikolize, lipolize i proteolize u tkivu. BAS (medijatori, enzimi) imaju patogeno dejstvo i izazivaju dalje uništavanje (sekundarnu alteraciju) ćelija.
Alteracija se završava nekrozom upaljenog tkiva sa stvaranjem nekroze, čireva, rana i sl. Alterativno-distrofične promene se manifestuju značajnim fizičko-hemijskim poremećajima u upaljenom tkivu. Najizraženije distrofične promjene praćene su razvojem acidoznog oštećenja (H+-hiperionija), hiperosmijom i hiperhidratacijom upaljenog tkiva. Upala nastaje kao samoregulirajući proces oštećenja strukture, metaboličkih poremećaja i funkcije tkiva. Međutim, razvoj i širenje upale u obliku lokalni proces zavisi od sveukupnog reaktivnost tela.
Eksudativna upala manifestuje se ozbiljnim poremećajima lokalne cirkulacije (ishemija, arterijska i venska hiperemija, staza) i limfne cirkulacije fenomenima eksudacije (pojačana filtracija, difuzija i mikrovezikulacija krvne plazme kroz zid mikrožila) u tkivo i serozne šupljine uz formiranje infiltrata. i različite vrste eksudati, emigracija leukocita u tkivo i fagocitoza u upaljenom tkivu.
Među zaštitnim i adaptivnim reakcijama važnu ulogu imaju hiperemija tkiva, fagocitoza, kompenzatorna popravka i regeneracija (proliferacija), koji imaju veliku protuupalno vrijednost.
Proliferativnu upalu karakterizira patološka popravka i regeneracija (regenerativna hipertrofija, granulomatoza s formiranjem polipa, skleroza i ciroza).
Liječenje upale zasniva se na patofiziološkim principima otklanjanja patoloških alterativno-distrofičnih, eksudativno-vaskularnih i proliferativnih reakcija obnavljanjem neurohumoralne regulacije vitalne aktivnosti tkiva.
Na ranim fazama evolucijski razvoj(filogeneza) upala se manifestuje fagocitnom reakcijom (I.I. Mechnikov).
U ranom periodu ontogeneze ili na pozadini imunobiološkog nedostatka upalni procesčesto ima generalizovanu distribuciju (sepsu).
Jedan od prvih i glavnih procesa upale je refleksno širenje malih arterija i kapilara, uzrokovano iritacijom nervnih završetaka ugrađenih u zidove krvnih sudova, ili refleksno kroz centralni nervni sistem. Zbog širenja krvnih žila prelijevaju se krvlju i usporavaju protok krvi u njima, što dovodi do upalne hiperemije. U krvnim sudovima krvni pritisak raste, zidovi se rastežu i postaju prohodniji za tečni deo krvi. Povećava se poroznost zidova krvnih žila zbog njihovih promjena uzrokovanih upalnim procesom.
Kroz izmijenjene zidove krvnih žila tečni dio krvi prodire u okolno tkivo. Što je zid krvnog suda više oštećen, kroz njega prolaze veće proteinske čestice. Dakle, veći ili manji sadržaj proteina u eksudatu zavisi od stepena oštećenja vaskularnog zida. Poznato je da se prilikom brzog kretanja tečnosti u cevi suspendovane čvrste čestice nalaze u sredini toka tečnosti, a kada se uspori, počinju da se talože uz zidove posude. Ista stvar se dešava i sa krvlju: kod normalnog protoka krvi u sudovima, suspendovane krvne ćelije su u centru krvotoka, a kada se protok krvi uspori, leukociti napuštaju aksijalni protok krvi u plazmu. Leukociti prianjaju za endotel - razvija se fenomen marginalnog stajanja leukocita.
U krvi se opaža leukocitoza, povećava se sadržaj proteina akutne faze (CRP, fibrinogen, ceruloplazmin, komponente komplementa, globulini itd.), ESR se povećava (zbog smanjenja negativnog naboja eritrocita, povećanja viskoziteta krvi i porast temperature).
Upala(upala, od lat. u plamenu- zapaliti) reakcija organizma na lokalna oštećenja nastala u procesu evolucije, koju karakteriziraju fenomeni alteracije, poremećaja mikrocirkulacije (sa eksudacijom i emigracijom) i proliferacije, s ciljem lokalizacije, uništavanja i uklanjanja štetnog agensa, kao i kao restauracija (ili zamjena) oštećenih tkiva.
Alteracija, poremećaji mikrocirkulacije (sa eksudacijom i emigracijom) i proliferacija su glavne komponente ili unutrašnji znaci upale. Osim toga, žarište upale karakterizira pet vanjskih (lokalnih) manifestacija: crvenilo (rubor), otok (tumor) groznica, ili groznica (kaloričnost) bol ili bol (dolor), disfunkcija functio laesa)(Sl. 10-1). Ovi znakovi su posebno dobro izraženi kada je žarište upale na vanjskom pokrovu.
Upala se može manifestirati ne samo lokalnim, već i općim znakovima, čija težina ovisi o intenzitetu i rasprostranjenosti procesa.
Uobičajene manifestacije upale su groznica, reakcije krvotvornog tkiva sa razvojem leukocitoze, povećana brzina sedimentacije eritrocita, ubrzani metabolizam, promijenjena imunološka reaktivnost i intoksikacija organizma.
Upala je jedan od najčešćih tipičnih patoloških procesa. Istovremeno, to je važna zaštitna i adaptivna reakcija koja je evoluirala kao način očuvanja cijelog organizma po cijenu oštećenja njegovih dijelova. Uz pomoć upale, pružiti
Rice. 10-1. Drevni temelji doktrine upale (prema Willoughbyju i Spectreu). Vrućina, crvenilo, otok i bol dovode do disfunkcije
utvrđuje se lokalizacija i eliminacija upalnog agensa i (ili) tkiva oštećenog pod njegovim utjecajem.
10.1. OSNOVNE TEORIJE UPALE
Kao patološki proces u osnovi većine ljudskih bolesti, upala je bila centralni problem patologije kroz povijest proučavanja bolesti. Formiranje ideja o suštini upale dugo je usko povezano s razvojem pogleda na prirodu bolesti.
U ranim fazama proučavanja upale dominirale su teorije R. Virchowa (1858) i Yu. Konheima (1885). Prema ćelijski(atraktivna, nutritivna) teorije R. Virchowa, upala je kršenje vitalne aktivnosti ćelijskih elemenata kao odgovor na iritaciju, razvoj distrofične promjene, koji se sastoji u pojavi proteinskih zrnaca i grudvica u ćelijama, privlačenju (privlačenju) hranljivog (hranljivog) materijala iz tečnog dela krvi i pojavi zamućenog oticanja citoplazme kao posledica toga, karakterističnog za upala.
 Rice. 10-2. I.I. Mečnikov (1845-1916). Laureat nobelova nagrada 1908
Rice. 10-2. I.I. Mečnikov (1845-1916). Laureat nobelova nagrada 1908
By vaskularna teorija J. Kongeyma upalu karakteriziraju poremećaji cirkulacije koji dovode do eksudacije i emigracije i uzrokuju naknadne stanične (distrofične) promjene. Međutim, kako je kasnije utvrđeno, upalu karakterizira istovremeni razvoj i bliska povezanost vaskularnih i tkivnih fenomena. Yu. Kongeym je po prvi put detaljno opisao čitav niz promjena u vaskularnom tonusu i krvotoku s eksudacijom i emigracijom.
Posebno značajan doprinos proučavanju upale dao je I.I. Mechnikov(1892) (sl. 10-2). Pokrenuo je komparativnu patologiju upale, teoriju ćelijskog i humoralnog imuniteta, teoriju fagocitoze i formulirao biološki(fagocitni) teorija upala. Prema njenim riječima, glavna i središnja karika upalnog procesa je apsorpcija stranih čestica, uključujući i bakterije, od strane fagocita.
Nakon analize upalni odgovor at razne vrsteživotinje koje stoje u različitim fazama evolucijskog razvoja, I.I. Mečnikov je pokazao njegovu komplikaciju u filogenezi. U ranim fazama filogeneze (kod najjednostavnijih jednoćelijskih organizama) zaštita od stranog materijala provodi se fagocitozom. Istovremeno, čak i u najjednostavnijim organizmima, javljaju se neki fenomeni alteracije. Kod višećelijskih organizama koji nemaju vaskularni sistem, upala se manifestuje nakupljanjem fagocitnih ameboidnih ćelija (amebocita) oko mesta povrede. Kod viših beskičmenjaka upala se izražava nakupljanjem krvnih stanica - limfohematocita - na mjestu oštećenja. Unatoč prisutnosti cirkulacijskog sistema (otvorenog tipa), vaskularne reakcije karakteristične za kičmenjake ne nastaju. U isto vrijeme, fenomen proliferacije se već nalazi u ovoj fazi evolucijskog razvoja. Kod kičmenjaka i ljudi upalni odgovor je značajno komplikovan zbog vaskularnih fenomena sa eksudacijom i emigracijom, te zahvaćenosti nervnog sistema.
Rezultati uporednih patoloških studija, koji ukazuju na uključenost sve složenijih zaštitnih i
adaptivne pojave kako se upalni proces razvijao, omogućio je I.I. Mečnikova da pokaže važnost upale kao zaštitne i adaptivne reakcije cijelog organizma. I.I. Mečnikov je prvi uspostavio vezu između upale i imuniteta, u čijim mehanizmima fagocitoza također igra značajnu ulogu.
U prvoj polovini ovog veka, doktrina upale je počela da se razvija u vezi sa pojavom biofizičkih i biohemijskih metoda. Dopušteni su rezultati raznovrsnih fizičko-hemijskih studija žarišta upale G. Sade(1923) nominirati fizički i hemijski, ili molekularne patološke, hipoteza upala, prema kojoj je vodeći u patogenezi ovog procesa lokalni metabolički poremećaj, koji dovodi do razvoja acidoze i povećanja osmotskog tlaka u tkivu, što je, zauzvrat, u osnovi poremećaja cirkulacije i staničnih pojava u toku upale. Međutim, ubrzo se pokazalo da se fizičko-hemijske promjene karakteristične za žarište upale otkrivaju u toku već razvijene upalne reakcije i stoga ne mogu biti okidač za vaskularne i stanične fenomene (DE Alpern, 1927). Kod nekih vrsta upala (na primjer, alergijskih), acidoza se ne razvija ili je blaga (A.D. Ado, 1935).
Na osnovu rezultata opsežnih patohemijskih studija V. Menkin(1938) zaključio je glavnu ulogu biohemijske promene u patogenezi upale. Izdvojio je niz supstanci specifičnih za upalu koje posreduju u različitim inflamatornim pojavama - proučavani nekrozin, ekssudin, leukotoksin, pireksin itd. Međutim, bilo bi pogrešno cjelokupnu patogenezu upale svesti samo na različite učinke pojedinih medijatora.
Od početka ovog veka, kada je ustanovljeno učešće nervnog sistema u patogenezi upale, javljaju se hipoteze koje primarnu ulogu daju nervnom faktoru – refleksnim mehanizmima, poremećenoj trofičkoj funkciji nervnog sistema. Da, do vazomotorna (neurovaskularna) teorija G. Rickera(1924) primarni u nastanku upale je poremećaj funkcije vazomotornih nerava. U zavisnosti od stepena
njihova iritacija i, posljedično, vaskularna reakcija u razvoju razvija takav odnos između tkiva i krvi, što dovodi do pojave upalne hiperemije i zastoja i, shodno tome, određuje intenzitet i prirodu metaboličkih poremećaja. Međutim, čitav niz upalnih pojava ne može se objasniti samo reakcijom krvnih žila mikrovaskulature.
D.E. Alpern(1959) su posebnu pažnju posvetili pitanju jedinstva lokalnog i opšteg u upali, ulozi reaktivnosti organizma u razvoju ovog procesa. Naglasio je suštinu upale kao opće reakcije organizma na djelovanje štetnog agensa. On je opravdao neuro-refleksni krug patogeneza upale, prema kojoj različite reakcije vaskularnog tkiva regulišu nervni i humoralni (uglavnom hipofizno-nadbubrežni) sistem.
10.2. ETIOLOGIJA UPALE
Od najviše zajednički uzrok upale su infektivni uzročnici, prema etiologiji se dijeli na infektivno (septično) I neinfektivne (aseptične).
10.3. EKSPERIMENTALNA REPRODUKCIJA UPALE
U eksperimentu se u pravilu koriste modeli aseptične upale uzrokovane kemijskim agensima. Tradicionalno
To su iritantni flogogeni koji dovode do razvoja akutne gnojne upale: terpentin, krotonsko ulje, lapis, ksilen, formalin itd. Koriste se i hemijski indiferentne supstance, kao što je kaolin. Za reprodukciju aseptične upale s prevladavanjem eksudativnih pojava, koristi se dekstran. Posljednjih godina najčešće korišteno aseptično sredstvo je karaginan, sulfatni glikozaminoglikan izoliran iz irske mahovine. Chondrus.
Kako bi se izbjeglo daljnje prisustvo flogogena u žarištu, koriste se modeli termičke ili radijacijske (ultraljubičaste zrake, jonizujuće zračenje) upale.
Hiperergijska upala se često modelira kao trenutne ili odgođene alergijske reakcije. Ova upala je zanimljiva zbog brzog toka, čestih nekroza, što je posljedica povećane reaktivnosti senzibiliziranog organizma.
U patofiziološkim studijama modeli infektivne upale se koriste relativno rijetko. To je zbog složenosti modeliranja takve upale, zbog dublje interakcije mikroorganizama sa imunološki sistem tokom svog razvoja i razvoja. Trenutno od infektivnih agenasa pretežno se koriste coli, stafilokoke, Pseudomonas aeruginosa, jer su najčešći uzročnici gnojno-upalnih bolesti i infektivne komplikacije u osobi. Modeli bliski infektivnoj upali su, na primjer, fekalni peritonitis.
Za proučavanje vaskularnih fenomena u žarištu upale, najpogodniji objekt je mezenterij žabe (iskustvo Yu. Kongeyma), uho zeca (metoda transparentne kamere - EL Clark i ER Clark), kesica hrčka, naduvana vazduhom (G. Selye); za proučavanje stanične dinamike žarišta upale, preporučljivo je koristiti metodu „prozora kože“ (J. Riback) ili modele kao što su potkožni „zračni jastuk“ (G. Selye), peritonitis, pleuritis, kada može doći do eksudata. biti lako prikupljeni.
10.4. PATOGENEZA UPALE
Svaka upala uključuje 3 glavne komponente:
Alteracija - oštećenje ćelija i tkiva;
Poremećaj mikrocirkulacije sa eksudacijom i emigracijom;
Proliferacija - reprodukcija ćelija i obnavljanje integriteta tkiva.
Shodno tome, postoje: alternativna upala, eksudativna upala, proliferativna (produktivna) upala i - kao njegova posebna varijanta - granulomatozna upala.
Patogeneza upale je složena kombinacija neuralnih, humoralnih i efektorskih mehanizama koji leže u osnovi velikog broja upalnih fenomena koji čine navedene fenomene (Sl. 10-3).
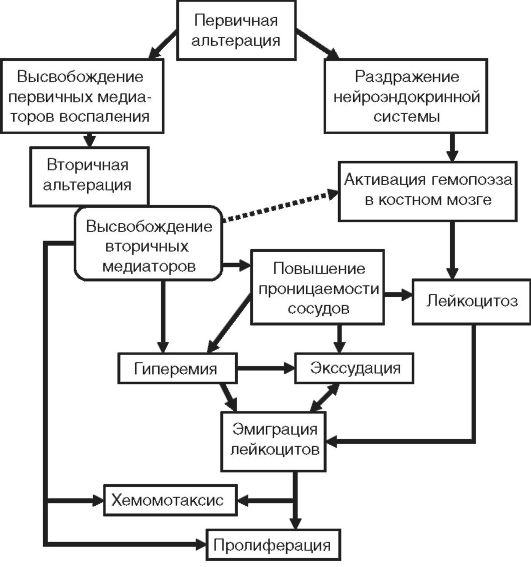 Rice. 10-3. Opća shema patogeneze upale
Rice. 10-3. Opća shema patogeneze upale
10.4.1. Uloga oštećenja tkiva u nastanku upale
Izmjena(izmjena, od lat. alterare- promijeniti) ili distrofija, oštećenje tkiva, pothranjenost (trofizam) i metabolizam u njemu, njegova struktura i funkcija. Razlikovati primarnu i sekundarnu promjenu.
primarna izmjena je rezultat štetnog djelovanja samog inflamatornog agensa, stoga njegova težina, pod jednakim uvjetima (reaktivnost organizma, lokalizacija), ovisi o svojstvima flogogena. Strogo govoreći, primarna alteracija nije sastavni dio upale, jer je upala reakcija na oštećenje uzrokovano flogogenom, tj. za primarnu promenu. Istovremeno, praktično primarne i sekundarne alternativne pojave teško je odvojiti jedna od druge.
sekundarna izmjena posljedica je utjecaja na vezivno tkivo, mikrožile i krv ekstracelularno oslobođenih lizosomskih enzima i aktivnih metabolita kisika. Njihov izvor su aktivirani imigrirani i cirkulirajući fagociti, dijelom - rezidentne ćelije. Kod upale kod životinja s prethodno izazvanom leukopenijom, alteracija je slabo izražena. Određenu ulogu u alteraciji može imati i litički kompleks C5b-C9, koji nastaje tokom aktivacije komplementa plazme i tkivna tečnost.
Sekundarna alteracija ne zavisi od inflamatornog agensa, za njen razvoj nije potrebno dalje prisustvo flogogena u žarištu. To je odgovor tijela na oštećenja koja su već uzrokovana štetnim početkom. Ovo je svrsishodna i neophodna komponenta upale kao zaštitna i adaptivna reakcija, koja ima za cilj brzo razgraničenje (lokalizaciju) flogogena i (ili) tkiva oštećenog pod njegovim utjecajem od ostatka organizma. Po cijenu oštećenja postižu se i drugi važni zaštitni fenomeni: izraženiji mikrobicidni i litički učinak lizosomskih enzima i aktivnih metabolita kisika, budući da se odvija ne samo u fagocitima, već i vanćelijskim putem; uključivanje drugih medijatora upale i ćelija, pojačana eksudacija, emigracija i fagocitoza. Kao rezultat toga, upalni proces se brže završava. Međutim, izmjena je korisna samo u određenim granicama. Tako, na primjer, s neravnotežom u sistemu, lizozomalne proteinaze -
njihovi inhibitori izazivaju prekomerne manifestacije alteracije sa prevagom nekroze.
Alternativni događaji kod upale uključuju raspad tkiva I poboljšana razmjena supstance („metabolička vatra”), što dovodi do brojnih fizičko-hemijskih promena u upaljenom tkivu: nakupljanje kiselih produkata (acidoza, ili H + -hiperionija), povećanje osmotskog pritiska (osmotska hipertenzija, ili hiperosmija), povećanje koloidno-osmotskog ili onkotskog pritiska (hiperonkija).
Ovisno o jačini štetnog agensa, intenzitetu i lokalizaciji upale morfološke manifestacije promjene uvelike variraju: od jedva primjetnih strukturnih i funkcionalnih promjena do potpunog uništenja (nekrobioza) i smrt (nekroza) tkiva i ćelije. Otkrivaju se mutno oticanje citoplazme ćelija, pojave proteina, masti i druge vrste njihove distrofije. Propustljivost ćelijskih membrana i ćelijskih organela naglo se povećava. Subcelularne strukture se također mijenjaju - mitohondrije, lizozomi, ribozomi i endoplazmatski retikulum. Mitohondrije nabubre ili se smanjuju, njihove kriste su uništene. Povećanje propusnosti i oštećenje membrana lizosoma praćeno je oslobađanjem različitih enzima koji igraju ulogu u uništavanju subcelularnih struktura. Mijenjaju se oblik i veličina cisterni endoplazmatskog retikuluma, u citoplazmi se pojavljuju vezikule, koncentrične strukture itd. Uočava se rubna lokacija kromatina i oštećenje nuklearne membrane. U stromi se opaža mukoidno i fibrinoidno oticanje do nekroze, otapanje kolagenih i elastičnih vlakana.
Pojačani metabolizam tokom upale javlja se pretežno na račun ugljikohidrata. U početku se povećavaju i njihova oksidacija i glikoliza. Ovaj fenomen se zasniva na aktivaciji odgovarajućih enzima tkiva. Potrošnja kiseonika u upaljenom tkivu se značajno povećava. Kako se leukociti akumuliraju u žarištu, lizozomski enzimi koji anaerobno razgrađuju ugljikohidrate, kao i oštećenje i smanjenje broja mitohondrija tijekom alteracije, oksidacijske reakcije osjetno slabe, a reakcije glikolize se povećavaju. Shodno tome, razgradnja ugljikohidrata ne dolazi uvijek do krajnjih proizvoda - ugljičnog dioksida i vode. Respiratorni kvocijent je smanjen. U tkivu se nakupljaju nedovoljno oksidirani produkti metabolizma ugljikohidrata - mliječna i trikarboksilna kiselina.
Osim toga, zbog kršenja metabolizma masti, proteina i razgradnje nukleinskih kiselina u fokusu, sadržaj masnih kiselina, ketonskih tijela, polipeptida, aminokiselina, nukleotida (ATP, adenilna kiselina), nukleozida (adenozin) povećava. Kao rezultat, razvija se acidoza. U početku se nadoknađuje tkivnim puferskim sistemima i ubrzanim protokom krvi i limfe. Pošto ste iscrpljeni tampon sistemi i usporavanjem protoka krvi i limfe, acidoza se povećava i postaje nekompenzirana. Ako je normalna koncentracija vodonikovih jona u tkivu 0,5?10 -7, tj. pH je 7,34, tada u slučaju upale može biti 25?10 -7 i 5,6 i niže. Što je upalni proces akutniji, acidoza je izraženija. Dakle, u akutnom gnojna upala pH je 6,5-5,39, a kod hronične - 7,1-6,6. Acidoza je uključena u povećanje vaskularne permeabilnosti. Stvara povoljne uslove za provođenje destruktivnog djelovanja lizosomalnih enzima, posebno glikozidaza, koje razgrađuju ugljikohidratne komponente matriksa vezivnog tkiva.
Uz H + -hiperioniju, u žarištu se povećava i sadržaj drugih jona - jona kalijuma, natrijuma, kalcijuma. To je zbog uništavanja stanica i povećane disocijacije soli u kiseloj sredini. Usled uznapredovalog porasta nivoa ekstracelularnog kalijuma poremećen je odnos jona kalijuma i kalcijuma (dizija). Promjene u homeostazi Ca 2+ jona mogu biti u osnovi ćelijske smrti u žarištu upale. Ca 2 + je jedan od sekundarnih glasnika između membranskog i ćelijskog enzimskog sistema, kao i genskog aparata. Povećanje nivoa intracelularnog Ca 2+ dovodi do njegove apsorpcije mitohondrijalnim membranama i naknadnog blokiranja respiratornog lanca elektrona. Povećan intracelularni sadržaj Ca 2+ aktivira ne-lizozomske proteaze, što dovodi do lize citoskeleta, razgradnje enzima, proteina vezanih za membranu (jonski kanali, nosači, receptori, adhezioni molekuli). Primijećeno je da iako je smanjenje ekstracelularnog Ca 2+ važno za preživljavanje stanica, to može biti prepreka njihovom novom rastu. U žarištu upale povećava se molekularna koncentracija, jer se u procesu propadanja tkiva i pojačanog metabolizma velike molekule cijepaju na mnogo malih. Zbog povećanja koncentracije jona i molekula razvija se hiperosmija. Dakle, ako je normalna depresija intersticijske tečnosti
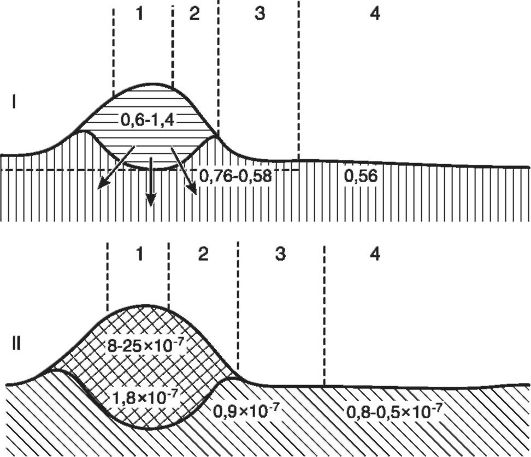 Rice. 10-4.Šematski prikaz presjeka kroz upalni edem kože: I - promjene osmotskog tlaka (A°C) u različitim zonama žarišta upale: 1 - žarište upale, 2 - zona pletore, 3 - zona očiglednog edema, 4 - zona latentnog edema; II - promjene u koncentraciji vodikovih jona: 1 - centar gnojne upale, 2 - zona upalnog infiltrata, 3 - zona perifernog edema, 4 - zona prijelaza u normalno stanje(prema Sadeu)
Rice. 10-4.Šematski prikaz presjeka kroz upalni edem kože: I - promjene osmotskog tlaka (A°C) u različitim zonama žarišta upale: 1 - žarište upale, 2 - zona pletore, 3 - zona očiglednog edema, 4 - zona latentnog edema; II - promjene u koncentraciji vodikovih jona: 1 - centar gnojne upale, 2 - zona upalnog infiltrata, 3 - zona perifernog edema, 4 - zona prijelaza u normalno stanje(prema Sadeu)
iznosi 0,62°, tj. osmotski pritisak je 8 atm, zatim sa gnojnom upalom - 0,80° i 19 atm (sl. 10-4).
Kao rezultat fizičkih i kemijskih promjena u upaljenom tkivu dolazi do razgradnje proteina na polipeptide i aminokiseline s povećanjem koncentracije potonjih, povećanjem disperzije koloida, njihove sposobnosti da privlače i zadržavaju vodu. Razvija se hiperonkija. Promjene osmotskog i onkotskog tlaka važan su faktor eksudacije i, shodno tome, upalnog edema.
10.4.2. Inflamatorni medijatori
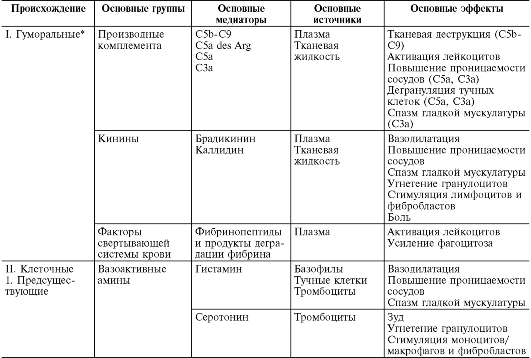
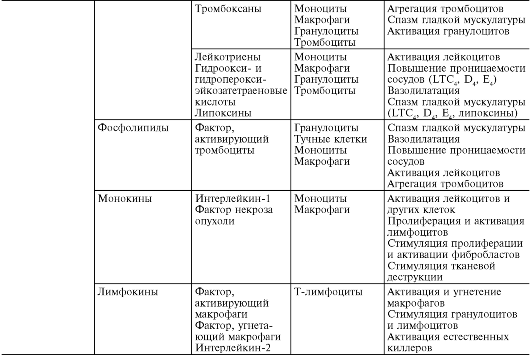
Prilikom primarne i sekundarne alteracije oslobađaju se velike količine različitih medijatora i modulatora upale (Tabela 10-1).
sto 10-1. Inflamatorni medijatori
 *Sve već postojeće.
*Sve već postojeće.
Pod posrednicima upale (medijatorima) se podrazumijevaju biološki aktivne tvari koje ostvaruju nastanak i potporu različitih upalnih pojava, na primjer, povećanje vaskularne permeabilnosti, emigraciju itd. Tokom normalnog života, te iste supstance u fiziološkim koncentracijama odgovorne su za regulaciju funkcija ćelija ili tkiva. Prilikom upale, oslobađajući se u velikim količinama, dobijaju novi kvalitet - upalne medijatore. Gotovo svi medijatori su i modulatori upale; može pojačati ili oslabiti težinu upalnih pojava. Shodno tome, djelovanje medijatora može biti aditivno (aditivno), potencirajuće (sinergističko) i oslabljujuće (antagonističko), a interakcija medijatora je moguća na nivou njihove sinteze, izlučivanja ili djelovanja. Medijatorska karika je glavna u patogenezi upale. Koordinira interakciju mnogih ćelija - efektora upale, promjene ćelijske faze na mestu upale.
Picks upale se dijele na humoralni(nastaje u tečnom mediju - krvnoj plazmi i tkivnoj tečnosti) i ćelijski. Sve humoralni posrednici već postoje, one. dostupni kao prekursori prije aktivacije potonjeg; oni uključuju derivate komplementa, kinine i faktore koagulacije krvi. Među ćelijskih medijatora dodijeliti već postojeće(taloženi u ćelijama u neaktivnom stanju) - vazoaktivni amini, lizozomalni enzimi, neuropeptidi i novoformirani(tj. koje proizvode ćelije tokom stimulacije) - eikozanoidi, citokini, limfokini, aktivni metaboliti kiseonika.
Glavni izvori ćelijskih medijatora su:
1. neutrofili, koji luče kationske proteine, stimuliraju oslobađanje biogenih amina iz trombocita i mastocita, sadrže inhibitor oslobađanja histamina i histaminazu. Neutrofilne proteaze su uključene u formiranje kinina i aktivnih fragmenata komplementa (C3a, C3b). Neutrofili proizvode prostaglandin (PG) E 2 i druge eikozanoide. Enzimi neutrofila aktiviraju i koagulaciju krvi i fibrinolizu.
2. makrofagi luče angiotenzin konvertazu, koja inaktivira bradikinin, pretvara angiotenzin-I u angiotenzin-II. Sintetišu PGE 2, kao i tromboksane i leu-
kotrijeni (LT). Budući da PGE 2 sprječava oslobađanje ćelijskih medijatora upale i inhibira agregaciju trombocita, makrofagi, osim proinflamatorne, imaju i protuupalno djelovanje. Makrofagi sintetiziraju različite komponente komplementa, imaju koagulacijsku i fibrinolitičku aktivnost.
3. Eozinofili služe kao negativni modulatori upale. Sadrže histaminazu, kininazu, enzime koji razgrađuju leukotriene C i D (lizofosfalipazu, arilsulfatazu B, fosfolipazu D), glavni alkalni protein koji obavlja citotoksičnu funkciju i neutralizira heparin. Dakle, eozinofilni enzimi neutraliziraju proizvode mastocita, doprinose uništavanju staničnih ostataka. Eozinofili fagocitiraju granule koje luče mastociti i potiskuju oslobađanje histamina. Posebno je zanimljivo prisustvo lizofosfolipaze u eozinofilima. Njegov supstrat su delimično razgrađeni fosfolipidi sadržani u membranama mrtvih ćelija. Oslobađanjem slobodnih masnih kiselina iz fosfolipida, lizofosfolipaza potiče stvaranje arahidonska kiselina.
4. Mastociti i bazofili luče histamin i serotonin, heparin, faktore hemotakse neutrofila i eozinofila, faktor aktivacije trombocita, proteolitičke enzime, proizvode peroksidazu, superoksid i vodikov peroksid, kao i proteazu koja pretvara kininogen u kinin.
5. trombociti luče faktore rasta i koagulacije, vazoaktivne amine i lipide, neutralne i kisele hidrolaze.
Derivati komplementa(Slika 10-5) su najvažniji od humoralnih inflamatornih medijatora. Među skoro 20 različitih proteina nastalih tokom aktivacije komplementa, njegovi fragmenti C5a, C3a, C3b i kompleks C5b-C9 direktno su povezani sa upalom:
C5a i C3a su akutni inflamatorni medijatori i anafilatoksini (tj. oslobađači histamina iz mastocita), tako da povećavaju propusnost kapilara i direktno i indirektno preko histamina (Sl. 10-6);
C5a des Arg i C3a nastaju od C5a u plazmi i tkivnoj tečnosti pod uticajem karboksipeptidaze N i povećavaju permeabilnost postkapilarnih venula. Efekat C5a des Arg
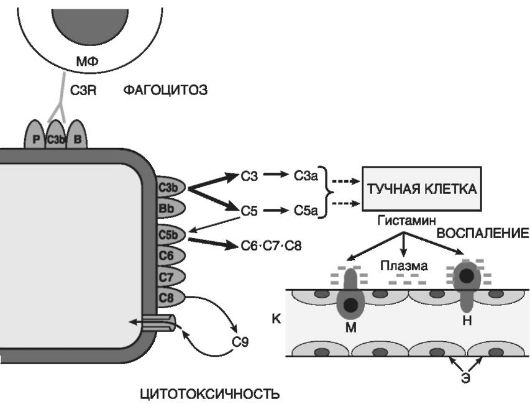 Rice. 10-5. Komponente sistema komplementa: C3b, C5b - fragmenti C3 i C5 povezani sa membranom; C3a i C5a - peptidi odvojeni od C3 i C5, respektivno; S6-S8 - komponente kompleksnih napadačkih membrana; C9 - protein polimerizovan u membrani; Bb - fragment proteina B povezan sa membranom; strelice - komponente reakcije koje se povećavaju kaskadom; MF - makrofag; C3R - receptor za komponentu C3b komplementa; K - kapilarni; E - endotelna obloga kapilare; H i M - dijapedeza neutrofila i monocita
Rice. 10-5. Komponente sistema komplementa: C3b, C5b - fragmenti C3 i C5 povezani sa membranom; C3a i C5a - peptidi odvojeni od C3 i C5, respektivno; S6-S8 - komponente kompleksnih napadačkih membrana; C9 - protein polimerizovan u membrani; Bb - fragment proteina B povezan sa membranom; strelice - komponente reakcije koje se povećavaju kaskadom; MF - makrofag; C3R - receptor za komponentu C3b komplementa; K - kapilarni; E - endotelna obloga kapilare; H i M - dijapedeza neutrofila i monocita
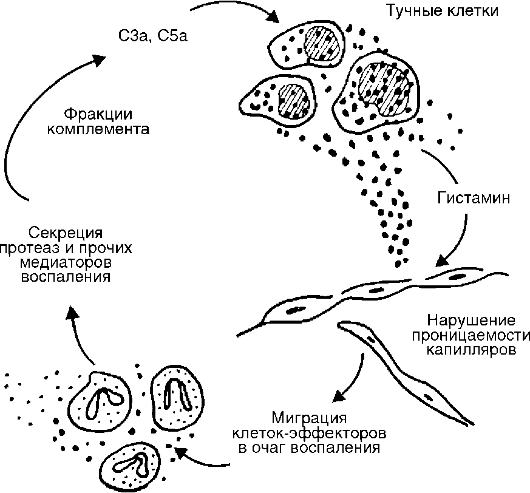 Rice. 10-6. Povezanost komplementa sa mastocitima u žarištu akutne upale
Rice. 10-6. Povezanost komplementa sa mastocitima u žarištu akutne upale
nije povezan sa histaminom, ali je zavisan od neutrofila, tj. provodi zbog faktora permeabilnosti oslobođenih iz polimorfonuklearnih granulocita - lizozomalnih enzima i neenzimskih kationskih proteina, aktivnih metabolita kisika. Osim toga, C5a i C5a des Arg privlače neutrofile. Nasuprot tome, C3a praktično nema hemotaktička svojstva;
C3b opsonizira patogeni agens i, shodno tome, potiče imunološku adheziju i fagocitozu;
C5b-C9 kompleks je odgovoran za lizu mikroorganizama i patološki izmijenjenih stanica.
Izvor komplementa je krvna plazma i, u manjoj meri, tkivna tečnost. Pojačani protok plazma komplementa u tkivo je jedna od važnih svrha eksudacije. Aktivne komponente komplementa oslobađaju ne samo histamin, već i interleukin (IL) 1, prostaglandine, leukotriene, faktor aktiviranja trombocita i sinergijski djeluju s prostaglandinima i supstancom P.
kinins- vazoaktivni peptidi nastali iz kininogena (a 2-globulina) pod uticajem kalikreina u plazmi (bradikinin) i u tkivnoj tečnosti (kalidin). Aktivacijski faktor za aktivaciju kalikrein-kinin sistema je aktivacija Hageman faktora (XII), koji pretvara prekalikreine u kalikreine, u slučaju oštećenja tkiva. Faktor XII je prisutan u krvi i ima afinitet za negativno nabijene površine. U tečnoj fazi krvi spontano se raspada na dva fragmenta: CPa - enzimski aktivan fragment i CPb. XIIa se adsorbuje na površini stranog agensa (flogogen), gde se stabilizuje. Ima proteolitičku aktivnost, čiji je supstrat sam CP faktor i drugi protein, prekalekrein. Nadalje, prekalikrein se pod djelovanjem CP pretvara u proteazu kalikrein. Kalikrein naglo pojačava stvaranje CN iz CP faktora i istovremeno djeluje na novi supstrat - takozvani kininogen visoke molekularne težine (HMK). Pod djelovanjem kalikreina iz spirale nastaje bradikinin, koji je jedan od glavnih medijatora upale. Bradikinin djeluje na vaskularni endotel, uzrokujući "otvaranje" rubova stanica vaskularnog endotela i na taj način otvarajući put krvnoj plazmi do mjesta upale. Dakle, ovaj sistem detektuje strano telo po njegovom negativnom naelektrisanju
površine. Površine njihovih vlastitih ćelija su raspoređene tako da ne adsorbiraju CP, ne stabiliziraju ga i tako ne indukuju daljnji lanac događaja. Ovo je najjednostavniji i najprimitivniji način razlikovanja "vlastitog" od "nevlasnog".
Kinini posreduju u širenju arteriola i povećavaju permeabilnost venula kontrakcijom endotelnih ćelija. Oni kontrahiraju glatke mišiće vena i povećavaju intrakapilarni i venski pritisak, inhibiraju emigraciju neutrofila, moduliraju distribuciju makrofaga, stimulišu migraciju i mitogenezu T-limfocita i lučenje limfokina. Osim toga, pojačavaju proliferaciju fibroblasta i sintezu kolagena i stoga imaju ulogu u reparativnim pojavama kod kronične upale. Jedan od najvažnijih efekata kinina je njihova sposobnost da iritiraju senzorne nervne završetke, uzrokujući upalni bol. Kinini pospješuju oslobađanje histamina iz mastocita, sintezu prostaglandina mnogim tipovima stanica, pa su neki od njihovih glavnih efekata - vazodilatacija, kontrakcija glatkih mišića, bol - povezani s oslobađanjem drugih medijatora, posebno prostaglandina.
Aktivacija Hagemanovog faktora pokreće ne samo proces stvaranja kinina, već i koagulaciju krvi i fibrinolizu. U ovom slučaju nastaju medijatori kao što su fibrinopeptidi i produkti razgradnje fibrina, koji su moćni hematraktanti.
Eikozanoidi(Sl. 10-7) su važna posrednička karika u inflamatornom odgovoru, o čemu svjedoči njihova dugotrajna produkcija u žarištu i bliska veza sa ključnim događajem upale - infiltracijom leukocita, kao i moćno protuupalno djelovanje. efekat inhibitora njihove sinteze. U žarištu upale, glavni proizvođači eikozanoida su monociti i makrofagi, iako ih formiraju gotovo sve vrste nuklearnih stanica kada su potonje stimulirane. U žarištu upale dominiraju eikozanoidi prostaglandini(PGE 2), leukotrieni(LTB4) i 5-hidroperoksieikozatetraenska kiselina(5-HPETE). Nastaje i tromboksan, ali u manjoj količini. A 1(TxA 2), PGF 2a, PGD 2, prostaciklin (PGI 2), LTC 4, LTD 4, LTE 4, drugi HPETE. Glavni efekat eikozanoida je njihov efekat na leukocite; kao moćni hematraktanti, igraju važnu ulogu u mehanizmima samoodržive infiltracije leukocita.
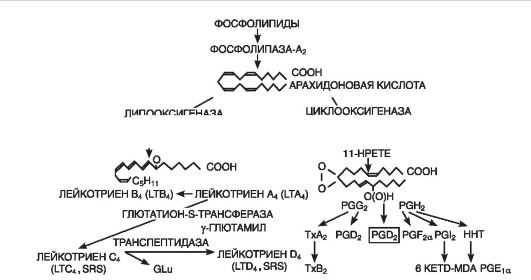
Rice. 10-7. Formiranje leukotriena i prostaglandina iz ćelijske membrane (prema D. Gemsa et al., 1981): Tx - tromboksan; PG (prostaglandin)- prostaglandin; LT (leukotrien)- leukotrien; HPETE (hidroksiperoksi-eikozatetranoična kiselina)- hidroperoksieikozatetraenska kiselina
Prostaglandini oni sami ne povećavaju vaskularnu permeabilnost, ali, kao jaki vazodilatatori, povećavaju hiperemiju i, posljedično, eksudaciju. Prostaglandini i leukotrieni su važni u nastanku upalnog bola. Istovremeno, PGE 2, koji nema direktnu bolnu aktivnost, povećava osjetljivost receptora aferentnih bolnih nervnih završetaka na bradikinin i histamin. PGE 2 je jak antipiretik i učestvuje u razvoju groznice. Prostaglandini igraju ključnu ulogu u modulaciji upalnog procesa regulacijom eksudacije leukocita, emigracije i degranulacije, te fagocitoze. Tako, na primjer, PGE potencira razvoj edema uzrokovanog histaminom ili bradikininom, dok PGF 1a, naprotiv, slabi. Slično, PGE i PGF 1a djeluju na emigraciju leukocita.
Leukotrieni(sintetiziraju se u svim krvnim stanicama, osim eritrocita, kao iu vaskularnoj adventicii, mastocitima, plućima) doprinose kontrakciji glatkih mišića gastrointestinalnog trakta, imaju vazokonstrikcijski učinak (uključujući koronarne arterije). LTC 4 , LTD 4 , LTE 4 povećavaju vaskularnu permeabilnost direktnom kontrakcijom endotelnih ćelija, a LTB 4 djeluje kao medijator ovisan o neutrofilima. Leukotrieni na-
dovode do spazma glatkih mišića bronhija (efekat bronhospazma, za razliku od histamina, razvija se sporije, ali je duži), razvoja edema, zahvata eozinofila, pojačanog lučenja sluzi i poremećaja njenog transporta . Ciljni organ za leukotriene je srce. Pošto se oslobađaju u višku, oni inhibiraju (za 60%) kontraktilnost srčanog mišića, smanjujući koronarni protok krvi i pojačavajući upalni odgovor. Leukotrieni su u ekstenzivnoj interakciji s drugim medijatorima upale. Pojačavaju bronhospastičko djelovanje histamina, acetilholina, prostaglandina i tromboksana, stimuliraju oslobađanje prostaglandina i tromboksana.
Tromboksani(nastaju u tkivu mozga, slezene, pluća i u trombocitima, inflamatornim ćelijama granuloma) izazivaju adheziju i agregaciju trombocita, doprinose razvoju tromboze u koronarne bolesti srca, imaju vazospastički efekat.
Modulaciona funkcija eikozanoida ostvaruje se kroz promjene u omjeru cikličkih nukleotida u stanicama.
Biogeni amini - histamin i serotonin se smatraju glavnim medijatorima početnih mikrocirkulacijskih poremećaja u žarištu akutne upale i neposredne faze povećane vaskularne permeabilnosti.
Mala količina neurotransmitera serotonin nalazi se u mastocitima i enterohromafinskim ćelijama, ali njegov glavni izvor su trombociti. Efekti serotonina su dvosmisleni i variraju ovisno o količini. U normalnim fiziološkim uslovima, serotonin je vazokonstriktor, izaziva produženi vazospazam i povećava njihov tonus. Sa upalom, količina serotonina se dramatično povećava. U visokim koncentracijama, serotonin je vazodilatator, širi krvne sudove, povećava permeabilnost i 100 puta je efikasniji od histamina. Serotonin je u stanju da izazove direktnu kontrakciju endotelnih ćelija venula, a takođe je i medijator bola. Osim toga, serotonin stimulira monocite na mjestu upale.
Histamin djeluje na dva načina u odnosu na sudove i ćelije. Preko H 1 receptora širi arteriole i inhibira emigraciju i degranulaciju leukocita, a preko H 1 receptora sužava venule, povećavajući intrakapilarni pritisak i stimuliše
stimuliše emigraciju i degranulaciju leukocita. U normalnom toku upale histamin djeluje uglavnom preko H 1 receptora na neutrofile, ograničavajući njihovu funkcionalnu aktivnost, i preko H 1 receptora na monocite, stimulirajući ih. Dakle, uz proupalne vaskularne efekte, djeluje i protuupalno. Posjedujući sposobnost regulacije proliferacije, diferencijacije i funkcionalne aktivnosti fibroblasta, histamin je uključen u procese reparacije. Modulacijski efekti histamina također su posredovani cikličkim nukleotidima.
Što se tiče interakcija biogenih amina u žarištu upale, poznato je da histamin može pokrenuti ili pojačati sintezu prostaglandina preko H 1 receptora, a inhibirati je preko H 2 receptora. Međusobno i sa bradikininom, nukleotidima i nukleozidima, supstancom P, biogeni amini povećavaju vaskularnu permeabilnost. Vazodilatacijski učinak histamina se pojačava u kombinaciji s acetilkolinom, serotoninom i bradikininom.
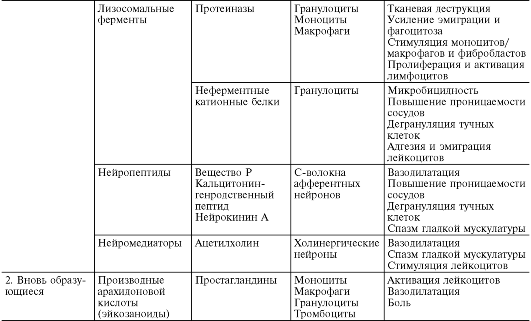
Lizozomalni enzimi oslobađaju se u žarištu upale iz granulocita i monocita makrofaga tokom njihove kemotaktičke stimulacije, migracije, fagocitoze, oštećenja, smrti. Neutrofilne granule sadrže proteinaze - elastazu, katepsin G i kolagenaze, koje obezbeđuju antimikrobnu zaštitu lizom mrtvih mikroorganizama. Imaju medijatorne i modulatorne efekte na vaskularnu permeabilnost, emigraciju i fagocitozu.
Povećanje vaskularne permeabilnosti pod utjecajem lizosomskih enzima nastaje zbog lize subendotelnog matriksa, stanjivanja i fragmentacije endotelnih stanica i praćeno je krvarenjem i trombozom. Formirajući ili cijepajući najvažnije hemotaksine, lizozomalni enzimi moduliraju infiltraciju leukocita. Ovisno o koncentraciji, oni sami mogu pojačati ili inhibirati migraciju neutrofila. Neutralne proteinaze su u stanju da moduliraju fagocitozu. Na primjer, elastaza formira C3b opsonin, koji je neophodan za adheziju čestica na površini neutrofila. Posljedično, sam neutrofil obezbjeđuje mehanizam za pojačavanje fagocitoze. I katepsin G i elastaza povećavaju afinitet Fc receptora neutrofilne membrane za imunoglobulinske komplekse i, shodno tome, povećavaju efikasnost preuzimanja čestica.
Zbog sposobnosti lizosomskih enzima da aktiviraju sistem komplementa, kalikrein-kinina, koagulacije i fibrinolize, oslobađaju citokine i limfokine, upala se razvija i samoodržava dugo vremena.
neenzimski kationski proteini, sadržane u azurofilnim i specifičnim granulama neutrofila, imaju tako važno svojstvo kao što je visoka mikrobicidnost. U tom smislu, oni su u sinergijskoj interakciji sa sistemom mijeloperoksidaza-vodonik peroksid. Kationski proteini se sorbiraju na negativno nabijenoj membrani bakterijske ćelije elektrostatičkom interakcijom, narušavajući permeabilnost i strukturu njene membrane. Tada dolazi do smrti mikroorganizma, nakon čega slijedi efikasna liza njegovim lizozomalnim proteinazama. Osim toga, oslobođeni kationski proteini posreduju povećanu vaskularnu permeabilnost (pospješujući degranulaciju mastocita i oslobađanje histamina), kao i adheziju i emigraciju leukocita.
Citokini tokom upale proizvode ih uglavnom stimulisani monociti i makrofagi (monokini), kao i neutrofili, limfociti, endotelne i druge ćelije. Citokini povećavaju vaskularnu permeabilnost (na način ovisan o neutrofilima), adheziju i emigraciju leukocita. Uz proinflamatorna svojstva, citokini su važni i za direktnu odbranu organizma, jer stimulišu neutrofile i monocite da ubijaju, apsorbuju i vare invazivne mikroorganizme, a takođe pojačavaju fagocitozu opsonizacijom patogenog agensa. Stimulirajući čišćenje rane, proliferaciju i diferencijaciju stanica, citokini pospješuju reparativne procese. Uz to, mogu posredovati u destrukciji tkiva (degradaciju hrskavičnog matriksa i resorpciju kosti) i na taj način igrati ulogu u patogenezi bolesti vezivnog tkiva, posebno reumatoidnog artritisa. Djelovanje citokina također uzrokuje niz metaboličkih efekata koji su u osnovi uobičajenih manifestacija upale - groznica, pospanost, anoreksija, metaboličke promjene, stimulacija hepatocita na pojačanu sintezu proteina akutne faze, aktivacija krvnog sistema itd. Citokini stupaju u interakciju jedni s drugima, sa prostaglandinima, neuropeptidima i drugim medijatorima.
Inflamatorni medijatori (citokini) također uključuju brojne limfokini- polipeptidi proizvedeni od strane stimuliranih limfocita. Limfokini koordiniraju interakciju neutrofila, makrofaga i limfocita, regulišući upalni odgovor općenito.
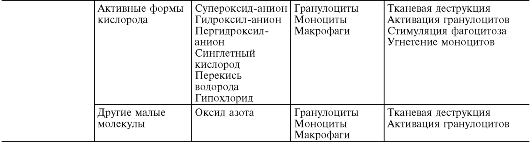
Aktivni metaboliti kiseonika, prije svega, slobodni radikali - superoksidni anjonski radikal (O*-), hidroksilni radikal (HO*), hidroperoksidni radikal (HO*,), zbog prisustva jednog ili više nesparenih elektrona u svojoj vanjskoj orbiti, imaju povećanu reaktivnost sa drugih molekula i, stoga, značajan destruktivni potencijal, koji je važan u patogenezi upale (Sl. 10-8).
Izvori reaktivnih vrsta kiseonika - radikali kiseonika, vodikov peroksid (H 1 O 1), singletni kiseonik (1 O 1), hipohlorit (HOCl) itd. - su: respiratorni nalet fagocita tokom njihove stimulacije, kaskada arahidonske kiseline u proces stvaranja eikozanoida, enzimski procesi u endoplazmatskom retikulumu i peroksizomima, mitohondrijama, citosolu, kao i autooksidacija malih molekula kao što su hidrokinoni, leukoflavini, kateholamini itd.
Kiseonički radikali povećavaju baktericidnu sposobnost fagocita, a imaju i posredničke i modulatorne funkcije.
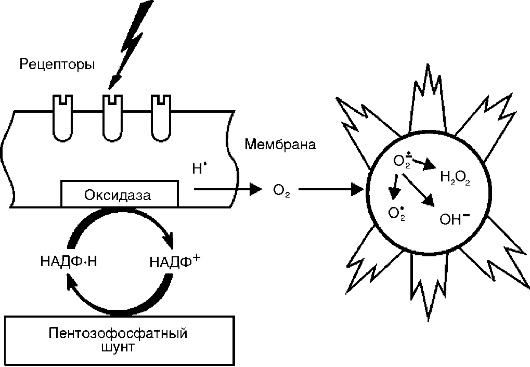 Rice. 10-8. Indukcija reaktivnih vrsta kiseonika pri aktivaciji oksidaznog sistema ćelijske membrane
Rice. 10-8. Indukcija reaktivnih vrsta kiseonika pri aktivaciji oksidaznog sistema ćelijske membrane
cije. Kao posrednici upale, aktivni metaboliti kisika uzrokuju peroksidaciju lipida, oštećenje proteina, ugljikohidrata, nukleinskih kiselina, što povećava vaskularnu permeabilnost (zbog oštećenja endotelnih stanica) i potiče stimulaciju fagocita. Kao modulatori, mogu pojačati upalu (oslobađanjem enzima i interakcijom s njima kada je tkivo oštećeno) ili imati protuupalni učinak (inaktivacija lizozomalnih hidrolaza i drugih medijatora upale). Aktivni metaboliti kiseonika su od velike važnosti u održavanju hronične upale.
Nazivaju se i posrednicima i modulatorima upale neuropeptidi- tvari koje oslobađaju C-vlakna kao rezultat aktivacije inflamatornim agensom polimodalnih nociceptora, koji igraju važnu ulogu u nastanku aksonskih refleksa u terminalnim granama primarnih aferentnih (osjetljivih) neurona. Najviše proučavane su supstanca P, peptid vezan za kalcitonin gen, neurokinin A. Neuropeptidi povećavaju vaskularnu permeabilnost, a ta sposobnost je u velikoj mjeri posredovana medijatorima koji potiču iz mastocita. Postoje membranski spojevi između nemijeliniziranih nerava i mastocita koji obezbjeđuju komunikaciju između centralnog nervnog sistema i žarišta upale. Neuropeptidi sinergistički interaguju u povećanju vaskularne permeabilnosti kako među sobom tako i sa histaminom, bradikininom, C5a, faktorom aktiviranja trombocita, leukotrienom B 4 ; antagonistički - sa ATP-om i adenozinom. Oni također imaju potencirajući učinak na privlačnost i citotoksičnu funkciju neutrofila, pojačavaju adheziju neutrofila na endotel venule. Osim toga, neuropeptidi povećavaju osjetljivost nociceptora na djelovanje različitih medijatora, posebno prostaglandina E 1 i prostaciklina, te tako učestvuju u stvaranju bola tokom upale.
Pored gore navedenih supstanci, uključuju se i medijatori upale acetilholin i kateholamini, oslobađa se pri ekscitaciji holina i adrenergičkih struktura. Acetilholin izaziva vazodilataciju i igra ulogu u aksonsko-refleksnom mehanizmu arterijske hiperemije tokom upale. Norepinefrin i epinefrin inhibiraju rast vaskularne permeabilnosti, djelujući uglavnom kao modulatori upale.
10.4.3. Poremećaji cirkulacije i mikrocirkulacije u upaljenom tkivu
Poremećaji mikrocirkulacije. Vaskularni fenomeni se razvijaju nakon izlaganja inflamatornom agensu, budući da su početne refleksne prirode. Oni su dobro praćeni pod mikroskopom u klasičnom eksperimentu Yu. Kongeyma na mezenteriju žabe i uključuju nekoliko faza:
1. kratkotrajni grč arteriola, praćeno blanširanjem tkiva. To je rezultat refleksne ekscitacije vazokonstriktora uslijed izlaganja upalnim agensima. Traje od nekoliko desetina sekundi do nekoliko minuta, pa ga nije uvijek moguće primijetiti.
2. arterijska hiperemija, zbog ekspanzije arteriola, čiji je mehanizam, s jedne strane, povezan sa akson-refleksnom ekscitacijom vazodilatatora, as druge strane, sa direktnim vazodilatacijskim djelovanjem medijatora upale: neuropeptida, acetilkolina, histamina, bradikinina, prostaglandini, itd. Arterijska hiperemija je u osnovi dva glavna spoljašnja lokalna znaka upale – crvenilo i povećanje temperature tkiva. Osim toga, u ponovnom stvaranju topline važna je povećana proizvodnja topline u fokusu zbog pojačanog metabolizma.
3. Venska hiperemija. Može se razviti u roku od nekoliko minuta nakon izlaganja flogogenu i karakterizira ga značajno trajanje - prati cijeli tok upalnog procesa. Istovremeno, budući da se uz njegovo učešće provode glavni upalni fenomeni, smatra se prava inflamatorna hiperemija.
U mehanizmu venska kongestija Postoje 3 grupe faktora: a) kršenje reoloških svojstava krvi i njegovu cirkulaciju. To uključuje povećanje viskoznosti krvi zbog njenog zgušnjavanja zbog eksudacije, gubitak albumina, povećanje sadržaja globulina, promjene u koloidnom stanju proteina; povećana otpornost na protok krvi kao rezultat marginalnog stajanja leukocita, oticanja i agregacije eritrocita; stvaranje tromba zbog aktivacije sistema koagulacije krvi; kršenje prirode protoka krvi - usporavanje protoka krvi u aksijalnoj zoni, smanjenje marginalne plazma zone;
b) promjene vaskularni zid, koji uključuju gubitak vaskularnog tonusa zbog paralize neuromišićnog aparata krvnih žila; smanjena elastičnost vaskularnog zida; oticanje endotela i povećanje njegove adhezivnosti, zbog čega se lumen krvnih žila sužava, stvaraju se uvjeti za prianjanje leukocita na endotel;
u) promjene tkiva, koji se sastoji od kompresije venula i limfnih sudova edematozno, infiltrirano tkivo; smanjenje elastičnosti vezivnog tkiva. Mnogi od ovih faktora su i uzroci i, u isto vrijeme, posljedice razvoja venske hiperemije.
Upalna hiperemija se razlikuje od drugih vrsta hiperemije (uzrokovane, na primjer, mehaničkim faktorom) značajnim slabljenjem ili čak izopačenošću reakcije žila upaljenog tkiva na djelovanje vazokonstriktivnih sredstava (adrenalin, kofein) i na iritaciju simpatičkih nerava. Ovaj fenomen može biti povezan sa "desenzibilizacijom" krvnih sudova, tj. njihova smanjena ili kvalitativno izmijenjena osjetljivost na djelovanje vazokonstriktornih stimulusa, što je posljedica blokade receptora. Ostale razlike u inflamatornoj hiperemiji povezane su sa izraženijom prokrvljenošću upaljenog područja organa ili tkiva, širenjem i povećanjem broja funkcionalnih kapilara, intenzitetom mikrocirkulacije, zaostajanjem linearne brzine krvotoka itd., što omogućava nam da smatramo inflamatornu hiperemiju kao posebna vrsta poremećaja mikrocirkulacije.
4. Stasis. Može se razviti u nekim granama žila upaljenog tkiva. Rasprostranjena staza je karakteristična za akutnu, brzo razvijajuću, na primjer hiperergijsku, upalu. Po pravilu, poremećaj protoka krvi u inflamatornoj stazi je prolazan, međutim, ako dođe do oštećenja vaskularnog zida i tromba u mnogim mikrožilama, zastoj postaje ireverzibilan.
10.4.4. Eksudacija i eksudati
Poremećaji mikrocirkulacije tokom upale praćeni su fenomenima eksudacije i emigracije.
Eksudacija(exudatio, od lat. exudare- znoj) - izlučivanje tečnog dijela krvi koji sadrži proteine kroz vaskularni zid
u upaljeno tkivo. Shodno tome, tečnost koja izlazi iz krvnih sudova u tkivo tokom upale naziva se eksudat. Izrazi "eksudat" i "eksudacija" koriste se samo u odnosu na upalu. Osmišljeni su da naglase razliku između upalne tekućine (i mehanizma njenog nastanka) od međustanične tekućine i transudata - neupalnog izljeva koji izlazi s drugim, neupalnim, edemima. Ako transudat sadrži do 2% proteina, onda eksudat sadrži više od 3 (do 8%).
Mehanizam eksudacije uključuje 3 glavna faktora:
1) povećana vaskularna permeabilnost (venule i kapilare) kao rezultat izloženosti medijatorima upale i, u nekim slučajevima, samom inflamatornom agensu;
2) povećanje krvnog (filtracionog) pritiska u žilama žarišta upale zbog hiperemije;
3) povećanje osmotskog i onkotskog pritiska u upaljenom tkivu kao rezultat započete alteracije i eksudacije i, moguće, smanjenje krvnog onkotskog pritiska usled gubitka proteina tokom obilnog izlučivanja (sl. 10-9, 10-10).
Vodeći faktor u eksudaciji je povećana vaskularna permeabilnost,što je obično Ima dvije faze - neposrednu i odloženu.
 Rice. 10-9. Oslobađanje Evans blue iz žile mezenterija žabe tokom upale, X 35 (prema A.M. Chernukh)
Rice. 10-9. Oslobađanje Evans blue iz žile mezenterija žabe tokom upale, X 35 (prema A.M. Chernukh)
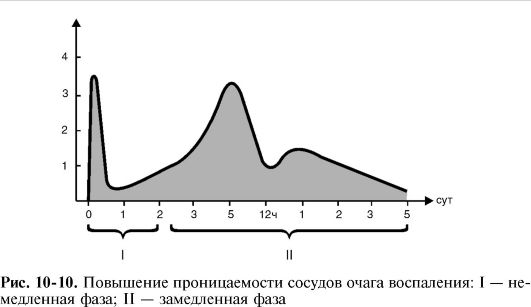 Neposredna faza nastaje nakon djelovanja upalnog agensa, dostiže maksimum u roku od nekoliko minuta i završava u prosjeku za 15-30 minuta, kada se propusnost može vratiti u normalu (ako sam flogogen nema direktan štetni učinak na krvne žile). Prolazno povećanje vaskularne permeabilnosti u neposrednoj fazi uglavnom je posljedica kontraktilnih pojava iz endotela venula. Kao rezultat interakcije medijatora sa specifičnim receptorima na membranama endotelnih stanica, aktinski i miozinski mikrofilamenti citoplazme stanica su smanjeni, a endotelne stanice su zaokružene; dvije susjedne ćelije se udaljavaju jedna od druge, a između njih se pojavljuje interendotelni jaz kroz koji dolazi do eksudacije.
Neposredna faza nastaje nakon djelovanja upalnog agensa, dostiže maksimum u roku od nekoliko minuta i završava u prosjeku za 15-30 minuta, kada se propusnost može vratiti u normalu (ako sam flogogen nema direktan štetni učinak na krvne žile). Prolazno povećanje vaskularne permeabilnosti u neposrednoj fazi uglavnom je posljedica kontraktilnih pojava iz endotela venula. Kao rezultat interakcije medijatora sa specifičnim receptorima na membranama endotelnih stanica, aktinski i miozinski mikrofilamenti citoplazme stanica su smanjeni, a endotelne stanice su zaokružene; dvije susjedne ćelije se udaljavaju jedna od druge, a između njih se pojavljuje interendotelni jaz kroz koji dolazi do eksudacije.
spora faza razvija se postepeno, dostiže maksimum nakon 4-6 sati, a ponekad traje i do 100 sati, ovisno o vrsti i intenzitetu upale. Posljedično, eksudativna faza upale počinje odmah nakon izlaganja flogogenu i traje više od 4 dana.
Uporno povećanje vaskularne permeabilnosti u sporoj fazi povezano je sa oštećenjem vaskularnog zida venula i kapilara leukocitnim faktorima - lizosomskim enzimima i aktivnim metabolitima kiseonika.
U odnosu na vaskularnu permeabilnost inflamatornih medijatora dijele se na:
1) direktna gluma, direktno utiču na endotelne ćelije i izazivaju njihovu kontrakciju - histamin, serotonin, bradikinin, C5a, C3a, LTC 4 i LTD 4 ;
2) ovisni o neutrofilima,čiji je efekat posredovan leukocitnim faktorima. Takvi medijatori nisu u stanju povećati vaskularnu permeabilnost kod leukopeničnih životinja. Ovo je komponenta komplementa C5a des Arg, LTB 4 , interleukina, posebno IL-1, dijelom faktora aktiviranja trombocita.
Izlazak tečnog dijela krvi iz žile i njegovo zadržavanje u tkivu objašnjava se: povećanom vaskularnom permeabilnosti, povećanim tlakom filtracije krvi, osmotskim i onkotskim tlakom tkiva, filtracijom i difuzijom kroz mikropore u samim endotelnim stanicama (transcelularni kanali). ) na pasivan način; na aktivan način - uz pomoć takozvanog mikrovezikularnog transporta, koji se sastoji u mikropinocitozi endotelnim stanicama krvne plazme, njenom transportu u obliku mikromjehurića (mikrovezikula) prema bazalnoj membrani i naknadnom oslobađanju (ekstruziji) u tkivo. .
Povećana vaskularna permeabilnost tokom upale više nego kod bilo kojeg neupalnog edema, pa je stoga količina proteina u eksudatu veća od one u transudatu. Ova razlika je zbog razlike u količinama i skupu oslobođenih biološki aktivnih supstanci. Na primjer, leukocitni faktori koji oštećuju vaskularni zid imaju važnu ulogu u patogenezi eksudacije i manje značajnu kod neupalnih edema.
Stupanj povećanja vaskularne permeabilnosti također je određen sastavom proteina eksudata. Uz relativno malo povećanje permeabilnosti, mogu izaći samo fino dispergirani albumini, s daljnjim povećanjem - globulini i, konačno, fibrinogen.
Ovisno o kvalitativnom sastavu, razlikuju se sljedeće vrste eksudata: serozni, fibrinozni, gnojni, truležni, hemoragični, mješoviti (sl. 10-11, vidi umetak u boji).
Serozni eksudat karakteriše umereni sadržaj proteina (3-5%), uglavnom fino dispergovanih (albumin), i malom količinom polimorfonuklearnih leukocita, usled čega ima nisku specifičnu težinu (1015-1020) i
dovoljno transparentan. Sastav je najbliži transudatu. Karakteristično za upalu seroznih membrana (serozni peritonitis, pleuritis, perikarditis, artritis, itd.), rjeđe kod upale u parenhimskim organima. Eksudat sa seroznom upalom sluzokože karakterizira velika primjesa sluzi. Ova upala se naziva kataralna (od grčkog. catarrheo- teći dole, teći dole; kataralni rinitis, gastritis, enterokolitis itd.). Najčešće se serozni eksudat opaža s opeklinom, virusnom, alergijskom upalom.
fibrinozni eksudat je drugačije visokog sadržaja fibrinogen, koji je rezultat značajnog povećanja vaskularne permeabilnosti. U kontaktu s oštećenim tkivima, fibrinogen se pretvara u fibrin i ispada u obliku viloznih masa (na seroznim membranama) ili filma (na sluznicama), zbog čega se eksudat zgušnjava. Ako se fibrinozni film nalazi labavo, površno, lako se odvaja bez narušavanja integriteta sluznice, takva upala se naziva krupozna. Uočava se u želucu, crijevima, dušniku, bronhima. U slučaju kada je film čvrsto zalemljen za osnovno tkivo i njegovim uklanjanjem se razotkriva ulcerozna površina, govorimo o difteritičnoj upali. Karakteristična je za krajnike, usnu šupljinu, jednjak. Ova razlika je zbog prirode epitela sluznice i dubine oštećenja. Fibrinozni filmovi se mogu spontano odbaciti zbog autolize, koja se razvija oko žarišta, i demarkacijske upale, te izaći van; podvrgnuti enzimskom topljenju ili organizovanju, tj. klijanje vezivnim tkivom sa stvaranjem priraslica vezivnog tkiva, odnosno adhezija. Fibrinozni eksudat može nastati kod difterije, dizenterije, tuberkuloze.
Gnojni eksudat karakterizira prisustvo velikog broja polimorfonuklearnih leukocita, uglavnom mrtvih i uništenih (purulentna tijela), enzima, produkata autolize tkiva, albumina, globulina, ponekad fibrinskih niti, posebno nukleinskih kiselina, koji uzrokuju visoku viskoznost gnoja. Kao rezultat toga, gnojni eksudat je prilično zamućen, sa zelenkastom nijansom. Karakteristična je za upalne procese uzrokovane koknom infekcijom, patogenim gljivicama ili hemijskim flogogenima poput terpentina, toksičnim supstancama.
Gnojni (ihorski) eksudat Odlikuje se prisustvom produkata trulog raspadanja tkiva, zbog čega ima prljavo zelenu boju i loš miris. Nastaje u slučaju pristupa patogenim anaerobima.
Hemoragični eksudat odlikuje se visokim sadržajem crvenih krvnih zrnaca, što mu daje ružičastu ili crvenu boju. Karakterističan je za tuberkulozne lezije (tuberkulozni pleuritis), kugu, antraks, male boginje, toksična gripa, alergijske upale, tj. za uticaj visoko virulentnih agenasa, nasilne upale, praćene značajnim povećanjem propusnosti, pa čak i uništavanjem krvnih sudova. Hemoragični karakter može poprimiti bilo koju vrstu upale - seroznu, fibrinoznu, gnojnu.
Mješoviti eksudati primjećuju se tijekom upale koja se javlja u pozadini oslabljene odbrane tijela i kao rezultat toga vezanja sekundarne infekcije. Postoje serozno-fibrinozni, serozno-gnojni, serozno-hemoragični, gnojno-fibrinozni eksudati.
Biološki značaj eksudacije duplo. Obavlja važnu zaštitnu ulogu: obezbjeđuje opskrbu tkiva medijatorima plazme - aktivnim komponentama komplementa, kininima, faktorima koagulacionog sistema, enzimima plazme, biološki aktivnim supstancama koje oslobađaju aktivirana krvna zrnca. Zajedno s tkivnim medijatorima sudjeluju u ubijanju i lizi mikroorganizama, regrutaciji krvnih leukocita, opsonizaciji patogena, stimulaciji fagocitoze, čišćenju rana i reparativnim pojavama. Uz eksudat, produkti metabolizma, toksini izlaze iz krvotoka u žarište, tj. žarište upale obavlja eliminativnu funkciju drenaže. S druge strane, zbog koagulacije limfe u žarištu, gubitka fibrina, pogoršanja venske staze i tromboze venskih i limfnih žila, eksudat je uključen u zadržavanje mikroba, toksina i metaboličkih produkata. u fokusu.
Kao komponenta patološkog procesa, eksudacija može dovesti do komplikacija - protok eksudata u tjelesnu šupljinu s razvojem pleuritisa, perikarditisa, peritonitisa; kompresija obližnjih organa; stvaranje gnoja s razvojem apscesa, empijema, flegmona, pijemije. Stvaranje adhezija može uzrokovati pomicanje i disfunkciju organa. Lokalizacija upalnog procesa je od velike važnosti. Na primjer,
stvaranje fibrinoznog eksudata na sluznici larinksa kod difterije može dovesti do gušenja.
Nakupljanje eksudata u tkivu uzrokuje takav vanjski lokalni znak upale kao što je oteklina. Osim toga, uz djelovanje bradikinina, histamina, prostaglandina, neuropeptida, pritisak eksudata na završetke osjetilnih nerava je od određenog značaja u nastanku upalnog bola.
10.4.5. Oslobađanje leukocita u upaljeno tkivo (migracija leukocita)
Emigracija(emigracija, od lat. emigrirati- iseliti se, preseliti - oslobađanje leukocita iz krvnih sudova u tkivo. Izvodi se dijapedezom uglavnom kroz zid venula. Emigracija leukocita u žarište je ključni događaj u patogenezi upale. Leukociti su glavni efektori upale. Ekstracelularni baktericidni i litički efekti leukocitnih produkata i fagocitoze igraju odlučujuću ulogu u borbi protiv flogogena. Istovremeno, djelujući na stanice, krvne sudove i krv, leukocitne komponente djeluju kao važni posrednici i modulatori upale, uključujući i oštećenja vlastitih tkiva. Provodeći čišćenje rane, fagociti stvaraju preduvjete za reparativne pojave, gdje stimuliraju proliferaciju, diferencijaciju i funkcionalnu aktivnost fibroblasta i drugih stanica. Mehanizam emigracije (prema I. I. Mechnikovu) sastoji se u fenomenu kemotaksije.
Polazna tačka za aktivaciju leukocita je uticaj na receptore (često specifične) ćelijskih membrana različitih hemotaktičkih agenasa. (kemattraktanti), oslobađaju mikroorganizmi ili fagociti, kao i nastaju u tkivu kao rezultat djelovanja upalnog agensa ili pod utjecajem samih fagocita. Najvažniji hematraktanti su: fragmenti komplementa, fibrinopeptidi i produkti razgradnje fibrina, kalikrein, proaktivator plazminogena, fragmenti kolagena, fibronektin, metaboliti arahidonske kiseline, citokini, limfokini, bakterijski peptidi, produkti razgradnje granulocita.
Kao rezultat vezivanja hematraktanata na receptore i aktivacije enzima plazma membrane, u fagocitu se razvija respiratorni udar - naglo povećanje potrošnje
kisik i stvaranje njegovih aktivnih metabolita. Ovaj proces nema nikakve veze sa snabdijevanjem fagocita energijom. Usmjeren je na dodatno naoružavanje fagocita visokoreaktivnim toksičnim tvarima za efikasnije uništavanje mikroorganizama. Uz respiratorni udar, u fagocitu se javljaju i druge promjene: povećana proizvodnja posebnih membranskih glikoproteina koji određuju adhezivnost fagocita; smanjenje površinske napetosti membrane i promjena koloidnog stanja citoplazmatskih regija (reverzibilni prijelaz iz gela u sol), što je neophodno za stvaranje pseudopodija; aktivacija aktinskih i miozinskih mikrofilamenata, što je osnova migracije; pojačano lučenje i oslobađanje supstanci koje olakšavaju vezivanje leukocita za endotel (laktoferin, kationski proteini, fibronektin, interleukini).
Leukociti izlaze iz aksijalnog krvotoka u plazmu. To je olakšano kršenjem reoloških svojstava krvi, usporavanjem protoka krvi, promjenom njegove prirode, posebno smanjenjem marginalne plazma zone (sl. 10-12).
Zbog povećanja adhezivnih svojstava leukocita i endotelnih ćelija, leukociti se prianjaju na
 Rice. 10-12.Šema krvotoka u normalnim uslovima i kod upala: 1 - normalna cirkulacija: aksijalni tok, marginalna plazma zona sa pojedinačnim leukocitima; 2 - usporavanje protoka krvi: vidljivi su eritrociti, rubno stajanje leukocita i trombocita; 3 - jak zastoj krvi: marginalno stajanje leukocita i trombocita, smanjenje marginalne zone plazme (prema D.E. Alpernu)
Rice. 10-12.Šema krvotoka u normalnim uslovima i kod upala: 1 - normalna cirkulacija: aksijalni tok, marginalna plazma zona sa pojedinačnim leukocitima; 2 - usporavanje protoka krvi: vidljivi su eritrociti, rubno stajanje leukocita i trombocita; 3 - jak zastoj krvi: marginalno stajanje leukocita i trombocita, smanjenje marginalne zone plazme (prema D.E. Alpernu)
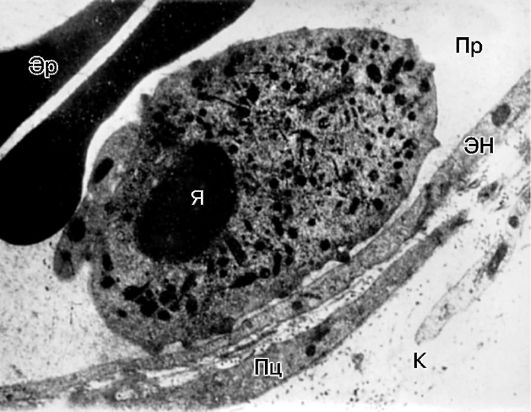 Rice. 10-13. Rubno stajanje leukocita u venuli mezenterija pacova tokom upale: Pr - lumen krvnog suda; EN - endotelna ćelija; Pc - pericit; K - kolagena vlakna; ja sam jezgro; Er - eritrociti. Elektronska mikroskopija, x10.000 (prema A.M. Chernukh)
Rice. 10-13. Rubno stajanje leukocita u venuli mezenterija pacova tokom upale: Pr - lumen krvnog suda; EN - endotelna ćelija; Pc - pericit; K - kolagena vlakna; ja sam jezgro; Er - eritrociti. Elektronska mikroskopija, x10.000 (prema A.M. Chernukh)
endotel - razvija se fenomen marginalnog stajanja leukocita
(Sl. 10-13).
Povećana adhezivnost endotela može biti posljedica: povećane proizvodnje adhezivnih glikoproteina (lektina) i drugih supstanci koje su uključene u sastav fibrinskog filma, koji normalno prekriva endotel iz lumena žile, fiksacije hemattraktanata na endotelnim stanicama, naknadne interakcije sa specifičnim receptori na leukocitima, povećana ekspresija na endoteliocitima receptori za imunoglobulin G i fragment komplementa C3b, koji doprinosi fiksaciji imunih kompleksa, a preko njih - leukocita koji nose receptore za imunoglobulin (Ig) G i C3b.
prianjanje leukocita na endotel posredovan sledećim faktorima:
Leukociti se u fazi inicijacije upale aktiviraju i formiraju agregate; kao rezultat aktivacije leukocita, njegov negativni naboj se smanjuje, što smanjuje sile međusobnog odbijanja između njega i negativno nabijenog endotela;
Kalcijumovi mostovi se formiraju između leukocita i endotela (Ca 2+ i drugi dvovalentni joni igraju ključnu ulogu u adheziji leukocita);
Tokom aktivacije u leukocitima, pojačava se sinteza specifičnih granula čije neke komponente, poput laktoferina, pojačavaju adhezivna svojstva ćelija;
Na membrani leukocita povećava se ekspresija adhezivnih glikoproteina Mac-1 i LAF-1 klasa.
Početni kontakt leukocita sa endotelom je vrlo krhak i pod uticajem krvotoka mogu da se kotrljaju preko površine fibrinskog filma, međutim, kontakt se brzo stabilizuje, jer leukociti luče proteaze u adhezijsku zonu, otkrivajući lektinski sličan dijelovima membrane endoteliocita i dajući im povećanu adhezivnost. Fibronektin koji luče fagociti direktno je povezan s adhezijom fagocita na endotel. Leukociti koji su zauzeli marginalni položaj oslobađaju pseudopodije, koje prodiru u interendotelne praznine i tako se „prelivaju“ kroz endotelni sloj (sl. 10-14). Emigracija je olakšana povećanjem vaskularne permeabilnosti i povećanjem protoka tekućine iz žile u tkivo, što uvelike olakšava prolazak vaskularnog zida za leukocite.
Jednom između endotelnog sloja i bazalne membrane, leukocit luči lizozomske proteinaze koje ga otapaju, kao i kationske proteine koji mijenjaju koloidno stanje bazalne membrane (reverzibilni prijelaz iz gela u sol), što osigurava njegovu povećanu permeabilnost za leukocite. . Imigrirani leukociti se odvajaju od vanjske površine vaskularnog zida i ameboidnim pokretima usmjeravaju do centra žarišta upale (sl. 10-15), što je određeno gradijentom koncentracije hemotaktičkih supstanci u žarištu. Određenu ulogu mogu imati elektrokinetički fenomeni zbog razlike potencijala između negativno nabijenog leukocita i pozitivnog naboja tkiva koje karakterizira H + - hiperionija.
U početku, među leukocitima eksudata u žarištu akutne upale, prevladavaju granulociti, uglavnom neutrofili, a zatim monociti/makrofagi. Kasnije se u žarištu nakupljaju limfociti.
Budući da usporavanje protoka krvi u pojedinim granama mikrovaskulature i marginalno stajanje leukocita može
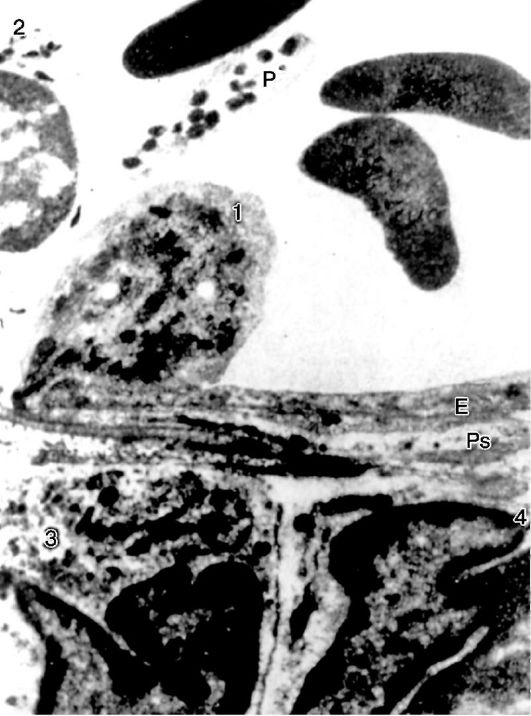 Rice. 10-14. Emigracija neutrofila: 1 - emigrirajući neutrofil; E - endotelna ćelija; Ps - duga pseudopodija, smještena paralelno s endotelom; 2 - neutrofil u lumenu žile; 3, 4 - emigrirani neutrofili; P - trombocit. x15 500 (prema Marchesiju)
Rice. 10-14. Emigracija neutrofila: 1 - emigrirajući neutrofil; E - endotelna ćelija; Ps - duga pseudopodija, smještena paralelno s endotelom; 2 - neutrofil u lumenu žile; 3, 4 - emigrirani neutrofili; P - trombocit. x15 500 (prema Marchesiju)
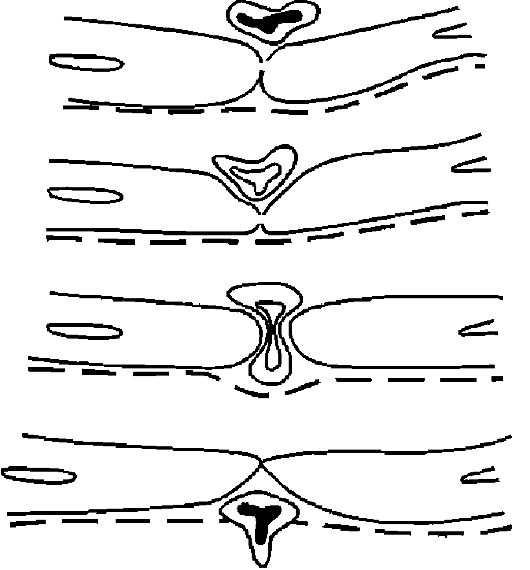 Rice. 10-15. Šema emigracije leukocita (prema Marchesiju)
Rice. 10-15. Šema emigracije leukocita (prema Marchesiju)
razvijaju se vrlo brzo i potrebno je 3-12 minuta da migrirajući neutrofil prođe kroz endotel, pojava granulocita u žarištu se može uočiti već 10. minuta od početka upale. Stopa akumulacije neutrofila u žarištu je najveća u prva 2 sata, a u naredna se postepeno smanjuje. Njihov broj dostiže maksimum nakon 4-6 sati.U tom periodu leukociti žarišta su zastupljeni neutrofilima sa više od 90%. Granulociti fagocitiraju bakterije ili druga strana tijela i čestice umirućih ćelijskih elemenata, istovremeno vršeći ekstracelularnu opskrbu enzima, kationskim proteinima, aktivnim metabolitima kisika. Istovremeno dolazi do masovnog uništenja neutrofila, čiji su ostaci važan poticaj za širenje infiltracije - kako neutrofilne tako i monocitne. Kao normalno, većina granulocita oslobođenih u tkivo nikada se ne vraća u krvotok.
Monociti obično prevladavaju u žarištu akutne upale nakon 16-24 sata i dostižu vrhunac, po pravilu, trećeg dana. Međutim, migracija monocita iz krvi u tkivo počinje istovremeno s migracijom neutrofila. Pretpostavlja se da je, u početku, brzina akumulacije monocita, koja je niža od one neutrofila, povezana sa inhibicijom kemotakse ovih ćelija pod uticajem otpadnih produkata neutrofila na određeno vreme, što je neophodno. za potpunu ekspresiju neutrofilne reakcije i prevenciju njene monocitne kontrole. U žarištu upale dolazi do postupne transformacije useljenih monocita u makrofage i sazrijevanja potonjih, pri čemu se povećava volumen citoplazme i organela u njoj. Konkretno, povećava se broj mitohondrija i lizosoma, što je bitno za punu izvedbu makrofaga svojih funkcija u fokusu. Povećava se aktivnost pinocitoze, povećava se broj fagolizosoma u citoplazmi, a povećava se broj filopodija. Monociti/makrofagi su također izvor inflamatornih medijatora (enzima, metabolita kisika, citokina), fagocitiziraju bakterije, ali su od primarnog značaja u fagocitozi ostataka mrtvih stanica, posebno neutrofila. Stoga je razumljiva zavisnost akumulacije monocita o prethodnom izlazu neutrofila. Tako se kod kunića sa neutropenijom monociti ne pojavljuju u žarištu upale u roku od 16 sati, dok se u prirodnim uslovima upale otkrivaju već nakon 4 sata, a unošenje u žarište
upala neutrofila kod leukopeničnih životinja vraća uobičajenu akumulaciju mononuklearnih stanica. Poznato je kemotaktičko djelovanje lizata neutrofila na monocite, dijelom zbog kationskih proteina njihovih lizosomalnih granula.
S druge strane, akumulacija neutrofila u velikoj mjeri ovisi o monocitima. To se posebno odnosi na onaj dio neutrofilne infiltracije koji je povezan sa povećanom hematopoezom, budući da je potonja inicirana monocitno-makrofagnim hematopoetskim faktorima, posebno IL-1, raznim vrstama tzv. priroda proteina odgovorna za proliferaciju i diferencijaciju u koštana srž hematopoetskih ćelija. Trenutno je izolovan veći broj hemotaktičkih peptida iz ljudskih monocita za neutrofile, koji mogu igrati ulogu u mehanizmu samoregulacije leukocitne reakcije žarišta upale. Međutim, pitanje mehanizama promjene staničnih faza u žarištu upale, prijelaza od razvoja upalne reakcije do njenog rješavanja, jedno je od najmanje proučavanih u problemu upale.
Ćelijski sastav eksudata u velikoj mjeri ovisi o prirodi i toku upalnog procesa, koji su pak determinirani uzročnikom upale i stanjem reaktivnosti organizma. Dakle, eksudat je posebno bogat neutrofilima ako je upalu uzrokovano piogenim mikrobima; kod alergijske upale žarište sadrži mnogo eozinofila. Hronične upalne procese karakterizira nizak sadržaj neutrofila, prevlast monocita i limfocita.
Imigrantski leukociti, zajedno s proliferirajućim stanicama lokalnog porijekla, formiraju inflamatorni infiltrat. Istovremeno, eksudat sa ćelijama sadržanim u njemu impregnira tkivo, raspoređujući se između elemenata upalnog područja i čineći ga napetim i gustim. Infiltrat zajedno s eksudatom uzrokuje oticanje i važan je u nastanku upalnog bola.
10.4.6. Procesi oporavka u upaljenom tkivu
pod inflamatornom proliferacijom(proliferate, od lat. proles- potomstvo ferre- stvoriti) razumjeti umnožavanje lokalnih ćelija
tačni elementi u žarištu upale. Proliferacija se razvija od samog početka upale uz pojave alteracije i eksudacije, ali postaje dominantna u kasnijoj fazi. procesni period, kako se eksudativno-infiltrativni fenomeni povlače. U početku je izraženiji na periferiji fokusa. Najvažniji uslov za progresiju proliferacije je efikasnost čišćenja žarišta upale od mikroorganizama ili drugih štetnih agenasa, produkata promjene tkiva, mrtvih leukocita (čišćenje rane). Vodeća uloga u tome je pripisana makrofagima - hematogenog (monociti) i tkivnog (histociti) porijekla.
čišćenje rana nastaje uglavnom ekstracelularnom degradacijom oštećenog tkiva i fagocitozom. Obavlja se pod regulatornim uticajem citokina uz pomoć enzima kao što su proteoglikanaza, kolagenaza, želatinaza. Aktivacija ovih enzima može se desiti pod uticajem aktivatora plazminogena koji se oslobađa uz učešće citokina iz mezenhimskih ćelija. Prostaglandini, koji se oslobađaju zajedno sa enzimima, mogu, sa svoje strane, inducirati proteinaze i doprinijeti procesima razgradnje.
Fagocitoza je otkrio i shvatio kao bitan element upale i prirodnog imuniteta I.I. Mečnikov 1882
I.I. Mečnikov je izdvojio 4 faze fagocitoze:
1) faza pristupa: izlazak leukocita iz posude i pristup objektu fagocitoze pod djelovanjem hematraktanata;
2) faza adhezije(kontakt);
3) faza ronjenja: omotavanje i uranjanje objekta unutar fagocita; formira se posebna vakuola u kojoj se akumuliraju lizozomi;
4) faza varenja,što može rezultirati sa 2 ishoda: a) adekvatno dozirano oslobađanje lizosomalnih enzima, uništavajući samo flogogen (sam fagocit ostaje netaknut); b) prekomjerno oslobađanje lizosomskih enzima, što dovodi do uništenja objekta fagocitoze i samog fagocita.
Fagociti u interakciji s bakterijama se aktiviraju, njihova membrana postaje "ljepljiva", jer se broj različitih receptora na njoj dramatično povećava, kao i "osjetna" pokretljivost citoplazme ovih stanica. Istovremeno, peroksizomi i granule se nakupljaju u citoplazmi, ispunjenoj
nye moćne proteaze. Kada takva ćelija naiđe na mikroorganizam, bakterija se "zalijepi" za površinu fagocita, omota se oko njegovih pseudopodija i završi unutar ćelije gdje se uništava. Makrofagi počinju da oslobađaju faktor tumorske nekroze (TNF), interferon γ (IFN-γ) i IL-8 u okolinu, koji ima posebnu ulogu u upali – izaziva pojavu receptora u endoteliocitima koji reaguju sa monocitima i neutrofilima sa visokim afiniteta, pa se ove ćelije zaustavljaju u kapilarama koje se nalaze u zoni upale. IL-8 je najefikasniji u stvaranju gradijenta za hemotaksu fagocitnih ćelija. Fagociti imaju receptore za IL-8, koji „osjete“ razliku u njegovoj koncentraciji sa strane okrenute izvoru i sa suprotne strane i usmjeravaju svoje kretanje duž ose maksimalne razlike. Tako se fagocitne stanice nakupljaju u žarištu upale, aktivno apsorbiraju i uništavaju (intracelularno) bakterije i stanične ostatke, te luče enzime koji uništavaju međućelijsku tvar vezivnog tkiva. Kod gnojenja koža koja prekriva okolnu upalu (apsces) postaje tanja i puca: flogogeni, fragmenti ćelija i nakupljeni fagociti se izbacuju iz tijela. Zahvaćeno područje tkiva se postepeno obnavlja. Uklanjanjem ostataka leukocita i uništenih tkiva, makrofagi eliminiraju najvažniji izvor vlastite kemotaktičke stimulacije i potiskuju dalji razvoj lokalna leukocitna reakcija. Kako se žarište upale čisti, broj makrofaga se smanjuje zbog smanjenja njihovog unosa iz krvi. Iz žarišta se oporavljajućim protokom limfe odnesu u regionalne limfne čvorove, gdje umiru. Limfociti dijelom umiru, dijelom se pretvaraju u plazma ćelije koje proizvode antitijela, a zatim se postupno eliminiraju.
Proliferacija se odvija uglavnom zbog mezenhimskih elemenata strome, kao i elemenata parenhima organa. Uključuje kambijalne, adventivne, endotelne ćelije. Kao rezultat diferencijacije matičnih ćelija vezivnog tkiva - poliblasta - epiteloidne ćelije, fibroblasti i fibrociti se pojavljuju u žarištu. Glavni ćelijski elementi odgovorni za reparativne procese u žarištu upale su fibroblasti. Oni proizvode glavnu međućelijsku tvar - glikozaminoglikane, a također sintetiziraju i luče vlaknaste strukture - kolagen,
elastin, retikulin. Zauzvrat, kolagen je glavna komponenta ožiljnog tkiva.
regulacija proliferacije. Proces proliferacije je pod složenom humoralnom kontrolom. Odlučujuče ovdje imati opet makrofagi. Oni su glavni izvor faktora rasta fibroblasta, termolabilnog proteina koji stimulira proliferaciju fibroblasta i sintezu kolagena. Makrofagi također povećavaju privlačenje fibroblasta na mjesto upale, lučeći IL-1 i fibronektin. Makrofagi stimulišu proliferaciju endotelnih i glatkih mišićnih ćelija vaskularnog zida, bazalne membrane i na taj način formiranje mikrožila. Inhibicija ili stimulacija sistema mononuklearni fagociti odnosno slabi ili pojačava razvoj granulacionog tkiva u žarištu gnojne upale.
Zauzvrat, makrofagi posreduju u regulatornom efektu na fibroblaste i proliferaciju T-limfocita. Potonje se aktiviraju proteinazama koje nastaju u žarištu upale kao rezultat razgradnje tkiva. Proteinaze mogu imati direktan učinak i na makrofage i na fibroblaste. Makrofagi i limfociti mogu oslobađati mono- i limfokine, koji ne samo da stimuliraju, već i inhibiraju fibroblaste, djelujući kao pravi regulatori njihovih funkcija.
Fibroblasti također ovise o faktoru rasta trombocita, koji je termostabilan protein s visokim sadržajem cisteina i molekulskom težinom od 30.000 D. Drugi faktori rasta fibroblasta se nazivaju somatotropin, somatomedini, insulinu slični peptidi, insulin, glukagon.
igraju važnu ulogu u proliferativnim pojavama. keylons- termolabilni glikoproteini sa molekulskom težinom od 40.000 D, sposobni da inhibiraju ćelijsku deobu inaktivacijom enzima uključenih u replikaciju DNK. Jedan od glavnih izvora šalona su segmentirani neutrofili. Kako se broj neutrofila smanjuje u žarištu upale, smanjuje se i sadržaj halona, što dovodi do ubrzanja diobe stanica. Prema drugim pretpostavkama, tokom upale segmentirani neutrofili praktički ne proizvode hajlone i intenzivno proizvode antikejloni(stimulansi diobe); shodno tome, ubrzava se dioba stanica, pojačava proliferacija.
Druge ćelije i medijatori mogu modulirati reparativni proces utječući na funkcije fibroblasta, makrofaga
gov i limfociti. Značajan značaj u regulaciji reparativnih pojava, prema D.N. Mayanskog, oni takođe imaju recipročne odnose u sistemu kolagen-kolagenaza, stromalno-parenhimske interakcije.
Proliferacija se zamjenjuje regeneracijom. Potonje nije uključeno u sam kompleks upalnih pojava, ali ih svakako prati i teško se od njih odvaja. Sastoji se od proliferacije vezivnog tkiva, neoplazme krvni sudovi, u manjoj mjeri - u reprodukciji specifičnih elemenata tkiva. Kod manjih oštećenja tkiva dolazi do relativno potpune regeneracije tkiva. Kada nastane defekt, prvo se ispuni granulacionim tkivom – mladim, bogatim krvnim sudovima, koje se naknadno zamenjuje vezivnim tkivom sa formiranjem ožiljka.
10.5. HRONIČNA UPALA
Postoje slučajevi kada se od samog početka u upalnim infiltratima ne nakupljaju polimorfonuklearni leukociti, već monociti, limfociti i njihovi derivati. Formiranje takve akumulacije mononuklearnih ćelija, tzv "granulom" je preduslov za dug tok upale. Hronična upala služi kao ilustracija validnosti izjave I.I. Mehnikov: "Upala je zaštitna reakcija u svojoj biološkoj suštini, ali, nažalost, za tijelo ne dostiže uvijek savršenstvo."
Za razliku od akutne upale hronična upala počinje ne sa poremećajima mikrocirkulacije i prethodno opisanim događajima u vaskularni krevet, ali od akumulacije kritičnog broja nadražen (aktiviran) makrofagi Na jednom mestu.
Trajna iritacija makrofaga može biti uzrokovana na različite načine.
Makrofagi apsorbiraju veliki broj mikroba, ali jednom u svojim fagosomima, oni ne umiru i dobijaju priliku da dugo opstanu i razmnožavaju se unutar ćelije (to su uzročnici tuberkuloze, lepre, listerioze, toksoplazmoze i mnogi drugi). Makrofagi koji sadrže mikrobe postaju aktivni i počinju lučiti medijatore upale.
Makrofagi mogu apsorbirati neinfektivne čestice koje stanica nije u stanju razgraditi ili baciti u okolinu (složeni polisaharidni kompleksi - koragenan morske alge, dekstran, zimosan iz pekarskog kvasca). Poslije intravenozno davanje kod miševa sa zymosan granulama, oni se preuzimaju od rezidentnih makrofaga (Kupfferove ćelije) jetre i intersticijalnih makrofaga pluća i aktiviraju ih. Nakon 2-3 dana, oko takvih makrofaga, kao oko epicentra, počinju da se nakupljaju monociti koji su ušli u krv i nastaje ono što se obično naziva granulom ili mononuklearni infiltrat. Privlačenje novih monocita/makrofaga u zonu lokalizacije aktiviranih makrofaga povezano je sa supstancama koje izazivaju hemotaksiju. Izlučuju ih aktivni makrofagi u gotovom obliku (LTC 4 , LTD 4 , PGE 2) ili u obliku prekursora: komponenti komplementa C2, C4, C5, C6, koje se pretvaraju u frakcije C3, C5a, C567 sa visokom hemotaktičkom aktivnošću. pod dejstvom proteaza, koje luče isti makrofagi.
Lizozomalni enzimi koje luče makrofagi, poput kolagenaze, razgrađuju kolagen. Proizvodi djelomične razgradnje kolagena imaju moćnu sposobnost da privlače svježe monocite na mjesto upale.
Aktivirani makrofagi luče biooksidanse koji pokreću peroksidaciju lipida u membranama drugih stanica u području infiltracije. Međutim, jednostavan povećani hemotaksini u nekom dijelu tkiva još ne bi značilo priliv novih inflamatornih efektorskih stanica iz krvi. Neophodno je da se, uz formiranje gradijenta ovih supstanci, povećanje propusnosti mikrožile, iz kojih bi mononuklearni leukociti mogli ući u područje lokalizacije iritiranih makrofaga. Aktivirani makrofagi povećavaju permeabilnost mikrosula, proizvodeći LTC 4 , LTD 4 , faktor agregacije trombocita, O 2 *- , kolagenazu i aktivator plazminogena, labaveći barijeru kapilarnog vezivnog tkiva. Oni ili dekomprimiraju kapilarnu bazalnu membranu, ili kontrahiraju endotelne stanice i izlažu interendotelne pukotine, ili djeluju na oba načina. Kao rezultat, olakšano je oslobađanje leukocita iz krvi i njihovo kretanje u to područje. visoka koncentracija hemotaksinima, gdje se vežu za druge ćelije u infiltratu. Monociti, došavši u infiltrat, luče
fibronektin. Zbog toga su čvrsto povezani sa matriksom vezivnog tkiva, prvenstveno sa kolagenim vlaknima. Čini se da su se "usidrili". U engleskoj literaturi takva imobilizacija ćelija je čak dobila i naziv "sidrenje"(sa engleskog. sidro- sidro). Ovo je veoma važna tačka, jer "u pokretu" fagociti "nemaju vremena da riješe probleme" koji se pojavljuju pred njima u žarištu upale.
Fagocitoza se najefikasnije odvija tek nakon što se monociti fiksiraju i rašire na strukturama vezivnog tkiva. Dakle, aktivni makrofagi ne samo da pokreću već i određuju cijeli proces kronične upale. Međutim, u realnim uslovima Makrofagi ne rade izolovano, već u kombinaciji sa drugim tipovima ćelija koje su deo inflamatornog infiltrata (granuloma) (sl. 10-16, vidi umetak u boji).
najbolje proučavan funkcionalna saradnja između makrofaga I limfociti:
1. Prije svega, ove ćelije stupaju u blisku interakciju u specifičnom imunološkom odgovoru koji se razvija tokom infektivne upale. Makrofagi gutaju i djelomično uništavaju mikrobne antigene u svojim fagolizosomima. U modificiranom obliku, ovi antigeni se ponovo pojavljuju na citoplazmatskoj membrani makrofaga, gdje ulaze u složen odnos sa specifičnim proteinima. Samo u ovoj kombinaciji antigen prepoznaju T-limfociti. Ova interakcija makrofaga i T-limfocita u žarištu kronične upale može se nazvati antigen ovisnom. Najvidljivije se manifestuje u onim oblicima hroničnih upala koje se javljaju tokom mikrobna kontaminacija i nastaviti sa fenomenom preosjetljivosti odgođenog tipa (DTH).
2. Uz to, makrofagi su povezani sa limfocitima ne samo preko antigena, već i kroz njihove tajne. Makrofagi luče tvari (na primjer, IL-1) koje pospješuju rast limfocita i povećavaju njihovu aktivnost.
3. Istovremeno, aktivno proliferirajući limfociti luče limfokine koji aktiviraju makrofage i naglo povećavaju njihove efektorske funkcije u žarištu kronične upale:
Faktor inhibicije migracije makrofaga povećava adhezivnost membrana makrofaga i omogućava im da se čvrsto fiksiraju
prianjati za podlogu. Isti faktor dezinhibira lučenje inflamatornih medijatora od strane makrofaga;
Faktor koji pospješuje agregaciju makrofaga, njihovu proliferaciju, fuziju makrofaga jedni s drugima uz formiranje gigantskih višenuklearnih stanica, tako karakterističnih za žarišta kronične upale. Posebno je mnogo takvih ćelija u tuberkuloznim infiltratima u plućima;
Načini izazivanja i razvoja akutne i kronične upale suštinski drugačije:
1. Kod akutne upale proces počinje „iz krvnih sudova“, dok kod hronične upale – sa teritorije vezivnog tkiva, gde se nalaze aktivni makrofagi.
2. Vodeća ćelija akutne upale - efektor - je neutrofil, a hronične upale - aktivni makrofag. Sve ostale mezenhimske ćelije (mastociti, limfociti, eozinofili) takođe doprinose sprovođenju procesa modulacijom reaktivnosti neutrofila i makrofaga.
3. Akutna upala prestaje brzo, za nekoliko dana, ako nema komplikacija u vidu gnojne šupljine (apscesa).
4. Hronična upala se ne može brzo završiti iz sljedećih razloga:
Prvo, makrofagi u žarištu upale imaju dugo životni ciklus, koji se računa u sedmicama, mjesecima, pa čak i godinama. U početku, u fazi nastanka, do granuloma dolaze svježi monociti s krvlju, limfociti - s krvlju i limfom. Oni još nemaju dovoljno visoku mikrobicidnu aktivnost. Zatim granulom postupno sazrijeva, a u njemu se nakupljaju diferencirani makrofagi koji aktivno apsorbiraju mikrobe. Konačno, u završnoj fazi, kod starog granuloma, broj aktivno fagocitnih ćelija se smanjuje, ali se procenat povećava u odnosu na
Inertan u smislu fagocitoze epiteloidnih i džinovskih višejezgarnih ćelija; drugo, bilo koji granulom nije "zamrznuta" formacija. Stalno ga prati mlaz sve više monocita s krvlju iz koštane srži. Ako u granulomu ima mnogo aktiviranih makrofaga, priliv će premašiti odliv ćelija iz granuloma. Činjenica je da nadraženi makrofagi intenzivno proizvode posebne hematopoetine. Stimuliraju stvaranje fagocita u koštanoj srži. Metcalfeov faktor stimulacije kolonija je jedan od njih. Dakle, dok nadraženi makrofagi "rade", ravnoteža će se pomjeriti prema ulivu ćelija u infiltrat, a njegova resorpcija je nemoguća. Ako makrofagi ispuštaju mnogo biooksidanata u svoju okolinu, oni ne samo da mogu sanirati žarište, već i oštetiti vlastite tjelesne stanice. Uz hiperprodukciju H 2 O 2 i O 2 * - ovi faktori mogu pobjeći iz fagosoma u citosol makrofaga i dovesti do njegove smrti. Kako bi se spriječila ovakva situacija, makrofagi imaju sistem hitne neutralizacije viška biooksidansa. Uključuje enzime: katalazu, glutation peroksidazu i glutation reduktazu. Konkretno, pod djelovanjem glutation reduktaze, vodikov peroksid se neutralizira u reakciji 2 HH + H 2 O 2 - G-G + 2H 2 O, gdje je G glutation. Enzim superoksid dismutaza neutralizira superoksidni anjonski radikal (O 2 *-) u reakciji O 2 *- + O 2 *- + 2H + - H 2 O 2 + O 2. Kada antioksidativni odbrambeni sistem zakaže, upala traje.
Hronična upala može se nastaviti do kraja života. Povremeno se pogoršava kada u fokus uđu neutrofili i svježi makrofagi s visokom proinflamatornom aktivnošću. U fokusu mononuklearne infiltracije je destrukcija vezivnog tkiva. Kao odgovor na to dolazi do rasta vlaknastih struktura. U konačnici, skleroza s djelomičnim ili potpuno gašenje specijalizirane tjelesne funkcije. To je olakšano nakupljanjem u granulomu posebna klasa makrofagi koji luče faktore stimulacije fibroblasta. Liječnici se moraju nositi s takvom situacijom s cirozom jetre nakon virusnog hepatitisa, hronična upala pluća, kronični glomerulonefritis i druge kronične upalne bolesti.
10.6. OPĆE MANIFESTACIJE ZAPALE
Opće manifestacije upale su posljedica utjecaja iz žarišta procesa, uglavnom medijatora upale.
Vrućica je rezultat djelovanja endogenih pirogena, posebno IL-1, koji oslobađaju aktivirani leukociti žarišta upale i periferne krvi, na centar termoregulacije.
Ubrzani metabolizam je posljedica pojačanog lučenja kataboličkih hormona, posebno pod utjecajem monokina, a može biti i sekundarno uz groznicu. Istovremeno, u krvi se bilježi povećan sadržaj glukoze, globulina i rezidualnog dušika.
povećanje ESR odražava apsolutnu ili relativnu prevagu globulina nad albuminom u plazmi, što nastaje zbog povećane proizvodnje “proteina akutne faze” od strane hepatocita pod utjecajem monokina ili uznapredovalog gubitka albumina tijekom eksudacije. Prevladavanje proteina velike disperzije u plazmi smanjuje negativni naboj eritrocita i, shodno tome, njihovo međusobno odbijanje. To povećava aglutinaciju eritrocita i, posljedično, njihovu sedimentaciju.
Promjene imunoloških svojstava organizmi, koji se manifestuju, posebno, povećanom otpornošću na ponovno izlaganje flogogenu, posebno infektivnom, nastaju zbog formiranja ćelijskog i humoralnog imuniteta tokom upale. U tome važnu ulogu imaju limfoidne stanice žarišta upale, na primjer B-limfociti, koji se pretvaraju u plazma stanice koje proizvode antitijela. Upala formira imunološku reaktivnost tijela („imunitet kroz bolest“).
Reakcije krvnog sistema kod upale uključuju emigraciju leukocita u žarište i niz promjena u hematopoetskom tkivu i perifernoj krvi:
1) početno prolazno smanjenje broja cirkulirajućih leukocita u krvi (prolazna leukopenija), zbog njihove margine i emigracije;
2) smanjenje broja zrelih i nezrelih granulocita i monocita u koštanoj srži kao rezultat njihovog pojačanog ispiranja u krv, što je omogućeno refleksnim i, eventualno, humoralnim ubrzanjem protoka krvi u koštanoj srži. Kada broj leukocita u krvi dolazi iz koštane srži
premašuje broj onih koji su emigrirali u žarište upale, razvija se leukocitoza;
3) naknadno obnavljanje broja nezrelih i zrelih granulocita i monocita u koštanoj srži, što ukazuje na aktivaciju hematopoeze;
4) povećanje (u odnosu na početno) ukupnog broja mijelokariocita i ćelija pojedinih hematopoetskih linija u koštanoj srži, što ukazuje na razvoj njene hiperplazije. Sve to osigurava razvoj i dugotrajno održavanje leukocitne infiltracije žarišta upale.
Aktivacija hematopoeze kod upale, nastaje zbog povećane proizvodnje hematopoetskih supstanci stimuliranim leukocitima žarišta upale i krvi - kolonijostimulirajući faktori, interleukini i dr., koji su početna karika u mehanizmu samoodržavanja infiltracije leukocita u žarište upale. U samoregulaciji infiltracije neophodni su lizozomalni enzimi, reaktivne vrste kisika i eikozanoidi.
Akutnu upalu karakterizira neutrofilna leukocitoza. sa pomakom ulijevo (povećanje broja mlađih, ubodnih i mladih neutrofila kao rezultat uključivanja rezerve koštane srži i aktivacije hematopoeze), kao i monocitoze, kod kronične upale - monocitna leukocitoza i limfocitoza.
U nastanku opštih pojava kod upale bitni su humoralni i refleksni uticaji iz žarišta. O tome svjedoči, na primjer, povećanje Goltzovog refleksa kod žabe (smanjenje otkucaja srca uz lagano tapkanje po trbuhu) uz upalu trbušnih organa.
10.7. ULOGA REAKTIVNOSTI U UPALU
Nastanak, razvoj, tok i ishod upale zavise od reaktivnosti organizma, koja je, pak, prvenstveno određena funkcionalnim stanjem viših regulatornih sistema – nervnog, endokrinog, imunološkog.
Uloga nervnog sistema. Učešće nervnog sistema u patogenezi upale postalo je očigledno zahvaljujući istraživanju I.I. Mečnikova o komparativnoj patologiji upale, koja je pokazala da što je tijelo složenije, to je njegov nervni sistem više diferenciran.
sistema, to je upalna reakcija svetlija i potpunije izražena. Potom je utvrđena suštinska uloga refleksnih mehanizama u nastanku i razvoju upale. Preliminarna anestezija tkiva na mjestu primjene flogogena odlaže i smanjuje upalni odgovor. Oštećenje i prekid aferentnog dela refleksnog luka tokom upale oslabljuju njegov dalji razvoj. Kao što je spomenuto, kratkotrajna ishemija i arterijska hiperemija u žarištu upale su refleksne prirode. O ulozi refleksnih reakcija svjedoče i podaci iz kliničkih opservacija da se upala može spontano razviti u simetričnim dijelovima tijela.
Na značaj viših delova centralnog nervnog sistema ukazuje zaostajanje u razvoju i slabljenje upale u pozadini anestezije ili tokom hibernacije. Poznata je mogućnost reprodukcije upale uvjetovanog refleksa i leukocitoze djelovanjem samo uvjetnog stimulusa (grebanje ili zagrijavanje kože abdomena) nakon razvoja uvjetnog refleksa korištenjem flogogena (intraperitonealna injekcija ubijenih stafilokoka) kao bezuvjetnog stimulusa. .
O ulozi donjih dijelova centralnog nervnog sistema svjedoče podaci o razvoju ekstenzivnih upalnih procesa u koži i sluzokožama u hroničnim oštećenjima talamičke regije. Vjeruje se da je to zbog kršenja nervnog trofizma tkiva, a time i smanjenja njihove otpornosti na štetne agense.
Autonomni nervni sistem ima značajan uticaj na razvoj upale. Na desimpatičnom uhu zeca upala se odvija brže, ali i brže završava. Naprotiv, iritacija simpatičkih nerava inhibira razvoj upale. Acetilholin izaziva vazodilataciju i potiče razvoj arterijske hiperemije, pojačava emigraciju. Norepinefrin izaziva kratkotrajnu ishemiju, inhibira rast vaskularne permeabilnosti i emigraciju. Dakle, parasimpatikus nervni sistem djeluje proupalno, a simpatično - protuupalno.
Uloga endokrinog sistema. U odnosu na upalu, hormoni se mogu podijeliti na pro- i protuupalne. Prvi uključuju somatotropin, mineralokortikoide, hormone štitnjače, inzulin, a drugi - kortikotropin, glukokortikoide, polne hormone.
Uloga imunog sistema. U imuniziranom organizmu, kao rezultat povećane otpornosti na štetni agens, upala se karakterizira smanjenim intenzitetom i brže završava. Kod smanjene imunološke reaktivnosti (imunološki nedostatak - nasljedne i stečene imunodeficijencije) uočava se troma, dugotrajna, često ponavljajuća i ponovljena upala. Uz povećanu imunološku reaktivnost (alergija), upala se odvija brže, uz prevladavanje alterativnih pojava, sve do nekroze.
Efektori nervnog, endokrinog i imunog sistema - neurotransmiteri, neuropeptidi, hormoni i limfokini - vrše kako direktno regulatorno dejstvo na tkivo, krvne sudove i krv, hemo- i limfopoezu, tako i posredovani drugim inflamatornim medijatorima čije oslobađanje moduliraju kroz specifične receptore staničnih membrana i mijenjaju koncentracije cikličkih nukleotida u stanicama.
U zavisnosti od reaktivnosti organizma, upala može biti normergična, hiperergična i hipergična.
Normergična upala- obično teče, upala u normalnom tijelu.
hiperergijska upala- brzo teče, upala u senzibiliziranom organizmu. Klasični primjeri su Artusov fenomen, Pirquetova reakcija, itd. Odlikuje se dominacijom fenomena alteracije.
hiperinflamacija- Blaga ili spora upala. Prvi se uočava s povećanom otpornošću na stimulus, na primjer u imuniziranom organizmu, a karakterizira ga smanjeni intenzitet i brži završetak. (pozitivna hipergija). Drugi - sa smanjenom općom i imunološkom reaktivnošću (imunodeficijencije, gladovanje, tumori, dijabetes itd.) i karakteriše ga slaba dinamika, dugotrajan tok, odložena eliminacija flogogena i tkiva oštećenog njime, povlačenje reakcije (negativna hipergija).
Značaj reaktivnosti u patogenezi upale omogućio je da se ona smatra kao opšta reakcija tijela za lokalna oštećenja.
10.8. VRSTE ZAPALE
Prema prirodi reakcije vaskularnog tkiva razlikuju se alterativna, eksudativno-infiltrativna i proliferativna upala.
Vrsta upale ovisi o reaktivnosti organizma, lokalizaciji procesa, vrsti, jačini i trajanju djelovanja flogogena.
Alterativno zapaljenje karakterizira posebna ozbiljnost fenomena distrofije (do nekrobioze i nekroze) i, stoga, njihova prevlast nad eksudativno-infiltrativnim i proliferativnim. Najčešće se alternativna upala razvija u parenhimskim organima i tkivima (miokard, jetra, bubrezi, skeletni mišići) tijekom infekcija i intoksikacija, pa se naziva i parenhimskom. Sa izraženim nekrobiotičkim promjenama, alternativna upala se naziva nekrotična, na primjer imunokompleksna alergijska upala (eksperimentalni Arthusov fenomen i Arthusove reakcije kod ljudi).
Eksudativno-infiltrativna upala karakteriziraju prevagu poremećaja cirkulacije s eksudacijom i emigracijom nad promjenom i proliferacijom. Ovisno o prirodi eksudata, može biti serozni, fibrinozni, gnojni, gnojni, hemoragični i mješoviti.
10.9. TOK UPALE
Tijek upale određen je reaktivnošću organizma, vrstom, jačinom i trajanjem djelovanja flogogena. Postoje akutne, subakutne i kronične upale.
Akutna upala karakteriše prilično izražen intenzitet i relativno kratko trajanje
hronična upala karakteriše nizak intenzitet i dugo trajanje - od nekoliko meseci do mnogo godina i decenija. Po prirodi reakcije vaskularnog tkiva najčešće je proliferativna. Vodeću ulogu u njegovoj patogenezi imaju monociti-makrofagi i limfociti. Hronična upala može biti primarna i sekundarna (zbog prelaska akutne upale u kroničnu). Razvoj primarne hronične upale prvenstveno je određen svojstvima flogogena (tuberkuloza, sifilis i dr.), sekundarne hronične upale determinisan je karakteristikama reaktivnosti organizma.
Ispod akutna upala zauzima srednju poziciju. Njegovo kliničko trajanje- Otprilike 3-6 sedmica.
Akutna upala može dobiti dugotrajan tok, tj. postaju subakutni ili sekundarno kronični. Možda valoviti tok kronične upale, kada se periodi spuštanja procesa smjenjuju s egzacerbacijama. Istovremeno, u periodu egzacerbacije, eksudativni fenomeni sa infiltracijom polimorfonuklearnim leukocitima, pa čak i alterativnim, intenziviraju se i postaju dominantni. U budućnosti, proliferativni fenomeni ponovo dolaze do izražaja.
Generalno, ne postoje fundamentalne razlike u općim mehanizmima akutne i produžene upale (upala je tipičan proces). Razlika je u tome što se tokom dugotrajnog procesa, zbog izmijenjene reaktivnosti tijela, narušava jedinstvo oštećenja i zaštite, a upalni proces poprima karakter negativno hipoergijskog, proliferativnog.
10.10. ISHODI UPALE
Ishod upale ovisi o njenoj vrsti i toku, lokalizaciji i prevalenci. Mogući su sljedeći ishodi upale:
1. Praktično potpuna obnova strukture i funkcije(vratiti se u normalu - restitutio ad integrum). Uočava se s manjim oštećenjima, kada se obnavljaju specifični elementi tkiva.
2. Formiranje ožiljaka(vraćanje u normalu sa nepotpunim oporavkom). Uočava se sa značajnim defektom na mjestu upale i njegovom zamjenom vezivnim tkivom. Ožiljak ne može uticati na funkcije ili dovesti do disfunkcije kao rezultat: a) deformacije organa ili tkiva (na primjer, cicatricijalne promjene na srčanim zaliscima); b) pomicanje organa (npr. pluća kao rezultat stvaranja adhezija u grudnu šupljinu u ishodu pleuritisa).
3. Smrt organa i cijeli organizam - sa nekrotičnom upalom.
4. Smrt organizma s određenom lokalizacijom upale - na primjer, od gušenja zbog stvaranja filmova difterije na sluznici larinksa. Prijeteća je lokalizacija upale u vitalnim organima.
5. Razvoj komplikacija upalni proces: a) protok eksudata u tjelesnu šupljinu s razvojem, na primjer, peritonitisa kod upalnih procesa u trbušnim organima; b) stvaranje gnoja sa razvojem apscesa, flegmona, empijema, pijemije; c) skleroza ili ciroza organa kao rezultat difuzne proliferacije vezivnog tkiva tokom proliferativne inflamacije.
6. Prijelaz akutne upale u kroničnu.
U kliničkom ishodu upale veliki značaj ima osnovnu bolest ako je s njom povezana pojava žarišta (žarišta) upale.
10.11. ZNAČAJ UPALE ZA ORGANIZAM
U opštem biološkom smislu upala je bitan zaštitna i adaptivna reakcija, nastala u procesu evolucije kao način očuvanja cijelog organizma po cijenu oštećenja njegovog dijela. Riječ je o metodi hitne zaštite tijela, koja se koristi u slučaju kada tijelo nije moglo da se nosi sa štetnim agensom kroz njegovo fiziološko eliminisanje i kada je došlo do oštećenja. Upala je svojevrsna biološka i mehanička barijera, uz pomoć koje se osigurava lokalizacija i eliminacija flogogena i (ili) njime oštećenog tkiva i njegova obnova ili kompenzacija defekta tkiva. Postižu se svojstva biološke barijere
adhezijom, ubijanjem i lizom bakterija, degradacijom oštećenog tkiva. Funkcija mehaničke barijere ostvaruje se zbog gubitka fibrina, koagulacije limfe u žarištu, blokade krvnih i limfnih žila, reprodukcije ćelija vezivnog tkiva na granici oštećenog i normalnog tkiva (demarkacija). Sve to sprječava apsorpciju i širenje mikroba, toksina, produkata poremećenog metabolizma i propadanja.
Upalni žarište obavlja ne samo barijeru, već i drenažnu funkciju: s eksudatom iz krvi, proizvodi poremećenog metabolizma, toksini ulaze u fokus. Kao što je već spomenuto, upala utiče na formiranje imuniteta.
Istovremeno, svrsishodnost upale kao zaštitne i adaptivne reakcije bezuvjetna je samo u evolutivno-biološkom smislu. I kao lokalni proces sa određenom lokalizacijom i rasprostranjenošću upala može biti praćena općim patološkim manifestacijama(opijanje, promjene u reaktivnosti i sl.) pa čak i uobičajenim tokom štetiti organizmu. Osim toga, u vezi sa izmijenjenom reaktivnošću, u praksi se često susreću neobični oblici i komplikacije upale.
Fagocitoza.
Fagocitoza – sastoji se u apsorpciji i varenju bakterija, produkata oštećenja i propadanja ćelija. Fagocitnu aktivnost pokazuju prvenstveno neutrofilni leukociti i makrofagi. Postoje 4 faze fagocitoze: 1. faza je približavanje fagocita stranom objektu, 2. faza je adhezija fagocita na objekt. Prethodi joj oblaganje fagocita imunoglobulinima M i J i fragmentima komplementa (opsonizacija). 3. faza - apsorpcija objekta invaginacijom fagocita i stvaranjem vakuole - fagosoma. Prije formiranja fagosoma, u fagocitu se aktivira oksidaza, koja osigurava sintezu vodikovog peroksida. Vodikov peroksid pod utjecajem peroksidaza stvara aktivne molekule kisika, koji peroksidacijom uništavaju stanične membrane. Uništavanje membrana također olakšavaju lizozomalni enzimi i baktericidni proteini koji se oslobađaju tokom degranulacije leukocita. To se događa u 4. fazi - unutarćelijsko cijepanje i probava fagocitiranih mikroba i ostataka oštećenih stanica. U tom slučaju sami fagociti umiru. Proizvodi njihovog uništenja stimuliraju procese proliferacije.
Proliferacija.
Elementi proliferacije se javljaju od samog početka upale, ali ona postaje dominantna kako se eksudacija smiri. U fazi proliferacije, destruktivni procesi postupno prestaju i zamjenjuju ih kreativni. Aktivno se otplaćuje upalni proces. U tom pogledu, protein α2-makroglobulin igra aktivnu ulogu. Ima širok spektar djelovanja, posebno inhibira kinine. U inaktivaciji inflamatornih ćelija, pored lokalnih faktora, veliki značaj imaju i opšti faktori, poput endokrinih. Kortizol inhibira sintezu vazoaktivnih supstanci, uzrokuje eozinofilopeniju, limfopeniju i bazofilopeniju. Tada se defekt zamjenjuje zdravim tkivom. To se radi umnožavanjem preostalih živih ćelija (rezidentne ćelije), kao i novih ćelija iz susjednih zona (emigrantske ćelije). Matične ćelije vaskularnog tkiva - poliblasti i limfoidne ćelije se razmnožavaju, pojavljuju se nove kapilare. Formira se granulaciono tkivo. Stimulatori rasta su: faktor rasta trombocitnih fibroblasta (trombociti); slični faktori se formiraju u limfocitima i monocitima. U nekim organima nastaju tvari koje stimuliraju proliferaciju. Na primjer, u hipofizi faktor rasta fibroblasta, u jetri somatomedin, koji također stimulira proliferaciju. Postoje i inhibitori proliferacije - kaloni, hormon kortizon.
Na kraju upale, kada je završena, dvije ćelije, fibroblast i endoteliocit, igraju odlučujuću ulogu. Dolazi do naseljavanja zone upale fibroblastima i neoangiogeneze. Fibroblasti sintetiziraju kolagen. Endoteliociti doprinose stvaranju krvnih sudova.
Sa blagim oštećenjem tkiva, sa ranama koje zarastaju primarnom namjerom, upalni proces se završava potpunim oporavkom. Kada veliki broj ćelija umre, defekt se zamenjuje vezivnim tkivom uz formiranje ožiljka. Može doći do stvaranja viška ožiljnog tkiva.
Patogeneza kliničkih znakova upala.
Crvenilo je posljedica razvoja arterijske hiperemije, povećanja protoka krvi s visokog sadržaja kiseonik, povećanje broja funkcionalnih kapilara.
"Otok" se objašnjava arterijskom i venskom hiperemijom, eksudacijom i migracijom leukocita.
Groznica je uzrokovana pojačanim metabolizmom u ranim fazama upale, protokom krvi sa višom temperaturom, prekidom procesa biološke oksidacije i fosforilacije.
Groznica se razvija pod uticajem pirogenih faktora koji dolaze iz žarišta upale, kao što su lipopolisaharidi, katjonski proteini, interleukin-1 itd.
Bol je uzrokovana iritacijom receptora u žarištu upale medijatorima, posebno serotoninom, kininima, prostaglandinima, pomjeranjem reakcije okoline na kiselu stranu, pojavom dizionije, povećanjem osmotskog tlaka, te mehaničkim istezanjem ili kompresija tkiva.
Poremećaj funkcije upaljenog organa povezan je s poremećajem njegove neuroendokrine regulacije, razvojem boli i strukturnim poremećajima.
Leukocitoza je posljedica aktivacije leukopoeze i preraspodjele leukocita u krvotoku. Među glavnim razlozima njegovog razvoja su: stimulacija simpatičko-nadbubrežnog sistema, izloženost određenim bakterijskim toksinima, produktima raspadanja tkiva, kao i nizu inflamatornih medijatora (interleukin-1).
Promjena proteinskog "profila" krvi izražava se u činjenici da kada akutni proces u krvi se akumuliraju takozvani "proteini akutne faze" upale - C-reaktivni protein itd. Za hronični tok upale karakterističan je porast sadržaja alfa i posebno gama globulina u krvi.
Do povećanja ESR dolazi zbog smanjenja negativnog naboja eritrocita, aglomeracije eritrocita, promjena u proteinskom spektru krvi, posebno povećanja sadržaja fibrinogena i porasta temperature.
Imunitet i upale.
Promjene u imunološkom sistemu tokom upale izražavaju se povećanjem titra antitijela, pojavom senzibiliziranih limfocita u krvi. U razvoju imuniteta tokom upale, potrebno je obratiti pažnju na nespecifične faktore kao što su fagocitoza i komplement. Mjesto fagocitoze koju sprovode PNL i monocitni fagocit (makrofag) u imunološkom sistemu određeno je činjenicom da uprkos nespecifičnosti samog čina fagocitoze, makrofagi učestvuju u njihovoj preradi u imunogeni oblik. Sistem komplementa je uključen u specifične reakcije, vezujući svoje komponente za molekule antitijela, čime se osigurava liza antigenskih supstanci protiv kojih su se razvila antitijela, aktivira imunološke komplekse. Dakle, aktivaciju imunološkog odgovora tokom upale osiguravaju dva ćelijskih sistema nespecifična zaštita - sistemom PMN i makrofaga, kao i plazme. sistem - sistem komplementa.
Odnos između lokalnog i opšte promene sa upalom.
U žarištu upale nastaju složeni procesi koji se ne mogu odvijati autonomno. Oni su signal da se uključe u inflamatorni odgovor. razni sistemi organizam. Materijalni supstrat ovih signala je akumulacija i cirkulacija u krvi biološki aktivnih supstanci, komponenata, interferona i dr. Od faktora koji određuju odnos lokalnih i opštih promena tokom upale, reaktanti akutne faze su tzv. od velikog značaja. Ove supstance nisu specifične za upalu. Pojavljuju se 4-6 sati nakon raznih ozljeda, uključujući i oštećenja tijekom upale. Najvažniji od njih su: C-reaktivni protein, interleukin-1, T-kininogen, transferin, apoferitin itd. Većinu reaktanata akutne faze sintetiziraju makrofagi, hepatociti. Interleukin-1 utječe na funkciju stanica žarišta upale, uključujući limfocite, aktivira PNL, stimulira sintezu prostaglandina i prostaciklina u endoteliocitima i potiče hemostatsku reakciju u leziji. Koncentracija C-reaktivnog proteina se tokom upale povećava 100-1000 puta. Ovaj protein aktivira citolitičku aktivnost T-limfocita ubojica i inhibira agregaciju trombocita.
T-kininogen je prekursor kinina i inhibitor proteinaze. Upala izaziva sintezu apoferitina u jetri, koji stimulira proizvodnju PNL. Reaktanti akutne faze određuju nespecifičan odgovor tijela, stvarajući uvjete za razvoj lokalne upalne reakcije. Istovremeno, stimulišu uključivanje drugih tjelesnih sistema u proces, doprinoseći interakciji lokalnog i opšteg tokom upale.
Veličina, prevalencija žarišta upale, kao i karakteristike oštećujućeg agensa imaju izražen uticaj na odnos između lokalnih i opštih promena upale. Polazeći od neke kritične veličine ovog žarišta, razvoj upale je u kombinaciji s nizom poremećaja homeostaze uzrokovanih kako produktima oštećenja tkiva i medijatorima, tako i stresom (bolnim, emocionalnim).
Upala i reaktivnost organizma.
Pojava, razvoj, tok i ishod upale zavise od reaktivnosti organizma. Reaktivnost zavisi prvenstveno od stanja viših regulatornih sistema: nervnog, endokrinog, imunološkog.
Upotreba anestetičkih supstanci koje mogu isključiti receptorske formacije značajno slabi tok upalnog procesa. Stvaranje stabilnog fokusa ekscitacije u centralnom nervnom sistemu naglo slabi tok i intenzitet upale. Duboka anestezija značajno slabi stvaranje infiltrata. Značajan uticaj na razvoj upale ima endokrini sistem. U odnosu na upalu, hormoni se mogu podijeliti na pro- i protuupalne. Prvi uključuju somatotropin, mineralokortikoide, hormone štitnjače, inzulin, a drugi - kortikotropin, glukokortikoide. Protuupalni hormoni: 1. Smanjuju vaskularnu permeabilnost. 2. Stabilizirati lizozomske membrane. 3. Pojačati djelovanje kateholamina. 4. Oslabiti sintezu i
djelovanje biološki aktivnih supstanci (histamin, serotonin). 5. Smanjiti emigraciju
leukociti, slabe fagocitozu.
Razvoj upale značajno ovisi o dobi. Kod novorođenčadi eksudativna komponenta upale gotovo da nije izražena, jer su vaskularne reakcije nesavršene. Nesavršeni su jer periferni nervni završeci simpatičkog i vagusnog živca i njihovi centri nisu dovoljno formirani. Simpatički nervni sistem zadržava dominantan uticaj na vaskularni tonus nakon rođenja, što dovodi do vazospazma. Upala u neonatalnom periodu poprima alternativni karakter. Proliferativna komponenta upale je odgođena. Najčešće u ovoj dobi dolazi do upale kože, jer je epidermalni sloj vrlo slabo razvijen.
Koža i sluzokože djece djetinjstvo nije u stanju da pruži antimikrobnu zaštitu. Fagocitna aktivnost leukocita je vrlo niska. Štaviše, fagociti su u stanju da apsorbuju mikrobe, ali ih ne mogu lizirati, jer. aktivnost hidrolitičkih enzima je niska (fagocitoza nije završena). Fagozomi takvih leukocita pretvaraju se u "skladišta" živih mikroba, uzrokujući generalizaciju infekcije.
Kod djece, počevši od 5 mjeseci, često se javljaju zapaljenja tankog i debelog crijeva (enteritis, kolitis).
U starijoj dobi češće se javljaju upalni procesi gastrointestinalnog trakta, jer. smanjuje se kiselost želudačnog soka, što je zaštitni faktor kada bakterije uđu u želudac. Kao rezultat inhibicije aktivnosti cilija epitela respiratornog traktačesto se javlja upala pluća.
Vrste upala.
U zavisnosti od prirode dominantnog lokalnog procesa (alteracija, eksudacija, proliferacija), razlikuju se 3 tipa upale. U alternativnoj upali prevladavaju oštećenja, distrofija i nekroza. Uočava se najčešće u parenhimskim organima kod infektivnih bolesti koje se javljaju uz jaku intoksikaciju (sirasto propadanje pluća kod tuberkuloze).
Eksudativnu upalu karakteriziraju teški poremećaji cirkulacije sa simptomima eksudacije i emigracije leukocita.
druže Po prirodi eksudata razlikuju se serozne, gnojne, hemoragične, fibrinozne, gnojne, mješovite upale.
Proliferativnu ili produktivnu upalu karakteriše činjenica da dominira reprodukcija ćelija hematogenog i histiogenog porekla. Na upaljenom području pojavljuju se ćelijski infiltrati. Tokom upale, ćelije prolaze kroz transformaciju i diferencijaciju, što rezultira stvaranjem mladog vezivnog tkiva. Prolazi sve faze sazrijevanja, uslijed čega u organ ili njegov dio prodiru niti vezivnog tkiva.
Prema prirodi toka, upala može biti akutna, subakutna i kronična. Akutna upala traje od nekoliko dana do nekoliko sedmica. Karakterizira ga: izražen intenzitet upalne reakcije i dominacija alternativnih ili vaskularno-eksudativnih fenomena. Ulogu glavnih efektora u njegovoj patogenezi igra PNL. Hronična upala je spor, dugotrajan proces. Dominiraju distrofični i proliferativni fenomeni. Glavnu ulogu u kroničnoj upali imaju makrofagi i limfociti. Subakutna upala zauzima srednji položaj.
ishodi upale.
1. Potpuna restauracija oštećenog organa. To se događa ako ni djelovanje flogogenog faktora ni razvoj upalnog procesa ne dovode do odumiranja značajne količine tkiva. 2. Ako se kao rezultat djelovanja flogogenog faktora ili kao posljedica sekundarne alteracije izgubi značajna količina tkiva, tada se defekt tkiva otklanja stvaranjem ožiljka ili difuznim klijanjem vezivnog tkiva. Prisutnost ožiljka ponekad ne uzrokuje značajno kršenje funkcije organa, ali u nekim slučajevima može dovesti do ozbiljnih posljedica. Na primjer, ožiljci na zidu jednjaka (nakon spaljivanja) mogu uzrokovati suženje jednjaka, što će otežati hranjenje tijela. 3. Upala može biti štetna za tijelo. To je zbog činjenice da u slučaju ekstenzivne promjene tkivo vitalnog organa može odumrijeti, ili kao rezultat eksudacije, organi kao npr.
mozak, srce, pluća, koji tako mogu poremetiti njihovu funkciju,
da će to postati nespojivo sa životom.
Hronična upala (Ado 1994, str. 171-173).
Hronična upala počinje nakupljanjem velikog broja
la iritiranih (aktiviranih) makrofaga na jednom mjestu. Perzistentna iritacija makrofaga je uzrokovana na različite načine: 1. Defekt makrofaga. U ovom slučaju, makrofagi apsorbuju strani faktor, ali ga ne mogu uništiti. Postoji nepotpuna fagocitoza. Stoga su makrofagi stalno u aktivnom stanju. 2. Makrofagi apsorbuju veliki broj mikroorganizama, ali zbog svojih karakteristika ne umiru u fagosomima i dobijaju priliku da žive i razmnožavaju se dugo vremena. Ovi oblici uključuju uzročnike tuberkuloze, lepre, toksoplazmoze i mnogih drugih zaraznih bolesti. 3. Makrofagi ne mogu apsorbirati strani agens. Oni ga okružuju, pobuđuju se i počinju da privlače nove makrofage, formirajući granulaciono tkivo.
Privlačenje novih makrofaga, monocita, limfocita u zonu lokalizacije aktiviranih makrofaga povezano je sa supstancama koje izazivaju pozitivnu kemotaksiju. Ove supstance luče sami iritirani makrofagi. To uključuje leukotriene C i D, prostaglandine E2 grupe. Priliv makrofaga u žarište upale je olakšan povećanjem vaskularne permeabilnosti. Leukotrieni, FAT, kolagenaza povećavaju propusnost mikrožilnih sudova. Ove supstance ili labave bazalnu membranu kapilara ili kontrahuju endotelne ćelije i proširuju interendotelne praznine. Tako se u žarištu kronične upale nakupljaju mononuklearne ćelije- monociti, makrofagi, limfociti. Nakupljanje takvih ćelija naziva se "granulom".
Aktivirani makrofagi luče biooksidanse koji pokreću lipidnu peroksidaciju u ćelijskim membranama zone infiltracije. Makrofagi također luče lizozomalne enzime. Monociti luče svoje biološki aktivne supstance, posebno fibronektin. Zahvaljujući fibronektinu, monociti su čvrsto vezani za granulom i imobilizirani.
Limfociti luče različite limfokine, uključujući i one koji aktiviraju makrofage i naglo povećavaju njihov efektor
funkcionira u žarištu kronične upale. Makrofagi, zauzvrat, luče interleukin-1, koji pospješuje rast limfocita i povećava njihovu aktivnost.
Dakle, kronična upala značajno se razlikuje od akutne upale. Akutna upala počinje promjenom i poremećenom mikrocirkulacijom, kronična aktivacijom makrofaga. Vodeća stanica akutne upale je neutrofil, kronična - aktivni makrofag. Akutna upala brzo prestaje, kronična upala teče dugo, ponekad i cijeli život. Hronična upala teče dugo jer makrofagi u žarištu upale imaju dug životni ciklus. Potrebno im je dosta vremena da pređu u iritirano stanje, osim toga u granulom stalno ulaze nove stanice koje također polako prelaze u aktivno stanje. Egzacerbacija kod kronične upale je povezana s prilivom svježih makrofaga s visokom proinflamatornom aktivnošću u žarište upale. Kronična upala često završava sklerozom s djelomičnim ili potpunim gašenjem funkcija organa.
Biološki značaj upale.
Kao i svaki patološki proces, upala je inherentno kontradiktoran proces. Kombinira i mobilizaciju obrambenih snaga tijela i fenomen oštećenja. Tijelo je zaštićeno od djelovanja stranih i štetnih faktora razgraničavanjem žarišta upale od cijelog organizma. Ova akcija sprečava širenje i generalizaciju upalnog procesa, fokusirajući borbu protiv štetnog agensa na jednom mestu. Žarište upale hvata sve što se nalazi u njemu, apsorbira otrovne tvari koje kruže krvlju. To se objašnjava činjenicom da se oko fokusa formira svojevrsna barijera s jednostranom propusnošću. U početku nastaje zbog blokade izlaznih žila i zbog blokade transporta ekstravaskularnog tkiva. Nadalje, ova barijera se konačno formira zbog veličine. ćelije vezivnog tkiva između normalnog i bolesnog tkiva. U žarištu upale stvaraju se nepovoljni uslovi za život mikroorganizama. U tom smislu, glavnu ulogu igraju fagociti i specifična antitijela, enzimi. Pozitivna strana upala se posebno ispoljava u fazi proliferacije i regeneracije. Upala je jedan od načina na koji se formira imunitet. Druga suprotna strana upale uvijek nosi elemente destrukcije. Borba protiv štetnog agensa u zoni upale neizbežno je kombinovana sa odumiranjem sopstvenih ćelija. U nekim slučajevima počinje da prevladava promjena, što dovodi do odumiranja tkiva ili organa. Eksudacija može dovesti do pothranjenosti tkiva, njegovog enzimskog topljenja, hipoksije i opće intoksikacije. Resorpcija iz žarišta upale različitih toksina. supstance izazivaju intoksikaciju. Prijenos fagocitiranih bakterija leukocitima tijekom nepotpune fagocitoze može uzrokovati razvoj žarišta upale u drugim dijelovima tijela.
Principi patogenetske terapije upale:
I. Utjecaj na štetni faktor kako bi se spriječila ili zaustavila primarna alteracija (antibiotici, imuni odgovori)
kragne itd.)
II Proinflamatorna terapija.
1. Lokalno stimulativno dejstvo na žarište upale (vruće kupke, jastučići za grejanje itd.)
2. Opšte dejstvo na organizam (vakcinoterapija, laktoterapija, autohemoterapija).
III. Protuupalna terapija:
1. Upotreba lijekova koji sprječavaju stvaranje i oslobađanje medijatora permeabilnosti:
a) blokada oslobađanja lizosomskih enzima, stabilizacija lizosomskih membrana.
b) Suzbijanje glikolize kao izvora energije za oslobađanje faktora permeabilnosti.
2. Upotreba antagonista i inhibitora biološki aktivnih supstanci.
a) inhibitori kinina.
b) Inhibitori prostaglandina.
c) Antiproteazni lijekovi.
3. Lokalna primjena vazokonstriktornih lijekova.
4. Lokalni uticaji na mnogim karikama upalnog procesa (prehlada).
5. Opšti uticaj na organizam (racionalna ishrana, zdravog načina životaživot).
Šta je upala?
 Svaki živi organizam opremljen je sistemom zaštite od raznih nedaća. U stvari, čak i suza je takođe zaštitna reakcija organizma na strano tijelo, uključujući "duhovne" suze. Sve ovo, naravno, nije kuriozitet, a svi znaju za zaštitne funkcije tijela. I postoji takav zaštitna funkcija, kao upala, koja se najčešće odnosi na uzroke bolesti. Ovo tumačenje nije sasvim ispravno, jer upala ne nastaje tek tako, već iz nekog razloga.
Svaki živi organizam opremljen je sistemom zaštite od raznih nedaća. U stvari, čak i suza je takođe zaštitna reakcija organizma na strano tijelo, uključujući "duhovne" suze. Sve ovo, naravno, nije kuriozitet, a svi znaju za zaštitne funkcije tijela. I postoji takav zaštitna funkcija, kao upala, koja se najčešće odnosi na uzroke bolesti. Ovo tumačenje nije sasvim ispravno, jer upala ne nastaje tek tako, već iz nekog razloga. Dakle, upala je reakcija tijela na oštećenje stanica, tkiva, kostiju, a također je reakcija na kvar u bilo kojem organu. Prvi znak upalnog procesa u tijelu je povećanje tjelesne temperature. Naravno, toplota može nastati i zbog povećanja šećera u krvi, stoga je, da bi dijagnoza bila preciznija, potrebno proći opšta analiza krv, koja će pokazati čak i minimalni upalni proces.
Svaka upala je fiziološka reakcija koja bi vas trebala isprovocirati na hitnu akciju. Glavni uzroci upale su sljedeći:
Fizički - nastaju kao posljedica ozljeda, radioaktivnog zračenja, strujnog udara, termičkog oštećenja.
. Hemijski - opekotine kiselinama i alkalijama, mineralnim i organskim materijama.
. biološki - virusne bolesti, bakterije, gljivice i slične lezije kože i sluzokože.
Po prvi put, opisi upalnih procesa otkriveni su u antičko doba. Jedan od prvih koji je opisao vanjske znakove upale bio je starorimski pisac Aulus Cornelius. Njegova lista simptoma upale izgledala je ovako: rubor (crvenilo), tumor (otok, otok), calor (groznica, temperatura), dolor (bol). Kasnije je ovaj popis Claudius Galen dopunio znakom kao kršenje funkcija - functio laesa. Ovaj zapis datira iz 130. - 200. godine nove ere.
Medicinska interpretacija upalnog procesa izgleda ovako: crvenilo, otok, groznica, bol, kvarovi u radu nekih organa, gubitak snage. Svaki od ovih simptoma je povezan. Zahvaćeno područje izaziva vazodilataciju, što rezultira povećanom opskrbom krvlju. Nakon toga se protok krvi usporava i javlja se crvenilo, temperatura raste. Nadalje, dolazi do propusnosti krvnih žila i kapilara, što dovodi do oslobađanja leukocita iz krvne plazme u područje oštećenja - lokalni edem, koji vrši pritisak na živčane stanice i uzrokuje bol. Dakle, dolazi do kršenja funkcija u tijelu. I to postaje dobra odskočna daska za stvaranje slobodnih radikala.
Upala se također razlikuje po vrstama i oblicima. Upala može biti akutna, subakutna i kronična. Razlika između njih je brzina razvoja i trajanje procesa. Dakle, prvi traje do 2 mjeseca, drugi - do 6 mjeseci, posljednji - traje više od šest mjeseci. Svaki upalni proces prolazi kroz nekoliko faza. Naime: alteracija - povreda ćelija, tkiva. Eksudacija - oslobađanje krvnih zrnaca i tekućine iz krvnih žila u tkiva. Proliferacija - umnožavanje ćelija, što uzrokuje proliferaciju tkiva i naknadno stvaranje ožiljaka.
Na osnovu toga postoje takve vrste upala:
. Alternativa - upala, koju karakteriziraju distrofične i nekrotične promjene u stanicama i tkivima u organima kao što su srce, jetra, bubrezi i moždano tkivo. U ovom slučaju, proces eksudacije i proliferacije je slab. Na taj način dolazi do upale kod dizenterije, trbušnog tifusa i drugih sličnih bolesti.  . Eksudativna upala je upala u kojoj reakcije mikrovaskularnih žila sa stvaranjem eksudata dominiraju nad alternativnim i proliferativnim komponentama. Eksudat je bjelkasta tekućina, koja se sastoji od proteina i ćelija hematogene i histogene prirode. Nastaje na mjestu upale. S tim u vezi, ova tekućina može sadržavati bakterije koje izazivaju infekcija. Stoga smatram eksudativnu tečnost biološki materijal za laboratorijska istraživanja. Proces eksudacije - prodiranje tekućine u tkiva organa, fiziološki je i obavlja zaštitne funkcije.
. Eksudativna upala je upala u kojoj reakcije mikrovaskularnih žila sa stvaranjem eksudata dominiraju nad alternativnim i proliferativnim komponentama. Eksudat je bjelkasta tekućina, koja se sastoji od proteina i ćelija hematogene i histogene prirode. Nastaje na mjestu upale. S tim u vezi, ova tekućina može sadržavati bakterije koje izazivaju infekcija. Stoga smatram eksudativnu tečnost biološki materijal za laboratorijska istraživanja. Proces eksudacije - prodiranje tekućine u tkiva organa, fiziološki je i obavlja zaštitne funkcije.
. Proliferacija je konačna, koja se sastoji u stvaranju novih ćelija i obnavljanju tkiva. U procesu proliferacije nastaje nekoliko vrsta ćelija - kombinovane ćelije vezivnog tkiva, B i T-limfociti, monociti i ćelije lokalnog tkiva, gde je došlo do lezije i izvora upale. Sve to dovodi do stvaranja makrofaga, koji su izvori "rađanja" epitela. U procesu oporavka kože nakon upalnog procesa mogu nastati nepravilnosti, hrapavost, značajni ožiljci. Razlog za ovaj završetak može biti rast fibroznog tkiva. Preduvjet za to su fibroblasti - stanice koje proizvode kolagen u višku. Proliferativna upala dijeli se na sljedeće vrste: granulomatozna, intersticijalna i inflamacija pri kojoj nastaju polipi i genitalne bradavice.
Svaka upala se može kontrolisati. Najčešći načini "ukroćenja" upale su hormonski, imunološki i nervni faktori. Među hormonima postoje oni koji pojačavaju upalu, a postoje i oni koji je gase. Pojačivači upale uključuju mineralokortikoide, hipofizni tireostimulin, aldosteron, hipofizni hormon rasta. "Inhibitori" uključuju glukokortikoide i adrenokortikotropni hormon hipofize. Terapeutska svojstva ovih hormona dugo su uspješno obnavljala različite upale. Uz njihovu pomoć blokiraju se vaskularni i stanični fenomeni upale. Oni su inhibitori procesa pokretljivosti leukocita, pospješuju stvaranje limfocita.
U pitanju različitih upalnih procesa, imunitet igra veliku ulogu. Koliko je jak zavisi od trajanja upalnog procesa, kao i od pojave komplikacija povezanih sa upalom. Najjače, upala se javlja u stanju antigenske stimulacije. To ukazuje na imunološku ili alergijsku upalu.
Bez obzira koliko dugo i u kojem obliku se upala javlja, potrebna je obavezna dijagnoza i prognoza. I što se prije postavi ispravna dijagnoza, to će liječenje biti efikasnije. Na primjer, akutna upala nastaje kako bi se neutralizirao agens koji je izazvao upalni odgovor.
Popravak oštećenog tkiva odvija se na nekoliko različitih načina. Ako akutna upala nema komplikacija, tada se oštećeno tkivo obnavlja ukapljivanjem i uklanjanjem eksudata i staničnih ostataka uz pomoć makrofaga i limfnog sistema. Ako je upala praćena nekrozom tkiva, tada dolazi do sanacije oštećenja stvaranjem ožiljka. U slučajevima kada imunološki sistem ne neutrališe akutnu upalu, dolazi do hronične upale. U ovom slučaju, restauracija se najčešće završava ožiljkom tkiva.
Moderna medicina liječi upale na dva načina. S jedne strane, ovo je fiziološka reakcija koja ukazuje na kvarove i kvarove u tijelu, ili signalizira prisutnost lokalne ozljede. Na osnovu toga, upalni proces pomaže u neutralizaciji daljnjeg razvoja infekcije. S druge strane, upala je bolest koja remeti funkcionisanje cijelog organizma, tjera ga da radi u hitnom režimu. Uz slab imunitet, lagana upala može izazvati toksičnost tijela i pojavu složenih bolesti dugotrajne prirode. Osim toga, upala može biti fatalna.


