26.06.2019
Inflamaţie. inflamația este o reacție de protecție a organismului față de efectele nocive, o reacție locală adaptativă. Inflamația: cauze, condiții de apariție și manifestări
Inflamația este o reacție protectoare și adaptativă a organismului formată în procesul de evoluție, care urmărește localizarea, distrugerea sau îndepărtarea unui agent patogen din organism și caracterizată prin fenomene de alterare, exudare și proliferare.
Există trei puncte de remarcat în această definiție. În primul rând, inflamația ca reacție s-a format în procesul de evoluție. În al doilea rând, inflamația joacă un rol protector și adaptativ și are ca scop localizarea, distrugerea sau îndepărtarea unui factor dăunător din organism. În al treilea rând, inflamația se caracterizează prin coexistența a trei manifestări: alterări (leziuni tisulare), exudație (acumularea de lichid în țesuturi) și proliferare (proliferarea elementelor celulare și tisulare).
Etiologia inflamației
Cauza inflamației pot fi factori dăunători foarte diverși: mecanici, fizici (arsuri, radiații ionizante), chimici (acțiunea acizilor, alcaline, otrăvuri), biologici (microbi, viruși, ciuperci patogene, helminți, protozoare). Pe lângă diverși iritanti exogeni, în inflamație sunt implicați și factori endogeni: de exemplu, țesutul necrotic, scurgerea sângelui, hematom, atac de cord, cheaguri de sânge, depunere de sare.
Procesul patologic, în funcție de locul de acțiune al factorului dăunător, se caracterizează printr-o manifestare diferită.
Clasificarea formelor de reacție inflamatorie
În funcție de componenta care predomină în răspunsul inflamator, inflamația este împărțită în: alternativă (principala manifestare este afectarea tisulară), exudativă (există o efuziune pronunțată în focarul inflamator) și proliferativă (procesele de reproducere celulară ies în prim-plan).
Inflamația exudativă, la rândul său, este împărțită în următoarele tipuri:
inflamație seroasă - cu exudat lichid care conține proteine și nu conține FEK.
inflamație fibrinoasă, când exudatul conține o cantitate semnificativă de fibrină, care precipită pe țesuturile inflamate sub formă de fire și filme. Tipurile de inflamație fibrinoasă sunt inflamație diftiritică- la îndepărtarea peliculelor de fibrină se detectează un ulcer hemoragic și inflamație lobară- filmele sunt usor separate.
inflamație purulentă, în care exudatul conține o mare număr de celule albe din sânge, în mare parte morți.
inflamație hemoragică - inflamație cu exudat care conține globule roșii (sânge în exudat).
inflamație ichoră, când microflora putrefactivă se instalează în exsudat.
Inflamația este împărțită în acută, subacută și cronică.
Semne cardinale de inflamație.
Aceste semne au fost descrise de Galen și Celsus, dar nu și-au pierdut semnificația până în prezent, deoarece prezența combinației lor face posibilă diagnosticarea inflamației și, în plus, anumite mecanisme patofiziologice stau în spatele fiecărui semn.
Semnele inflamației includ:
roșeață (rubor). Roșeața zonei inflamate este asociată cu dezvoltarea hiperemiei arteriale, în care arterele se extind și numărul lor crește, iar fluxul de sânge stacojiu bogat în oxigen crește. Cu toate acestea, trebuie remarcat faptul că, odată cu dezvoltarea unui puternic congestie venoasă roșeața se poate transforma în cianoză.
umflare (tumoare). O creștere a volumului zonei inflamate este asociată cu dezvoltarea edemului.
căldură (calor). O creștere a temperaturii zonei inflamate se datorează mai multor factori. În primul rând, este asociată cu hiperemia arterială, adică cu afluxul de sânge mai cald. În al doilea rând, printre polipeptidele biologic active formate în focarul inflamației, se numără cele care sunt factori pirogene (care provoacă febră). În al treilea rând, intensificarea proceselor metabolice, intensificarea unui număr de reacții exoterme duce și la o creștere locală a temperaturii.
durere (dolor). Durerea zonei inflamate este cauzată de iritarea receptorilor de durere ai substanțelor biologic active, precum și ca urmare a comprimării acestora prin edem inflamator.
disfuncție (functio laesa). Dacă în orice organ există o sursă de iritație dureroasă, atunci corpul cruță acest organ și funcția sa va fi redusă. În plus, edemul inflamator, care comprimă organul, și alterarea țesuturilor duce la scăderea funcției.
Semne comune de inflamație
Inflamația este un proces care se manifestă nu numai prin semne locale pronunțate, ci și prin modificări foarte caracteristice și adesea semnificative în întregul corp.
Ce semne generale pot indica dezvoltarea inflamației?
Modificări ale numărului de leucocite în periferiecare sânge: leucocitoza (se dezvoltă în marea majoritate procese inflamatorii) sau mult mai rar leucopenie (de exemplu, cu inflamație de origine virală). Leucocitoza se datorează activării leucopoiezei și redistribuirii leucocitelor în fluxul sanguin. Principalele motive pentru dezvoltarea sa includ stimularea sistemului simpatoadrenal, expunerea la anumite toxine bacteriene, produse de degradare a țesuturilor și o serie de mediatori inflamatori (de exemplu, interleukina-I, factorul de inducție a monocitopoiezei etc.).
Febră se dezvoltă sub influența factorilor pirogene proveniți din focarul inflamației, precum lipopolizaharidele, proteinele cationice, interleukina-I.
Modificarea „profilului” proteic al sângelui se exprimă prin faptul că proces acutîn sânge se acumulează așa-numitele „proteine de fază acută” (APF) ale inflamației sintetizate de ficat - proteina C reactivă, ceruloplasmina, haptoglobina, componentele complementului etc. curs cronic inflamația se caracterizează printr-o creștere a conținutului sanguin de globuline alfa și în special gama.
Modificări ale compoziției enzimatice a sângelui sunt exprimate printr-o creștere a activității transaminazelor (de exemplu, alanin transaminaza în hepatită; aspartat transaminaza în miocardită), hialuronidază, trombokinaza etc.
Creșterea vitezei de sedimentare a eritrocitelor (ESR) datorită scăderii sarcinii negative a eritrocitelor, creșterii vâscozității sângelui, aglomerării eritrocitelor, modificărilor spectrului proteic al sângelui și creșterii temperaturii.
Modificări hormonaleîn sânge sunt, de regulă, o creștere a concentrației de catecolamine, corticosteroizi.
Modificări ale sistemului imunitar și reacții alergiceganisma exprimată prin creșterea titrului de anticorpi, apariția limfocitelor sensibilizate în sânge, dezvoltarea reacțiilor alergice locale și generale.
În plus, focarul inflamației poate fi sursăreflexe patologice(de exemplu, dezvoltarea anginei cu colecistită, aritmii cardiace cu apendicită), intoxicaţie organism şi septicemie.
Mecanisme de dezvoltare a inflamației. Componentele inflamației
Dinamica procesului inflamator, indiferent de cauzele care îl provoacă, este întotdeauna destul de standard, adică. inflamația este în esență un proces „miopatogenetic”.
Baza patogenetică a inflamației constă din trei componente interdependente - alterare, exudare si proliferare .
Modificare
Modificare(din lat. alteratio - schimbare). Alterarea în focarul inflamației este înțeleasă ca un complex de modificări metabolice, fizico-chimice, structurale și funcționale, precum și formarea și/sau activarea mediatorilor inflamatori. Se obișnuiește să se facă distincția între alterarea primară și secundară în focarul inflamației.
Alterarea primară are loc ca răspuns la impactul direct al factorului flogogen. Reacțiile de alterare primară, parcă, prelungesc acțiunea cauzei inflamației.
Alterarea secundară are loc atât sub influența unui stimul flogogen, cât și a factorilor de alterare primară. Aceste efecte sunt mediate de sistemul nervos, de factori fizico-chimici (acidoza etc.) si in principal de mediatorii inflamatori.
schimbari de schimb odată cu dezvoltarea alterării secundare, acestea includ intensificarea proceselor de descompunere a carbohidraților, grăsimilor și proteinelor, creșterea glicolizei anaerobe și a respirației tisulare, decuplarea oxidării și fosforilării biologice și scăderea activității proceselor anabolice. Consecința acestor modificări este o creștere a producției de căldură, dezvoltarea deficienței de macroergi, acumularea de produse metabolice și formarea de mediatori inflamatori.
Complex de modificări fizice și chimice include acidoza, hiperionia (acumularea de ioni de K +, Cl -, HPO, Na + în focarul inflamației), disionia. hiperosmie, hiperonie (datorită creșterii concentrației proteinelor, dispersiei și hidrofilității acesteia).
Modificări structurale și funcționaleîn timpul inflamației sunt foarte diverse și se pot dezvolta la nivel subcelular, celular și organ.
Natura regulată a dezvoltării inflamației se datorează în mare parte mediatorilor săi.
Mediatorii inflamatori sunt un complex de substanțe fiziologic active care mediază acțiunea factorilor flogogeni care determină dezvoltarea și rezultatul procesului inflamator.
De origine distinge condiționat între mediatorii celulari și plasmatici (umorali).
Exudația
Exudația- (din lat. exsudatio - transpiratie). Această componentă include o triadă: a) reacții vasculare și modificări ale circulației sângelui în focarul inflamației; b) ieșirea părții lichide a sângelui din vase - exudația propriu-zisă; c) emigrare (din latină emigratio - evacuare) - eliberarea leucocitelor în focarul de inflamație și dezvoltarea unei reacții fagocitare.
Dinamica reacțiilor vasculare și modificările circulației sanguine în timpul dezvoltării inflamației este stereotipată: la început, apare un spasm reflex pe termen scurt al arteriolelor și precapilarelor odată cu încetinirea fluxului sanguin. Apoi, înlocuindu-se unul pe altul, se dezvoltă hiperemia arterială (datorită dominanței efectelor colinergice asupra peretelui vaselor, acidozei, hiperkaliioniei, distrugerii cuplurilor de țesut conjunctiv din jurul vaselor și, cel mai important, acumulării de mediatori inflamatori); hiperemie venoasă (datorită microtrombozei venelor și vase limfatice, umflarea endoteliului, poziționarea marginală a leucocitelor, slugging sânge, comprimarea vaselor prin exudat); prestasis (flux de sânge asemănător cu smucitura, mișcarea pendulului a sângelui) și, în final, staza - oprirea fluxului sanguin. Ca urmare a stazei, se formează un fel de barieră care asigură o funcție restrictivă a focarului inflamației.
Ieșirea părții lichide a sângelui în focarul de inflamație (exsudația reală) are loc din cauza unei creșteri accentuate a procesului de filtrare, difuzie, osmoză și transport microvezicular, iar acumularea de lichid în exces în țesuturi este asociată cu o scaderea procesului de resorbtie datorita cresterii presiunii venoase. Exudatul ca fluid inflamator, spre deosebire de transudat, conține o cantitate mare de proteine (cel puțin 3-5%), enzime, imunoglobuline, celule sanguine și resturi de elemente tisulare. Datorită exsudației, focarul inflamației este delimitat, toxinele și produsele de degradare a țesuturilor sunt diluate, iar protecția împotriva factorilor flogogeni și a celulelor deteriorate se realizează cu ajutorul enzimelor și imunoglobulinelor.
Emigrarea leucocitelor către focarul inflamației începe cu poziția lor marginală (parietală), care poate dura câteva zeci de minute. Apoi granulocitele (prin goluri interendoteliale) și agranulocitele (prin citoemză - transfer transendotelial) trec prin peretele vascular și se deplasează spre obiectul fagocitozei. Mișcarea amiboidă a leucocitelor este posibilă datorită modificărilor reversibile ale stării citoplasmei lor (tranziția reciprocă a gelului la sol-tixotropie) și a tensiunii superficiale a membranelor, a „polimerizării” reversibile a actinei și miozinei folosind energia glicolizei anaerobe ATP. Mișcarea direcționată a leucocitelor se explică prin acumularea în focarul inflamației chemoatractanților - proteine, polipeptide, deșeuri ale microbilor (chemotaxie), creșterea temperaturii (termotaxie), precum și dezvoltarea condițiilor pentru galvanotaxie, hidrotaxie, thigmotaxis (din greaca thigma - atingere).
Fagocitoza este o reacție de protecție și adaptare a organismului dezvoltată evolutiv, care constă în recunoașterea, captarea activă (absorbția) și digestia microorganismelor, a celulelor distruse și a particulelor străine de către celule specializate - fagocite. Acestea includ PMN (în principal neutrofile), celule ale sistemului de celule mononucleare fagocitare (monocite, macrofage tisulare), precum și celule Kupffer din ficat, celule mezangiale ale rinichilor, celule gliale din SNC etc.
Există 4 etape ale fagocitozei: 1) apropierea fagocitei de obiect; 2) aderenta (atractie, aderenta); 3) capturarea obiectului fagocitat; 4) poziția intracelulară și digestia obiectului, precum și îndepărtarea resturilor obiectului în spațiul extracelular. În procesul de recunoaștere, opsoninele joacă un rol important, care sunt mediatori în interacțiunea receptorilor fagocitelor cu microorganismele. Rolul principal în absorbție revine proteinelor contractile care promovează formarea pseudopodiilor. În paralel cu absorbția, are loc în ea formarea de forme active toxice pentru microbi. O 2 - peroxid de hidrogen, radicali hidroxil, anion superoxid (așa-numita explozie respiratorie). Enzima mieloperoxidaza le intensifică acțiunea, iar protecția fagocitelor față de acestea este asigurată de superoxid dismutază, catalază și în reacțiile șuntului hexoză monofosfat.
Proliferare
Proliferare(din lat. proliferatio - reproducere). În focarul inflamației, elementele locale de țesut se înmulțesc și se maturizează, în principal țesutul conjunctiv (rar epitelial) cu înlocuirea ulterioară a zonei de țesut deteriorat. Etapa finală a proliferării este involuția secundară a cicatricei, când structurile de colagen în exces sunt lizate, îndepărtate și rămâne doar cantitatea dintre ele necesară pentru finalizarea adecvată a procesului inflamator. Cursul proliferării este controlat de mulți factori:
fibroblastele sintetizează procolagenul și, în același timp, secretă colagenază, care descompune colagenul. Între aceste procese există o interacțiune a tipului de autoreglare. Încălcarea acestui regulament poate duce la dezvoltarea scleropatiilor;
fibroblastele formează fibronectium, care determină migrarea, proliferarea și aderența celulelor țesutului conjunctiv;
macrofagele aflate în stadiul final al inflamației secretă un factor special de stimulare a fibroblastelor care le crește reproducerea și proprietățile adezive;
celulele mononucleare din sânge ale animalelor și păsărilor secretă limfokine și monokine care inhibă proliferarea fibroblastelor și formarea colagenului;
macrofagele secretă prostaglandine de grup E, care pot potența creșterea prin creșterea aportului de sânge către țesutul în regenerare;
neutrofilele sunt capabile să producă inhibitori specifici țesuturilor - kaloni și antikeyloni - stimulatori de proliferare care interacționează într-o manieră de feedback;
corticosteroizi: glucocorticoizii inhibă regenerarea, reduc sensibilitatea macrofagelor la limfokine și astfel inhibă secreția de colagen; mineralocorticoizii stimulează procesul de regenerare;
nucleotide ciclice: cAMP inhibă activitatea mitotică a celulelor; cGMP, dimpotrivă, este un stimulator al proliferării.
Cauzele inflamației pot fi:
Inflamație acutăînsuși apare ca reacție locală cu simptome cunoscute din cele mai vechi timpuri: durere (dolor), umflare (tumoare), roșeață (rubor) și căldură (calor). În plus, inflamația poate fi însoțită reacții sistemice(răspuns în fază acută).
La dezvoltare ulterioară reacție inflamatorie, leucotrienele și PAF sunt eliberate din neutrofile, eozinofile și macrofage. Acesta din urmă este, de asemenea, eliberat din trombocite. Întărește răspuns inflamatorşi provoacă implicarea sistemului hemostază în procesul de inflamaţie. Aceste celule sunt implicate în focarul inflamației chemokine (chemotaxie). Eotaxina, PAF și leucotriena B4 acționează asupra eozinofilelor (și a celulelor Th 2) precum chimioatractanții. Deoarece PAF activează și mastocitele, cele două tipuri de celule lucrează împreună. Neutrofilele și monocitele sunt implicate în inflamația de către leucotriene B4, componenta complement C5a, NCF, TNF-α, IL-1, IL-4 și unele chemokine, cum ar fi IL-8.
Histamina, PAF, leucotrienele C4, D4 și E4 acționează împreună cu alți mediatori (PGE2, bradikinină) și provoacă: 1) vasodilatație (arteriole), 2) creșterea permeabilității paracelulare a endoteliului și 3) stimularea nociceptorilor.
Vasodilatația provoacă înroșirea țesutului inflamat și creșterea temperaturii acestuia. Vasodilatația duce, de asemenea, la o încetinire a fluxului sanguin, ceea ce permite leucocitelor să se deplaseze din fluxul axial mai aproape de endoteliu după expunerea la chemoatractanți. Celulele endoteliale activate la locul inflamației diverse substante, inclusiv IL-4 (din celulele Th 2), exprimă selectine pe suprafaţa lor îndreptată spre lumenul vasului. Aceste selectine, care sunt în esență molecule de adeziune celulară, provoacă mișcarea leucocitelor de-a lungul suprafeței endoteliale și activează alte molecule de adeziune (integrine, ICAM-1, VCAM). Acest lucru permite leucocitelor să se atașeze de peretele vascular (marginocie). Creșterea permeabilității endoteliale(pierderea contactelor dintre celulele endoteliale) permite leucocitelor să iasă din vase în spațiul extravascular (diapedeză). În plus, în spațiul interstițial intră un lichid care conține o cantitate mare de proteine (exudat inflamator), în urma căruia se dezvoltă edem. În cazuri severe, chiar și celulele roșii din sânge ies din vase (inflamație hemoragică). În cele din urmă, apare durerea, din cauza căreia o persoană este conștientă de prezența unui proces patologic și caută în mod reflex să protejeze zona inflamată (de exemplu, un membru).
Încep neutrofilele care au migrat către focarul de inflamație și macrofagele care s-au diferențiat de monocitele care au migrat către acest focar. fagocita agenți patogeni inflamatori și digerați-i cu lizozomi. „Apetitul” fagocitelor este sporit după opsonizarea agenților patogeni de către IgG sau componenta complement C3b.
Se activează și inflamația sistem de complement. Aceasta se întâmplă fie în mod clasic în prezența complexelor antigen-anticorp, fie într-un mod mai lent, așa-numita cale alternativă prin legarea mai puțin specifică la celulele infectate cu bacterii sau viruși. În ambele cazuri, se formează componenta C3b a complementului. Nu numai că opsonizează antigenele, dar provoacă și polimerizarea altor componente (C5-C9) pe suprafața celulelor atacate de agentul patogen, cu formarea unui complex de atac membranar, care declanșează liza agentului patogen. În plus, sistemul de complement este capabil să distrugă particulele de virus și complexele antigen-anticorp. Produsele secundare ale activării sistemului complement (C3a, C4a și C5a, așa-numitele anafilaxine) acționează ca chimioatractanți și activează macrofagele.
Macrofage sunt activate în principal de exo- și endotoxine ale agenților patogeni, complexe antigen-anticorp, C5a, diverse cristale, precum și în timpul fagocitozei. Ca urmare a activării lor, sunt eliberați oxidanți precum O 2 -, OH-, 1 O 2 și H 2 O 2, dăunând agenților patogeni. Macrofagele secretă, de asemenea, mediatori inflamatori cum ar fi PAF, leucotriene, prostaglandine și citokine IL-1, IL-6, TNF-α. Aceștia din urmă acționează nu numai local, ci nu doar ca chemoatractanți - implică și organismul în ansamblu în reacția inflamatorie (răspunsul fazei acute a inflamației). Manifestările acestui răspuns, mediat de IL-1, IL-6, TNF-α și realizat prin receptori specifici, sunt următoarele:
- efect asupra neuronilor responsabili de somn lent provoacă letargie, somnolență, oboseală, oboseala;
- punctul de referință de termoreglare este deplasat cu mai mult nivel inalt, se dezvoltă febră;
- stimulează eliberarea de leucocite din măduvă osoasă cu dezvoltarea leucocitozei;
- funcția hepatică este stimulată, care se manifestă prin captarea crescută a fierului de către hepatocite și formarea așa-numitelor proteine de fază acută;
- sistemul imunitar este stimulat (în special, producția de anticorpi este îmbunătățită);
- se lanseaza lipoliza si procesele catabolice, contribuind la scaderea greutatii corporale.
vindecarea țesuturilor. După formarea țesutului de granulație bogat în celule (macrofage etc.) și caracterizat prin vascularizare pronunțată, factorul de creștere derivat din trombocite (PDGF) și alți mediatori stimulează proliferarea și migrarea fibroblastelor. Ei produc glicozaminoglicani, care se umfla si se depun in tesuturi sub forma de fibre de colagen. În plus, se formează noi fibre de colagen, datorită reducerii cărora marginile rănii se unesc.
Ca urmare, la locul deteriorării, fibrele de colagen (cicatrice) sunt înlocuite cu țesut nou (din latină restitutio ad integrum - restaurare completă). Cu toate acestea, o astfel de înlocuire a țesutului deteriorat este tipică numai pentru răni mici și neinfectate. În prezența unei inflamații secundare (datorită prezenței corpuri străineîn rană sau infecția acesteia) vindecarea plăgii este întârziată în timp, răspunsul protector al macrofagelor este îmbunătățit. Acest lucru necesită energie suplimentară (creșterea temperaturii). Un sistem de hemostază activat sincron promovează ocluzia vasculară în zonele adiacente; ca urmare a lipsei de O 2, se dezvoltă deficitul de ATP; datorită acumulării de lactat în condiţii anaerobe, pH-ul scade. Oxidanții eliberați dăunează și celulelor proprii ale corpului. Când aceste celule mor, enzimele lizozomale sunt eliberate în spațiul extracelular, care contribuie la moartea leucocitelor și a celulelor din țesutul inflamat. O astfel de moarte celulară (necroză) poate duce la formarea unui abces cu cicatrici ulterioare, care ar trebui să fie considerată ca un fel de plată pentru prevenirea răspândirii inflamației. Formarea cicatricilor apare și în cazurile de leziuni tisulare extinse (de exemplu, răni căscate).
Tulburări de vindecare a rănilor apar în cazul unui dezechilibru între procesele de inflamație și vindecare (cu inflamație cronică, de exemplu, cu bronșita fumătorilor sau în caz de boală hepatică alcoolică). Formarea unor cantități prea mari de colagen provoacă inflamații fibrozante (în special în ciroza hepatică). În cazurile cu formarea excesivă a țesutului de granulație, se dezvoltă inflamația granulomatoasă (în tuberculoză, precum și în inflamația cauzată de corpi străini).
Cu defecte ale caracteristicilor calitative ale țesutului cicatricial (de exemplu, în cazul unei încălcări a procesului de sinteză a colagenului sub influența glucocorticoizilor sau a formării de legături încrucișate între fibrele de colagen în deficiența de vitamina C), tensiune locală în zona rănii poate contribui la redeschiderea acesteia (de exemplu, divergența marginilor rănii după abdominală interventii chirurgicale). Cicatricile pe față pleacă defecte cosmetice, în special cu cicatrici excesive (cicatrici cheloide). În unele cazuri, cicatricile pot provoca grave tulburari functionale: cicatricile corneene sunt însoțite de tulburări de vedere, cicatricile în zona valvelor cardiace provoacă stenoză sau regurgitare a sângelui, cicatricile în cavitatea abdominală sunt adesea cauza bolii adezive.
Dacă nu este posibilă localizarea inflamației cauzate de agenți patogeni, aceștia se răspândesc în tot organismul, de obicei prin sistemul limfatic, odată cu dezvoltarea septicemie. Acest lucru se întâmplă, de exemplu, atunci când agenții patogeni lovesc brusc o suprafață mare a peritoneului (cu o ruptură a colonului, deschiderea unui abces).
Inflamaţie- tipic proces patologic care vizează distrugerea, inactivarea sau eliminarea agentului dăunător și refacerea țesutului deteriorat.
Inflamația este un proces local. Cu toate acestea, aproape toate țesuturile, organele și sistemele corpului iau parte la apariția, dezvoltarea și rezultatele acestuia.
Terminologie. Pentru a desemna inflamația în orice țesut sau organ, se folosește numele lor latin sau grecesc și se adaugă elementul terminologic „it” (în combinație cu numele greco-latin al țesutului sau organului - este). De exemplu, inflamația pielii - dermatită, ficat - hepatită, rinichi - nefrită, meninge - meningită, miocard - miocardită, pereții venelor - flebită etc.
Etiologie
Inflamația este răspunsul organismului la influența unei cauze - flogogenă (din greacă. phlox, phlogos- flacără) a unui factor care acționează în anumite condiții.
Cauzele inflamației
Natura factorului flogogen pot fi fizice, chimice sau biologice.
♦ Factori fizici: leziune mecanică a țesuturilor, excesiv de mare sau temperatura scazuta, expunerea la curent electric sau energie radiantă.
♦ Factori chimici: acizi organici și anorganici, alcalii și săruri; medicamente injectate în țesuturi.
♦ Agenți biologici: infecțioase (virusuri, rickettsiae, bacterii, ciuperci); imunoalergice (complexe Ag-AT; proteine denaturate și secțiuni de țesut mort; celule infectate cu virus și tumori); toxine ale insectelor, animalelor, plantelor.
Originea factorului flogogen. Ca factori dăunători, factorii flogogeni sunt împărțiți în exogeni și endogeni, iar în fiecare dintre aceste grupe se disting agenții infecțioși și neinfecțioși.
Severitatea efectului inflamator agenții flogogeni depind nu numai de natura și originea lor, ci și de intensitatea acțiunii: cu cât este mai mare, cu atât reacția inflamatorie este, de regulă, mai acută.
Condiții care afectează apariția și cursul inflamației
reactivitatea corpului. Inflamația poate avea un curs norrergic, hiperergic și hipoergic, în funcție de reactivitatea organismului și de proprietățile reactive ale țesutului sau organului în acest moment.
Caracteristicile regionale ale țesuturilor sunt importante pentru apariția și natura dezvoltării inflamației. Astfel, leziunile tisulare locale cronice, procesele distrofice, tulburările circulatorii sau imunitatea locală facilitează punerea în aplicare a acțiunii factorului patogen și exacerbează adesea afectarea țesuturilor în focarul inflamației.
Patogeneza
În mecanismul de dezvoltare a inflamației se disting mai multe componente: alterare, reacții vasculare, modificări ale circulației sanguine și limfatice, exudarea fluidelor și eliberarea celulelor sanguine în țesut, fagocitoză și proliferare.
modificare
Modificare(din lat. alterare- schimbare, deteriorare) ca o componentă a mecanismului de dezvoltare a inflamației include modificări în: structurile celulare și extracelulare, metabolismul, proprietățile fizico-chimice, precum și formarea și punerea în aplicare a efectelor mediatorilor inflamatori. În același timp, se disting zone de alterare primară și secundară.
alterare primară Se realizează datorită acțiunii unui agent patogen în zona de introducere a acestuia, care este însoțită de modificări grosolane, adesea ireversibile.
alterare secundară Este cauzată atât de un agent patogen, cât și, în principal, de produse de alterare primară. Mai târziu, alterarea secundară capătă un caracter relativ independent. Volumul zonei de deteriorare secundară este întotdeauna mai mare decât cel primar, iar durata poate varia de la câteva ore la câțiva ani.
Schimbarea structurilor
Gradul de modificări ale structurilor celulare și necelulare în focarul inflamației variază de la minim până la distrugerea și necroza lor. Cauză modificările structurii sunt activate stadiul inițial inflamație, efectul direct al factorului flogogen și apoi - tulburări metabolice, tulburări fizico-chimice, microcirculatorii și de reglare (pentru mai multe detalii despre cauzele leziunilor structurale, vezi Capitolul 4 „Patologia celulară”).
Modificări metabolice
Semnificația biologică a modificărilor metabolice constă în furnizarea energetică și plastică a proceselor care au loc în focarul inflamației. În stadiul inițial al inflamației în țesuturi predomină reacțiile de catabolism, iar atunci când procesele de proliferare sunt activate, reacțiile anabolice încep să domine. Modificările metabolice sunt în mare măsură reglate de mediatorii inflamatori. În focarul inflamației, și adesea în organism în ansamblu, există o restructurare a tuturor tipurilor de metabolism: carbohidrați, proteine, grăsimi și apă-sare, ceea ce duce la modificări fizice și chimice în focarul inflamației.
Carbohidrați
♦ Se activează glicogenoliza şi glicoliza, asigurând o creştere a producţiei de compuşi macroergici.
♦ Sub influența decuplatoarelor de oxidare și fosforilare, formarea de ATP în ciclul Krebs este perturbată și se eliberează energie sub formă de căldură.
♦ Glicoliza în condiții de hipoxie în focarul inflamației trece pe calea anaerobă, rezultând acumularea de lactat și piruvat în exces, care formează acidoza metabolica.
♦ Reluarea oxigenării tisulare, de regulă, este însoțită de normalizarea aprovizionării cu energie procesele celulare.
Lipidele
♦ Creșterea lipolizei (este însoțită de acumularea de acizi grași liberi) și distrugerea lipidelor ca urmare a intensificării reacțiilor LPO (cu formarea de peroxizi și hidroperoxizi lipidici, cetoacizi).
♦ Datorită acumulării de acizi grași liberi în celule se remarcă efectul lor de decuplare și scăderea eficienței respirației tisulare în mitocondrii. IVFA au, de asemenea, un efect de detergent (vezi secțiunea Deteriorarea membranei, Capitolul 4).
♦ Acumularea excesului de cetoacizi (acetoacetic, β-hidroxibutiric, β-cetoglutaric și alții) din cauza oxidării afectate a acizilor grași determină acidoză și alterarea secundară a focarului de inflamație.
♦ Acidul arahidonic format în exces servește ca substrat pentru formarea Pg, tromboxanilor și leucotrienelor.
Veverițe
♦ Se activează proteoliza, ale cărei produse servesc drept substrat pentru sinteza componentelor celulare pentru a le înlocui pe cele deteriorate.
♦ Se dezvoltă reacții imune (inclusiv imunopatologice) (datorită denaturarii proteinelor atât ale celulelor moarte proprii cât și ale agentului flogogen). Includerea mecanismelor celulare și umorale ale imunității asigură detectarea, distrugerea și eliminarea structurilor străine antigenic.
Ioni și apă
♦ Aprovizionarea cu energie a transportului selectiv de cationi este întreruptă și activitatea ATPazelor membranare dependente de cationi (α+, K+-ATPaza, Ca 2 +Mg 2 +-ATPaza) scade. Acest lucru provoacă o încălcare a formării MP și AP, dezvoltarea depolarizării persistente a membranelor celulelor excitabile (de exemplu, cardiomiocite și neuroni).
♦ Raportul extra- și intracelular încălcat între ionii individuali. Există o pierdere de K +, Mg 2 + de către celulă și acumularea lor în lichidul intercelular. Na + și Ca 2 + intră în celulă.
♦ O cantitate suplimentară de cationi (K+, Na+, Ca 2+ , fier, zinc) este eliberată în timpul hidrolizei sărurilor și a aportului unei cantități mari de Ca 2 + din depozitele intracelulare deteriorate (mitocondrii și cisterne ale reticulului endoplasmatic) .
♦ Crește semnificativ presiunea osmotică din interiorul celulelor și organelelor acestora, care este însoțită de supraîntinderea și ruperea membranelor acestora.
Modificări fizico-chimice
acidoza metabolicaîn focarul inflamației se datorează acumulării unui exces de diverși acizi: lactic, piruvic, aminoacizi, acizi grași și CT.
♦ Mecanisme de dezvoltare:încălcarea eliminării din focarul inflamației formate într-un număr mare de produse metabolice acide. Acest lucru determină epuizarea sistemelor tampon (bicarbonat, fosfat, proteine) ale celulelor și lichidului interstițial.
♦ Consecințe:
O creștere a permeabilității membranelor, inclusiv a lizozomilor, care duce la eliberarea de hidrolaze în citosol și substanță intercelulară.
Creșterea permeabilității pereților vaselor datorită hidrolizei neenzimatice și enzimatice crescute a componentelor matricei extracelulare, inclusiv a membranelor bazale.
Formarea unei senzații de durere în focarul de inflamație din cauza iritației și lezării terminațiilor nervoase sensibile în condiții de exces de H + .
Modificări ale sensibilității receptorilor celulari (inclusiv pereții vasculari) la factorii de reglare (neurotransmițători, hormoni, mediatori inflamatori), care este însoțită de o tulburare în reglarea tonusului peretelui vascular.
Hiperosmia- creșterea presiunii osmotice în regiunea inflamației. Datorită acumulării unui număr mare de ioni și compuși cu greutate moleculară mică.
♦ Mecanisme de dezvoltare: creșterea distrugerii enzimatice și non-enzimatice a macromoleculelor, hidroliza îmbunătățită a sărurilor în condiții de acidoză și eliberarea de compuși activi osmotic din celulele deteriorate.
♦ Efecte: hiperhidratarea focarului de inflamație, stimularea emigrării leucocitelor, modificări ale tonusului pereților vaselor de sânge, formarea unei senzații de durere.
hiperonchie- creșterea presiunii oncotice în țesut în timpul inflamației acestuia.
♦ Mecanisme de dezvoltare: o creștere a concentrației de proteine în focarul de inflamație din cauza hidrolizei enzimatice și neenzimatice crescute a peptidelor și eliberării proteinelor (în principal albumine) din sânge în focarul de inflamație datorită creșterii permeabilității vasculare. perete.
♦ Efecte: dezvoltarea edemului în focarul inflamației.
Modificarea încărcăturii de suprafață celule (de obicei o scădere). Este cauzată de o încălcare a echilibrului apă-electroliți în țesutul inflamat.
♦ Mecanisme de dezvoltare:încălcarea aprovizionării cu energie a transportului ionic transmembranar și dezvoltarea dezechilibrului electrolitic.
♦ Efecte: modificarea pragului de excitabilitate celulară, potențarea migrării fagocitelor datorită electrokinezei; stimularea cooperării celulare în legătură cu scăderea mărimii sarcinii lor negative de suprafață, neutralizarea sau chiar reîncărcarea acesteia.
Modificări ale stării coloidale substanță intercelulară și hialoplasma celulelor în focarul inflamației.
♦ Mecanisme de dezvoltare:
Hidroliza enzimatică și neenzimatică a macromoleculelor (glicozaminoglicani, proteine, proteoglicani).
Schimbări de fază ale microfilamentelor, facilitând tranziția stării lor de la gel la sol și invers.
♦ Efecte(primar): creșterea permeabilității tisulare.
Reducerea tensiunii superficiale a membranelor celulare. Este cauzată de modificări în structura moleculelor plasmalemei.
♦ Mecanisme de dezvoltare: expunerea membranelor celulare la o cantitate semnificativă de agenți tensioactivi (fosfo-
lipide, VFA, K+, Ca2+).
♦ Efecte: facilitarea mobilității celulare și potențarea aderenței celulare în timpul fagocitozei.
Mediatori inflamatori
Mediatori inflamatori- substanțe biologic active, sub influența cărora se realizează dezvoltarea regulată și rezultatele inflamației, se formează semnele locale și generale.
Există două grupe de mediatori inflamatori: celulari și plasmatici.
Mediatori celulari ai inflamației
Grupuri principale mediatori celulari inflamațiile includ: amine biogene, peptide și proteine, oxid nitric, derivați acizi grașiși lipide, nucleotide și nucleozide. Sursele lor sunt mastocite, granulocite neutrofile și bazofile, trombocite și o serie de alte celule aflate în focarul inflamației.
Amine biogene. Cei mai importanți reprezentanți sunt histamina și serotonina.
♦ histamina, acționând asupra receptorilor H 2 ai celulelor țintă, provoacă dilatarea vaselor microvasculare și crește permeabilitatea venulelor, ceea ce contribuie la exudare. Interacționând cu receptorii H 1, histamina provoacă: senzații de durere, arsură, mâncărime, tensiune.
♦ Serotonina de asemenea, crește permeabilitatea vasculară și activează contracția venulelor SMC (care contribuie la dezvoltarea hiperemiei venoase), duce la formarea unei senzații de durere, stimulează tromboza.
Peptide și proteine
♦ Neuropeptide. Dintre neuropeptidele din inflamație, substanța P joacă cel mai important rol.
♦ Citokine reglează activitatea proliferativă, diferențierea și fenotipul celulelor țintă. Citokinele includ factori de creștere, interleukine (IL), factor de necroză tumorală
(TNF), factori de stimulare a coloniilor, interferoni (IFN) și chemokine.
Termenul general modern pentru întreaga clasă este citokine, nume depășite ale subclaselor: limfokine și monokine.
♦ Leucokinele- denumirea generală pentru diferite substanțe biologic active (BAS) formate din leucocite, dar care nu sunt legate de imunoglobuline (Ig) și citokine. Leucokinele includ proteine de fază acută, proteine cationice și fibronectină.
♦ Enzime. Enzimele din toate grupele majore se găsesc în focarul inflamației. Sursa lor principală sunt neutrofilele și alte fagocite. La începutul inflamației, enzimele provoacă slăbirea cuplurilor țesutului conjunctiv din jurul vaselor și distrugerea substanței intercelulare a pereților vasculari, favorizând vasodilatația și creșterea permeabilității vasculare. În etapele ulterioare ale inflamației, din cauza enzimelor, focarul inflamației este curățat de celulele și țesuturile moarte și sunt implementate și procese proliferative.
Oxid de azot(factor de vasodilatație eliberat de endoteliu) este un mediator inflamator important.
Mediatori lipidici ai inflamației
♦ Derivate acid arahidonic sunt prostaglandine, tromboxani și leucotriene. Acidul arahidonic face parte din fosfolipidele membranelor celulare, de unde este eliberat sub influența fosfolipazelor. Transformări ulterioare ale acestui acid apar fie prin ciclooxigenază (cu formarea de prostaglandine și tromboxani), fie prin calea lipoxigenazei (cu formarea de leucotriene).
? Prostaglandine au un spectru larg de acțiune, inclusiv deteriorarea pereților vaselor microvasculare și crește permeabilitatea acestora, îmbunătățește chimiotaxia și promovează proliferarea fibroblastelor. Pg reduce pragul de sensibilitate la durere și contribuie la dezvoltarea febrei.
? Tromboxani provoacă vasoconstricție, promovează agregarea celulelor sanguine, stimulează formarea de trombi.
? leucotriene provoacă spasm al SMC în pereții vaselor de sânge, bronhiole și intestine (durata efectului leucotrienelor este foarte lungă), prezintă un efect chemotactic pozitiv în raport cu fagocite și crește permeabilitatea membranei.
♦ Factorul de activare a trombocitelor Este format din fosfolipide membranare și este cel mai puternic vasoconstrictor.
♦ Lipoperoxizii- produse SPOL. Ele destabilizează membranele lizozomilor, favorizând eliberarea enzimelor din acestea și determină eficacitatea etapelor finale ale fagocitozei.
Nucleotide și nucleozide
♦ ATP oferă „suport” energetic al celulelor și proceselor plastice din ele în focarul inflamației.
♦ ADP stimulează aderența, agregarea și aglutinarea celulelor sanguine. Aceasta provoacă tromboză, formarea de nămol, fluxul sanguin și limfatic afectat în vasele microvasculare.
♦ adenozina, eliberat din celule, are un efect vasodilatator semnificativ cu dezvoltarea hiperemiei arteriale.
Mediatori plasmatici ai inflamației
Mediatorii plasmatici ai inflamației, precum și mediatorii celulari, sunt produși de celule și eliberați de acestea într-o stare inactivă. Ele apar atunci când sunt activate trei sisteme sanguine - kinin, complement și hemostaza. Toate componentele acestor sisteme sunt prezente în sânge ca precursori și devin active după expunerea la mediatorii celulari inflamatori.
Mediatori ai sistemului kinin. Bradikinina și kalikreina sunt de importanță primordială în inflamație.
♦ Bradikinina sporește permeabilitatea vasculară, provoacă o senzație de durere, are un efect hipotensiv pronunțat.
♦ Kalikrein provoacă chemotaxia leucocitară, dar semnificația sa principală este activarea factorului Hageman.
Mediatori ai sistemului de hemostază: factori ai sistemelor de coagulare, anticoagulare și fibrinolitică. Factorul Hageman este activat mai întâi. Inițiază coagularea proteinelor din sânge, crește permeabilitatea pereților vaselor de sânge, îmbunătățește migrarea neutrofilelor și agregarea trombocitelor.
Sistemul de complement constă dintr-un grup de proteine din plasmă sanguină specializate care provoacă liza bacteriană și celulară. În plus, unele componente ale complementului, în primul rând C3b și C5b, cresc permeabilitatea pereților vasculari, sporesc activitatea chemotactică a neutrofilelor și macrofagelor.
Anti-mediatori inflamatori.În toate etapele dezvoltării inflamației, se formează și acționează substanțe care împiedică acumularea excesivă sau opresc acțiunea mediatorilor, care împreună pot fi combinați într-un sistem de antimediatori inflamatori. Cei mai importanți antimediatori sunt enzimele. Deci, histaminaza distruge histamina, carboxipeptidazele - kinine, es-
teraze - fracții complement, prostaglandin dehidrogenază - Pg. Influențele umorale sunt de mare importanță. Astfel, unul dintre tipurile de antitripsină formată în hepatocite inhibă o serie de proteaze implicate în inflamație, care inhibă formarea kininelor. Glucocorticoizii slăbesc reacțiile vasculare prin stabilizarea membranelor vasculare, reduc exsudația și emigrarea leucocitelor și, de asemenea, slăbesc fagocitoza. Datorită prezenței antimediatorilor, inflamația se oprește după eliminarea sau inactivarea agentului dăunător și repararea țesuturilor deteriorate.
REACȚII VASCULARE, MODIFICĂRI ÎN SÂNGE
SI CIRCULATIILE LIMFO. EXUDARE DE LICHID.
IEȘIREA ELEMENTELOR SANGUELOR FORMATE ÎN ȚESUT
Această componentă a inflamației este urmatoarele procese:
♦ modificarea tonusului peretilor si lumenului vaselor;
♦ încălcarea hemodinamicii și limfodinamicii;
♦ modificări ale proprietăților reologice ale sângelui;
♦ creșterea permeabilității vasculare;
♦ procesul propriu-zis de exudare a lichidului din microvase;
♦ migrarea către focarul de inflamație a leucocitelor și fagocitoză, eliberarea de trombocite și eritrocite în țesut.
Modificări ale tonusului pereților și lumenului vaselor de sânge. Tulburări hemodinamice regionale
Lumenul vaselor, circulația sanguină și limfatică în focarul inflamației se modifică din momentul apariției și pe parcursul întregului proces de inflamație. În același timp, în diferite părți ale acestuia și mai departe diferite etape are de obicei un alt caracter.
♦ Ischemie este rezultatul spasmului muscular al arteriolelor si precapilarelor datorat eliberarii reflexe (ca raspuns la durere) a neurotransmitatorilor (norepinefrina). Manifestari externe: paloare, unele scaderi ale volumului si temperaturii tesuturilor. Durată - de la câteva secunde la câteva minute, deoarece norepinefrina este rapid scindată de sistemele enzimatice.
♦ Hiperemia arterială datorită scăderii tonusului mușchilor pereților și expansiunii arteriolelor sub influența mediatorilor inflamatori. O creștere a aportului de sânge este un mecanism de protecție important și contribuie la aprovizionarea cu energie a inflamației. Manifestări externe: roșeață, turgență crescută, ușoară creștere a volumului și a temperaturii țesuturilor.
♦ Congestie venoasă din cauza fluxului sanguin afectat. Acest lucru este facilitat de compresia venulelor și capilarelor perivascutului edematos.
țesut lar, umflarea endoteliului și modificări ale proprietăților reologice ale sângelui. Hiperemia venoasă contribuie la creștere presiune hidrostaticaîn vasele microvasculare și filtrarea în țesutul părții lichide a sângelui și, în consecință, agravarea edemului.
♦ Stază- oprirea temporară a fluxului sanguin și limfatic în vasele microvasculare. Se dezvoltă ca urmare a comprimării semnificative a venulelor de către țesutul edematos și a dezvoltării unui fenomen de nămol în ele.
♦ Normalizare fluxul sanguin regional are loc pe măsură ce inflamația se completează.
Modificări ale proprietăților reologice ale sângelui.În vasele țesutului inflamat există o îngroșare a sângelui, o poziție marginală a leucocitelor, formarea de nămol și agregate celulare, ceea ce reduce fluxul sanguin și favorizează tromboza vaselor mici.
Creșterea permeabilității vasculare și tisulare
Factorul determinant în exudarea lichidului în afara vaselor în timpul inflamației este creșterea permeabilității peretelui vascular, care este asociată cu formarea de exudat. Mediatorii inflamatori au influența principală asupra permeabilității peretelui vascular. O creștere a permeabilității vasculare promovează transportul interendotelial și transendotelial al plasmei și eliberarea celulelor sanguine din vase.
♦ Se formează goluri interendoteliale datorită contracției actomiozinei în celulele endoteliale și modificărilor structurii citoscheletului din acestea.
♦ Transportul transendotelial se realizează cu ajutorul veziculelor și microcanalelor.
O creștere a permeabilității tisulare se datorează și modificărilor stării coloidale a substanței intercelulare.
EXUDAREA LICHIDULUI SI ELIBERAREA ELEMENTELOR FORMULATE
SÂNGE ÎN FOCALUL INFLAMAȚIEI
Exudația(din lat. exsudatum- a transpira, transpira) - procesul de ieșire a plasmei și a celulelor sanguine din vasele patului de microcirculație în țesuturi și cavitățile corpului cu formarea de exudat.
Exudat- un lichid format în timpul inflamației și care conține o cantitate mare de proteine și celule sanguine (în principal leucocite).
De asemenea, organismul poate forma un lichid neinflamator - transudat. Diferă de exudat prin conținutul scăzut de proteine, leucocite și alte celule sanguine.
Cauzele exsudației
Principala cauză a plasmoragiei (eliberarea pasivă a plasmei sanguine în interstițiu) este creșterea permeabilității vasculare și creșterea tensiunii arteriale hidrostatice în vasele microvasculare.
Principala cauză a infiltrației leucocitelor este chimio- și electrotaxia leucocitelor.
Tipuri de exudat. Exista mai multe tipuri de exudat: seros, fibrinos, purulent, putrefactiv, hemoragic si cataral. Tipul de exudat determină denumirea formei de inflamație exudativă acută.
Valoarea exsudației.În focarul inflamației, procesul de exudare are o dublă direcție semnificație biologică: adaptativ și patogen.
adaptativ semnificația constă în fixarea flogogenului în focarul inflamației și crearea condițiilor optime pentru inactivarea și eliminarea acestuia.
patogen sens:
♦ compresia si deplasarea organelor si tesuturilor prin exudat;
♦ este posibil ca procesul inflamator să se extindă la țesuturile adiacente sau la fluidele biologice (limfă, sânge, lichid cefalorahidian etc.);
♦ formarea de focare de distrugere tisulară în caz de inflamație purulentă.
Emigrarea leucocitelor
Emigrarea leucocitelor este un proces activ de ieșire a acestora din lumenul vaselor microvasculare în spațiul intercelular. După 1-2 ore de la expunerea la țesutul factorului flogogenic, în focarul inflamației se găsesc un număr mare de neutrofile emigrate și alte granulocite, mai târziu - după 15-20 de ore sau mai mult - monocite și apoi limfocite.
Procesul de emigrare trece succesiv prin etapele de rulare (stare marginală - „rulare”) a leucocitelor, aderarea acestora la endoteliu și pătrunderea prin peretele vascularși, de asemenea, - mișcarea direcționată a leucocitelor în focarul inflamației (Fig. 5-1).
Funcțiile leucocitelor în inflamație
Fagocitoză.
Sinteza și eliberarea mediatorilor inflamatori.
Prezentarea antigenului la limfocite. Această funcție a fagocitelor este realizată prin procesare (captarea și transformarea structurilor antigenice) și prezentarea Ag către celule. sistem imunitar(transmiterea informațiilor despre Ag către limfocite).
Orez. 5-1. Etapele migrației leucocitelor prin peretele vascular(pe exemplul neutrofilelor). [pe 4].
Mai târziu, o parte semnificativă a leucocitelor care au migrat către focarul de inflamație suferă modificări distrofice si se transforma in „corpi purulenti” sau sufera apoptoza. O parte din leucocite, după ce și-au îndeplinit funcțiile, revine în patul vascular și circulă în sânge.
Cu o creștere semnificativă a permeabilității pereților vaselor microvasculare, eritrocitele și trombocitele intră, de asemenea, „pasiv” în locul inflamației.
FAGOCITOZĂ
Fagocitoză(gr. fageina- a mânca, a devora + gr. kitos- celulă + greacă. osis- proces, stare) - proces biologic activ, constând în recunoașterea, absorbția și distrugerea intracelulară a materialului străin de către celule specializate - fagocite: microfage (leucocite polimorfonucleare) și macrofage.
În timpul fagocitozei se disting mai multe etape principale (Fig. 5-2).
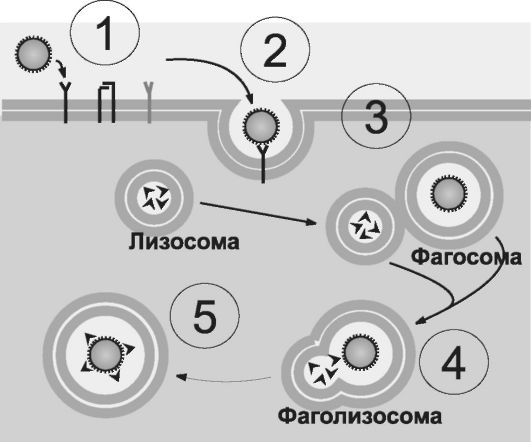 Orez. 5-2. Stadiile fagocitozei: 1 - aderența unei particule (de exemplu, bacterii) folosind receptorul Fc al membranei fagocitelor; 2 - imersarea particulei aderente în fagocit și formarea unui fagozom; 3 - abordarea și atașarea de fagozomul lizozomilor; 4 - fuziunea membranelor de fagozom și lizozom pentru a forma un fagolizozom; 5 - distrugerea particulei absorbite. [pe 4].
Orez. 5-2. Stadiile fagocitozei: 1 - aderența unei particule (de exemplu, bacterii) folosind receptorul Fc al membranei fagocitelor; 2 - imersarea particulei aderente în fagocit și formarea unui fagozom; 3 - abordarea și atașarea de fagozomul lizozomilor; 4 - fuziunea membranelor de fagozom și lizozom pentru a forma un fagolizozom; 5 - distrugerea particulei absorbite. [pe 4].
Recunoașterea de către fagocit a obiectului de absorbție și aderență la acesta are loc în mai multe etape:
♦ Detectarea determinanților de suprafață ai obiectului fagocitozei.
♦ Opsonizarea obiectului fagocitozei.
♦ Adeziunea fagocitei la obiectul fagocitozei. Acest proces este realizat cu participarea receptorilor leucocitari FcyR (dacă obiectul are ligandul corespunzător) și a moleculelor de adeziune (în absența unui ligand, de exemplu, în particule necelulare).
Absorbția unui obiect de către un fagocit cu formarea ulterioară a unui fagolizozom. Materialul absorbit este scufundat în celulă ca parte a fagozomului, o veziculă formată de membrana plasmatică. Lizozomii se apropie de fagozom, membranele fagozomului și ale lizozomului se contopesc și se formează un fagolizozom.
Distrugerea intracelulară a obiectului fagocitozei se realizează ca urmare a activării a două mecanisme complexe: citotoxicitatea dependentă de oxigen și independentă de oxigen a fagocitelor.
♦ Citotoxicitatea dependentă de oxigen joacă un rol principal în distrugerea obiectului fagocitozei. Este asociat cu o creștere semnificativă a intensității metabolismului cu participarea oxigenului (explozie respiratorie).
♦ Mecanismele independente de oxigen se datorează acțiunii enzimelor fagocitare lizozomale.
fagocitoză incompletă. Cu fagocitoza incompletă, microorganismele absorbite de fagocite nu sunt distruse. Acest lucru contribuie la persistența și răspândirea infecției în organism. Cauzele fagocitozei incomplete:
Membrano- și fermentopatia lizozomilor fagocitari.
Creșterea rezistenței microbiene la enzimele fagocitelor.
Capacitatea unor microbi de a părăsi rapid fagozomul și de a persista în citoplasma fagocitelor (rickettsia, chlamydia).
Efectul insuficient al hormonilor - regulatori ai procesului de fagocitoză.
PROLIFERARE
Proliferarea, o componentă importantă a mecanismului de dezvoltare a procesului inflamator și a stadiului său final, se caracterizează prin creșterea numărului de celule stromale și parenchimatoase, precum și formarea unei substanțe intercelulare în focarul inflamației. Aceste procese au ca scop regenerarea sau înlocuirea elementelor tisulare distruse.
♦ Cu o evoluție favorabilă a inflamației, se observă regenerarea completă a țesuturilor - refacerea morților săi și refacerea elementelor structurale deteriorate reversibil (restituire).
♦ Cu o distrugere semnificativă a unui țesut sau a unui loc de organ, se formează mai întâi un țesut de granulație la locul unui defect al celulelor parenchimatoase și, pe măsură ce se maturizează, o cicatrice, i.e. există o regenerare incompletă.
Inflamație nespecifică și specifică
Inflamație nespecifică nu are caracteristici specifice și poate fi cauzată de diverși agenți flogogeni. inflamație specifică are, împreună cu caracteristici comune, specifice și este cauzată de un anumit agent patogen. Sunt mai multe boli inflamatorii specifice: tuberculoza, sifilisul, lepra, scleromul etc.
INFLAMAȚIE ACUTĂ ȘI CRONICĂ
De-a lungul cursului, acută și inflamație cronică.
Inflamație acută
Inflamația acută se caracterizează prin:
Curs intensiv și finalizarea inflamației, de regulă, în decurs de una sau două săptămâni.
Cel mai adesea, procesele exudative predomină în focarul inflamației, iar o astfel de inflamație este numită „exudativă”.
INFLAMAȚIA EXUDATIVĂ
Inflamația exudativă se caracterizează prin formarea de exudat, a cărui compoziție este determinată în principal de cauza inflamației și de răspunsul organismului la deteriorare.
Inflamație seroasă caracterizată prin formarea de exudat tulbure, care conține o cantitate mică de leucocite, celule epiteliale descuamate și până la 2-2,5% proteine. Exemple: inflamație în urticarie sau pemfigus.
inflamație fibrinoasă caracterizată prin formarea de exudat care conține, pe lângă leucocite, o cantitate mare de fibrinogen, care precipită în țesuturi sub formă de fire de fibrină. Exudatul fibrinos impregnează țesuturile moarte, formând o peliculă gri deschis. În funcție de structura tegumentului epitelial și de caracteristicile țesutului conjunctiv subiacent, se disting două tipuri de inflamație fibrinoasă:
♦ Inflamație crupoasă. Pe un strat epitelial cu un singur strat și o membrană bazală densă se formează un film fibrinos subțire, ușor de îndepărtat. O astfel de inflamație fibrinoasă se numește croupoasă. Se găsește pe membranele mucoase ale traheei și bronhiilor, membranele seroase.
♦ Inflamație difterică. Epiteliul scuamos stratificat nekeratinizant, epiteliul de tranziție și baza de țesut conjunctiv lat a organului contribuie la dezvoltarea necrozei profunde și la formarea unui film fibrinos gros, greu de îndepărtat, după îndepărtarea căruia rămân ulcere profunde. O astfel de inflamație fibrinoasă se numește difterică. Se dezvoltă în faringe, pe membranele mucoase ale esofagului, uterului și vaginului, intestinelor și stomacului, Vezică.
Inflamație purulentă caracterizat prin formarea de exudat purulent. Este o masă cremoasă formată din detritus, celule sanguine moarte (de la 17% la 29%),
microbii. Puroiul are un miros specific, o culoare albăstruie-verzuie cu diverse nuanțe, conținutul de proteine din acesta este de 3-7% sau mai mult. Forme de bază inflamație purulentă sunt abces, flegmon, empiem, rană purulentă.
♦ Abces- inflamație purulentă delimitată cu formarea unei cavități umplute cu exsudat purulent.
♦ Flegmon- inflamatie purulenta difuza, in care exudatul impregneaza si exfoliaza tesuturile.
♦ empiem- inflamația purulentă focală a cavităților corpului sau a organelor goale.
♦ rană purulentă- apare fie ca urmare a supurației unei plăgi traumatice, fie ca urmare a deschiderii unui focar de inflamație purulentă în mediul extern și a formării unei suprafețe a plăgii.
Inflamație putridă(ichorus) se caracterizează prin necroză tisulară severă.
Inflamație hemoragicăînsoțită de o permeabilitate deosebit de ridicată a vaselor microvasculare, diapedeză a eritrocitelor și amestecarea acestora cu exudatul deja existent (inflamație sero-hemoragică, purulent-hemoragică).
Catar caracterizat printr-un amestec de mucus la orice exudat.
SEMNELE DE INFLAMAȚIE ACUTĂ
Semnele de inflamație acută sunt împărțite în locale și generale (sistemice).
semne locale inflamație acută.În focarul inflamației acute se observă: ❖ roşeaţă - rubor;❖ umflătură - tumoră;
♦ durere - dolor;❖ febră (creșterea temperaturii în focarul inflamației) - calorii;❖ disfuncție - functio laesa.
Modificări sistemice ale inflamației acute. Datorită resorbției mediatorilor inflamatori și a produselor de descompunere tisulară din focarul inflamației în sânge, se dezvoltă o serie de efecte sistemice: leucocitoză, febră, disproteinemie, o creștere a vitezei de sedimentare a eritrocitelor, o modificare a starea hormonală organism, alergizare a organismului.
Astfel, inflamație, ființă proces local, reflectă reacția generală, sistemică a organismului la acțiunea unui agent flogogen.
inflamație cronică
Inflamația cronică poate fi primară sau secundară.
Dacă inflamația după perioada acuta devine prelungit, este desemnat ca „cronic secundar”.
Dacă inflamația are inițial un curs persistent (lent și lung), se numește „cronică primară”.
Manifestări ale inflamației cronice. Inflamația cronică se caracterizează printr-o serie de semne: dezvoltarea granuloamelor, formarea de capsule, necroză, infiltrarea tisulară de către monocite și limfocite. Activarea macrofagelor de către factori imuni și non-imuni (Fig. 5-3) provoacă leziuni tisulare suplimentare și dezvoltarea fibrozei. În inflamația cronică, adesea predomină procesul de proliferare, iar o astfel de inflamație se numește proliferativă. Cauzele inflamației cronice diverse:
Diferite forme de insuficiență fagocitară.
Stresul prelungit și alte condiții însoțite de o concentrație crescută de catecolamine și glucocorticoizi în sânge. Aceste grupuri de hormoni suprimă procesele de proliferare, maturare a fagocitelor și potențează distrugerea acestora.
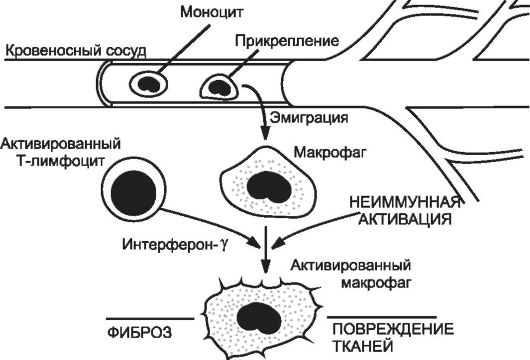 Orez. 5-3. Rolul macrofagelor activate în dezvoltarea și evoluția inflamației cronice. Macrofagele activate sintetizează acidul arahidonic, factorii de creștere a trombocitelor și alți mediatori inflamatori care potențează alterarea secundară. Metaboliții toxici ai oxigenului, proteazele, factorii de chemotaxie a neutrofililor, factorii de coagulare, metaboliții acidului arahidonic și oxidul nitric sunt implicați în dezvoltarea leziunilor tisulare. Endotoxinele, fibronectina, mediatorii chimici ai inflamației sunt importanți pentru dezvoltarea activării non-imune. Dezvoltarea fibrozei depinde de restructurarea colagenului sub influența diverșilor factori de creștere și citokine, precum și de factorii de angiogeneză. [pe 4].
Orez. 5-3. Rolul macrofagelor activate în dezvoltarea și evoluția inflamației cronice. Macrofagele activate sintetizează acidul arahidonic, factorii de creștere a trombocitelor și alți mediatori inflamatori care potențează alterarea secundară. Metaboliții toxici ai oxigenului, proteazele, factorii de chemotaxie a neutrofililor, factorii de coagulare, metaboliții acidului arahidonic și oxidul nitric sunt implicați în dezvoltarea leziunilor tisulare. Endotoxinele, fibronectina, mediatorii chimici ai inflamației sunt importanți pentru dezvoltarea activării non-imune. Dezvoltarea fibrozei depinde de restructurarea colagenului sub influența diverșilor factori de creștere și citokine, precum și de factorii de angiogeneză. [pe 4].
Interacțiunea dintre limfocite și macrofage, care infiltrează țesuturile în exces în timpul inflamației cronice, cu eliberarea unui număr mare de mediatori dăunători (Fig. 5-4).
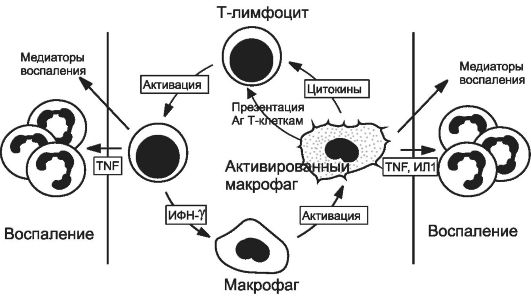 Orez. 5-4. Interacțiunea macrofagelor și limfocitelor în inflamația cronică. Limfocitele și macrofagele activate se influențează reciproc și eliberează mediatori inflamatori care dăunează celulelor din jur. TNF - factor de necroză tumorală. [pe 4].
Orez. 5-4. Interacțiunea macrofagelor și limfocitelor în inflamația cronică. Limfocitele și macrofagele activate se influențează reciproc și eliberează mediatori inflamatori care dăunează celulelor din jur. TNF - factor de necroză tumorală. [pe 4].
Leziuni repetate ale unui țesut sau organ (de exemplu, plămânii prin componente de praf), însoțite de formarea de antigene străine și dezvoltarea reacțiilor imunopatologice.
Caracteristicile microorganismelor (rezistența la acțiunea factorilor sistemului de supraveghere imunobiologică a organismului, mimetism, formarea formelor L).
Principiile terapiei inflamatorii
Tratament etiotrop presupune eliminarea, terminarea, reducerea forței și duratei de acțiune asupra țesuturilor și organelor a factorilor flogogeni. În acest scop, de exemplu, se folosesc medicamente antibacteriene.
Tratament patogenetic are ca scop blocarea mecanismului de dezvoltare a inflamației. În același timp, impacturile vizează ruperea legăturilor din patogeneza inflamației, care stau la baza, în principal, proceselor de alterare și exudare. Pentru aceasta, de exemplu,
antihistaminice, glucocorticoizi, inhibitori de ciclooxigenază.
Terapia sanogenetică are ca scop activarea mecanismelor generale și locale de compensare, regenerare, protecție, restaurare și eliminare a modificărilor țesuturilor și celulelor cauzate de un agent flogogen.
tratament simptomatic. Măsuri care vizează prevenirea sau eliminarea simptomelor neplăcute, dureroase, agravante ale stării pacientului (în acest scop, de exemplu, se folosesc medicamente anestezice, substanțe care contribuie la normalizarea funcțiilor organelor și sisteme fiziologice).
Caracteristicile generale ale inflamației
Inflamaţie- reacția de protecție și adaptare a întregului organism la acțiunea unui stimul patogen, manifestată prin dezvoltarea unor modificări ale circulației sângelui la locul afectarii unui țesut sau organ și o creștere a permeabilității vasculare în combinație cu degenerarea țesuturilor și proliferarea celulară . Inflamația este un proces patologic tipic care vizează eliminarea unui stimul patogen și refacerea țesuturilor deteriorate.
Celebrul om de știință rus I.I. Mechnikov la sfârșitul secolului al XIX-lea a arătat pentru prima dată că inflamația este inerentă nu numai la oameni, ci și la animalele inferioare, chiar și unicelulare, deși într-o formă primitivă. La animalele superioare și la oameni, rolul protector al inflamației se manifestă:
a) în localizarea şi delimitarea focarului inflamator din ţesuturile sănătoase;
b) fixarea în loc, în focar de inflamație a factorului patogen și distrugerea acestuia; c) îndepărtarea produselor de carie și refacerea integrității țesuturilor; d) dezvoltarea imunității în procesul de inflamație.
În același timp, I.I. Mechnikov credea că această reacție de protecție a corpului este relativă și imperfectă, deoarece inflamația este baza multor boli, care se termină adesea cu moartea pacientului. Prin urmare, este necesar să se cunoască tiparele de dezvoltare a inflamației pentru a interveni activ în cursul acesteia și pentru a elimina amenințarea cu moartea din acest proces.
Pentru a desemna inflamația oricărui organ sau țesut până la rădăcina lor nume latin adăugați terminația „it”: de exemplu, inflamația rinichilor - nefrită, ficat - hepatită, vezica urinară - cistita, pleura - pleurezie etc. etc. Odată cu aceasta, medicina a păstrat vechile denumiri pentru inflamația unor organe: pneumonie - inflamația plămânilor, panaritium - inflamația patului unghial al degetului, amigdalita - inflamația gâtului și altele.
2 Cauze și condiții de inflamație
Apariția, cursul și rezultatul inflamației depind în mare măsură de reactivitatea organismului, care este determinată de vârstă, sex, caracteristici constituționale, starea sistemelor fiziologice, în primul rând imunitar, endocrin și nervos, prezența boli concomitente. De o importanță nu mică în dezvoltarea și rezultatul inflamației este localizarea acesteia. De exemplu, un abces al creierului, inflamația laringelui în difterie sunt extrem de amenințătoare pentru viață.
În funcție de severitatea modificărilor locale și generale, inflamația este împărțită în normergică, când răspunsul organismului corespunde forței și naturii stimulului; hiperergic, în care răspunsul organismului la iritație este mult mai intens decât acțiunea stimulului, și hiperergic, când modificările inflamatorii sunt ușoare sau deloc pronunțate. Inflamația poate fi limitată, dar se poate extinde la un întreg organ sau chiar la un sistem, cum ar fi sistemul de țesut conjunctiv.
3 Etape și mecanisme ale inflamației
Caracteristica inflamației, care o deosebește de toate celelalte procese patologice, este prezența a trei etape succesive de dezvoltare:
1) modificări,
2) exudație și 3) proliferare celulară. Aceste trei etape sunt în mod necesar prezente în zona oricărei inflamații.
Modificare- afectarea tesuturilor - este un declansator pentru dezvoltarea procesului inflamator. Aceasta duce la eliberare clasa speciala substanțe biologic active numite mediatori inflamatori. În general, toate modificările care apar în focarul inflamației sub influența acestor substanțe vizează dezvoltarea celei de-a doua etape a procesului inflamator - exsudația. Mediatorii inflamatori modifică metabolismul, proprietățile fizico-chimice și funcțiile țesuturilor, proprietățile reologice ale sângelui și funcțiile elementelor formate. Mediatorii inflamatori includ aminele biogene - histamina si serotonina. Histamina este eliberată de mastocitele ca răspuns la deteriorarea țesuturilor. Provoacă durere, extinderea microvaselor și o creștere a permeabilității acestora, activează fagocitoza, îmbunătățește eliberarea altor mediatori. Serotonina este eliberată din trombocite în sânge și modifică microcirculația la locul inflamației. Limfocitele secretă mediatori numiți limfokine, care activează cele mai importante celule ale sistemului imunitar - limfocitele T.
Polipeptidele din plasmă sanguină - kininele, inclusiv kalikreinele și bradikinina, provoacă durere, dilată microvasele și măresc permeabilitatea pereților lor, activează fagocitoza.
Mediatorii inflamatori includ și unele prostaglandine care provoacă aceleași efecte ca și kininele, reglând în același timp intensitatea răspunsului inflamator.
patogen de protecție împotriva inflamației
Restructurarea metabolismului în zona de alterare duce la o modificare a proprietăților fizico-chimice ale țesuturilor și la dezvoltarea acidozei în ele. Acidoza crește permeabilitatea vaselor de sânge și a membranelor lizozomului, descompunerea proteinelor și disocierea sărurilor, provocând astfel o creștere a presiunii oncotice și osmotice în țesuturile deteriorate. Aceasta, la rândul său, crește fluxul de lichid din vase, provocând dezvoltarea exudației, edemului inflamator și infiltrarea tisulară în zona inflamației.
Exudația- ieșirea, sau transpirația, din vase în țesutul părții lichide a sângelui cu substanțele din acesta, precum și celulele sanguine. Exudația apare foarte repede după alterare și este asigurată în primul rând de reacția microvasculară în focarul inflamației. Prima reacție a vaselor de microcirculație și a circulației sanguine regionale ca răspuns la acțiunea mediatorilor inflamatori, în principal histaminei, este spasmul arteriolelor și scăderea fluxului sanguin arterial. Ca urmare, ischemia tisulară apare în zona inflamației, asociată cu o creștere a influențelor simpatice. Această reacție a vaselor este de scurtă durată. Încetinirea ratei fluxului sanguin și scăderea volumului sângelui care curge duce la tulburări metabolice în țesuturi și acidoză. Spasmul arteriolelor este înlocuit cu expansiunea lor, o creștere a vitezei fluxului sanguin, a volumului sângelui care curge și o creștere a presiunii hidrodinamice, de exemplu. apariția hiperemiei arteriale. Mecanismul dezvoltării sale este foarte complex și este asociat cu o slăbire a simpatiei și o creștere a influențelor parasimpatice, precum și cu acțiunea mediatorilor inflamatori. Hiperemia arterială promovează o creștere a metabolismului în focarul inflamației, crește afluxul de leucocite și anticorpi la acesta, promovează activarea sistemului limfatic, care duce la îndepărtarea produselor de degradare a țesuturilor. Hiperemia vaselor determină creșterea temperaturii și roșeața locului de inflamație.
Hiperemia arterială cu dezvoltarea inflamației este înlocuită cu hiperemia venoasă. Tensiunea arterială în venule și postcapilare crește, fluxul sanguin încetinește, volumul sângelui care curge scade, venulele devin sinuoase și în ele apar mișcări sacadate ale sângelui. În dezvoltarea hiperemiei venoase, pierderea tonusului de către pereții venulelor este importantă din cauza tulburărilor metabolice și a acidozei țesuturilor în focarul inflamației, trombozei venulelor și compresiei lichidului lor edematos. Încetinirea vitezei fluxului sanguin în hiperemia venoasă favorizează mișcarea leucocitelor din centrul fluxului sanguin spre periferie și aderarea acestora la pereții vaselor de sânge. Acest fenomen se numește poziție marginală a leucocitelor, precedă ieșirea lor din vase și trecerea la țesuturi. Hiperemia venoasă se termină cu o oprire a sângelui, adică. apariția stazei, care se manifestă mai întâi în venule, iar mai târziu devine adevărată, capilară. Vasele limfatice sunt pline de limfa, fluxul limfatic încetinește și apoi se oprește, pe măsură ce apare tromboza vaselor limfatice. Astfel, focarul inflamației este izolat din țesuturile intacte. În același timp, sângele continuă să curgă către acesta, iar fluxul de ieșire al acestuia și al limfei este redus brusc, ceea ce previne răspândirea agenților dăunători, inclusiv a toxinelor, în tot organismul.
Exudația începe în perioada hiperemiei arteriale și atinge un maxim în timpul hiperemiei venoase. Eliberarea crescută a părții lichide a sângelui și a substanțelor dizolvate în aceasta din vase în țesut se datorează mai multor factori. Rolul principal în dezvoltarea exsudației este creșterea permeabilității pereților microvaselor sub influența mediatorilor inflamatori, metaboliților (acid lactic, produși de degradare a ATP), enzime lizozomale, dezechilibru al ionilor de K și Ca, hipoxie și acidoză. Eliberarea de lichid se datorează și creșterii presiunii hidrostatice în microvase, hiperonchiei și hiperosmiei țesuturilor. Din punct de vedere morfologic, o creștere a permeabilității vasculare se manifestă prin creșterea pinocitozei în endoteliul vascular, umflarea membranelor bazale. Pe măsură ce permeabilitatea vasculară crește, celulele sanguine încep să se scurgă din capilare în focarul inflamației.
Lichidul care se acumulează în focarul inflamației se numește exudat. Compoziția exudatului diferă semnificativ de transudat - acumulare de lichid în timpul edemului. Exudatul conține un conținut de proteine mult mai mare (3-5%), iar exudatul conține nu numai albumine, precum transudatul, ci și proteine cu greutate moleculară mare - globuline și fibrinogen. În exudat, spre deosebire de transudat, există întotdeauna celule sanguine - leucocite (neutrofile, limfocite, monocite) și adesea eritrocite, care, acumulându-se în focarul inflamației, formează un infiltrat inflamator. Exudația, adică fluxul de lichid din vase în țesut spre centrul focarului de inflamație, previne răspândirea iritantului patogen, a produselor reziduale ale microbilor și a produselor de degradare ale propriilor țesuturi, promovează intrarea leucocitelor și a altor celule sanguine, anticorpi și substanțe biologic active în focarul inflamației. Exudatul conține enzime active care sunt eliberate din leucocite moarte și lizozomi celulari. Acțiunea lor vizează distrugerea microbilor, topirea rămășițelor celulelor și țesuturilor moarte. Exudatul conține proteine și polipeptide active care stimulează proliferarea celulară și repararea țesuturilor în stadiul final al inflamației. În același timp, exudatul poate comprima trunchiurile nervoase și poate provoca durere, perturba funcția organelor și poate provoca modificări patologice în ele.
Exudația este însoțită de emigrarea leucocitelor și a altor celule sanguine, adică. trecerea lor de la pat vascularîn țesătură. Emigrarea leucocitelor include o perioadă de staționare marginală la peretele vasului, trecerea prin perete și o perioadă de mișcare în țesut. Trecerea leucocitelor prin peretele vasului se realizează după cum urmează. Celulele endoteliale ale vasului se contractă, iar leucocitul ejectează o parte din citoplasmă, pseudopodii, în golul interendotelial rezultat. Apoi, întreaga citoplasmă este turnată în pseudopodii, iar leucocitul se află sub endoteliocit. După ce a depășit membrana bazală, aceasta trece dincolo de vas și se deplasează în centrul focarului inflamator. Astfel, granulocitele (neutrofile, eozinofile, bazofile), precum și eritrocitele, trec prin peretele vascular. Monocitele și limfocitele emigrează din vas într-un mod diferit, trecând direct prin celula endotelială. Mișcarea leucocitelor către centrul focarului de inflamație este facilitată de sarcina lor negativă, în timp ce ionii H - încărcați pozitiv se acumulează în țesuturile inflamate.
I.I. Mechnikov a dezvoltat conceptul de chemotaxie a leucocitelor, adică. mișcarea lor din cauza iritației chimice. În conformitate cu această idee, leucocitul nu este atras pasiv de forțele externe - mișcarea fluidului, diferența de sarcini, ci percepe diverși stimuli chimici și răspunde activ la aceștia deplasându-se de-a lungul gradientului de concentrație al substanțelor care apar în focarul inflamației. . În prezent, se știe că mulți compuși cauzează chemotaxia leucocitară.
Fagocitoza se desfășoară în patru etape:
1) apropierea de obiect,
2) aderența obiectului la învelișul fagocitei,
3) imersarea obiectului în fagocit,
4) digestia intracelulară a obiectului fagocitat. În citoplasma fagocitei din jurul obiectului fagocitozei, se formează o vacuolă - un fagozom. Lizozomul fagocitei se apropie de el, fagozomul și lizozomul se contopesc, formând un fagolizozom, în interiorul căruia enzimele lizozomale digeră obiectul fagocitat.
Există fagocitoză completă și incompletă. În primul caz, obiectul fagocitozei este complet distrus. Cu fagocitoza incompletă din mai multe motive, microorganismul fagocitat nu este distrus. Mai mult, în fagocit își găsește un habitat bun și se înmulțește. Ca urmare, fagocitul moare, iar microorganismele sunt transportate de sânge și limfă. O astfel de insuficiență a fagocitozei poate fi ereditară și dobândită. Insuficiența ereditară a fagocitozei apare atunci când maturarea fagocitelor este afectată, precum și atunci când formarea enzimelor acestora este inhibată. Insuficiența dobândită a fagocitozei poate apărea cu boala de radiații, înfometarea de proteine, la bătrânețe, cu un tratament pe termen lung cu hormoni steroizi care inhibă fagocitoza și dintr-o serie de alte motive.
Proliferare- procesul de reproducere celulară este etapa finală a inflamației. Celulele mezenchimului, vaselor de sânge, sânge - limfocitele și monocitele se înmulțesc. Fibroblastele proliferează în mod deosebit activ, care servesc ca sursă de proteină de colagen, care formează țesutul conjunctiv. Ca urmare a proliferării celulare la locul focarului inflamației, fie se reface un țesut similar cu cel distrus, fie se formează mai întâi un țesut de granulație tânăr, care, la maturitate, se transformă într-un țesut conjunctiv fibros matur, formând un cicatrice. Este posibil să nu afecteze funcția organului, dar în unele cazuri provoacă alte procese patologice. Deci, o cicatrice în partea pilorică a stomacului, formată la locul unui ulcer vindecat, poate împiedica evacuarea masei alimentare. O cicatrice în țesuturile unui membru poate irita terminațiile nervoase și poate provoca durere, afecta funcția articulațiilor sau musculare. Uneori, cicatricea trebuie îndepărtată chirurgical.
Astfel, rezultatul inflamației este fie o restaurare completă a țesutului deteriorat, fie formarea unei cicatrici în locul său.
4 Manifestări locale și generale ale inflamației
Manifestări locale ale inflamației a permis chiar lui Galen și Celsus (secolul al II-lea d.Hr.) să identifice 5 trăsături caracteristice principale ale acestuia: roșeață, căldură, umflare, durere și disfuncție. Roșeața este asociată cu dezvoltarea hiperemiei arteriale. O creștere a fluxului de sânge arterial care conține oxihemoglobină roșu aprins provoacă înroșirea pielii. Hiperemia arterială formează și al doilea semn de inflamație - febră (creșterea temperaturii locale). Umflarea apare din cauza acumulării de exudat în țesuturile inflamatorii. Durerea este un semn tipic de inflamație. Apare din cauza formării crescute a mediatorilor durerii în focarul inflamației - în primul rând histamina, kinine, precum și unii metaboliți (acid lactic), ioni H, K.
Este important și edemul, în care receptorii durerii și căile nervoase sunt comprimate. Încălcarea funcției organului inflamat este asociată cu modificări patologice ale metabolismului, circulației sângelui și reglării nervoase.
Durerea joacă un rol important în disfuncția organului în timpul inflamației. Deci, de exemplu, cu inflamarea mușchilor și a articulațiilor, o persoană restricționează în mod deliberat mișcarea, evitând durerea.
Manifestări comune ale inflamației sunt de obicei de natură protectoare și adaptativă. Tipic trasatura comuna majoritatea proceselor inflamatorii este o creștere a numărului de leucocite pe unitatea de volum sânge periferic- leucocitoza si modificarea formula leucocitară. Cu toate acestea, se știe că procesele inflamatorii însoțesc boli infecțioase(febră tifoidă), în care numărul de leucocite din sângele periferic scade.
Febra apare adesea cu inflamație. Se dezvoltă sub influența pirogenilor, care sunt formați din leucocite neutrofile. Inflamația se modifică compozitia proteinelor sânge. Inflamația acută este de obicei însoțită de o creștere a nivelurilor plasmatice de - și - globuline și de inflamație cronică - globuline. Leucocitoza, febra si acumularea in sange – globulinele au o mare importanta adaptativa. Leucocitele fagocitează și distrug microorganismele. O creștere a temperaturii în timpul febrei provoacă diverse efecte adaptative, inclusiv creșterea activității leucocitelor, sporirea producției de imunoglobuline care conțin anticorpi. Datorită modificărilor compoziției fracțiilor proteice ale plasmei sanguine (scăderea albuminei și creșterea globulinelor), precum și scăderea încărcăturii eritrocitelor în timpul inflamației, viteza de sedimentare a eritrocitelor (VSH) crește. Modificări generaleîn organism se poate manifesta și prin dureri de cap, slăbiciune, stare de rău și alte simptome.
Lista literaturii folosite
1. Paukov V.S., Khitrov N.K. Patologie: manual. - M.: Medicină, 1989.
2. Levchenko V.A., Seredyuk N.M., Vakalyuk I.P., Malinovskaya O.I., Mudrak M.V., Koval N.M. Boli interne: manual. - Lvov.: Editura „Lumina”, 1995.
3. Cherenko M.P. Manualul unui chirurg policlinic: - K .: „Sănătatea”, 1990.


