31.07.2019
Celulele inflamatorii. Marea enciclopedie a petrolului și gazelor
Cel mai important proces inflamația este emigrarea leucocitelor din vase în țesutul deteriorat de flogogen pentru implementarea funcției de protecție a leucocitelor. Cu toate acestea, leucocitele apar în focarul inflamației și efectuează o alterare secundară, adică. îndeplinesc și o funcție de reglementare.
Emigrarea leucocitelor se efectuează după cum urmează: leucocitele părăsesc curentul axial, mai întâi la marginea stratului de plasmă, apoi încep să adere la celulele endoteliale ale vasului. Un rol important în adeziunea (lat. adhaesio - lipire) leucocitelor este atribuit moleculelor de adeziune endoteliale-leucocite. selectine și integrine. Sub influența citokinelor IL-1,8, FAT, TNF-α, componentele complementului, apar modificări conformaționale în membranele leucocite și endoteliale și se exprimă molecule de adeziune.
Etapele emigrării:
Stadiul I - aderența reversibilă, rularea sau alunecarea leucocitelor;
Stadiul II - aderența ireversibilă la endoteliu și migrarea transendotelală ulterioară;
· etapa a III-a- chemotaxie - mișcare dirijată în focarul inflamației.
Adeziunea leucocitelor la endoteliu vas se produce conform principiului mecanismului ligand-receptor. Factorii de stimulare a aderenței leucocitelor sunt mediatorii inflamatori: eicosanoizii, aminele biogene, interleukina-1, interleukina-8, FAT, TNF-α, componentele complementului.
Faza de rulare (planarea leucocitelor) este asigurata de molecule - selectine.Exista 3 subgrupe de selectine:
- L-selectine (LAM-1) sintetizat de leucocite
- P-selectină - ligand de glicoproteină (GMP-140)
- E-selectină(ELAM-1) este sintetizat de endoteliocite
Orez. 6. Exprimarea moleculelor de adeziune pe endoteliu
faza de aderenta stransa - o etapă ulterioară a interacțiunii dintre leucocite și endoteliul vascular este asigurată de molecula ICAM-1 (molecula de adeziune intercelulară -1 sau molecula de adeziune intercelulară-1) (Fig. 6) și VCAM-1 (molecula de adeziune celulară a vasului-1 sau tip 1). moleculă de adeziune endotelială vasculară) (Figura 7).
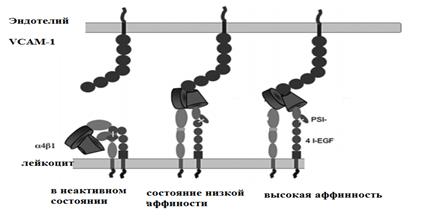
Orez. 7. Variante ale diferitelor afinități ale moleculelor de adeziune celulară
Migrație transendotelială leucocitele din țesut reprezintă un element cheie al imunității înnăscute și adaptive. Acest proces are două modalități posibile implementare. Spărgând membrana bazală peretele vascular eventual prin contact interendotelial (migrare paracelulară). Toate granulocitele care au un nucleu segmentat pot trece între celulele endoteliale prin joncțiuni interendoteliale, deoarece nucleele neutrofile segmentate pot trece prin goluri înguste. Rolul moleculei PECAM este important în migrarea transendotelială a leucocitelor ( moleculă de adeziune plachetar/celulă endotelială).
Formarea legăturii între moleculele PECAM de pe leucocite și endoteliu este etapa cea mai vulnerabilă în întregul proces de transmigrare a leucocitelor. Mecanismul de transmigrare dependent de PECAM este următorul proces: pe măsură ce leucocitele se deplasează spre membrana bazală a celulei, ele formează pseudopodi la joncțiunile interendoteliale. La sfârșitul procesului de conectare a leucocitelor cu endoteliul, întreaga celulă se deplasează în stratul subendotelial.
celule mononucleare, cum ar fi monocitele și limfocitele, sunt, de asemenea, capabile să treacă între celulele endoteliale cu activarea semnificativă a endoteliului și modificarea formei acestuia.
Mișcarea leucocitelor către focarul inflamației.
Procesul de mișcare direcționată a leucocitelor (microfage, macrofage) către focarul inflamației se numește chimiotaxie, iar substanţele care provoacă această mişcare dirijată a celulelor se numesc chimioatractanteși sunt împărțite în exogene și endogene. Chemoatractanții exogeni includ deșeuri sau elemente structurale ale microorganismelor, precum și alte substanțe străine.
Rolul principal în stimularea chemotaxiei leucocitelor revine chimioatractanților endogeni, care sunt nespecifici și specifici. Majoritatea substanțelor biologic active, precum și produșii de deteriorare celulară și mediatorii inflamatori (histamină, serotonina, ATP, ADN, produșii de degradare a fibrinei (FDP), produșii de degradare a colagenului, fibronectina, trombina) acționează ca chimioatractanți nespecifici. Unele substanțe sunt de o importanță fundamentală pentru chemotaxie, iar încălcarea formării lor afectează în mod semnificativ eliberarea leucocitelor din vase. Aceste substanțe sunt numite chimioatractanți specifici. Acestea includ: leucotriene B4 și complement (C5a, C3a) (determină chemotaxia neutrofilelor, eozinofilelor și monocitelor); factor de activare a trombocitelor (afectează chemotaxia neutrofilelor și eozinofilelor)
Specificitatea componentelor LtB 4 , FAT, complement C5a și C3a este mai degrabă condiționată, deoarece aceste substante au multe alte efecte, dintre care stimularea chemotaxiei este una dintre cele mai importante. În timpul inflamației, ele se formează în număr mare și atrag în principal granulocitele neutrofile la locul inflamației.
Un rol deosebit în mecanismele chemotaxiei revine chemokinelor, citokinelor care reglează chimiotaxia. Dintre acestea, cel mai activ efect chemoatractant îl are interleukina-8 (IL-8). Poate fi produs de majoritatea celulelor ca răspuns la expunerea la endotoxină, TNF-α și IL-1. În plus, chemokinele includ peptida activatoare de neutrofile ale celulelor epiteliale (ENA-78), peptida activatoare de neutrofile-2 (NAP-2) și proteina inflamatorie a macrofagelor α și β (MIP-1), proteina inflamatorie a macrofagelor-2 α și β ( MIP-2), proteina de chemotaxie a monocitelor (MCP-1, 2 și 3), eotaxină.
Chemokinele sunt responsabile pentru o mai mare reglare a ieșirii din vasele diferitelor leucocite, ceea ce contribuie la succesiunea corectă a emigrării leucocitelor. Reglarea secvenței de eliberare a leucocitelor din vase este importantă semnificație biologică. Prima linie de apărare în orice inflamație sunt leucocitele neutrofile, care aparțin imunității nespecifice. Dacă este imposibil să distrugi rapid antigenul, imunitatea specifică este conectată activ, iar mai întâi celulele prezentatoare de antigen (monocite din sânge), apoi limfocitele și eozinofilele, intră în focarul inflamației.
Organele și țesuturile au, de asemenea, propria lor populație de macrofage reziduale, care joacă un rol cheie în inițierea unui răspuns inflamator local. În timpul recrutării neutrofilelor, populația de macrofage reziduale scade. Acest fenomen a fost numit reacții de dispariție a macrofagelor. La fel ca neutrofilele, monocitele din sânge migrează, de asemenea, în focarul inflamației și de ceva timp se transformă în macrofage, cu toate acestea, numărul lor maxim în țesut este observat ceva mai târziu decât neutrofilele.
Neutrofilele au proprietăți histotoxice puternice. Prin urmare, pe măsură ce alte leucocite sunt recrutate, neutrofilele trebuie să moară prin apoptoză sau necroză. În plus, o parte din neutrofile este capabilă să părăsească locul inflamației prin sistemul de drenaj limfatic și să intre înapoi în fluxul sanguin.
FAGOCITOZĂ
Ilya Ilici Mechnikov a descris fagocitoza în 1883 ca un fenomen biologic general în viața unicelulară și organisme pluricelulare, constând în absorbția de către celulele altor celule.
Fagocitoza este procesul de captare a particulelor de către o celulă prin endocitoza receptorului. Activitatea maximă a fagocitelor se observă în raport cu particulele cu un diametru mai mare de 1 micron. Cu toate acestea, este posibilă și fagocitoza particulelor mai mici, de până la 100 nm în diametru. Fagocitoza în focarul inflamației este efectuată de macrofage, care sunt fagocite „profesionale”. Fagocitoza se desfășoară în mai multe etape: 1 - abordare (chemotaxie), 2 - aderență la obiectul fagocitozei (atracție, aderență), 3 - imersarea obiectului fagocitozei (endocitoza receptorului), 4 - uciderea (uciderea), 5 - intracelular digestie.
3.6.1. aderenţa unui leucocite la un obiect de fagocitoză este proces mediat de receptor. Pe membrana leucocitelor pot fi găsiți receptori pentru mulți antigeni ai microorganismelor, care aparțin receptorilor „imunitații primare”. Cu toate acestea, acest mecanism de legare a unui leucocite la un antigen este limitat și nu permite un răspuns imun cu drepturi depline. Prin urmare, în majoritatea cazurilor, aderența unui leucocite la obiectul fagocitozei se realizează cu ajutorul „mediatorilor” universali, care sunt imunoglobulinele (în principal IgG) și sistemul complement (C3b). Procesul de legare a obiectului fagocitozei cu astfel de proteine pentru fagocitoza ulterioară se numește opsonizarea, în timp ce proteinele care îndeplinesc această funcție sunt opsonine. După opsonizarea obiectului fagocitozei, leucocitul interacționează nu cu antigenul microorganismului, ci cu imunoglobulina prin receptorul corespunzător pentru fragmentul Fc al imunoglobulinei sau prin receptorul pentru C3b. Cele mai active ca opsonine sunt imunoglobulinele G1 și G3, într-o măsură mai mică Μ și Ε. Sunt recunoscuți de Fcy sau de alți receptori Fc. Factorul de complement C3b și forma sa instabilă iC3b sunt, de asemenea, implicate în opsonizarea prin receptorii CR1-CR3 atât atunci când sunt activate direct de obiecte de fagocitoză, cât și atunci când sunt activate de imunoglobuline și complexe imune. Opsonizarea crește activitatea de aderență de câteva ori. Proteina C reactivă este, de asemenea, o co-opsonină, deoarece leagă proteina C a pneumococilor și a altor microbi și mediază atașarea factorilor complementului și fagocitelor la aceștia.
Uneori, opsonizarea poate avea un efect negativ. Unele microorganisme (de ex. Staphylococcus aureus) și virusurile (de exemplu, virusul herpes) în procesul de evoluție au dezvoltat abilități care le permit să evite opsonizarea cu ajutorul analogilor proteici ai receptorilor Fcy. Ele blochează anticorpii opsoninei și împiedică fagocitele să se lipească de obiectul care le posedă. Agenții patogeni care au capacitatea de a se lega de anticorpi nu numai pe Fab, ci și pe fragmentul Fc, sunt capabili să provoace formarea de complexe mari care conțin mai multe molecule de imunoglobuline și corpuri microbiene (particule virale).
Inițial, organismul are o cantitate insuficientă de imunoglobuline care se pot lega de un anumit antigen al microorganismului, astfel încât activitatea maximă a fagocitozei este imposibilă fără formarea unei cantități suficiente de imunoglobuline specifice acestui antigen. După recunoașterea antigenului și producerea de imunoglobuline specifice antigenului, procesul de opsonizare se intensifică, ceea ce are ca rezultat distrugerea microorganismului, inclusiv prin fagocitoză.
3.6.2 Etapa de scufundare obiectul fagocitozei se încheie cu formarea unui fagozom. Acest proces este dependent de energie și este asociat cu activitatea proteinelor contractile ale fagocitelor, care are loc după interacțiunea microorganismului opsonizat cu receptorii corespunzători de pe membrana fagocitelor. Ca urmare a scufundării, obiectul se află în citoplasma fagocitei, complet înconjurat de un fagozom creat prin invaginarea și închiderea unei secțiuni a membranei celulare.
3.6.3.Etapa de digestie apare cu participarea microfilamentelor citoscheletice și a proteinelor fagozogene. Fagozomul fuzionează cu lizozomii și granulele specifice fagocitei (degranulare internă), formând un fagolizozom, unde are loc stadiul final al fagocitozei. Toate aceste procese sunt inițiate de intrarea ionilor de calciu în celulă și de activarea proteinei kinazei C.
Distrugerea (uciderea) obiectelor fagocitozei are loc printr-o varietate de mecanisme. Ele sunt împărțite în dependenți de oxigen și independenți de oxigen:
Ucidere dependentă de oxigen constă în distrugerea conținutului fagozomului de către componente formate în reacția de halogenare și peroxidare și anume, hipoclorit, peroxid de hidrogen, oxigen singlet, radicali hidroxil și alte specii reactive de oxigen.
La mecanismele independente de oxigen include expunerea la substanțe precum lizozima, elastaza, colagenaza, catepsinele, lactoferina, proteinele cationice (defensine, protegrine).
După moartea microorganismului, are loc digestia finală a structurilor acestuia de către enzimele fagocitare. Fagocitoza, care s-a încheiat cu distrugerea microorganismului și digestia obiectului fagocitozei se numește efectuat.
3.6.3.3. fagocitoză incompletă.
1. Blocarea fuziunii fagozom-lizozomale întâlnită în viruși (de exemplu, virusul gripal), bacterii (micobacterii) și protozoare (toxoplasmă).
2. Rezistenta la enzimele lizozomale (gonococi si stafilococi).
3. Capacitatea microorganismelor patogene de a părăsi rapid fagozomii după absorbție și de a rămâne în citoplasmă pentru o perioadă lungă de timp (rickettsiae).
4. Capacitatea de a produce catalaza, care distruge peroxidul de hidrogen (stafilococ, aspergillus), care blocheaza distrugerea microorganismelor si functia prezentatoare de antigen a fagocitei.
PROLIFERARE
Proliferarea în contextul inflamației se referă la procesul de refacere a structurii țesutului deteriorat, care are loc la câteva ore după deteriorare. Scopul proliferării poate fi atins numai dacă nu mai apare nicio deteriorare a țesuturilor, altfel celulele noi vor fi distruse de factorii dăunători. În procesul de proliferare, se disting 3 etape:
curăță țesutul de deteriorat elemente celulare, microorganisme și alte elemente străine
stimularea creșterii vasculare în țesutul deteriorat
restabilirea integrității țesuturilor.
Procesul de proliferare și reparare a țesutului deteriorat devine semnificativ numai în momentul în care procesele principale de deteriorare primară și secundară sunt finalizate. Condiția principală pentru desfășurarea cu succes a procesului reparator în inflamație este atenuarea modificărilor acute alterative și exsudative. Acest lucru este realizabil numai dacă agentul flogogen este complet eliminat (eliminat). Dacă agentul flogogen nu este eliminat complet, inflamația poate deveni cronică. A doua condiție pentru trecerea la procesele reparatorii necesită acțiunea mediatorilor antiinflamatori.
Curățarea țesăturilor leucocitele neutrofile și macrofagele, care sunt celulele principale, se desfășoară din celulele și microorganismele deteriorate inflamație acută. Leucocitele neutrofile înconjoară focarul inflamației, creând o barieră între zona afectată și țesutul sănătos. O funcție similară este îndeplinită de staza venoasă, împiedicând răspândirea flogogenului prin vase.
Angiogeneza - are loc refacerea rețelei vasculare în țesutul deteriorat sub influența factorilor de creștere. Acestea includ factorul de creștere a fibroblastelor (FGF), factorul de creștere derivat din trombocite (PDGF), factorul de creștere endotelial vascular (VEGF), factorul de creștere transformant (TGF α și β), factorul de creștere epidermică (EGF)). Sub influența lor, are loc divizarea celulelor endoteliale, dintre care unele provin direct din focarul inflamației, iar altele vin sub formă de precursori ai celulelor endoteliale din măduvă osoasă, și formarea tubului viitorului capilar (angiogeneză). Celulele endoteliale din capilarele nou formate sunt incompetente din punct de vedere funcțional, iar aceste vase sunt foarte permeabile. Apoi celulele endoteliale „se maturizează”, se formează membrana bazală, iar vasele nou formate capătă proprietățile capilarelor normale.
Regenerare este înlocuirea celulelor pierdute cu celule de același tip. Dacă o restaurare cantitativă completă a celulelor parenchimatoase este imposibilă, de exemplu, cu pierderea elementelor celulare incapabile de diviziune, atunci defectul parenchimului este completat cu țesut conjunctiv. Se formează un țesut tânăr de granulație, bogat în vase regenerante, foarte permeabile, apoi un țesut conjunctiv și o cicatrice. În timpul proceselor reparatorii în focarul inflamației, regenerarea celulară și creșterea țesutului conjunctiv sunt realizate prin creșterea proliferării. Stimulanti de proliferare sunt și factori de creștere. Factorii de creștere conducători pentru diferite celule pot varia. Deci, dacă pentru endoteliocite cel principal poate fi numit factor de creștere a endoteliului vascular (VEGF), atunci pentru fibroblaste - factor de creștere a fibroblastelor (FGF), iar pentru celulele epiteliale - factor de creștere epidermică (EGF).
Rezultatele inflamației acute
Rezultatele inflamației acute depind de factor etiologic care provoacă leziuni primare, precum și reactivitatea organismului, care determină gradul de deteriorare secundară și gradul de regenerare.
Rezultatul favorabil al inflamației -restaurarea completă a structurii și funcției apare în timpul inflamației în țesuturile bine regenerate, cu condiția unei cantități relativ mici de țesut deteriorat din cauza creșterii țesutului conjunctiv și a parenchimului, care apar concomitent cu creșterea vaselor de sânge. În funcție de activitatea lor proliferativă, țesuturile sunt împărțite în 3 tipuri: cu activitate proliferativă ridicată (măduva osoasă, epiteliul pielii și mucoaselor); cu posibilă activitate proliferativă în condiții de afectare (hepatocite); țesuturi neproliferante (nerv, mușchi).
Procesele de proliferare au nu numai mecanisme de stimulare, ci și de reglare inhibitorie, ceea ce este de asemenea foarte important. Astfel, fibroblastele implicate în regenerarea tisulară își pierd treptat activitatea proliferativă, ceea ce împiedică proliferarea lor excesivă. În acest caz, expresia factorilor de creștere și a receptorilor pentru aceștia este suprimată. Un obiect important în mecanismul de reglare a activității proliferative a celulelor îl reprezintă conexinele, molecule care formează nu numai contacte intercelulare, ci formează și canale prin care pătrund ionii de calciu și cAMP, afectând activitatea proliferativă a celulelor. Inhibarea activității proliferative a celulelor se realizează folosind așa-numitul fenomen de „inhibare a contactului”, când, la atingerea unei anumite densități de contacte celulare, inhibarea activității proliferative începe la nivelul de reglare a genomului celular.
Rezultatul relativ favorabil al inflamației – Refacerea incompletă a structurii(cicatrice) apare în orice țesut cu moarte celulară severă, sau cu orice lezare a țesuturilor cu posibilă activitate proliferativă sau a țesuturilor neproliferante (cicatrici pe piele datorate traumatismelor mecanice sau arsurilor, cardioscleroză postinfarct). Cu o creștere a activității proliferative a fibroblastelor și o reglare inhibitorie insuficientă, este posibilă proliferarea lor excesivă, care se manifestă sub formă de cicatrici hipertrofice și cheloide. Apariția unor astfel de cicatrici are parțial o predispoziție genetică asociată cu unele gene din sistemul HLA (HLA BW16, HLA BW21). S-a dovedit că fibroblastele din cicatricile hipertrofice și cheloide sunt mai active, produc mai mult colagen, fibronectină și proteoglicani și, de asemenea, au sensibilitate redusă la mecanismele de reglare.
Formarea unui defect tisular- O altă opțiune pentru un rezultat relativ favorabil al inflamației. Cu activitate insuficientă a proceselor proliferative pe fondul hipoxiei tisulare cronice, de exemplu, în patologia microvaselor în microangiopatia diabetică sau în cronică. insuficiență venoasă procesele de proliferare pot fi întârziate semnificativ. Iar discrepanța dintre pierderea naturală a celulelor și recuperarea lor poate duce la formarea unui defect tisular (ulcer).
Rezultate nefavorabile ale inflamației:
Moartea organelor sau țesutul are loc cu leziuni primare extrem de severe și cu o încălcare a reactivității corpului, de exemplu, pe fondul tulburărilor circulatorii (gangrenă).
Generalizarea inflamației(sepsis) este asociată cu intrarea în sânge a unui număr mare de citokine (IL-1b, IL-6, TNF-a) și dezvoltarea unui „sindrom de răspuns inflamator sistemic”. Generalizarea infecției dincolo de focarul inflamației se realizează prin vasele limfatice și de sânge.
inflamație cronică sta la baza multor boli comune, din artrita reumatoida iar tuberculoza la pneumoconioza si ateroscleroza. Motivul principal trecerea inflamației acute la cronice este o lezare tisulară permanentă pe termen lung prin factori infecțioși sau neinfecțioși. Inflamația infecțioasă cronică apare în două cazuri: 1 - odată cu dezvoltarea imunodeficienței, când sistemul imunitar organismul nu poate face față infecției; 2 - în cazul unei boli cauzate de o infecție specifică și insuficiență inițială a imunității împotriva agentului patogen (micoplasme, spirochete, chlamydia, protozoare etc.). Inflamația cronică neinfecțioasă se dezvoltă și din două motive: 1 - cu actiune de lunga durata asupra țesutului factorilor dăunători străini endo- sau exogeni (componente de praf, un corp străin în țesut); 2 - cu dezvoltare proces autoimun când există leziuni tisulare permanente de către autoanticorpi sau limfocite sensibilizate.
Mecanisme inflamație cronică diferă de mecanismele inflamației acute, precum și de compoziția lor celulară. Dacă în inflamația acută principalele celule efectoare sunt granulocitele neutrofile, atunci în inflamația cronică acestea sunt monocitele/macrofagele și limfocitele. Particularitatea inflamației cronice constă în infiltrarea mononucleară a țesuturilor afectate de către limfocite și macrofage. Adesea există o acumulare și o funcționare activă prelungită a macrofagelor în focarele de inflamație. Acest lucru este facilitat de factori care inhibă migrarea macrofagelor - lipidele oxidate, precum și peptidele secretate de limfocitele T (MIF).
Pentru inflamația cronică asociată cu acțiunea infecției, mecanismul unei reacții hiperergice de tip întârziat (DTH) este caracteristic. Citokinele eliberate în timpul infiltrației macrofage-limfocite activează reciproc limfocitele și macrofagele, creând un cerc vicios care menține inflamația, în special proteina chemotactică a monocitelor-1 (MCP-1) și proteina-beta inflamatorie a macrofagelor (MIP-1β).
Angiogeneza în zona de inflamație cronică: Inflamația cronică este însoțită de o activitate proliferativă ridicată a componentelor peretelui vascular și de creșterea vaselor de sânge (angiogeneza) datorită factorilor de creștere precum factorul de creștere a fibroblastelor (α-FGF și β-FGF). ). Factorul de creștere transformator (TGF-β), care are o acțiune pro-angiogenă, stimulează diferențierea celulelor musculare netede și formarea membranei bazale a vaselor de sânge.
Răspunsuri sistemice în inflamația acută
Răspunsurile sistemice ale organismului la inflamația acută sunt numite reacție de fază acută . Inflamația, de regulă, este însoțită nu numai de reacții locale, ci și de reacții sistemice. Reacțiile sistemice ale organismului la inflamație sunt asociate în principal cu eliberarea de citokine în sânge. Principalele citokine care provoacă o reacție sistemică sunt interleukina-1 β (Il-1b), interleukina-6 (Il-6) și factorul de necroză tumorală alfa (TNF-a).
· Inflamația acută provoacă pierderea poftei de mâncare, sănătate precară, somnolență, scăderea toleranței la stres fizic și psihic. Citokine (în principal TNF-a și IL-1 ) afectează zonele hipotalamusului și alte structuri ale sistemului nervos central responsabile de somn, provocând stimularea acestora. Prin urmare, cu inflamația acută, pacienții, de regulă, experimentează somnolență generală și stare generală de rău, care sunt adesea numite semne de „intoxicație”. Unele citokine, cum ar fi IL-1, sunt produse de microglia sub acțiunea stimulilor proinflamatori. Influența citokinelor asupra centrului de termoreglare din hipotalamus duce la dezvoltarea febrei. Citokinele modifică și activitatea funcțională a nucleilor hipotalamusului, influențând formarea neurotransmițătorilor.
Ca urmare a activării sistemului hipotalamo-hipofizo-suprarenal, nivelul catecolaminelor și glucocorticoizilor crește.
· Răspunsul măduvei osoase inflamația acută este activarea leucopoiezei, care duce la creșterea numărului de leucocite din sânge (leucocitoză) și, într-o măsură mai mică, la creșterea producției de trombocite. Pe fondul unor astfel de modificări ale leucocitelor și trombocitelor, există o anumită inhibare a eritropoiezei, care este însoțită de anemie.
· Funcția proteine-sintetică a ficatului: citokinele, în primul rând interleukina-6, cresc formarea proteinelor de fază acută în ficat. „Proteine de fază acută” este denumirea generală pentru proteinele formate în ficat în timpul inflamației, care au o funcție protectoare. Ele participă la protecția antimicrobiană, antioxidantă, antitoxică și fac parte din sistemul hemostazei.
Gastrointestinal: scăderea secreției suc gastric, motilitatea tractului gastrointestinal este inhibată.
Pagina 1
Focalizarea inflamatorie care apare în cornee provoacă iritarea terminațiilor nervoase, ceea ce presupune un răspuns tipic: fotofobie, lacrimare, blefarospasm, senzație. corp strain sub pleoapa Combinația acestor semne subiective se numește sindrom corneean. În prezența unui astfel de sindrom, corneea trebuie examinată cu atenție. Infiltratul inflamator în cornee este însoțit de înroșirea ochiului. În același timp, în proces sunt implicate vasele profunde ale regiunii perimbalului. Aportul de sânge și expansiunea acestor vase determină o culoare violet strălucitoare sub forma unei corole care înconjoară corneea. O astfel de hiperemie locală a ochiului se numește injecție perio-corneană.
Diferențierea unui focar inflamator proaspăt și a unei opacificări cicatrici veche este foarte importantă în diagnosticul și alegerea tratamentului. Este deosebit de important să ne amintim acest lucru în bolile recurente pentru a distinge focalizarea veche de cea nouă, conjunctivita pe ochi cu un ghimpe de la keratită, iridociclita în prezența cicatricilor corneene de la keratoirită.
Sursa osteoperiostitei anterioare sunt focarele inflamatorii în țesuturile adiacente orbitei pleoapelor, regiunea periorbitală, organele lacrimale, pielea feței, dar cel mai adesea provin din sinusuri paranazale nasul cu empiem al acestuia din urmă, din dinții cariați, iar la copiii sub vârsta de 3 luni - din rudimentele lor. Procesul inflamator se extinde de la focarul primar de-a lungul continuării sau de-a lungul vaselor venoase cu tromboflebită. La infectii comune procesul inflamator în pereţii osoşi ai orbitei se poate produce pe cale hematogen-metastatică.
Localizarea coloranților coloidali în focarele inflamatorii a determinat utilizarea derivaților radioactivi ai acestor coloranți pentru a detecta abcesele interne. În acest scop, a fost sintetizat dibromtripan. La iepuri, leziunile au fost induse prin injectarea de stafilococi virulenți lângă o masă de agar gelatinizată în țesutul subcutanat.
Descarcarea convalescentelor este posibila dupa recuperarea clinica si disparitia focarului inflamator din plamani. După externarea din spital în scop de profilaxie efecte rezidualeși posibilitatea de recidivă, examenul clinic este necesar în decurs de 1 până la 2 ani.
Evident, trebuie să admitem că există o anumită interacțiune între activitatea focarului inflamator din ochi și starea imunobiologică generală a pacientului. Și dacă posibilitatea unui focar violent al procesului tuberculos în ochi depinde în mare măsură de starea imunobiologică generală a corpului, atunci focalizarea inflamatorie a ochiului în sine, la rândul său, poate afecta într-o oarecare măsură sensibilitatea generală. Această întrebare a fost deja ridicată în mod repetat, dar nu a primit încă o soluție suficient de convingătoare. În orice caz, considerațiile lui Lelein (Lohlein, 1950) conform cărora dimensiunea focarului inflamator ocular sunt prea mici pentru ca acesta să aibă vreun efect vizibil asupra stării de imunitate a întregului organism par a fi puțin convingătoare. După cum se știe, reacția organismului la un focar inflamator, inclusiv tuberculoză, este determinată nu de dimensiunea acestuia din urmă, ci de numărul și virulența microorganismelor patogene conținute în acesta. Și dacă orice boli inflamatorii acute ale corneei sau ale altor țesuturi ale ochiului care sunt sărace în vasele de sânge chiar nu dau de obicei pronunțate reacții generale, atunci depinde nu atât de dimensiunea mică a focalizării ochiului, cât de izolarea acestuia de sistem comun circulaţie. Odată cu localizarea uveală a focalizării ochiului, condițiile pentru interacțiunea activă între procesul inflamator din ochi și starea imunobiologică generală a pacientului sunt, desigur, incomparabil mai favorabile. O confirmare clară a acestui lucru poate servi drept numeroase observații clinice care arată o scădere treptată a intensității reacției la administrarea intradermică a tuberculinei pe măsură ce procesul inflamator acut ocular se calmează la pacienții cu uveită anterioară și posterioară de etiologie tuberculoasă. Este deosebit de interesant de observat în dinamică o scădere paralelă a intensității procesului ocular în secțiunile posterioare ale tractului uveal, unde scăderea inflamației coroidale afectează imediat umflarea retinei înconjurătoare și o creștere corespunzătoare a acuității vizuale și o scăderea treptată a mărimii și intensității hiperemiei și papule care apar la locul injectării intradermice a tuberculinei.
După cum se știe, eliberarea accelerată și îmbunătățită de albastru tripan în focarul inflamator în țesut se datorează unei încălcări a permeabilității. vase de sânge. Întrucât, judecând după testul utilizat, permeabilitatea este mai puțin perturbată după administrarea de acetoxan, trebuie concluzionat că acetoxanul are un efect de normalizare cunoscut asupra permeabilității, prevenind perturbarea acestuia în focarul inflamator.
Ideile moderne nu exclud posibilitatea includerii proceselor de proliferare și diferențiere a limfocitelor direct în focarul inflamator. În orice caz, aici sunt prezente toate populațiile de celule necesare: T-helper, celule B și macrofage ca prezentatoare de antigen.
Observațiile clinice ne pot furniza adesea dovezi la fel de neîndoielnice ale influenței clare a unui focar inflamator tuberculos în curs de dezvoltare în tractul uveal al ochiului bolnav asupra stării imunobiologice generale a pacientului.
Desigur, în sine un rezultat pozitiv al testului intradermic de tuberculină Mantoux la un pacient cu focar inflamator în tractul uveal al ochiului nu poate fi considerat ca o dovadă a naturii tuberculoase a procesului ocular. Cu toate acestea, dacă arderea în acest caz se referă la o persoană la care chiar și cea mai amănunțită și cuprinzătoare examinare nu a evidențiat niciun alt focar inflamator activ în organism, în plus față de un singur focar inflamator cu dezvoltare rapidă în ochi, atunci să rezultate pozitive Probele de Mantoux trebuie tratate cu o anumită atenție. În acest sens, trebuie menționate și câteva statistici.
Toate considerentele de mai sus se aplică, desigur, numai acelor cazuri în care există un focar inflamator activ în ochi. Dacă acolo se păstrează doar rămășițele cicatriciale de inflamație care a încetat de mult să mai existe, atunci nici radiografia și nici pielea teste la tuberculina nu ne mai poate ajuta să deslușim etiologia procesului care a lăsat în urmă toate aceste schimbări.
Materialul pentru studiu este puroi din fistule și leziuni ulcerative, răzuire de la marginile ulcerelor, puncții ale focarelor inflamatorii închise, biopsii ale țesuturilor afectate.
Cu un tratament în timp util, ameliorarea apare după 2-3 zile: temperatura scade, simptomele de intoxicație scad, focarele inflamatorii suferă o dezvoltare inversă. Cu toate acestea, în majoritatea cazurilor unul terapie cu antibiotice nu este suficient și de aceea trebuie efectuat un tratament patogenetic: gammaglobuline specifice, corticosteroizi (70-100 mg pe zi) pe cale orală timp de 5-6 zile.
Tratamentul complexului de keratită herpetică: utilizare agenți antivirali, imunoterapie, metode care stimulează regenerarea și trofismul corneei, impact fizic asupra focarului inflamator din cornee și tratament chirurgical.
Inhalarea de clor provoacă o tuse ascuțită și sufocare, inflamarea membranelor mucoase tractului respirator, edem pulmonar, iar mai târziu formarea de focare inflamatorii în plămâni.
După cum știți, inflamația acută este caracterizată de o anumită secvență modificări vasculare, manifestată prin dezvoltarea vasospasmului, arterial, congestie venoasă si staza.
Vasospasmul este o reacție pe termen scurt. Spasmul poate dura de la câteva secunde (cu pagube usoarețesut) până la câteva minute (în caz de leziuni severe). O astfel de reacție vasculară în focarul inflamației nu este strict necesară și nu se manifestă în unele cazuri când organele parenchimatoase sunt deteriorate. Apariția vasospasmului în zona inflamației se datorează contracției elementelor musculare netede ale vaselor ca răspuns la deteriorarea acestora, precum și excitării vasoconstrictoare sub influența unui factor de alterare puternic, cu acțiune rapidă. Durata scurtă a acestei etape este determinată de inactivarea rapidă a mediatorilor vasoconstrictori - noradrenalina, adrenalina sub influența monoaminooxidazei. Este posibil ca serotonina să fie implicată în mecanismele vasospasmului în zona inflamației, care este eliberată în cantități mari atunci când țesuturile sunt deteriorate de trombocite și mastocite. O manifestare externă a vasospasmului este albirea zonei tisulare în care se dezvoltă procesul inflamator.
Stadiul hiperemiei arteriale se caracterizează printr-o expansiune moderată a arterelor mici, arteriolelor, capilarelor, venulelor, precum și funcționarea capilarelor de rezervă (fenomenul neoplasmului capilar). Expansiunea vaselor de sânge determină o creștere a alimentării cu sânge a țesutului, creșterea formării limfei și a fluxului limfatic. Afluxul de sânge poate depăși puțin fluxul său de ieșire, ceea ce contribuie la creșterea presiunii hidrodinamice în vase, la creșterea liniară și viteza volumetrica fluxul sanguin, reducând diferența de oxigen arteriovenos. În această etapă, așa semne externe inflamație precum roșeață și febră. Oxigenarea crescută a țesuturilor activează metabolismul celular, favorizează apariția speciilor reactive de oxigen, care, pe de o parte, pot avea un efect dăunător asupra celulelor intacte și țesutului conjunctiv și, pe de altă parte, devin factori de protecție a organismului împotriva agenților patogeni infecțioși. , și ulterior au un efect stimulator.influență asupra proceselor de proliferare în zona inflamației. Pe măsură ce se dezvoltă hiperemia arterială, afluxul factorilor umorali de protecție - complement, properdin, fibronectină, interferon, ceruloplasmină etc. - crește până la focarul inflamației, fluxul sanguin intens asigură spălarea produselor metabolice toxice, a factorilor de patogenitate produși de microorganisme, și substanțe biologic active. În unele cazuri, cu o scădere a reactivității organismului, din cauza fluxului sanguin intens, poate apărea diseminarea infecției și dezvoltarea unei stări septice. Hiperemia arterială poate dura câteva ore și zile, este cel mai pronunțată de-a lungul periferiei zonei de alterare. Dezvoltarea hiperemiei arteriale se bazează pe mai multe mecanisme:
1. Neurogenă - datorită activării reflexului axonal, întăririi colinergicului și histaminergic influențe nervoase pe peretele vascular, precum și deteriorarea peptidergică senzorială fibrele nervoase implicat în nocicepție și eliberarea de neuropeptide senzoriale - substanța P, o peptidă a unei gene înrudite cu calcitonina, o peptidă a unei gene proteice. Aceste neuropeptide au un efect vasodilatator pronunțat.
2. Neuropalitic - datorita parezei vasoconstrictoarelor simpatice si scaderii sensibilitatii adrenoreceptorilor vasculari.
3. Mioparalitic - datorită scăderii tonusului vascular bazal sub influența concentrațiilor moderate de compuși vasoactivi (histamină, kinine, leucotriene etc.), precum și datorită H + - și K + -hiperioniei. Pe măsură ce se ridică proces inflamator hiperemia arterială este înlocuită cu cea venoasă.
Hiperemia venoasă se caracterizează prin vasodilatație suplimentară, o scădere a vitezei fluxului sanguin, pletora tisulară, fenomenul de poziție marginală a leucocitelor și emigrarea acestora, o încălcare a proprietăților reologice ale sângelui și o creștere a proceselor de exudare.
Factorii care afectează tranziția hiperemiei arteriale la hiperemia venoasă pot fi împărțiți în două grupe: intravasculare și extravasculare.
Pentru factorii intravasculari, determinând dezvoltarea Hiperemia venoasă, includ umflarea celulelor endoteliale, poziționarea marginală a leucocitelor, activarea sistemului de hemostază, ameliorarea eritrocitelor, îngroșarea sângelui, creșterea vâscozității acestuia și formarea de microtrombi.
Dintre factorii extravasculari, edemul tisular și compresia venulelor, venele mici, vase limfatice exudat. Acumularea excesivă de mediatori cu acțiune vasodilatatoare, enzimele lizozomilor și ionilor de hidrogen, precum și încălcarea scheletului țesutului conjunctiv pericapilar și a desmozomilor în zona de alterare primară și secundară în focarul inflamației cresc hiperemia venoasă.
Manifestările externe ale hiperemiei venoase sunt edemul tisular, cianoza, o scădere a proceselor metabolice și, ca urmare, o scădere a temperaturii în focarul inflamației. Întărirea hipoxiei și a acidozei stimulează dezvoltarea elementelor de țesut conjunctiv de-a lungul periferiei focarului inflamator și, prin urmare, asigură formarea unei bariere care separă focarul inflamator de țesutul sănătos. Neutrofilele și celulele mononucleare participă și ele la formarea barierei.
Restricționarea fluxului sanguin în zona hiperemiei venoase și formarea de bariere ajută la reducerea resorbției produselor de degradare și a factorilor toxici din focarul inflamației și, de asemenea, la reducerea riscului de răspândire a agenților infecțioși. Cu toate acestea, odată cu dezvoltarea inflamației în organele parenchimatoase, hiperemia venoasă prelungită poate duce la o scădere a funcțiilor lor specializate și la dezvoltarea sclerozei celulare.
Rezultatul hiperemiei venoase este staza - o oprire completă a fluxului sanguin în vase. Staza larg răspândită este caracteristică inflamației acute, cu dezvoltare rapidă (hiperergică). Durata și rezultatul stazei pot fi diferite. Staza poate dura de la câteva ore până la câteva zile; poate fi reversibilă și ireversibilă.
Mecanismele emigrării leucocitelor. Rolul leucocitelor în inflamație
După cum sa menționat deja, cel mai important semn al hiperemiei venoase este emigrarea leucocitelor din vase în țesutul inflamat. Secvența eliberării leucocitelor se numește legea lui Mechnikov, conform căreia, după câteva ore (1,5-2 ore) după acțiunea factorului de modificare, neutrofilele și alte leucocite segmentate emigrează intens, apoi monocitele și limfocitele.
Procesul de emigrare este precedat de o încălcare a fluxului axial de sânge în interiorul vasului. În condiții de încetinire a fluxului sanguin, eritrocitele, unindu-se în „coloane de monede”, ocupă partea centrală a vasului, iar leucocitele, care au o masă specifică mai mică, părăsesc curentul axial, mai întâi la granița stratului de plasmă, apoi începe să adere la celulele endoteliale ale vasului. Un rol important în adeziunea (lat. adhaesio - lipire) leucocitelor este atribuit așa-numitelor molecule adezive endoteliale-leucocite (ELAM), care sunt exprimate pe suprafața leucocitelor, celulelor endoteliale și macromoleculelor matricei intercelulare din focar. de inflamație. Activatorii exprimării ELAM pe leucocite și celulele endoteliale din zona inflamației sunt substanțe biologic active - citokine, cum ar fi IL-1, IL-8, LT B4, FAT, TNF-a, interferon a, fracțiile complement C5a și Bb, factori chemotactici, lipopolizaharide bacteriene etc. Sub influența acestor mediatori, în leucocite și celulele endoteliale vasculare apar modificări conformaționale ale membranei, sunt eliberate și exprimate molecule de adeziune. Majoritatea citokinelor afectează în mod egal adezivitatea leucocitelor și a endoteliului, dar există și un efect selectiv al mediatorilor asupra diferitelor celule. Astfel, LT B4 induce apariția moleculelor de adeziune pe neutrofile, IL-1 pe endoteliul vascular, componente ale complementului pe monocite și granulocite.
În prezent sunt cunoscute mai multe clase de molecule de adeziune celulară:
1. Selectinele sunt molecule de adeziune a celulelor lectinei care mediază cel mai mult stadiu timpuriu interacțiunile dintre leucocite și peretele vascular. Selectinele sunt exprimate precoce și nu asigură o atașare puternică a leucocitelor la endoteliul vascular. Există trei tipuri de selectine: L-selectinele sunt sintetizate de toate leucocitele,
E-selectinele sunt sintetizate de endoteliocite. Aceste selectine asigură fenomenul de poziție marginală a leucocitelor. sursă
P-selectinele sunt trombocite și endoteliul vascular; pe lângă participarea la procesele de margine a leucocitelor, ele promovează aderența trombocitelor.
2. Integrinele sunt proteine heterodimerice exprimate de diferite leucocite și celule hematopoietice. Endoteliul exprimă doar câteva integrine. Până acum au fost identificate cinci tipuri de integrine. Cei mai importanți pentru procesul migrator și fagocitar sunt trei heterodimeri. Aceste integrine sunt responsabile pentru stadii târzii interacțiunile dintre leucocite, trombocite și endoteliul vascular.
3. Moleculele adezive ale superfamiliei imunoglobulinelor (ICAM) sunt proteine transmembranare cu cinci domenii extracelulare, exprimate predominant de endoteliu. Unele dintre aceste molecule sunt sintetizate de celulele neactivate și determină rata de migrare fiziologică a leucocitelor. În zona inflamației sub influența IL-1, TNF, gama-interferonului, sinteza și expresia moleculelor ICAM sunt activate, ceea ce asigură o fază întârziată de aderență și emigrare a leucocitelor. Grupul de proteine similare imunoglobulinelor include receptorii limfocitari - CD2, CD58 (LFA-3). Ele sunt exprimate pe limfocitele T și celulele prezentatoare de antigen, participă la prezentarea antigenului și contactul limfocitelor citotoxice cu celulele țintă.
4. Adresine - proteine ale celulelor endoteliale ale venulelor organelor limfoide. Avea mare importanțăîn migrarea limfocitelor către focarele de inflamație cronică și autoimună. În inflamația acută, adresinele sunt mai puțin semnificative.
5. Proteine conjunctive cartilaginoase. Exprimat de toate tipurile de leucocite, recunoaște acid hialuronic, care asigură mișcarea leucocitelor în substanța principală a țesutului conjunctiv.
Cu formarea insuficientă de selectine și integrine sau producția de anticorpi la receptorii membranari, proprietățile adezive ale leucocitelor scad, capacitatea lor de a emigra, de a se acumula în focarul inflamației și fagocitoza este afectată, ceea ce poate contribui la frecvente. infectii purulenteși dezvoltarea sepsisului.
Un rol important în procesele de aderență și emigrare îl revine eliminării sarcinii negative a celulelor endoteliale și a leucocitelor datorită acumulării în focarul de inflamație a ionilor monovalenți și divalenți (H, K, Ca, Mn, Mg), ca precum și proteinele cationice secretate de leucocite. Factorii care inițiază aderența leucocitelor la peretele vasului sunt complementul (C5a), leucotrienele, fibronectina, imunoglobulinele (fragment IgG Fc), histamina.
După aderență, leucocitul se deplasează de-a lungul suprafeței celulei endoteliale până la golul interendotelial, care este extins semnificativ în focarul inflamației, apoi se formează un pseudopod și mișcarea leucocitelor prin golul interendotelial în spațiul subendotelial și membrana bazală a vasului. Astfel, leucocitele sunt în afara vasului.
În majoritatea cazurilor de inflamație acută, mișcarea intravasculară a leucocitelor și emigrarea lor durează câteva ore. De regulă, neutrofilele sunt primele care intră în locul inflamației, ele se găsesc în țesutul inflamat după 6-24 de ore. Ceva mai târziu, monocitele și limfocitele emigrează (24-48 ore). O astfel de asincronie a emigrării celulare se datorează apariției nesimultane a moleculelor de adeziune și a factorilor chemotactici specifici diferitelor leucocite.
Trebuie remarcat faptul că intervalele de timp ale emigrării leucocitelor și succesiunea eliberării lor sunt foarte relative și sunt determinate de tipul vasului, tipul de inflamație și stadiul inflamației.
Deci, în zona procesului inflamator inițiat de agenții patogeni ai tuberculozei, listeriozei, chlamidiei, toxoplasmozei, infectie virala, inițial celulele mononucleare domină în focarul inflamației, în reacțiile alergice - eozinofile.
Mișcarea dirijată a leucocitelor este asigurată de chemoatractanți, a căror concentrație crește odată cu dezvoltarea unei modificări secundare în focarul inflamației, precum și de prezența receptorilor pentru diferiți chemoatractanți pe suprafața leucocitelor.
În timpul interacțiunii dintre receptori și chimioatractanți, are loc hiperpolarizarea membranei leucocitare, permeabilitatea acesteia pentru ionii de Ca crește, este inițiată sinteza fosfolipidelor și nucleotidelor ciclice active funcțional, crește numărul de organele intracelulare, a căror funcționare asigură mișcarea leucocite şi secreţia conţinutului granulelor. Pe lângă mișcarea orientată a leucocitelor, chemoatractanții induc aderența leucocitelor la endoteliu, promovează poziționarea marginală a leucocitelor și agregarea lor în lumenul microvaselor. Chemotaxia este mediată de diferite grupe de substanțe:
1. Citotaxigeni, care, nefiind chimioatractanți, generează factori de chimiotaxie.
2. Citotaxine, care au efect direct asupra leucocitelor. Unele citotaxine sunt specifice neutrofilelor (de exemplu, extractul de cultură de E. coli), în timp ce alte citotaxine induc migrarea granulocitelor și monocitelor.
Chemoatractanții pot fi de origine endogenă și exogenă. Chemoatractanții exogeni sunt peptide bacteriene, în special cele care conțin grupări N-formil. Proprietățile chimioatractanților endogeni sunt posedate de componentele complementului, imunoglobuline, complexe imune, limfokine și monokine, kinine, leucotriene B4, produși ai căii lipoxigenazei acid arahidonic, factor de activare a trombocitelor, factor Hageman, enzime lizozomale și altele.
Rolul leucocitelor în inflamație
Neutrofilele care au emigrat în zona de inflamație sunt fagocite active care curăță zona de inflamație din agenti patogeni. Aderența neutrofilelor la obiectul fagocitozei este accelerată de opsonine, molecule de proteine active care se atașează de obiect și facilitează recunoașterea obiectului de către celulele fagocitare. Concomitent cu procesele de mișcare direcționată a leucocitelor și fagocitoză, în ele are loc o explozie respiratorie - o creștere bruscă a consumului de oxigen pentru formarea radicalilor liberi de oxigen bacterici (oxigen singlet, radical hidroxil, peroxid de hidrogen, anion superoxid). Formarea speciilor reactive de oxigen are loc cu participarea enzimelor mieloperoxidază, superoxid dismutază și catalază. Speciile reactive de oxigen eliberate în focarul inflamației sunt factori extrem de toxici pentru bacterii, ciuperci, micoplasme, viruși, chlamydia și alți agenți patogeni, ele perturbă structura și funcția membranelor celulare microbiene, limitează activitatea lor vitală sau provoacă moartea microorganismelor. Pe lângă activitatea antimicrobiană, o creștere a proceselor de radicali liberi provoacă deteriorarea celulelor parenchimatoase intacte, a celulelor endoteliale vasculare și a elementelor de țesut conjunctiv în focarul inflamației, ceea ce contribuie la modificarea ulterioară a țesutului.
Pe lângă factorii nou sintetizați ai sistemului oxidant, granulele de neutrofile conțin lizozimă, lactoferină, proteine cationice, fosfataze alcaline și acide, ribonuclează, dezoxiribonuclează, hialuronidază, b-glucuronidază, elastază, colagenază, PAF, kinine, leucogen și factori chemopistactici. .
Astfel, acumularea de neutrofile în focarul inflamației și eliberarea acestor substanțe biologic active de către acestea provoacă moartea sau restrângerea activității vitale a microorganismelor, distrugerea și liza țesuturilor moarte și curățarea zonei deteriorate. Datorită neutrofilelor, în jurul focarului de inflamație se formează o barieră neutrofilă de protecție, care delimitează zona de deteriorare (împreună cu monocitară și fibroblastică) de țesutul sănătos și previne răspândirea infecției și a factorilor toxici dăunători.
Mediatorii neutrofili foarte activi sunt implicați în dezvoltarea alterării secundare, stimulează eliberarea de substanțe biologic active din alte celule, promovează vasodilatația, cresc permeabilitatea acestora, exsudația plasmatică și migrarea leucocitelor. Intrând în circulația sistemică, ele provoacă manifestarea unor efecte sistemice ale procesului inflamator.
Eozinofilele care au emigrat în zona de inflamație au, de asemenea, capacitatea de a fagocita bacterii, ciuperci și complexe imune. Conțin aproximativ același set de enzime ca și neutrofilele (cu excepția lizozimei). Cu toate acestea, fagocitoza implică un procent mai mic de eozinofile și se desfășoară mai puțin intens decât cel al neutrofilelor.
Principalii factori care stimulează procesul de degranulare a eozinofilelor sunt imunoglobulinele, complexele imune, complementul. Produșii de secreție ai eozinofilelor inhibă eliberarea histaminei de către mastocite și participă la inactivarea acesteia datorită histaminazei, proteina cationică eozinofilă se leagă și neutralizează heparina, concentratii mari arilsulfatazele inactivează proteinele chemotactice, iar substanța cu reacție lentă a anafilaxiei, fosfolipazele B și D inactivează factorul de activare a trombocitelor. Sub influența endotoxinelor și în procesul de fagocitoză, eozinofilele produc și secretă pirogen endogen, care asigură dezvoltarea unei reacții febrile care însoțește procesul inflamator.
Mediatorii eozinofililor, precum și neutrofilele, pot participa la reacțiile de afectare a țesuturilor și la răspândirea alterării secundare.
Leucocitele bazofile, ca și alte granulocite, au capacitatea de a fagocitoză, dar activitatea lor fagocitară este destul de scăzută. În zona de inflamație infecțioasă și alergică, are loc o reacție de degranulare bazofilă cu eliberarea de mediatori inflamatori - histamina, heparină, factor de activare a trombocitelor, leucotriene, kalikreină, factor chemotactic eozinofil, enzime.
În urma granulocitelor, celulele mononucleare se acumulează în focarul inflamației. Monocitele care au emigrat în țesuturi devin macrofage tisulare. În zona de inflamație, macrofagele se acumulează datorită emigrării monocitelor din fluxul sanguin, precum și datorită mobilizării macrofagelor tisulare. Macrofagele asigură fagocitoza nu numai a agenților patogeni infecțioși ai procesului inflamator, ci și a detritusului celular, curățând astfel zona de alterare și pregătind-o pentru regenerarea și repararea ulterioară. Fagocite mononucleare participă la asigurarea protecției nespecifice a organismului prin fagocitoză, secreție de factori umorali precum lizozima, interferon-alfa, TNF, componente ale complementului. În focarul inflamației, macrofagele capătă proprietăți antimicrobiene mai pronunțate datorită fagocitozei componentelor antimicrobiene produse de neutrofile (mieloperoxidază și proteine cationice). Astfel, macrofagele dobândesc capacitatea de a halogena proteine. Funcția microbicidă a macrofagelor se realizează prin produsele „exploziei respiratorii”, secreția de monokine, enzime lizozomale. Reacții oxidative sunt însoțite de acumularea de produse de peroxidare a lipidelor foarte toxice în focarul inflamației, provocând distrugerea în continuare a celulelor, vaselor și elementelor de țesut conjunctiv.
În prezenţa unui agent etiologic sub formă patogen bacterian monocitele/macrofagele sunt celule prezentatoare de antigen care declanșează răspunsul imun al organismului. În timpul prezentării antigenului, macrofagele activate secretă și eliberează citokine precum TNF, interleukine (IL-1, IL-3, IL-6, IL-8, IL-10, IL-12, IL-15), componente ale complementului, factori chemotactici . Eliberarea formelor mature de interleukine din celule începe în decurs de 2 ore după stimularea antigenică și continuă timp de 24-48 de ore. Monocitele/macrofagele din zona inflamației sunt o sursă de proteaze lizozomale - colagenază, elastază, angiotensin convertază, activator de plasminogen; substanțe adezive - fibronectină, trombospondină, proteoglicani; factori de creștere - factori de stimulare a coloniilor, factor de creștere a fibroblastelor; pirogeni endogeni.
Sub acțiunea mediatorilor de declanșare ai macrofagelor în focarul inflamației, are loc activarea tipuri variate leucocite, celule de țesut conjunctiv, endoteliu vascular, celule parenchimatoase, ceea ce duce la sinteza și secreția de compuși biologic activi care au efecte dăunătoare, protectoare și sistemice.
Emigrarea intensivă a limfocitelor în zona de inflamație are loc în majoritatea cazurilor după emigrarea neutrofilelor și monocitelor. Limfocitele stimulate secretă substanțe biologic active - limfokine, care asigură dezvoltarea unui răspuns imun, reactii alergice, procesele de proliferare și reparare.
Toate leucocitele din zona inflamației suferă rapid degenerescență grasă, se transformă în corpuri purulente și sunt îndepărtate împreună cu puroiul. În centrul inflamației, sunt posibile două moduri de moarte a leucocitelor.
Prima este deteriorarea gravă a membranei, încălcarea integrității celulei și necroza acesteia, care este posibilă în centrul modificării primare și secundare sub influența agentului dăunător în sine și a diverșilor mediatori inflamatori citotoxici.
Al doilea este o cale mai ușoară, programată de moarte celulară sau apoptoză. În timpul apoptozei, se observă o scădere a nucleului leucocitar, condensarea cromatinei nucleare, fragmentarea ADN-ului, suprimarea transcripției și o scădere a sintezei ARN-ului ribozomal și proteinelor. Neutrofilele senescente își pierd capacitatea de a secreta enzime lizozomale, iar acest lucru exclude deteriorarea ulterioară a țesuturilor. Macrofagele fagocitează în mod activ neutrofilele apoptotice. Absorbția neutrofilelor apoptotice este mediată de interacțiunea trombospondinei secretate de receptorii macrofagi și neutrofili. Prin apoptoză, nu numai neutrofilele, ci și eozinofilele și limfocitele pot fi îndepărtate din focarul inflamației.
macrofage. S-a stabilit că macrofagele activate sintetizează o substanță specială numită interleukina-1 (IL-1). Este eliberat de macrofage în mediul înconjurător și se răspândește în organism, unde își găsește țintele, care sunt miocitele, sinoviocitele, hepatocitele, celulele osoase, limfocitele și neurocitele. Aparent, există receptori specifici pe membranele acestor celule, datorită cărora IL-1 acționează în mod specific asupra lor, și nu asupra altor celule. Acțiunea este stimulatoare și mai ales studiată în raport cu hepatocite și limfocite. Acțiunea IL-1 este universală, adică. funcționează în orice boală infecțioasă (inflamatoare) și chiar la început și dă astfel un semnal organelor indicate pentru a se alătura procesului inflamator (infecțios). Există motive să credem că simptomele caracteristice stadiilor incipiente ale bolii ( durere de cap, durerea în mușchi și articulații, somnolență, febră, leucocitoză și creșterea conținutului de proteine, inclusiv imunoglobuline) se explică tocmai prin acțiunea IL-1 (Fig. 12.3).
Rolul macrofagelor nu se limitează la secreția de IL-1. În aceste celule sunt sintetizate o serie de substanțe biologic active, fiecare dintre acestea contribuind la inflamație. Acestea includ: esterazele, proteazele și antiproteazele; hidrolaze lizozomale - colagenază, alastază, lizozimă, α-macroglobulină; monokine - IL-1, factor de stimulare a coloniilor, factor care stimulează creșterea fibroblastelor; agenți antiinfecțioși - interferon, transferină, transcobalamină; componentele complementului: C1, C2, C3, C4, C5, C6; derivați ai acidului arahidonic: prostaglandina E2, tromboxan A2, leucotriene. Nu trebuie să uităm și de cea mai importantă funcție a macrofagelor - fagocitoza.
mastocitele. Rolul acestor celule în inflamație este că, atunci când sunt deteriorate, eliberează histamina și heparina conținute în granulele lor. Și deoarece aceste celule sunt situate în număr mare de-a lungul marginilor vaselor, efectul acestor substanțe se va manifesta în primul rând asupra vaselor (hiperemie).
Macrofagele și mastocitele sunt prezente permanent în țesuturi (celule rezidente). Alte celule inflamatorii pătrund în zona de inflamație din lateral (celule emigrante). Acestea includ neutrofile polimorfonucleare, eozinofile și limfocite.
Neutrofile. Funcția principală a acestor celule este fagocitoza. Sunt evacuați din măduva osoasă în sânge, emigrează din vase și se acumulează în cantități mari în țesutul inflamat. Și reproducerea lor activă, migrația și fagocitoza sunt supuse influenței de reglementare a substanțelor biologic active (tisulare, sistemice, organismice). Acțiunea lor se manifestă, însă, numai atunci când la nivelul celulelor există receptori care reacționează în mod specific cu mediatorul inflamator: histamina, adrenalina, glucocorticoizii, gama globulinele etc.
În citoplasma neutrofilelor, există două tipuri de granule: azurofile primare (mai mari) - lizozomii obișnuiți, granulele secundare sau specifice sunt mai mici și, cel mai important, conțin un set diferit de substanțe enzimatice și neenzimatice. Granulele primare conțin hidrolaze acide, precum și lizozimă, mieloperoxidază și proteine cationice. Granulele secundare sunt specifice; conține fosfataza alcalină, lactoferină și lizozim. Toate acestea sunt importante pentru înțelegerea implicării neutrofilelor în inflamație (vezi mai jos).
trombocite. Rolul trombocitelor (trombocitelor) în inflamație este în principal acela că sunt strâns legate de microcirculație. Probabil, aceștia sunt cei mai constanti și mai universali participanți la inflamație. Conțin substanțe care afectează permeabilitatea vaselor de sânge, contractilitatea acestora, creșterea și reproducerea celulelor și, cel mai important, coagularea sângelui.
Limfocite. Aceste celule joacă un rol în orice inflamație, dar mai ales în inflamația imunitară.
fibroblaste. Acțiunea fibroblastelor se manifestă în ultima etapă a procesului, când numărul acestor celule crește în focarul inflamației, sinteza de colagen și glicozaminoglicani din ele este reînviată.
Caracteristicile tulburărilor de microcirculație în focarul inflamației, cauzele apariției lor. Exudația, mecanismele dezvoltării. Rolul său în inflamație. Clasificarea inflamației în funcție de tipul de exudat.


