20.05.2018
Sindromul compartimental: tratament.
A.A. Bogdanov FRCA, DEAA
Caz clinic: O femeie de 45 de ani a fost internată în spital cu simptome de obstrucție intestinală, deshidratare severă, afectare a metabolismului apei și electroliților. Laparotomie de urgență a evidențiat obstrucție adezivă cu necroză a ansei intestinale. Rezecția efectuată intestinul subtire cu anastomoză. Cursul postoperator este sever. Peristaltismul nu este restabilit. Fenomenele de insuficiență renală, încălcări ale echilibrului acido-bazic sunt în creștere. Abdomenul este umflat, nu există peristaltism. La a doua operatie s-au constatat fenomene de peritonita flasca fara modificari pronuntate in cavitate abdominală. Lavaj abdominal cu sutura cavității abdominale. În perioada postoperatorie cresc fenomenele de insuficiență renală și instabilitate hemodinamică. Pacientul a fost transferat la secția de terapie intensivă, unde a început terapia intensivă pentru insuficiență renală cu includerea ventilației mecanice, perfuzie de inotropi pentru stabilizarea hemodinamicii. În ciuda dozelor crescânde de adrenalină, hemodinamica continuă să rămână instabilă, acidoza crește, iar valorile crescânde ale presiunii de ventilație și FiO2 sunt necesare pentru a menține gazele sanguine normale. S-a început hemofiltrarea pentru corectarea acidozei. Efectul hemofiltrarii este temporar, dupa unele imbunatatiri starea pacientului continua sa se deterioreze. În acest caz, abdomenul rămâne puternic umflat cu peristaltism absent. După o consultare cu chirurgii, a fost pus un diagnostic - sindromul de compartiment abominal. Rana abdominală este deschisă și lăsată deschisă. S-a decis să se lase alți parametri ai terapiei neschimbați. Aproape imediat, ventilația s-a îmbunătățit - valorile presiunii inspiratorii au scăzut, a devenit posibilă reducerea treptată a fracției de oxigen inhalat. În 6 ore starea pacientului s-a îmbunătățit semnificativ. Doză redusă de terapie inotropă (ulterior, inotopii au fost anulați la 14 ore după dizolvarea plăgii), recuperarea a avut loc în 8 ore valori normale KShchS, diureza a început.
Probabil o burtă umflată la un pacient în perioada postoperatorie- o condiție familiară fiecărui resuscitator. Cu toate acestea, nu se întâmplă adesea să credem că o burtă umflată este și o presiune intra-abdominală crescută care afectează funcționarea organe interne. Recent, au apărut mai multe publicații care discută această problemă din diverse puncte de vedere.
Interesant este că efectele nocive ale presiunii intra-abdominale crescute asupra funcțiilor organelor interne au fost descrise încă din prima jumătate a secolului al XIX-lea. Abia relativ recent au fost recunoscute efectele sale negative, și anume, dezvoltarea unui sindrom de insuficiență multiplă de organe cu o mortalitate de aproape 100% în absența tratamentului.
În mod normal, IBP este o reflectare a presiunii intrapleurale și este egal cu zero sau ușor negativ (sub atmosferă). O ușoară creștere a IBP (3-15 mm Hg) se poate observa cu ventilația mecanică, în perioada postoperatorie, cu obezitate. Sindromul compartimentar (sau sindromul de compresie) apare atunci când presiunea din cavitatea abdominală închisă crește la un nivel care întrerupe alimentarea normală cu sânge a organelor abdominale. Pragul pentru o astfel de presiune variază în funcție de gradul de volum și de complianță a peretelui abdominal. O creștere moderată a IBP poate fi compensată prin transfuzia de lichide. Când IBP atinge 25 mm Hg și mai mult, tulburările de flux sanguin apar în vasele mari intra-abdominale, ceea ce poate duce la insuficiență hepato-renală, insuficiență cardiovasculară și respiratorie. În consecință, diagnosticarea în timp util și tratament adecvat a acestui sindrom este cheia terapiei de succes în astfel de condiții.
Măsurarea IBP
Există mai multe metode de măsurare a IBP, care sunt împărțite în direct (în timpul laparoscopiei) și indirecte, atunci când presiunea este măsurată în organe și structuri anatomice (venă femurală, stomac, vezică urinară), reflectând modificările presiunii în cavitatea abdominală. Cea mai utilizată tehnică utilizând măsurarea presiunii în vezică. Cu un volum intravezical de aproximativ 50 - 100 ml de perete Vezicăîndeplinește funcția unei membrane pasive, care vă permite să măsurați presiunea IBP printr-un cateter urinar. Relația liniară dintre presiunea intravezicală și IBP rămâne în intervalul 5 - 70 mm Hg.
Tehnica presupune injectarea a 10 ml de soluție salină sterilă într-o vezică goală printr-un cateter urinar. După aceea, tubul de drenaj al sistemului de cateter este deconectat de la recipientul de colectare a urinei și conectat la un manometru sau traductor. Punctul zero este nivelul simfizei pubiene. Unii autori au folosit un gastrotonometru modificat.
Frecvența apariției și factorii de risc
Frecvența acestui sindrom în practica chirurgicală generală nu a fost încă evaluată în detaliu, dar este destul de clar că la unele categorii de pacienți apare mult mai des. Acești pacienți includ traumatisme abdominale contondente și penetrante, ruptură de anevrism aorta abdominala, tumori ale cavității abdominale, pancreatită, ascită masivă, transplant hepatic.
Tabelul 1. Factori de risc pentru dezvoltarea sindromului de hipertensiune abdominală
|
Subdiviziune |
|
|
Creșterea volumului de lichid intraabdominal |
Sângerare traumatică |
|
Edem visceral |
Pancreatită |
|
Pneumoperitoneu |
Laparoscopie |
|
Gaze intestinale |
Dilatarea acută a stomacului |
|
obiecte solide |
Constipație intratabilă |
|
Factorii peretelui abdominal |
Pierderea volumului abdominal după repararea herniei sau repararea herniei |
Probleme de fiziopatologie a presiunii intra-abdominale crescute
Creșterea cronică (lentă) a volumului intraabdominal poate fi compensată prin modificări ale complianței peretelui abdominal. În situațiile în care creșterea acestui volum se produce rapid sau capacitatea de rezervă a complianței peretelui abdominal este epuizată, se observă o creștere a IBP. În același timp, factori precum rata de creștere a volumului, prezența spasmului muscular din cauza peritonismului pot afecta gradul de creștere a presiunii.
Gradul de creștere a IBP este clasificat în funcție de datele obținute în timpul măsurării acestuia (vezi Tabelul 3).
Efecte sistemice ale IBP crescute
Sistemul cardiovascular:
Diverse studii au arătat că odată cu creșterea IBP, are loc o scădere a diametrului secțiunilor intra și subhepatice ale venei cave inferioare. O astfel de compresie a fost însoțită de o scădere a întoarcerii venoase din jumătatea inferioară a trunchiului. Deoarece creșterea IBP este însoțită de o creștere a presiunii intratoracice, aceasta a înrăutățit și mai mult condițiile pentru menținerea întoarcerii venoase normale. Desigur, toate aceste fenomene la pacienții cu hipovolemie se manifestă într-o măsură mult mai mare.
În același timp, are loc o scădere a debitului cardiac datorită creșterii rezistenței vasculare periferice (datorită atât componentelor pulmonare, cât și sistemice) și modificări ale complianței ventriculare.
În același timp, tensiunea arterială rămâne la un nivel normal pentru o perioadă destul de lungă de timp, poate chiar să crească pentru ceva timp datorită creșterii semnificative a PSS. Transmiterea presiunii crescute în cavitatea abdominală către vene centrale(prin analogie cu PEEP) este însoțită de o creștere atât a CVP, cât și a presiunii în pană artera pulmonara. Prin urmare, prezența unor valori ridicate ale CVP nu înseamnă absența hipovolemiei. Un indicator mai fiabil al nivelului volemiei în aceste condiții este măsurarea volumului diastolic rezidual al VS (ecocardiografie) sau corectarea CVP prin valoarea IBP sau a presiunii interpleurale.
Congestia venoasă care însoțește o creștere a IBP este însoțită de un risc crescut de venotromboză.
Sistemul respirator:
Odată cu creșterea presiunii în cavitatea abdominală, diafragma se deplasează progresiv în piept, care este însoțită de o creștere a presiunii intratoracice și de compresia parenchimului pulmonar. Clinic, acest lucru se manifestă printr-o creștere a cupolelor diafragmei. Apare atelectazia, care este însoțită de o creștere a șunturilor și o scădere a presiunii parțiale a oxigenului din sânge. O scădere a CO duce și la o creștere a manevării. După cum sa menționat deja, rezistența vasculară pulmonară crește. Creșterea nepotrivirii între ventilație și perfuzie. Compatibilitatea toracelui și a plămânilor este redusă, iar ventilația este redistribuită în principal către vârfurile plămânilor. În consecință, necesitatea creșterii presiunii inspiratorii, a valorilor ridicate ale PEEP, NPV și fracția de oxigen inhalat crește pentru a obține o ventilație adecvată. Decompresia cavității abdominale este însoțită de o recuperare foarte rapidă a funcțiilor afectate.
Rinichi:
O creștere a IBP a fost identificată ca un factor independent în dezvoltarea insuficienței renale. Mecanismele de dezvoltare a insuficienței renale acute sunt multiple. Odată cu creșterea PSS, fluxul sanguin renal și, în consecință, rata de filtrare glomerulară scade. Aceste modificări duc la oligurie, care poate continua în ciuda restabilirii debitului cardiac. alătură-te jocului și influente hormonale sub forma unei creșteri a secreției de ADH, aldosteron și renină, o scădere a secreției de peptidă natriuretică atrială (datorită scăderii întoarcerii venoase). Modificările biochimice din sânge reflectă toate modificările de mai sus.
Odată cu o creștere a IBP, se poate observa o creștere a ICP, cea mai probabilă explicație pentru acest fapt este scurgerea venoasă obstrucționată din cap și gât din cauza presiunii intratoracice crescute și a CVP. Aceste fapte trebuie luate în considerare atunci când se combină o creștere a IBP ( traumatism contondent abdomen de exemplu) și TBI. Interesant este că o creștere benignă a ICP a fost descrisă în afecțiuni precum obezitatea, în special la tipul abdominal. Decompresia chirurgicală și pierderea în greutate au fost însoțite de o scădere a IBP.
Influență asupra tractului gastrointestinal:
Odată cu creșterea IBP, se observă ischemia mucoasei intestinale din cauza scăderii fluxului sanguin mezenteric. Există, de asemenea, o scădere a presiunii parțiale a oxigenului în mucoasă și o creștere a producției de radicali liberi, ceea ce reduce proprietățile protectoare ale mucoasei intestinale și facilitează translocarea bacteriilor.
Riscul de eșec al anastomozelor chirurgicale crește. Scăderea fluxului sanguin hepatic cu tulburări asociate ale metabolismului hepatic, inclusiv medicamentele. Interesant este că efecte similare sunt observate cu o creștere a IBP la un nivel de peste 20 mm Hg.
Tabelul 2. Efecte sistemice ale IBP crescute.
Manifestari clinice
Sindromul de compartiment abdominal apare atunci când anomaliile de organ se unesc cu IBP crescută, revenind la normal după decompresie. După cum am menționat mai devreme, tulburările de organe apar în mai multe organe și sisteme simultan.
Manifestările clinice ale sindromului includ insuficiență respiratorie caracterizată prin scăderea complianței pulmonare, creșterea presiunii inspiratorii, hipoxie și hipercapnie. Uneori, pentru a obține chiar și valori mici ale DO, este necesar să se aplice valori foarte mari ale presiunii inspiratorii (în timpul ventilației cu presiune). În același timp, radiografie cufăr relevă ridicarea domurilor diafragmei cu scăderea volumelor pulmonare.
Manifestările hemodinamice includ tahicardie, hipotensiune arterială cu CVP normală sau crescută sau presiunea în pană a arterei pulmonare.
Disfuncția rinichilor se manifestă ca oligurie sau anurie cu creșterea azotemiei. În același timp, se subliniază că insuficiența renală acută în absența insuficienței respiratorii face improbabil diagnosticul sindromului de compartiment.
Probleme de tratament
Desigur, cea mai eficientă în astfel de condiții este prevenirea sau, mai realist, diagnosticarea precoce. În acest caz, este necesar să se identifice pacienții care sunt predispuși la dezvoltarea acestei afecțiuni. Aceste decizii sunt adesea luate chiar pe masa de operație la pacienții supuși intervenție chirurgicală despre afecțiunile care sunt factori de risc și enumerate mai sus. Decizia principală este decizia și tipul de sutură a plăgii chirurgicale. S-a demonstrat că utilizarea plaselor absorbabile este însoțită de un rezultat mai bun la pacienții cu risc crescut în acest sens.
O altă direcție de tratament este optimizarea nivelului de perfuzie tisulară. Mai mulți indicatori, cum ar fi nivelul de lactat plasmatic, deficiența de bază și nivelul pH-ului mucoasei gastrice (tonometrie gastrică), sunt numiți ca indicatori ai optimității perfuziei tisulare.
Tabelul 3 Managementul IBP crescut.
|
BBP măsurat |
Actiuni luate |
|
|
10-15 mm Hg |
Menținerea normovolemiei |
|
|
16-25 mmHg |
Realizarea hipervolemiei |
|
|
26-35 mmHg |
Decompresie |
|
|
> 35 mmHg |
Relaparotomie și decompresie |
Tabelul de mai sus arată gradația terapie intensivăîn funcţie de gradul de hipertensiune arterială IAD. Trebuie avut în vedere faptul că tabelul de mai sus ar trebui folosit doar ca un ghid general de acțiune și particularitățile fiecărui caz în parte trebuie să fie întotdeauna luate în considerare.
În prezent, decompresia chirurgicală este singurul tratament care este asociat cu o reducere semnificativă a mortalității în această afecțiune. În absența tratamentului (decompresie), este descrisă o mortalitate de 100%. În același timp, atunci când se folosește decompresia, letalitatea este redusă la 20% la decompresie timpurie și până la 43-62,5% la decompresie târzie.
După cum sa menționat mai sus, toate manifestările clinice și fiziopatologice ale sindromului de compartiment abdominal sunt mult mai pronunțate în prezența hipovolemiei la un pacient. Tulburările de organ în acest caz încep de la mai multe stadiu timpuriu si sunt mai severe. Prin urmare, toți pacienții cu suspiciune de dezvoltare a sindromului ar trebui să fie supuși terapiei intensive pentru a se recupera. nivel normal volemie. Din păcate, este dificil să se indice parametrii terapiei cu perfuzie la acest grup de pacienți din cauza dificultăților de monitorizare descrise mai sus. În același timp, diureza și perfuzia mucoasei intestinale pot să nu fie restabilite pentru o perioadă de timp după restabilirea normovolemiei.
Eficacitatea inotropilor în această situație rămâne neclară.
Spasmul muscular deja menționat ca urmare a peritonismului (sau peritonitei) poate contribui la menținerea sau creșterea hipertensiunii intraabdominale, prin urmare, utilizarea relaxantelor musculare este recomandată tuturor pacienților din această grupă.
Câteva întrebări de anestezie la pacienții cu sindrom compartimental
În primul rând, instabilitatea tot mai mare a unor astfel de pacienți poate fi un obstacol în calea transportului lor în sala de operație, prin urmare, în multe unități de terapie intensivă, chirurgii efectuează acum decompresie abdominală direct în secția de terapie intensivă.
De regulă, farmacocinetica și farmacodinamia medicamentelor sunt afectate la astfel de pacienți și sunt mai sensibili la efectul cardiodepresiv al medicamentelor anestezice. Pe de altă parte, modificările BCC și ale fluxului sanguin al organelor pot crește potența anestezicelor.
În timpul decompresiei chirurgicale pot apărea mai multe momente potențial periculoase.
O scădere bruscă a rezistenței vasculare periferice după decompresie poate fi însoțită de colaps cardiovascular. Utilizarea inotropilor (adrenalină, norepinefrină) era recomandată anterior, dar majoritatea înclină acum spre utilizarea agresivă a lichidelor în această situație.
O scădere bruscă a presiunii intratoracice cu o scădere semnificativă (îmbunătățire) a complianței pulmonare în condiții de ventilație mecanică anterior dificilă, cu presiuni inspiratorii mari, este plină de afectare a parenchimului pulmonar cu eliberarea unui volum mare inadecvat de mare.
Și, în sfârșit, restabilirea perfuziei țesuturilor perfuzate anterior inadecvat este însoțită de eliberarea în circulația generală a unei cantități mari de produse toxice (lactat, adenozină, potasiu), care este însoțită de dezvoltarea aritmiei, depresiei miocardice și vasodilatației. . La pacientii cu un grad ridicat de hipertensiune abdominala dupa decompresie, 25% din cazuri dezvolta stop cardiac cu 100% mortalitate. Acest sindrom de reperfuzie este prevenit prin transfuzie imediat înainte de decompresie cu 2 litri de clorură de sodiu 0,45% conţinând 50 g manitol şi 50 mEq bicarbonat de sodiu.
Închiderea abdominală după decompresie poate fi întârziată mult timp din cauza edemului intestinal. Trebuie avut în vedere faptul că nevoia de lichide la astfel de pacienți (cu o cavitate abdominală deschisă) crește brusc - uneori până la 10-20 l / zi. Hipotermia este un pericol grav. Recăderile sunt posibile în ciuda decompresiei, așa că monitorizarea IBP ar trebui să continue după decompresie. Astfel de pacienți tolerează bine nutriția enterală, care în acest caz poate contribui la rezolvarea rapidă a edemului intestinal.
Literatură
- D. Hopkins și colab. „Hipertenția intraabdominală și sindromul compartimentului abdominal” BJA CEPD Reviews, vol. 1, nr. 2, aprilie 2001
- J. Bailey și colab. „Abdominal compartment syndrome” Crit Care 2000, 4: 23-29
- BH Saggi și colab. „Sindromul compartimentului abdominal” J Trauma, 1998, 45:597-609
În a doua jumătate a secolului al XIX-lea. Marey și Burt au stabilit o relație între severitatea insuficienței respiratorii și gradul de tensiune al peretelui abdominal anterior, dar un interes larg față de problemă a apărut mult mai târziu, la sfârșitul secolului XX. Până în prezent, multe experimentale și cercetare clinica, s-a acumulat o cantitate mare de informații cu privire la această problemă.
Nivelul normal al presiunii intraabdominale (IAP) este de 0-5 mm Hg. Artă. În același timp, a fost observată o corelație pozitivă semnificativă între valoarea sa și indicele de masă corporală. Așa se explică situația în care anumite afecțiuni, precum obezitatea sau sarcina, sunt însoțite de o creștere persistentă a IAP la 10-15 mm Hg. Art. insa pacientul reuseste sa se adapteze la o astfel de crestere si nu joaca un rol important fata de o crestere brusca a IAP. Se crede că sexul, vârsta, boli însoțitoare iar operațiunile anterioare nu au un efect semnificativ asupra IAP.
În 2004, a avut loc prima conferință de consens pe problemele sindromului de compartiment abdominal (SCA), unde hipertensiunea intraabdominală (IAH) a fost definită ca o creștere susținută a IAP până la 12 mm Hg. Artă. și mai mult, care se înregistrează cu cel puțin trei măsurători standard cu un interval de 4-6 ore.Această definiție exclude înregistrarea fluctuațiilor scurte și scurte ale IAP care nu au semnificație clinică.
J.M. Burch şi colab. în 1996 a dezvoltat o clasificare a AHI pe baza nivelului IAP, care, după unele modificări minore, are în prezent următoarea formă:
- Gradul I se caracterizează prin presiune intravezicală de 12-15 mm Hg. Artă.;
- gradul II - 16-20 mm Hg. Artă.;
- gradul III - 21-25 mm Hg. Artă.;
- Gradul IV - mai mult de 25 mm Hg. Artă.
sindromul compartimentului abdominal (sinonime: sindrom de presiune intraabdominală ridicată, sindrom de cavitate abdominală) este definit în prezent ca o creștere persistentă a IAP la un nivel de peste 20 mm Hg. Art., care se asociaza cu manifestarea insuficientei/disfunctiei de organ.
Este important ca, spre deosebire de fenomenul IAH, ACS nu trebuie clasificat în funcție de nivelul IAP, deoarece acest sindrom este prezentat în literatura modernă ca un fenomen „totul sau nimic” (adică odată cu dezvoltarea ACS cu un anumit grad de IAH, o creștere suplimentară a IAP nu contează).
SCA este una dintre complicațiile severe ale unui număr de boli acute și boli cronice organele din cavitatea abdominală și spațiul retroperitoneal, precum și patologia extra-abdominală, necesitând măsuri de corectare și prevenire în timp util.
Incidenta exacta a acestei complicatii este necunoscuta. Conform diverselor date, incidența IAH la pacienții care au suferit laparotomie pentru traumatism abdominal în perioada postoperatorie variază de la 2 la 30%. Dintre pacienții de UTI internați la condiție critică, fenomenul IAH se observă în 54,4% din cazuri la pacienţii terapeutici şi în 65% din cazuri la pacienţii operaţi. În același timp, SCA se dezvoltă în aproximativ 8,2% din cazurile de IAH.
La efectuarea laparotomiei/relaparotomiei decompresive, efectuată după 3-6 ore de la apariția primelor semne de SCA, mortalitatea este în medie de aproximativ 20%, în mai mult. întâlniri târzii- de la 43 la 65,5%, fara decompresie chirurgicala ajunge la 100%.
Etiologie
Condițiile anatomice pentru dezvoltarea IAH și ACS sunt ca cavitatea abdominală, împreună cu spațiul retroperitoneal, să fie limitată din diferite părți de mușchi, coloana vertebrală, diafragmă și oasele pelvine. Datorită extensibilității țesuturilor moi, volumul cavității abdominale poate crește doar până la anumite valori finale.
Selectați un interval factori predispozanți dezvoltarea ACS, care poate fi împărțită în patru grupuri.
- Factori care contribuie la scăderea elasticității peretelui abdominal anterior: durere severă și spasm muscular al peretelui abdominal anterior; ventilația artificială a plămânilor, în special cu rezistență la aparatul respirator, selecția incorectă a parametrilor pentru presiunea finală de expirare pozitivă, pleuropneumonie, chirurgie plastică de întindere a herniilor ventrale gigantice, cicatrici pe peretele abdominal anterior.
- Factori care contribuie la creșterea conținutului cavității abdominale: pareza stomacului, obstructie intestinala, tumori ale cavității abdominale, anevrism al aortei abdominale, edem sau hematom al spațiului retroperitoneal.
- Factori care contribuie la acumularea de lichid sau gaz în cavitatea abdominală: ascită, pancreatită, peritonită, hemo- și pneumoperitoneu.
- Factori care contribuie la dezvoltarea „scurgerii capilare”: acidoza (pH sub 7,2), hipotermie, politransfuzie (mai mult de 10 unități RBC pe zi), coagulopatie, sepsis, bacteriemie, masiv terapie prin perfuzie(mai mult de 5 litri de coloizi sau cristaloizi în 8-10 ore), arsuri extinse (peste 25% din suprafața corpului).
Acești factori explică cerc mare motivele existente pentru dezvoltarea ACS, dintre care cele mai frecvente includ:
- traumatisme severe ale organelor abdominale,
- fractură pelviană,
- sângerare în cavitatea abdominală și spațiul retroperitoneal,
- anevrism de aortă abdominală rupt
- peritonită,
- pancreatită distructivă,
- arde peste 60% din suprafața corpului,
- terapie masivă cu fluide pentru șoc.
Mai rar, cauzele dezvoltării SCA sunt: obstrucția intestinală, sutura unei plăgi laparotomice cu tensiune pe marginile acesteia, repararea herniei, dializa peritoneală. La mai mult motive rare poate fi atribuită dezvoltării SCA la pacienții cu traumatisme cranio-cerebrale izolate și traumatisme izolate ale extremităților, inclusiv cei însoțiți de sindromul de compresie a țesuturilor moi.
Fraipont şi colab. a descris dezvoltarea sindromului ACS după traheostomie dilatată percutanată complicată de pneumoperitoneu. V. von Gruenigen și colab. au raportat două observații ale sindromului ACS după panhisterectomie. De asemenea, sunt descrise cazuri de dezvoltare a SCA după esofagogastroduodenoscopie, după endarterectomie din artera mezenterică superioară și în timpul laparoscopiei.
Clasificarea etiologică a SCA
- SCA primar (chirurgical sau abdominal) - ca o consecință procese patologice care se dezvoltă direct în cavitatea abdominală ca urmare a unui traumatism abdominal, ruptura unui anevrism al aortei abdominale, hemoperitoneu, pancreatită acută, peritonită larg răspândită, hematom retroperitoneal etc.
- SCA secundar (terapeutic, extra-abdominal) - caracterizat prin prezența IAH subacută sau cronică, ale căror cauze sunt patologia extra-abdominală, cum ar fi sepsis, arsuri extinse sau alte afecțiuni care necesită terapie cu lichide masive.
- AKS returnabil (terțiar) - este a reaparitie simptome caracteristice SCA, pe fondul unei imagini de rezolvare a unui SCA primar sau secundar care a apărut anterior. Această condiție este adesea denumită fenomenul „a doua lovitură”. SCA recurent se poate dezvolta pe fondul prezenței unui „abdomen deschis” la un pacient (sindromul compartimentului abdomen deschis) sau după suturarea „strânsă” a cavității abdominale (lichidarea unei laparostomii). SCA terțiar se caracterizează printr-o rată a mortalității semnificativ ridicată.
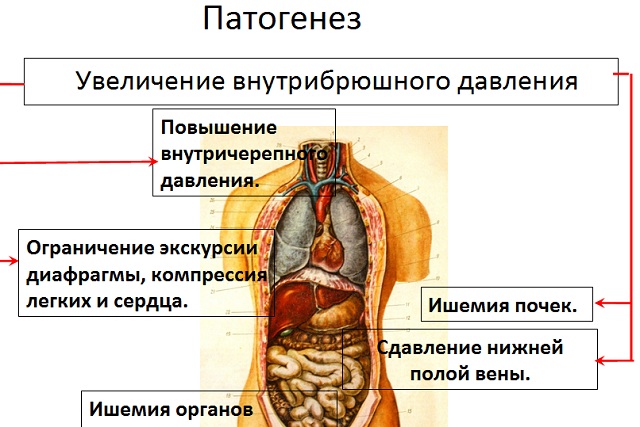
Patogeneza
Până în prezent, un număr semnificativ de studii au fost dedicate fiziologie patologică dezvoltarea ACS. Declanșatorul este considerat a fi o creștere a nivelului IAP la 15 mm Hg. Artă. și altele. De interes sunt datele experimentale, conform cărora insuficiența multiplă de organe se dezvoltă rapid cu o creștere a IAP la 30 mm Hg. Artă. (studiu pe animale), totuși, într-un alt experiment similar, s-a constatat că o creștere a IAP la 15 mm Hg. Art., care persistă 24 de ore, duce și la dezvoltarea SCA.
Fenomenul IAH declanșează o serie de modificări patologice în organe și sisteme, care pot fi descrise secvenţial după cum urmează.
Modificări ale organelor abdominale si spatiul retroperitoneal. Creșterea IAP până la 15 mm Hg. Artă. perturbă semnificativ alimentarea cu sânge a organelor abdominale și a spațiului retroperitoneal. Fluxul sanguin volumetric de-a lungul arterei mezenterice superioare și alimentarea cu sânge a mucoasei tract gastrointestinal scade, oxigenarea peretelui stomacal scade, ceea ce duce la o scădere pronunțată a nivelului pH-ului din membrana mucoasă a acestuia.
Din partea intestinului subțire modificări patologice exprimat într-o măsură mai mică, totuși, examenul histologic relevă afectarea membranei mucoase a tuturor părților tractului gastrointestinal, până la posibilitatea dezvoltării necrozei tuturor straturilor peretelui intestinal și a peritonitei. Aceste modificări par să progreseze către o reducere semnificativă a debitului cardiac și, prin urmare, pot servi ca semn precoce AKS.
Presiunea de perfuzie abdominală (presiunea de perfuzie abdominală), calculată ca diferență între presiunea arterială medie și presiunea intraabdominală, scade mai devreme și mai puternic decât presiunea arterială mezenterică superioară și debitul cardiac și, prin urmare, poate fi cel mai important parametru de prognostic.
Modificări ale homeostaziei incalca funcția de barieră membrana mucoasă a tractului gastrointestinal. Acest lucru duce la translocarea bacteriană în Ganglionii limfatici, splina si vena porte. Fluxul de sânge prin artera hepatică încetinește atunci când IAP este mai mare de 11 mm Hg. Art., în vena portă - cu IAP mai mare de 20 mm Hg. Artă. Aceasta duce la formarea necrozei de până la 12% din hepatocite, care se manifestă atât morfologic, cât și de laborator: o creștere a nivelului de ALT și fosfatază alcalină.
Modificări ale organelor cardiovasculare și sistemele respiratorii . Tulburările cardiorespiratorii se dezvoltă la 57% dintre pacienții cu SCA. O creștere a IAP duce la o deplasare în sus a diafragmei, o creștere a presiunii în cavitățile pleurale, o scădere a extensibilității toracice și o serie de modificări ale funcției de ventilație și schimbului de gaze.
Cercetătorii cred că o creștere a IAP la 25-30 mm Hg. Artă. duce, la rândul său, la o creștere a presiunii inspiratorii maxime de aproape 2 ori (de la 18 la 34-40 cm de coloană de apă). Crește și valoarea pCO2, iar valoarea pO2 scade. Se dezvoltă treptat sindromul de detresă respiratorie. Insuficiența respiratorie în creștere rapidă impune necesitatea transferului pacientului la ventilație pulmonară artificială cu parametri stricti.
Creșterea IAP duce la creșterea presiunii intratoracice și datorită compresiei venei cave inferioare, care reduce întoarcerea venoasă către inimă. Unii cercetători constată o scădere a debitului cardiac și a indicelui cardiac, alții cred că se modifică ușor. S-a înregistrat o creștere a rezistenței periferice totale și a presiunii venoase centrale. Crește, de asemenea, presiunea în venele femurale, în vena cavă inferioară și în venele jugulare interne.
sistolică presiunea arterială poate rămâne neschimbat, poate crește, de exemplu, din cauza vasoconstricției periferice sau poate scădea, în special în cazul terapiei conservatoare nereușite sau inadecvate.
LA acidoza respiratorie se adaugă metabolic, care se manifestă printr-o creștere a concentrației de lactat și o deficiență de baze, o scădere a nivelului pH-ului din sânge. Saturația cu oxigen a țesutului muscular scade, de asemenea, ceea ce depinde direct de conținutul de oxigen din artera pulmonară.
modificări ale rinichilor. Unii cercetători cred că cardiopulmonar şi insuficiență renală- acestea sunt cele mai frecvente și redutabile semne ale SCA. Creșterea IAP perturbă macro și microcirculația, secreția de urină și filtrarea glomerulară a rinichilor. Necroza epiteliului glomerular evidențiată histologic. Ca urmare, fluxul sanguin renal scade și filtrare glomerulară, crește concentrația de renină, aldosteron și hormon antidiuretic în plasmă, apare proteinurie.
Rata diurezei orare scade deja de mai mult de 2 ori cu o creștere a IAP la 15 mm Hg. Art., cu durata de 24 ore.Presiunea arteriala sistemica poate fi mai mare de 90 mm Hg. Artă. Creșterea IAP până la 20-30 mm Hg. Artă. în multe observații duce la anurie, neremediată prin introducerea de diuretice. Potrivit lui D. Meldrum et al., disfuncția renală se dezvoltă la 33% dintre pacienții cu SCA.
Creșterea presiunii intratoracice. Acest factor provoacă hipertensiune intracraniană din cauza blocării funcționale a fluxului de ieșire din creier prin venele jugulare. Umflarea crescută și disfuncția creierului, care la rândul său crește riscul de leziuni ischemice secundare ale neuronilor.
La pacienții cu leziuni cerebrale traumatice și leziuni ale organelor abdominale, apare un sindrom de încărcare reciprocă, care agravează semnificativ prognosticul. Deci, W. Ertel et al. raportează doi pacienți cu un nivel critic crescut presiune intracraniană pe fondul sindromului ACS. G. Citerio et al. în acest sens, se recomandă prudență la efectuarea laparoscopiei la pacienții cu leziuni cerebrale traumatice.
O creștere a IAP agravează condițiile de vindecare a rănilor laparotomice și poate provoca ischemie și necroză a peretelui abdominal.
Astfel, SCA are o serie de mecanisme patogenetice de dezvoltare care afectează toate organele și sistemele. În acest caz, în primul rând, tulburări respiratorii, apariția oliguriei, proteinurie, scăderea presiunii de perfuzie abdominală, modificări necrotice în peretele intestinal, în perioada ulterioară - scăderea debitului cardiac, semne de ischemie hepatică, apariția de acidoză respiratorie şi metabolică. Toate acestea necesită monitorizarea constantă a nivelurilor IAP la pacienții cu risc.
Tabloul clinic
Tabloul clinic al sindromului ACS este nespecific. Conform unor date, SCA se manifestă clinic printr-o creștere a volumului abdomenului și tensiune în mușchii peretelui abdominal, combinată cu oligurie și tulburări respiratorii.
Conform altor date, o creștere a presiunii inspiratorii maxime și o scădere a ratei diurezei se manifestă mai devreme decât alte simptome. Cheia pentru diagnosticarea precoce a SCA este grad înalt vigilența medicului și măsurarea regulată (aproximativ la fiecare 6 ore) a IAP la pacienții cu Risc ridicat ascensiunea lui.
Metode de măsurare a IAP
Metoda de măsurare directă a fost propusă de R. Overholt în 1931. Constă în măsurarea directă a IAP în prezența unui abdomen deschis (laparostomie), în timpul laparoscopiei, dializei peritoneale, sau prin drenuri instalate în cavitatea abdominală.
Aceste metode sunt considerate precise, dar nu sunt utilizate pe scară largă din cauza complexității tehnice și posibile complicații, în legătură cu care s-au efectuat o serie de studii pentru a găsi o metodă indirectă de măsurare a presiunii.
Legea lui Pascal spune că presiunea exercitată asupra unui lichid sau gaz se extinde neschimbată la toate părțile lichidului sau gazului. Rezultă că în toate punctele cavității abdominale și spațiului retroperitoneal, IAP este același. Astfel, prin această lege se aprobă posibilitatea măsurării IAP în vezica urinară, stomac, vena cavă inferioară.
Monitorizarea IAP prin presiunea vezicii urinare s-a dovedit a fi precisă și metoda sigura. Peretele vezical elastic și foarte extensibil acționează ca o membrană pasivă și transmite cu precizie nivelul presiunii din cavitatea abdominală. Această metodă a fost propusă pentru prima dată de I.L. Khop și colab. în 1984
În prezent, au fost dezvoltate sisteme închise sterile speciale pentru măsurarea presiunii intravezicale, Unometer™ Abdo-Pressure™ (Unomedical, Danemarca) fiind recunoscut ca fiind cel mai preferat. Aceste sisteme includ un urimetru de ultimă generație și o secțiune de măsurare cu filtru de aer antibacterian hidrofob încorporat.
La măsurarea presiunii intravezicale, volumul, viteza de administrare a soluției saline și temperatura acesteia joacă un rol important. Introducerea rapidă a unei soluții reci poate duce la o contracție reflexă a vezicii urinare și o creștere a nivelului presiunii intravezicale și, în consecință, a presiunii intraabdominale.
Cantitatea de lichid injectată a făcut obiectul unor controverse, în prezent este considerată a fi de 20-25 ml. În acest caz, pacientul ar trebui să se afle în decubit dorsal, pe o suprafață orizontală, nivelul simfizei pubiene este luat ca punct zero. La pacientii in perioada postoperatorie, la masurarea IAP, este necesara o anestezie adecvata care, datorita relaxarii muschilor peretelui abdominal anterior, permite obtinerea celor mai precise valori.
O contraindicație pentru utilizarea acestei metode este deteriorarea vezicii urinare sau comprimarea acesteia de către un hematom sau o tumoare. Într-o astfel de situație, AHI se evaluează prin măsurarea presiunii intragastrice. O sondă este introdusă în stomac și înălțimea coloanei de lichid este măsurată într-un tub transparent conectat la sondă. Nivelul liniei axilare anterioare este luat ca marcaj zero.
Mai rar, IAP este monitorizată prin măsurarea presiunii în vena cavă inferioară folosind un cateter introdus prin vena femurală.
Principiile de prevenire și tratare a SCA
Principiile principale ale prevenirii SCA sunt: terapia adecvată prin perfuzie, selectarea corectă a parametrilor de sprijin respirator, decomprimarea în timp util a cavității abdominale.
În prezent, există două abordări pentru prevenirea creșterii IAP și AKC. Unii autori sugerează cu scop preventiv nu suturați aponevroza la pacienții cu risc crescut de a dezvolta SCA care sunt supuși laparotomiei (în primul rând la pacienții cu traumatisme abdominale). Din păcate, această tehnică nu împiedică întotdeauna o creștere a IAP și dezvoltarea SCA.
Metoda de decompresie chirurgicală cavitate abdominală
Majoritatea cercetătorilor consideră că această metodă de tratament este cea principală. Cu toate acestea, indicațiile pentru conservatoare și tratament chirurgical ACS sunt cauza a numeroase discuții până în prezent, acestea nefiind stabilite definitiv.
Meldrum şi colab. oferă următorul algoritm de tratament:
- la gradul I de IAH - terapie cu perfuzie adecvată și observație;
- la gradul II - continuarea terapiei și observației, se efectuează laparotomia decompresivă când tablou clinic AKS;
- la gradul III - laparotomie decompresivă și continuarea terapiei intensive;
- la gradul IV – decompresie şi resuscitare imediată.
La pacienții cu lichid liber în cavitatea abdominală, în special în SCA secundar, unii cercetători sugerează că primul pas este efectuarea unei puncție a cavității abdominale, laparocenteză sau laparoscopie cu evacuarea lichidului și drenajul cavității abdominale și numai în absență. a efectului acestor proceduri de a efectua laparotomie.
Laparotomia decompresivă, care este în prezent operația de elecție, poate reduce semnificativ mortalitatea la pacienții cu SCA. Se recomandă efectuarea acestuia nu numai în sala de operație, ci și în UTI. În studiul lui S. Toens et al. s-a demonstrat că laparotomia decompresivă duce la scăderea IAP de la 31 ± 4 la 17 ± 4 cm de apă. Artă.
Ertel şi colab. după această operație, o creștere semnificativă a indicelui cardiac, a volumului curent și a ratei diurezei, a presiunii venoase centrale, o scădere a presiunii în artera pulmonară, a presiunii inspiratorii maxime, pCO2 în sânge arterialși nivelurile de lactat plasmatic. La 2 pacienți cu leziune cerebrală traumatică severă concomitentă, laparotomia decompresivă a dus în plus la o scădere a presiunii intracraniene critic ridicate.
Închiderea plăgii laparotomice se efectuează după reducerea edemului cavității abdominale și a spațiului retroperitoneal și ameliorarea SCA, care apare de obicei la 1-8 zile după laparotomia decompresivă. S-a remarcat că reconstrucția și închiderea finală a plăgii laparotomice în întâlniri timpurii posibil doar în 18% din cazuri.
Complicațiile tipice ale laparotomiei decompresive sunt fistulele intestinale și hernia postoperatorie (până la 90%), care se dezvoltă adesea după utilizarea plaselor absorbabile. O complicație mai puțin severă este formarea de multiple fistule de ligatură(frecvența acestei complicații este de aproximativ 22%).
Trebuie remarcat faptul că laparotomia decompresivă poate fi complicată de o creștere a insuficienței cardiovasculare acute și a asistoliei din cauza scădere bruscă IAP, rezistență periferică totală, hipovolemie agravată și reperfuzie de zone ischemice extinse, există dovezi ale creșterii numărului de complicații tromboembolice, în special un risc crescut de apariție a emboliei pulmonare.
Există dovezi de gestionare deschisă a cavității abdominale (laparostomie în sensul literal al acestui termen), indicațiile absolute pentru aceasta sunt stabilite cu semne de infecție anaerobă a cavității abdominale sau spațiului retroperitoneal, progresia SCA (mai ales pe fondul în curs de desfășurare). măsuri medicale), precum și atunci când este imposibil să se reducă marginile plăgii laparotomice, în special ca urmare a inflamației purulente-necrotice severe a plăgii sau a flegmonului peretelui abdominal anterior.
Intubația nazointestinală
Necesitatea decompresiei intestinale în tratamentul SCA este dincolo de orice îndoială. Opțiunea preferată în acest scop este utilizarea sondelor nazointestinale de diferite modele.
Verificați în mod obiectiv pozitia corecta sondă, adică în posibilitatea ei în această situație (starea intestinală, caracteristicile sondei în sine), este posibil să își îndeplinească funcțiile ulterioare așteptate numai intraoperator, prin urmare, cu peritonită, controlul eficacității evacuării conținutului și spălarea intestinală ar trebui să înceapă imediat după. instalarea finală a sondei (umplerea uniformă a intestinului la introducere și evacuare liberă) și control la fiecare igienizare în cazul tratamentului în etape.
Contraindicațiile intubației nazo-intestinale sunt: infiltrarea severă a peretelui intestinal (leziunea acestuia depășește efectul intubării), severitatea extremă a stării pacientului, sub rezerva alegerii tratamentului în etape al peritonitei. Utilizarea stoamelor de descărcare pentru decompresia tractului gastrointestinal în condiții de peritonită larg răspândită este puternic criticată și considerată nedorită.
Suport respirator
În condițiile de SCA dezvoltat, pacienții au nevoie, fără îndoială, de ventilație pulmonară artificială. Parametrii de ventilație selectați incorect nu numai că nu elimină, ci și exacerbează insuficiență respiratorie. Suportul respirator ar trebui să fie efectuat conform conceptului de ventilație de protecție pentru a preveni leziunile pulmonare asociate ventilatorului.
Este obligatorie selectarea valorii optime a presiunii finale-expiratorii pozitive pentru a crește alveolele active funcțional din cauza segmentelor bazale prăbușite. Un nivel insuficient al unei astfel de presiuni nu împiedică prăbușirea alveolelor la expirație din cauza stării înalte a cupolei diafragmei, contribuind la dezvoltarea atelectotraumatismului, dar excesiv. nivel inalt exacerbează tulburările hemodinamice din cauza creșterii presiunii intratoracice, astfel încât acest parametru trebuie selectat conform graficului „presiune-volum”.
În condiții de IAH, complianța peretelui toracic, și nu a plămânilor, scade în primul rând, prin urmare, utilizarea unor volume curente mici (5-6 ml/kg) este optimă pentru a preveni baro- și volutrauma. Fracția de oxigen inspirator ar trebui să fie minim suficientă pentru a normaliza saturația amestecului sânge venos. Scăderea acestuia din urmă poate fi asociată și cu o scădere a livrării de oxigen în condiții de tulburări hemodinamice.
Utilizarea parametrilor agresivi ai ventilației mecanice pe fondul SCA poate duce la dezvoltarea sindromului de detresă respiratorie acută.
Terapia prin perfuzie
Manifestările clinice și tulburările fiziopatologice care se dezvoltă în SCA sunt mult mai pronunțate la pacienții cu hipovolemie. Tulburările de organ în acest caz încep într-un stadiu mai devreme și sunt mai severe.
Prezența și severitatea hipovolemiei la pacienții cu IAH nu pot fi stabilite prin metode convenționale, prin urmare, terapia cu perfuzie trebuie efectuată ținând cont de posibilul edem al intestinului ischemic și de o creștere și mai mare a IAP.
La pregătirea pacientului pentru decompresie chirurgicală pentru a preveni hipovolemia, se recomandă perfuzia de cristaloid. După efectuarea unei laparotomii decompresive, trebuie avut în vedere faptul că nevoia de administrare de lichide la pacienții cu cavitate abdominală deschisă este puternic crescută - uneori până la 10-20 l / zi.
Restaurarea ratei diurezei, spre deosebire de parametrii hemodinamici și respiratori, nu are loc imediat chiar și după decompresie, iar acest lucru poate dura destul de mult timp. In aceasta perioada este indicat sa se foloseasca metode extracorporale de detoxifiere, tinand cont de monitorizarea electrolitilor, ureei si creatininei.
Concluzie
Datele de mai sus indică faptul că sindromul de compartiment abdominal este o complicație foarte gravă a leziunilor și bolilor cavității abdominale și spațiului retroperitoneal. Declanșatorul său este o creștere semnificativă a presiunii intraabdominale.
Apariția acestui sindrom duce în mod fiabil la dezvoltarea modificărilor fiziopatologice cu formarea de insuficiență multiplă de organe cu o rată de mortalitate foarte mare. Dacă apare această complicație, capacitatea de salvare a pacienților este redusă drastic din cauza dezvoltării rapide a tulburărilor de organ, prin urmare, în grupul de pacienți cu risc crescut de afecțiuni abdominale. sindromul compartimental monitorizarea presiunii intraperitoneale, terapia cu perfuzie adecvată, decompresia în timp util și alegerea regimului optim de suport respirator sunt vitale.
V.A. Ovchinnikov, V.A. Sokolov
Sindromul compartimental (sindromul presiunii intrafasciale crescute), cel mai adesea se dezvoltă cu fracturi deschise, cu fracturi cu un factor traumatic puternic, cu fracturi ale piciorului inferior.Fiziopatologia
Sindromul compartimental (sindromul de compresie pozițională) se dezvoltă atunci când există o diferență de presiune între secțiunile musculare, ceea ce duce la ischemie. Rămâne neclar de ce unii oameni experimentează o creștere a presiunii în secțiunile musculare. Pacienții se plâng de durere care apare la scurt timp după debut exercițiuși durează câteva minute după încetarea acestora. De asemenea, pot fi observate parestezii, convulsii și slăbiciune. Creșterea presiunii poate provoca neuropraxie temporară a nervilor din jur. Diagnosticul se confirmă prin măsurarea presiunii în secții membru inferiorînainte de exercițiu și apoi la 1 și 5 minute după exercițiu. Dacă nu este posibilă schimbarea modului activitate motorie, pentru tratamentul sindromului compartimental se recurge la fasciotomia deschisă sau endoscopică a secțiilor afectate.
Simptomele sindromului compartimental:
Durere care nu este supusă acțiunii analgezicelor nenarcotice;
Scăderea sensibilității;
Pielea este palidă, strălucitoare, „întinsă”, încordată;
Durere la palpare și contracție musculară;
Durere cu mișcări pasive la nivelul degetelor;
Presiunea în cazul fascial este mai mare de 45 mm Hg.
Simptome tardive:
Paralizie;
Fara puls;
parestezii;
Contractura.
Inspecție inițială
Verificați parametrii vitali ai pacientului, notați prezența sau absența hipotensiunii, a tahicardiei.
Cereți pacientului să descrie natura durerii experimentate (intensă, profundă, pulsantă).
Aflați circumstanțele rănirii.
Verifică-ți pulsul.
Verificați culoarea pielii.
Folosind un ac, determinați prezența paraliziei, gradul acesteia.
Primul ajutor
Îndepărtați de la pacient tot ceea ce poate strânge părți ale corpului - inele, ceasuri, brățări.
Manifestarea clinică a sindromului fascial apare destul de târziu și, odată cu severitatea sa clinică, tratamentul este eficient doar în fazele inițiale; în unele cazuri, cu diagnosticare tardivă, nu se poate vorbi decât de amputație în stadii incipiente sau corectarea ortopedică a tulburărilor existente. în etapele ulterioare. Diagnosticul sindromului fascial la pacienții cu traumatisme multiple este adesea dificil, deoarece este imposibil să se identifice simptomele la pacienții cu contact productiv afectat. Sindromul durerii poate fi mascat de analgezicele utilizate. În plus, dinamica procesului poate fi astfel încât umflarea mușchilor să înceapă sau să progreseze în perioade ulterioare după accidentare.
Pregătiți pacientul pentru monitorizarea tensiunii arteriale.
Instalați un cateter urinar.
Introduceți conform indicațiilor medicului dumneavoastră:
° analgezice pentru reducerea durerii;
° sedative, deoarece tensiunea duce la vasoconstricție;
° componente ale sângelui care previn consecințele pierderii de sânge;
° soluții intravenoase(de exemplu, ser fiziologic clorură de sodiu) pentru a îmbunătăți funcția rinichilor.
Următoarele acțiuni
Verificați constant parametrii vitali ai pacientului.
Monitorizați starea bandajelor.
Verificați rezultatele testelor de sânge pentru hemoglobină, protrombină etc.
Măsuri preventive
Este necesar să se promoveze respectarea regulilor de siguranță personală, inclusiv atunci când conduceți o mașină, mergeți cu bicicleta etc.
Sindromul compartimentar acut (SCA; Sindromul compartimentar, acut; Ischemia Volkmann)
Descriere
În prezența sindrom acut compartiment (CSC), presiunea crește în spațiile închise care dețin mușchii, nervii și vasele de sânge. Din această cauză, mușchii nu primesc suficient oxigen. OSK poate afecta starea brațelor, mâinilor, picioarelor, picioarelor și feselor.
Cauze
Sub pielea umană se află o teacă conjunctivă numită fascia. Acoperă grupuri de mușchi, nervi și vase de sânge. Fascia formează teci pentru aceste fibre, așa-numitele compartimente. Cu o creștere puternică a presiunii în aceste cazuri, fluxul sanguin este perturbat. Trauma accelerează acest proces. Vase de sânge mor, ducând la necroză tisulară.
Cauzele sindromului compartimental acut pot include:
- Traumă (de exemplu, dintr-un accident de mașină, sport, rană prin împușcătură);
- Fractură (asociată cu majoritatea cazurilor);
- obstrucție venoasă;
- arsuri;
- Sângerare;
- Edem (umflarea țesuturilor de sub piele);
- Complicația intervenției chirurgicale.
Factori de risc
Următorii factori cresc riscul de sindrom compartimental acut:
- O procedură sau boală care poate duce la sângerare fatală în caz de vătămare:
- luarea de anticoagulante;
- tulburări de coagulare a sângelui (hemofilie);
- Participarea la anumite sporturi (cum ar fi fotbalul)
- Bandaje sau pansamente îmbrăcate prea strâns sau care nu se desprind mult timp;
- daune recente.
Simptomele sindromului compartimental acut
Simptome similare pot fi cauzate nu numai de sindromul compartimental, ci și de alte boli. Este necesar să spuneți medicului dacă apar următoarele semne:
- Durere severă (chiar și din cauza unei răni minore);
- senzație de strângere sau umflare a mușchilor;
- Piele umflată, strălucitoare pe zona afectată.
Simptomele pot apărea în decurs de 30 de minute până la 2 ore. În alte cazuri, poate dura câteva zile până când simptomele să apară. Sindromul de compartiment este o leziune gravă. Daunele pot duce la complicații grave sau chiar la moarte.
Diagnosticare
Următoarele teste sunt necesare pentru a diagnostica sindromul compartimental acut:
- Analize pentru măsurarea presiunii în compartimente (de exemplu, folosind un cateter, tonometru);
- Spectroscopie în infraroșu apropiat - un test pentru măsurarea cantității de oxigen din țesut;
- RMN, un test care folosește unde magnetice pentru a fotografia structurile din corp;
- O scanare CT este un tip de radiografie care utilizează un computer pentru a fotografia organele interne;
- Testarea reflexelor;
- Testarea intervalului de mișcare.
Teste de laborator pentru a determina amploarea daunelor:
- Principalul panou metabolic - pentru a evalua starea principalelor funcții ale corpului;
- Panel metabolic general - pentru evaluarea funcției organelor.
- Hemoleucograma completă ( analiza clinica sânge) - pentru analiza celulelor și substanțelor conținute în sânge.
Tratamentul sindromului compartimental acut
Intervenția chirurgicală, numită fasciotomie, trebuie făcută cât mai repede posibil pentru a reduce presiunea din compartiment și a preveni deteriorarea permanentă. Medicul face o incizie lungă în fascie pentru a îndepărta fibrele tisulare și pentru a reduce presiunea.
Prevenirea sindromului compartimental acut
Sindromul compartimental acut este greu de prevenit deoarece există multe cauze pentru apariția lui. Dar există câțiva pași pe care îi puteți lua pentru a reduce riscul de rănire:
- Purtați echipament adecvat când faceți sport
- Amintiți-vă când ați folosit ultima dată anticoagulante sau medicamente pentru tulburări de sânge;
- Aveți grijă când utilizați bandajul.
1053 0
Conceptul de sindrom de compartiment, la fel ca mulți alți termeni din medicină, ne-a venit din străinătate. Ce înseamnă „sindrom” nu este greu de ghicit, dar „compartiment”, contrar traducerii, poate fi interpretat ca o cameră sau un spațiu închis.
Este greu de determinat exact când a început să fie folosit conceptul de „sindrom de compartiment”, dar începutul aproximativ a venit puțin după ridicarea cortinei de fier. Cu toate acestea, absența unui termen pentru desemnare nu înseamnă absența patologiei. Desigur, mulți medici din Rusia s-au confruntat cu un sindrom similar și nu numai că s-au întâlnit cu acest lucru, ci au tratat și această boală destul de adecvat.
În același timp, au fost folosiți termeni precum „strângerea”, „hipertensiune arterială”. Deci, dacă traducem numele străin în limba noastră, atunci această boală poate fi numită pe bună dreptate „Sindromul spațiului închis”.
Sindromul compartimentar este un complex de simptome diferite, trăsătură distinctivă care au presiune fascială excesiv de mare. Acest lucru, la rândul său, duce la blocarea accesului sângelui la țesuturi și, ca urmare, pielea și învelișurile fasciale în sine mor.
Sindromul este împărțit în două forme diferite:
- Forma miofascială(Denumit și sindrom de compartiment local). Adesea, acest tip de tulburare provoacă consecințe precum metabolismul afectat al țesutului muscular și, ca urmare, moartea acestuia.
- Abdominale sindromul compartimental (forma mai gravă).

Forme acute și cronice de afectare
Sindromul compartimental este împărțit în două tipuri în funcție de severitatea manifestării. Ele diferă în motivele apariției lor, precum și în cât timp și cât de acut se dezvoltă fiecare dintre simptome.
Forma acută a sindromului
Cauzele sindromului acut sunt deformarile mecanice ale tesuturilor, de la o fractura obisnuita pana la o gips aplicata incorect de catre un medic.
Sindromul este cauzat de compresia tisulara, intr-o forma sau alta. Dezvolta compartimentul acut sindromul este, de asemenea, capabil, ca continuarea unor operații lungi și periculoase.
Pot fi prezente și unele cauze excentrice, cum ar fi o mușcătură de șarpe sau fluide sub presiune injectate în spațiul subcutanat.
Riscul poate fi crescut dacă pacientului i se administrează agenți de subțiere a sângelui sau dacă pacientul are o tulburare naturală de coagulare.
De asemenea, puteți observa adesea o problemă similară cu manipularea neglijentă a salvatorilor cu persoane care sunt inconștiente sub dărâmături.
dobândită cronic
Această formă de încălcare apare în mod regulat la powerlifters și culturisti, adică la toți cei care, trăgând de fier, încearcă să-și distrugă mușchii cât mai mult posibil, astfel încât să crească în volum. Și răscumpărarea pentru aceasta este adesea sindromul de compartiment.
În plus, o încălcare se dezvoltă și cu hipertensiune arterială în interiorul țesuturilor, unde se dovedește presiune mare pe oase si muschi. Un bun exemplu aici este tibia.
Dar totuși, oamenii care stau constant pe picioare sunt cei mai susceptibili la dezvoltarea sindromului, iar printre sportivii profesioniști, aceștia sunt în mod natural alergători de maraton care aleargă la distanțe extreme, încărcând constant întregul corp inferior, având în același timp tensiune arterială crescută amenda.
De ce crește presiunea fascială?
Există mai multe motive, printre care:
- vânătăi și hematoame care se formează după o hemoragie subcutanată extinsă;
- același hematom, dar deja inflamat;
- presiune exercitată asupra unei zone a corpului;
- cancere corporale
Pentru măsurarea presiunii în exces se compară cu cea normală, care pentru majoritatea oamenilor se ține pe culoarele de 8-9 mm Hg. Când însă presiunea spațiului miofiscial crește de câteva ori, atunci diagnosticul de se face „sindromul compartimental”.
În funcție de cât de mult diferă această presiune față de normă, se clasifică formele ușoare și severe ale bolii.
Gradul de deteriorare și simptome
Clasificați următoarele tipuri de încălcări în funcție de severitatea leziunii:
- Încălcare ușoară– Țesuturile membrelor nu sunt reci, se păstrează homeostazia și metabolismul țesuturilor și organelor, nu se observă modificări ale pulsului. Presiunea subfascială diferă de presiunea diastolică cu 32-42 de puncte. Aceasta este cea mai ușoară și uneori chiar exagerată formă a sindromului.
- Forma mijlocie- Albire vizibilă a țesuturilor pielii, extremități mai reci. Lipsa de oxigen în țesuturi, precum și alți factori, duc la hipoestezie sau anestezie a membrului. Pulsul încă se simte, dar este mult mai slab decât ar trebui. Presiunile diastolică și padfoscială sunt egale.
- Forma severă- Nu există deloc puls, o paloare puternică a țesuturilor și o răceală vizibilă a membrului. Presiunea subfacială este mult mai mare decât cea diastolică.
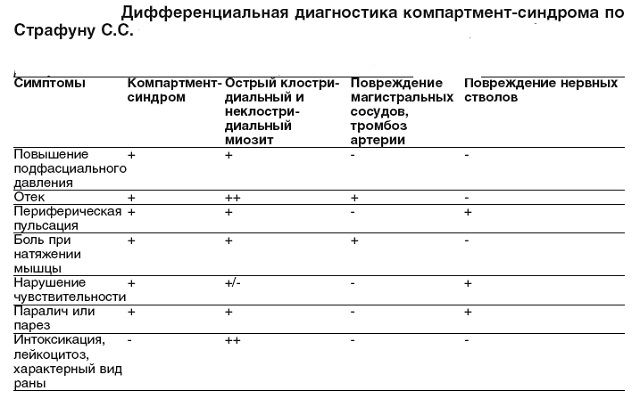
Diffdiagnostic
Este important să distingem acest sindrom, și unele boli similare ca simptome.
Printre altele, sunt:
- cheaguri de sânge în artere și deteriorare mecanică vase;
- probleme ale SNC și leziuni ale nervilor;
- diferite forme .
Următoarele criterii vă permit să recunoașteți sindromul de compartiment:
- pulsații de-a lungul perimetrului membrului;
- umflarea vizibilă cu ochiul liber;
- funcționarea afectată a terminațiilor nervoase;
- teste de sânge pozitive pentru leucocitoză excesivă;
- presiune subfascială crescută.
Pulsația va fi vizibilă aproape întotdeauna, cu excepția momentelor în care arterele și vasele sunt în plus înfundate cu cheaguri de sânge.
Edemul poate să nu fie vizibil, dar numai atunci când trunchiurile nervoase sunt afectate. Dar analizele de sânge dezvăluie doar procese infecțioase. Dar măsurarea presiunii subfasciale vă permite să determinați cel mai clar boala pacientului.
Cum să-l tratezi?

Tratamentul conservator al sindromului compartimental include:
- este necesară izolarea segmentului de țesut afectat de orice compresie mecanică, nu trebuie aplicate bandaje și plasturi pentru a preveni posibila ischemie;
- îndepărtarea spasmelor vaselor de sânge pentru a restabili circulația sângelui;
- scăpa de diferite infecții;
- luând un anestezic, iar în primele două zile este posibil să utilizați droguri narcotice;
- este necesar să se reducă cât mai mult posibil umflarea pe suprafața afectată;
- sunt necesare diferite medicamente care subțiază sângele și vă permit să faceți față unei posibile tromboze.


