05.11.2018
Inflamație - abstract - anatomie și fiziologie patologică - rezumat despre medicină
Modele generale de curgere proces inflamator. Reacția sângelui la inflamație.
Inflamaţie– tipic proces patologic, format în evoluție ca o reacție protectoare și adaptativă a organismului la impactul factorilor patogeni, având ca scop localizarea, distrugerea și îndepărtarea agentului patogen, precum și eliminarea consecințelor acțiunii acestuia, și caracterizată prin alterare, exudare și proliferare.
1. Modificare- deteriorarea structurii celulelor, țesuturilor și organelor, însoțită de o încălcare a activității lor vitale.
Distrofia este o tulburare metabolică a țesuturilor.
Mediatorii inflamatori sunt substanțe biologic active eliberate în țesuturi în timpul inflamației.
2. Exudația- exudarea părții lichide din sânge care conține proteine prin peretele vascular în țesutul inflamator.
Emigrare - eliberarea leucocitelor din sânge prin peretele vaselor mici în țesut sau în cavitățile seroase în timpul inflamației (prin diapedeză).
Fagocitoză - absorbția, digestia și neutralizarea microbilor, a celulelor deteriorate și a particulelor străine de către fagocite.
3. Proliferare- neoplasm al celulelor prin reproducerea lor prin diviziune pentru a reface țesutul deteriorat, participă diverse elemente tisulare. Este un parte integrantă regenerarea tesuturilor.
Reacții vasculare în inflamație- modificari fiziopatologice ale microcirculatiei (circulatia sanguina si limfatica) in tesuturi, manifestate prin ischemie, hiperemie arteriala si venoasa, exudatie, migrare leucocitara, staza.
Inflamația este unul dintre procesele patologice fundamentale care formează baza fiziopatologică a multor boli umane (de exemplu, encefalită, miocardită, pneumonie, stomatită, gripă, difterie etc.). Semnele clasice ale inflamației sunt durerea, roșeața, căldura, umflarea și funcționarea afectată a țesuturilor și a organelor.
Mecanismele procesului inflamator sunt universale, iar modelele de dezvoltare sunt comune, indiferent de diferențele structurale și funcționale ale țesuturilor.
Procesul inflamator se caracterizează prin dezvoltare trei tipuri reactii ale tesutului vascular: alterativ-distrofice, vasculare si proliferative.
Alterativ-distrofic reacțiile se manifestă prin afectarea locală a țesuturilor (alterarea) și tulburarea metabolismului tisular (distrofie). Alterarea primară apare ca urmare a unui efect dureros direct asupra structurile celulare organ. Ca răspuns la deteriorare, permeabilitatea membranelor celulare și subcelulare crește. Mastocitele secretă mediatori inflamatori (histamină, serotonină, heparină etc.). Enzimele lizozomale (glicolitice, litolice și proteolitice) sunt eliberate din diferite celule, activând reacțiile de glicoliză, lipoliză și proteoliză în țesut. BAS (mediatori, enzime) au un efect patogen și provoacă distrugerea ulterioară (alterarea secundară) a celulelor.
Alterarea se termină cu necroză a țesutului inflamat cu formarea de necroze, ulcere, răni etc. Modificările alterativ-distrofice se manifestă prin tulburări fizico-chimice semnificative în țesutul inflamat. Cele mai pronunțate modificări distrofice sunt însoțite de dezvoltarea leziunilor de acidoză (H + -hiperionia), hiperosmie și hiperhidratare a țesutului inflamat. Inflamația se formează ca un proces de autoreglare de deteriorare a structurii, a tulburărilor metabolice și a funcției tisulare. Cu toate acestea, dezvoltarea și răspândirea inflamației în formă proces local depinde de ansamblu reactivitatea corpului.
Inflamația exudativă se manifestă prin tulburări severe ale circulației sanguine locale (ischemie, hiperemie arterială și venoasă, stază) și circulație limfatică prin fenomene de exsudare (creșterea filtrării, difuziei și microveziculării plasmei sanguine prin peretele microvaselor) în țesuturi și cavități seroase cu formarea de infiltrate şi tipuri diferite exsudate, emigrarea leucocitelor în țesut și fagocitoză în țesutul inflamat.
Dintre reactiile protectoare si adaptative, un rol important il joaca hiperemia tisulara, fagocitoza, repararea compensatorie si regenerarea (proliferare), care au o mare valoare antiinflamatorie.
Inflamația proliferativă se caracterizează prin reparare și regenerare patologică (hipertrofie regenerativă, granulomatoză cu formare de polipi, scleroză și ciroză).
Tratamentul inflamației se bazează pe principiile fiziopatologice ale eliminării reacțiilor patologice alterativ-distrofice, exudativ-vasculare și proliferative prin restabilirea reglării neuroumorale a activității vitale tisulare.
Pe primele etape dezvoltare evolutivă(filogeneza) inflamația se manifestă printr-o reacție fagocitară (I.I. Mechnikov).
În perioada incipientă a ontogenezei sau pe fondul deficienței imunobiologice, procesul inflamator capătă adesea o distribuție generalizată (sepsis).
Unul dintre primele și principalele procese de inflamație este expansiunea reflexă a arterelor și capilarelor mici, cauzată de iritația terminațiilor nervoase înglobate în pereții vaselor de sânge, sau în mod reflex prin sistemul nervos central. Datorită expansiunii vaselor de sânge, acestea se revarsă cu sânge și încetinesc fluxul de sânge în ele, ceea ce duce la hiperemie inflamatorie. În vasele de sânge, tensiunea arterială crește, pereții se întind și devin mai transitabili pentru partea lichidă a sângelui. Porozitatea pereților vaselor de sânge crește datorită modificărilor acestora cauzate de procesul inflamator.
Prin pereții modificați ai vaselor, partea lichidă a sângelui pătrunde în țesutul din jur. Cu cât peretele vasului este mai deteriorat, cu atât particulele de proteine sunt mai mari prin care trece. Astfel, un conținut mai mare sau mai mic de proteine în exudat depinde de gradul de deteriorare a peretelui vascular. Se știe că în timpul mișcării rapide a unui lichid într-un tub, particulele solide în suspensie se află în mijlocul fluxului de lichid, iar atunci când acesta încetinește, încep să se așeze de-a lungul pereților vasului. Același lucru se întâmplă și cu sângele: cu un flux sanguin normal în vase, celulele sanguine suspendate sunt în centrul fluxului sanguin, iar când fluxul sanguin încetinește, leucocitele părăsesc fluxul sanguin axial în plasmă. Leucocitele aderă la endoteliu - se dezvoltă fenomenul de poziție marginală a leucocitelor.
Leucocitoza se observă în sânge, conținutul de proteine de fază acută (CRP, fibrinogen, ceruloplasmină, componente ale complementului, globuline etc.) crește, VSH crește (datorită scăderii sarcinii negative a eritrocitelor, creșterii vâscozității sângelui și o creștere a temperaturii).
Inflamaţie(inflamatie, din lat. în flăcări- aprinde) reacția organismului la deteriorarea locală formată în procesul de evoluție, caracterizată prin fenomene de alterare, tulburări de microcirculație (cu exudație și emigrare) și proliferare, care vizează localizarea, distrugerea și îndepărtarea agentului dăunător, precum și ca refacere (sau înlocuire) a țesuturilor deteriorate de aceasta.
Alterarea, tulburările de microcirculație (cu exsudație și emigrare) și proliferarea sunt principalele componente sau semne interne ale inflamației. În plus, focarul inflamației este caracterizat de cinci manifestări externe (locale): roșeață (rubor), umflătură (tumoare) febră, sau febră (calor) durere sau durere (dolor), disfuncție functio laesa)(Fig. 10-1). Aceste semne sunt bine definite în special atunci când focarul inflamației este pe tegumentul exterior.
Inflamația se poate manifesta nu numai prin semne locale, ci și prin semne generale, a căror severitate depinde de intensitatea și prevalența procesului.
Manifestările comune ale inflamației includ febră, reacții ale țesutului hematopoietic cu dezvoltarea leucocitozei, creșterea vitezei de sedimentare a eritrocitelor, metabolismul accelerat, reactivitatea imunologică alterată și intoxicația organismului.
Inflamația este unul dintre cele mai frecvente procese patologice tipice. În același timp, este o reacție importantă de protecție și adaptare care a evoluat ca o modalitate de a conserva întregul organism cu prețul deteriorării părților sale. Cu ajutorul inflamației, oferiți
Orez. 10-1. Bazele antice ale doctrinei inflamației (după Willoughby și Specter). Căldura, roșeața, umflarea și durerea duc la disfuncție
se determină localizarea și eliminarea agentului inflamator și (sau) țesutului lezat sub influența acestuia.
10.1. TEORII DE BAZĂ ALE INFLAMAȚIEI
Ca proces patologic care stă la baza majorității bolilor umane, inflamația a fost o problemă centrală a patologiei de-a lungul istoriei studiului bolii. Formarea ideilor despre esența inflamației a fost mult timp strâns asociată cu dezvoltarea opiniilor asupra naturii bolii.
În primele etape ale studiului inflamației, au dominat teoriile lui R. Virchow (1858) și Yu. Konheim (1885). Conform celular(atractiv, nutritiv) teoriile lui R. Virchow, inflamația este o încălcare a activității vitale a elementelor celulare ca răspuns la iritare, dezvoltare modificări distrofice, constând în apariția granulelor de proteine și a aglomerărilor în celule, atragerea (atracția) materialului nutritiv (nutritiv) din partea lichidă a sângelui și apariția acestei umflături tulburi a citoplasmei, care este caracteristică inflamației.
 Orez. 10-2. I.I. Mechnikov (1845-1916). Laureat Premiul Nobel 1908
Orez. 10-2. I.I. Mechnikov (1845-1916). Laureat Premiul Nobel 1908
De teoria vasculară a lui J. Kongeym inflamația se caracterizează prin tulburări circulatorii care duc la exudație și emigrare și provocând modificări celulare (distrofice) ulterioare. Cu toate acestea, după cum sa constatat mai târziu, inflamația se caracterizează prin dezvoltarea simultană și relația strânsă a fenomenelor vasculare și tisulare. Yu. Kongeym a descris pentru prima dată în detaliu întregul set de modificări ale tonusului vascular și fluxului sanguin cu exudație și emigrare.
O contribuție deosebit de importantă la studiul inflamației a avut-o I.I. Mechnikov(1892) (Fig. 10-2). A inițiat patologia comparativă a inflamației, teoria imunității celulare și umorale, teoria fagocitozei și a formulat biologic(fagocitar) teorie inflamaţie. Potrivit ei, veriga principală și centrală în procesul inflamator este absorbția particulelor străine, inclusiv a bacteriilor, de către fagocite.
După analizarea răspunsului inflamator în diferite feluri animale aflate în diferite stadii de dezvoltare evolutivă, I.I. Mechnikov și-a arătat complicația în filogeneză. În stadiile incipiente ale filogenezei (la cele mai simple organisme unicelulare), protecția împotriva materialelor străine se realizează prin fagocitoză. În același timp, chiar și la cele mai simple organisme apar unele fenomene de alterare. În organismele multicelulare care nu au un sistem vascular, inflamația se manifestă prin acumularea de celule amiboide fagocitare (amoebocite) în jurul locului de leziune. La nevertebratele superioare, inflamația este exprimată prin acumularea de celule sanguine - limfohematocite - la locul leziunii. În ciuda prezenței unui sistem circulator (de tip deschis), reacțiile vasculare caracteristice vertebratelor nu apar. Totodată, fenomene de proliferare sunt deja întâlnite în această etapă de dezvoltare evolutivă. La vertebrate și la om, răspunsul inflamator este semnificativ complicat din cauza fenomenelor vasculare cu exudație și emigrare, precum și a implicării sistemului nervos.
Rezultatele studiilor patologice comparative, indicând implicarea din ce în ce mai complexe de protecție și
fenomenele adaptative pe măsură ce procesul inflamator a evoluat, au permis I.I. Mechnikov pentru a arăta importanța inflamației ca reacție protectoare și adaptativă a întregului organism. I.I. Mechnikov a fost primul care a stabilit o legătură între inflamație și imunitate, în mecanismele cărora fagocitoza joacă, de asemenea, un rol semnificativ.
În prima jumătate a acestui secol, doctrina inflamației a început să se dezvolte în legătură cu apariția metodelor biofizice și biochimice. Rezultatele studiilor fizico-chimice versatile ale focarului inflamator au permis G. Sade(1923) nominalizează fizice si chimice, sau patologic molecular, ipoteză inflamație, conform căreia liderul în patogeneza acestui proces este o tulburare metabolică locală, care duce la dezvoltarea acidozei și la creșterea presiunii osmotice în țesut, care, la rândul lor, stau la baza tulburărilor circulatorii și a fenomenelor celulare în timpul inflamației. Cu toate acestea, s-a demonstrat curând că modificările fizico-chimice caracteristice focarului inflamației sunt detectate în cursul unei reacții inflamatorii deja dezvoltate și, prin urmare, nu pot fi un declanșator al fenomenelor vasculare și celulare (DE Alpern, 1927). În unele tipuri de inflamație (de exemplu, alergică), acidoza nu se dezvoltă sau este ușoară (A.D. Ado, 1935).
Pe baza rezultatelor unor studii patochimice extinse V. Menkin(1938) a încheiat rolul principal schimbări biochimiceîn patogeneza inflamaţiei. El a evidențiat o serie de substanțe specifice inflamației care mediază diferite fenomene inflamatorii - studiate necrozină, exsudină, leucotoxină, pirexină etc. Cu toate acestea, ar fi greșit să reducem întreaga patogeneză a inflamației doar la efectele disparate ale mediatorilor individuali.
De la începutul acestui secol, când a fost stabilită participarea sistemului nervos la patogeneza inflamației, au apărut ipoteze care dau rolul principal factorului nervos - mecanisme reflexe, afectarea funcției trofice a sistemului nervos. Da, de teoria vasomotorie (neurovasculară) a lui G. Ricker(1924) primar în apariția inflamației este o tulburare a funcției nervilor vasomotori. In functie de grad
iritația lor și, în consecință, reacția vasculară în curs de dezvoltare dezvoltă o astfel de relație între țesut și sânge, ceea ce duce la apariția hiperemiei inflamatorii și a stazei și, în consecință, determină intensitatea și natura tulburărilor metabolice. Totuși, întregul set de fenomene inflamatorii nu poate fi explicat doar prin reacția vaselor microvasculare.
D.E. Alpern(1959) au acordat o atenție deosebită problemei unității localului și generalului în inflamație, rolul reactivității organismului în desfășurarea acestui proces. El a subliniat esența inflamației ca reacție generală a organismului la acțiunea unui agent dăunător. El a justificat circuit neuro-reflex patogeneza inflamației, conform căreia diferite reacții ale țesutului vascular sunt reglementate de sistemele nervos și umoral (în principal hipofizar-suprarenal).
10.2. ETIOLOGIA INFLAMAȚIEI
Din moment ce cel mai mult cauza comuna inflamația sunt agenți infecțioși, se împarte după etiologie în infecțios (septic)și neinfectioase (aseptice).
10.3. REPRODUCEREA EXPERIMENTALĂ A INFLAMAȚIEI
În experiment, de regulă, se folosesc modele de inflamație aseptică cauzată de agenți chimici. Tradiţional
Aceștia sunt flogogeni iritanți care duc la dezvoltarea unei inflamații purulente acute: terebentină, ulei de croton, lapis, xilen, formol etc. Se folosesc și substanțe indiferente din punct de vedere chimic, precum caolinul. Pentru a reproduce inflamația aseptică cu predominanța fenomenelor exudative, se utilizează dextran. În ultimii ani, cel mai des folosit agent aseptic este caraginanul, un glicozaminoglican sulfat izolat din muşchiul irlandez. Chondrus.
Pentru a evita prezența ulterioară a unui flogogen în focar, se folosesc modele de inflamație termică sau cu radiații (raze ultraviolete, radiații ionizante).
Inflamația hiperergică este adesea modelată ca reacții alergice imediate sau întârziate. Această inflamație prezintă interes datorită cursului rapid, necrozei frecvente, care se datorează reactivității crescute a organismului sensibilizat.
În studiile fiziopatologice, modelele de inflamație infecțioasă sunt utilizate relativ rar. Acest lucru se datorează complexității modelării unei astfel de inflamații, datorită interacțiunii mai profunde a microorganismelor cu sistemul imunitar în procesul de apariție și curs. Momentan din agenti patogeni folosit predominant coli, stafilococi, Pseudomonas aeruginosa, deoarece sunt cele mai frecvente cauze ale bolilor purulent-inflamatorii și complicatii infectioaseîntr-o persoană. Modelele apropiate de inflamația infecțioasă sunt, de exemplu, peritonita fecală.
Pentru a studia fenomenele vasculare în focarul inflamației, cel mai convenabil obiect este mezenterul unei broaște (experiența lui Yu. Kongeym), urechea unui iepure (metoda camerei transparente - E.L. Clark și E.R. Clark), obrazul hamsterului husă, umflată cu aer (G. Selye ); pentru a studia dinamica celulară a focarului de inflamație, este recomandabil să se folosească metoda „ferestrei pielii” (J. Ribak) sau modele precum „airbag” subcutanat (G. Selye), peritonită, pleurezie, când exudatul poate să fie adunate cu ușurință.
10.4. PATOGENEZA INFLAMAȚIEI
Orice inflamație include 3 componente principale:
Alterare - deteriorarea celulelor și țesuturilor;
Tulburare de microcirculație cu exudație și emigrare;
Proliferarea - reproducerea celulelor și restabilirea integrității țesuturilor.
În consecință, există: inflamație alterativă, inflamație exsudativă, inflamație proliferativă (productivă).și - ca variantă separată - inflamație granulomatoasă.
Patogenia inflamației este o combinație complexă de mecanisme neuronale, umorale și efectoare care stau la baza unui număr mare de fenomene inflamatorii care alcătuiesc fenomenele de mai sus (Fig. 10-3).
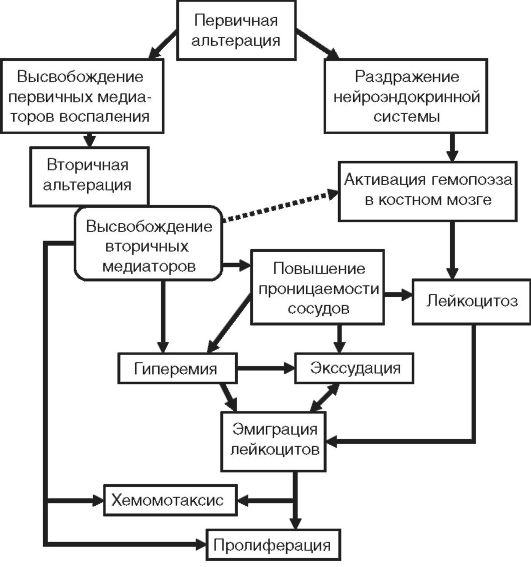 Orez. 10-3. Schema generală a patogenezei inflamației
Orez. 10-3. Schema generală a patogenezei inflamației
10.4.1. Rolul leziunilor tisulare în dezvoltarea inflamației
Modificare(alterare, din lat. alterare- Schimbare) sau distrofie, leziuni tisulare, malnutriție (trofism) și metabolism în ea, structura și funcția sa. Distinge între alterarea primară și secundară.
alterare primară este rezultatul efectului dăunător al agentului inflamator însuși, prin urmare, severitatea acestuia, celelalte lucruri fiind egale (reactivitatea organismului, localizare), depinde de proprietățile flogogenului. Strict vorbind, alterarea primară nu este o componentă a inflamației, deoarece inflamația este o reacție la deteriorarea cauzată de un flogogen, de exemplu. pentru alterarea primară. În același timp, practic, fenomenele alternative primare și secundare sunt greu de separat unul de celălalt.
alterare secundară este o consecință a impactului asupra țesutului conjunctiv, microvaselor și sângelui enzimelor lizozomale eliberate extracelular și metaboliților oxigenului activ. Sursa lor este activată fagocitele imigrate și circulante, parțial - celule rezidente. În inflamația la animalele cu leucopenie indusă anterior, alterarea este slab exprimată. Un anumit rol în alterare poate fi jucat și de complexul litic C5b-C9, care se formează în timpul activării complementului plasmatic și fluid tisular.
Alterarea secundară nu depinde de agentul inflamator; pentru dezvoltarea sa, prezența în continuare a unui flogogen în focar nu este necesară. Este răspunsul organismului la daune deja cauzate de un debut dăunător. Aceasta este o componentă oportună și necesară a inflamației ca reacție protectoare și adaptativă, care vizează delimitarea (localizarea) rapidă a flogogenului și (sau) țesutului deteriorat sub influența acestuia de restul corpului. Cu prețul daunelor, se realizează și alte fenomene de protecție importante: un efect microbicid și litic mai pronunțat al enzimelor lizozomale și al metaboliților de oxigen activ, deoarece se realizează nu numai în fagocite, ci și extracelular; implicarea altor mediatori ai inflamației și celulelor, exudație crescută, emigrare și fagocitoză. Ca urmare, procesul inflamator se termină mai repede. Cu toate acestea, modificarea este oportună numai în anumite limite. Deci, de exemplu, cu un dezechilibru în sistem, proteinazele lizozomale -
inhibitorii lor determină manifestări excesive de alterare cu predominanţă a necrozei.
Evenimentele alternative în inflamație includ degradarea țesuturilorși schimb sporit substanțe („foc metabolic”), conducând la o serie de modificări fizico-chimice în țesutul inflamat: acumularea de produse acide (acidoza, sau H + -hiperionia), creșterea presiunii osmotice (hipertensiune osmotică, sau hiperosmie), creșterea presiunii coloido-osmotice sau oncotice (hiperonchie).
În funcție de puterea agentului dăunător, de intensitatea și localizarea inflamației, manifestările morfologice ale modificării variază foarte mult: de la modificări structurale și funcționale abia vizibile până la distrugerea completă. (necrobioză) si moartea (necroză) tesuturi si celule. Se constată umflarea tulbure a citoplasmei celulelor, fenomenele de proteine, grăsimi și alte tipuri de distrofie a acestora. Permeabilitatea membranelor celulare și a organelelor celulare crește brusc. Se modifică și structurile subcelulare - mitocondriile, lizozomii, ribozomii și reticulul endoplasmatic. Mitocondriile se umflă sau se micșorează, cresta lor este distrusă. O creștere a permeabilității și deteriorarea membranelor lizozomilor sunt însoțite de eliberarea diferitelor enzime care joacă un rol în distrugerea structurilor subcelulare. Forma și dimensiunea cisternelor reticulului endoplasmatic se modifică, în citoplasmă apar vezicule, structuri concentrice etc.. Se notează localizarea marginală a cromatinei și deteriorarea membranei nucleare. În stromă, se observă umflarea mucoidelor și fibrinoidelor până la necroză, dizolvarea fibrelor de colagen și elastice.
Creșterea metabolismului în timpul inflamației apare predominant în detrimentul carbohidraților. Inițial, atât oxidarea cât și glicoliza lor cresc. Acest fenomen se bazează pe activarea enzimelor tisulare corespunzătoare. Consumul de oxigen de către țesutul inflamat crește semnificativ. Odată cu acumularea de leucocite în focar, ale căror enzime lizozomale descompun carbohidrații în mod anaerob, precum și deteriorarea și scăderea numărului de mitocondrii în timpul modificării, reacțiile de oxidare slăbesc vizibil și glicoliza crește. În consecință, descompunerea carbohidraților nu ajunge întotdeauna la produsele finale - dioxid de carbon și apă. Coeficientul respirator este redus. Produșii suboxidați ai metabolismului carbohidraților - acizii lactic și tricarboxilici - se acumulează în țesut.
În plus, din cauza unei încălcări a metabolismului grăsimilor, proteinelor și defalcării acizilor nucleici în focalizare, conținutul de acizi grași, corpi cetonici, polipeptide, aminoacizi, nucleotide (ATP, acid adenilic), nucleozide (adenozina). Ca urmare, se dezvoltă acidoza. Inițial, este compensată de sisteme tampon tisulare și de fluxul accelerat de sânge și limfa. Pe măsură ce ești epuizat sisteme tampon si incetinirea fluxului sanguin si limfatic, acidoza creste si devine necompensata. Dacă concentrația normală a ionilor de hidrogen în țesut este 0,5-10 -7, i.e. pH-ul este 7,34, apoi în caz de inflamație poate fi, respectiv, 25?10 -7 și 5,6 și mai mic. Cu cât procesul inflamator este mai acut, cu atât acidoza este mai pronunțată. Deci, în acută inflamație purulentă pH-ul este 6,5-5,39, iar în cronice - 7,1-6,6. Acidoza este implicată în creșterea permeabilității vasculare. Creează condiții favorabile pentru implementarea efectelor distructive ale enzimelor lizozomale, în special glicozidazele, care descompun componentele carbohidrate ale matricei țesutului conjunctiv.
Alături de H + -hiperionia, în accent crește și conținutul altor ioni - ioni de potasiu, sodiu, calciu. Acest lucru se datorează distrugerii celulelor și disocierii crescute a sărurilor într-un mediu acid. Datorită creșterii avansate a nivelului de potasiu extracelular, raportul dintre ionii de potasiu și calciu este perturbat (disionie). Modificările homeostaziei ionilor de Ca 2 + pot sta la baza morții celulare în focarul inflamației. Ca 2 + este unul dintre mesagerii secundari dintre membrană și sistemele enzimatice celulare, precum și aparatul genic. O creștere a nivelului de Ca 2 + intracelular duce la absorbția acestuia de către membranele mitocondriale și la blocarea ulterioară a lanțului respirator de electroni. Conținutul intracelular crescut de Ca 2 + activează proteazele non-lizozomale, ducând la liza citoscheletului, degradarea enzimelor, proteinelor asociate membranei (canale ionice, purtători, receptori, molecule de adeziune). S-a observat că, deși o scădere a Ca 2+ extracelular este importantă pentru supraviețuirea celulelor, poate fi un obstacol în calea noii lor creșteri. În centrul inflamației, concentrația moleculară crește, deoarece în procesul de degradare a țesuturilor și a metabolismului crescut, moleculele mari sunt împărțite în multe mici. Datorită creșterii concentrației ionice și moleculare, se dezvoltă hiperosmia. Deci, dacă depresia normală a lichidului interstițial
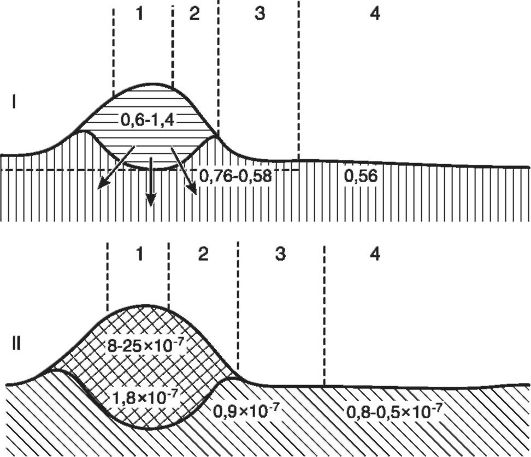 Orez. 10-4. Reprezentarea schematică a secțiunii prin edemul inflamator al pielii: I - modificări ale presiunii osmotice (A ° C) în diferite zone ale focarului inflamației: 1 - centrul inflamației, 2 - zona de pletoră, 3 - zona de edem evident, 4 - zona de edem latent; II - modificări ale concentrației ionilor de hidrogen: 1 - centrul inflamației purulente, 2 - zona de infiltrat inflamator, 3 - zona edemului periferic, 4 - zona de tranziție la stare normală(după Sade)
Orez. 10-4. Reprezentarea schematică a secțiunii prin edemul inflamator al pielii: I - modificări ale presiunii osmotice (A ° C) în diferite zone ale focarului inflamației: 1 - centrul inflamației, 2 - zona de pletoră, 3 - zona de edem evident, 4 - zona de edem latent; II - modificări ale concentrației ionilor de hidrogen: 1 - centrul inflamației purulente, 2 - zona de infiltrat inflamator, 3 - zona edemului periferic, 4 - zona de tranziție la stare normală(după Sade)
este 0,62°, adică presiunea osmotică este de 8 atm, apoi cu inflamație purulentă - respectiv 0,80 ° și 19 atm (Fig. 10-4).
Ca urmare a modificărilor fizice și chimice ale țesutului inflamat, are loc descompunerea proteinelor în polipeptide și aminoacizi, cu o creștere a concentrației acestora din urmă, o creștere a dispersiei coloizilor, capacitatea lor de a atrage și reține apa. Se dezvoltă hiperonkia. Modificările presiunii osmotice și oncotice sunt un factor important în exudație și, în consecință, edem inflamator.
10.4.2. Mediatori inflamatori
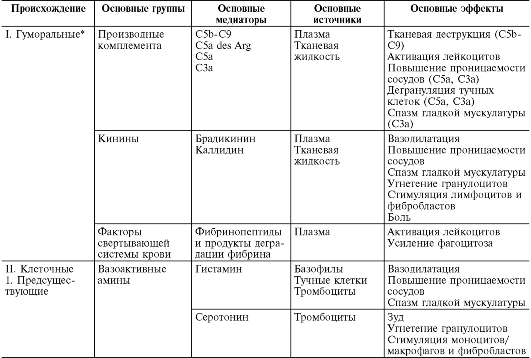
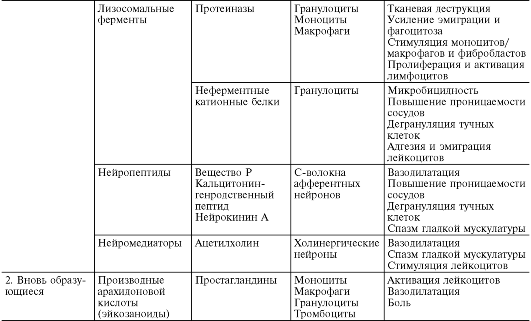
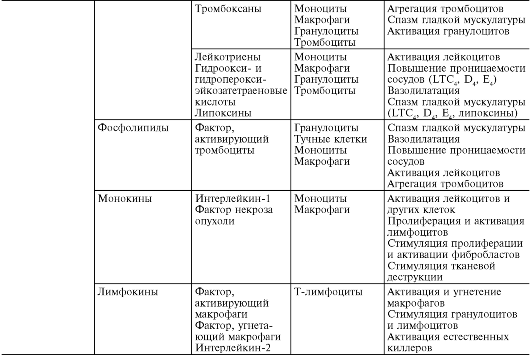
În timpul alterării primare și secundare, sunt eliberate cantități mari de diferiți mediatori și modulatori ai inflamației (Tabelul 10-1).
Masa 10-1. Mediatori inflamatori
 *Toate preexistente.
*Toate preexistente.
Mediatorii (mediatorii) inflamatorii sunt înțeleși ca substanțe biologic active care realizează apariția și susținerea diferitelor fenomene inflamatorii, de exemplu, creșterea permeabilității vasculare, emigrare etc. În timpul vieții normale, aceleași substanțe în concentrații fiziologice sunt responsabile de reglarea funcțiilor celulare sau tisulare. În timpul inflamației, fiind eliberate în cantități mari, aceștia capătă o nouă calitate - mediatori inflamatori. Aproape toți mediatorii sunt și modulatori ai inflamației; capabile să sporească sau să slăbească severitatea fenomenelor inflamatorii. În consecință, efectul mediatorului poate fi aditiv (aditiv), potențiant (sinergic) și slăbitor (antagonist), iar interacțiunea mediatorilor este posibilă la nivelul sintezei, secreției sau efectelor acestora. Legătura mediatoare este cea principală în patogeneza inflamației. Coordonează interacțiunea multor celule - efectori ai inflamației, schimbarea fazelor celulare în focarul inflamației.
Alegeri inflamatiile se impart in umoral(format în medii lichide - plasmă sanguină și lichid tisular) și celular. Toate mediatorii umorali sunt preexistenți, acestea. disponibile ca precursori înainte de activarea acestuia din urmă; acestea includ derivați de complement, kinine și factori de coagulare a sângelui. Printre mediatori celulari aloca preexistente(depuse în celule în stare inactivă) - amine vasoactive, enzime lizozomale, neuropeptide și nou format(adică produse de celule în timpul stimulării) - eicosanoide, citokine, limfokine, metaboliți de oxigen activ.
Principalele surse de mediatori celulari sunt:
1. neutrofile, care secretă proteine cationice, stimulează eliberarea de amine biogene din trombocite și mastocite, conțin un inhibitor de eliberare a histaminei și histaminază. Proteazele neutrofile sunt implicate în formarea kininelor și a fragmentelor de complement activ (C3a, C3b). Neutrofilele produc prostaglandine (PG) E 2 și alți eicosanoizi. Enzimele neutrofile activează atât coagularea sângelui, cât și fibrinoliza.
2. macrofage secretă angiotensin convertaza, care inactivează bradikinina, transformă angiotensina-I în angiotensină-II. Ei sintetizează PGE 2, precum și tromboxani și leu-
cotrienele (LT). Deoarece PGE 2 previne eliberarea mediatorilor celulari ai inflamației și inhibă agregarea trombocitară, macrofagele, pe lângă cele proinflamatorii, au și o funcție antiinflamatoare. Macrofagele sintetizează diverse componente ale complementului, au activitate de coagulare și fibrinolitică.
3. Eozinofile servesc ca modulatori negativi ai inflamației. Conțin histaminază, kininază, enzime care descompun leucotrienele C și D (lisofosfalipaza, arilsulfataza B, fosfolipaza D), principala proteină alcalină care îndeplinește o funcție citotoxică și neutralizează heparina. Astfel, enzimele eozinofile neutralizează produsele mastocitelor, contribuie la distrugerea resturilor celulare. Eozinofilele fagocitează granulele secretate de mastocite și suprimă eliberarea histaminei. De interes deosebit este prezența lizofosfolipazei în eozinofile. Substratul său este fosfolipidele parțial degradate conținute în membranele celulelor moarte. Prin eliberarea acizilor grași liberi din fosfolipide, lizofosfolipaza promovează formarea acid arahidonic.
4. Mastocitele și bazofilele secretă histamină și serotonină, heparină, factori de chemotaxie neutrofilă și eozinofilă, factor de activare a trombocitelor, enzime proteolitice, produc peroxidază, superoxid și peroxid de hidrogen, precum și o protează care transformă kininogenul în kinină.
5. trombocite secretă factori de creștere și coagulare, amine și lipide vasoactive, hidrolaze neutre și acide.
Complement derivate(Fig. 10-5) sunt cei mai importanți dintre mediatorii inflamatori umorali. Printre aproape 20 de proteine diferite formate în timpul activării complementului, fragmentele sale C5a, C3a, C3b și complexul C5b-C9 sunt direct legate de inflamație:
C5a și C3a sunt mediatori inflamatori acute și anafilatoxine (adică eliberatori de histamină din mastocitele), astfel cresc permeabilitatea capilară atât direct, cât și indirect prin histamină (Fig. 10-6);
C5a des Arg și C3a se formează din C5a în plasmă și fluid tisular sub influența carboxipeptidazei N și cresc permeabilitatea venulelor postcapilare. Efectul C5a des Arg
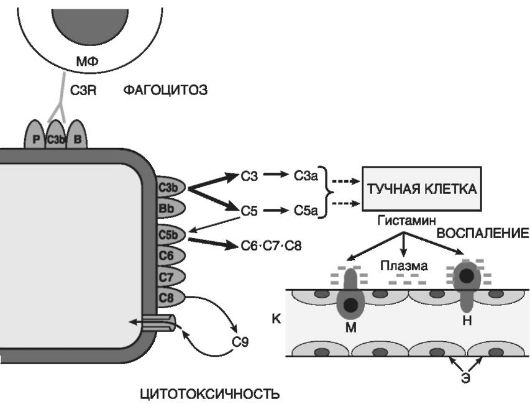 Orez. 10-5. Componentele sistemului complement: C3b, C5b - fragmente de C3 și C5 asociate membranei; C3a și C5a - peptide scindate din C3 și, respectiv, C5; С6-С8 - componente ale membranelor complexe de atac; C9 - proteină polimerizată în membrană; Bb - fragment de proteină B asociat membranei; săgeți - componente de reacție care cresc în cascadă; MF - macrofag; C3R - receptor pentru componenta complementului C3b; K - capilar; E - căptușeala endotelială a capilarului; H și M - diapedeza neutrofilelor și monocitelor
Orez. 10-5. Componentele sistemului complement: C3b, C5b - fragmente de C3 și C5 asociate membranei; C3a și C5a - peptide scindate din C3 și, respectiv, C5; С6-С8 - componente ale membranelor complexe de atac; C9 - proteină polimerizată în membrană; Bb - fragment de proteină B asociat membranei; săgeți - componente de reacție care cresc în cascadă; MF - macrofag; C3R - receptor pentru componenta complementului C3b; K - capilar; E - căptușeala endotelială a capilarului; H și M - diapedeza neutrofilelor și monocitelor
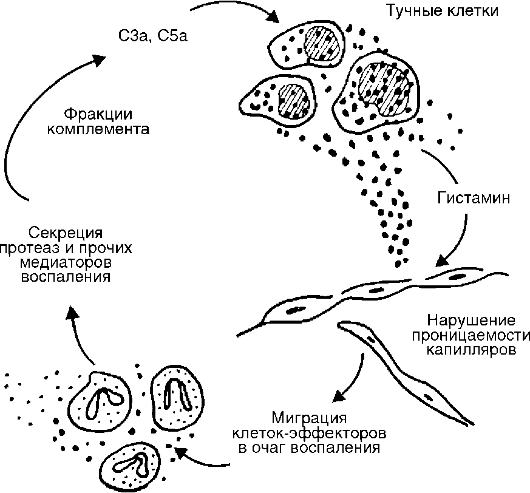 Orez. 10-6. Asocierea complementului cu mastocite în focarul inflamației acute
Orez. 10-6. Asocierea complementului cu mastocite în focarul inflamației acute
nu este asociat cu histamina, dar este dependent de neutrofile, de ex. realizată datorită factorilor de permeabilitate eliberați din granulocitele polimorfonucleare - enzime lizozomale și proteine cationice neenzimatice, metaboliți activi de oxigen. În plus, C5a și C5a des Arg atrag neutrofilele. În schimb, C3a nu are practic proprietăți chimiotactice;
C3b opsonizează agentul patogen și, în consecință, promovează aderența imună și fagocitoza;
Complexul C5b-C9 este responsabil pentru liza microorganismelor și a celulelor modificate patologic.
Sursa de complement este plasma sanguină și, într-o măsură mai mică, lichidul tisular. Fluxul sporit al complementului plasmatic în țesut este unul dintre scopurile importante ale exsudației. Componentele active ale complementului eliberează nu numai histamina, ci și interleukina (IL) 1, prostaglandine, leucotriene, factor de activare a trombocitelor și interacționează sinergic cu prostaglandinele și substanța P.
kinine- peptide vasoactive formate din kininogeni (a 2-globuline) sub influența kalikreinelor din plasmă (bradikinina) și din lichidul tisular (kalidină). Factorul declanșator pentru activarea sistemului kalicreină-kinină este activarea factorului Hageman (XII), care transformă prekalicreinele în kalicreine, în urma leziunilor tisulare. Factorul XII este prezent în sânge și are afinitate pentru suprafețele încărcate negativ. În faza lichidă a sângelui, se disociază spontan în două fragmente: CPa - un fragment activ enzimatic și CPb. XIIa este adsorbită pe suprafața unui agent străin (flogogen), unde este stabilizat. Are activitate proteolitică, al cărei substrat este însuși factorul CP și o altă proteină, prekallecreina. În plus, prekalicreina sub acțiunea CP este transformată în protează calicreină. Kalikreina îmbunătățește puternic formarea CN din factorul CP și, în același timp, acționează asupra unui nou substrat - așa-numitul kininogen cu greutate moleculară mare (HMK). Sub acțiunea kalikreinei, bradikinina se formează din DIU, care este unul dintre principalii mediatori ai inflamației. Bradikinina acționează asupra endoteliului vascular, provocând „deschiderea” marginilor celulelor endoteliului vascular și deschizând astfel calea pentru plasma sanguină către locul inflamației. Astfel, acest sistem detectează un corp străin prin încărcarea negativă
suprafete. Suprafețele propriilor celule sunt aranjate în așa fel încât să nu absoarbă CP, să nu-l stabilizeze și, astfel, să nu inducă un lanț suplimentar de evenimente. Acesta este cel mai simplu și mai primitiv mod de a distinge „propriu” de „non-propriu”.
Kininele mediază expansiunea arteriolelor și măresc permeabilitatea venulelor prin contracția celulelor endoteliale. Acestea contractă mușchii netezi ai venelor și cresc presiunea intracapilară și venoasă, inhibă emigrarea neutrofilelor, modulează distribuția macrofagelor, stimulează migrarea și mitogeneza limfocitelor T și secreția de limfokine. În plus, ele îmbunătățesc proliferarea fibroblastelor și sinteza colagenului și, prin urmare, au un rol în fenomenele reparatorii în inflamația cronică. Unul dintre cele mai importante efecte ale kininelor este capacitatea lor de a irita terminațiile nervoase senzoriale, provocând dureri inflamatorii. Kininele sporesc eliberarea de histamină din mastocite, sinteza de prostaglandine de către multe tipuri de celule, astfel încât unele dintre efectele lor principale - vasodilatație, contracția mușchilor netezi, durere - sunt asociate cu eliberarea altor mediatori, în special prostaglandinele.
Activarea factorului Hageman declanșează nu numai procesul de formare a kininei, ci și coagularea sângelui și fibrinoliza. În acest caz, se formează mediatori precum fibrinopeptidele și produșii de degradare a fibrinei, care sunt substanțe chimice atractoare puternice.
Eicosanoide(Fig. 10-7) reprezintă o legătură importantă de mediator răspuns inflamator, așa cum demonstrează producția lor pe termen lung în focus și o relație strânsă cu evenimentul cheie al inflamației - infiltrarea leucocitelor, precum și un efect antiinflamator puternic al inhibitorilor sintezei lor. În focarul inflamației, principalii producători de eicosanoide sunt monocitele și macrofagele, deși sunt formate din aproape toate tipurile de celule nucleare atunci când acestea din urmă sunt stimulate. Eicosanoidele predominante în focarul inflamației sunt prostaglandine(PGE 2), leucotriene(LTB4) și acid 5-hidroperoxieicosatetraenoic(5-HPETE). Se formează și tromboxan, deși într-o cantitate mai mică. A 1(TxA2), PGF2a, PGD2, prostaciclină (PGI2), LTC4, LTD4, LTE4, alte HPETE. Efectul principal al eicosanoidelor este efectul lor asupra leucocitelor; ca agenți chimici puternici, ei joacă un rol important în mecanismele de auto-susținere a infiltrației leucocitelor.
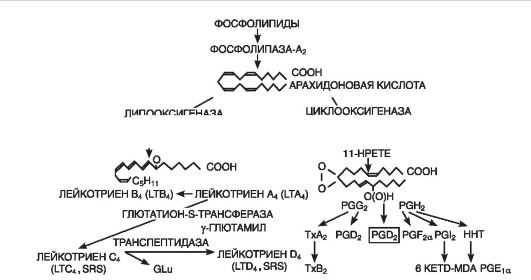
Orez. 10-7. Formarea leucotrienelor și prostaglandinelor din membrana celulară (după D. Gemsa și colab., 1981): Tx - tromboxan; PG (prostaglandine)- prostaglandine; LT (leucotrien)- leucotriene; HPETE (acid hidroxiperoxi-eicosatetranoic)- acid hidroperoxieicosatetraenoic
Prostaglandine nu cresc ele insele permeabilitatea vasculara, dar, fiind vasodilatatoare puternice, cresc hiperemia si, in consecinta, exudatia. Prostaglandinele și leucotrienele sunt importante în geneza durerii inflamatorii. În același timp, PGE 2, neavând activitate directă a durerii, crește sensibilitatea receptorilor terminațiilor nervoase dureroase aferente la bradikinină și histamină. PGE 2 este un agent antipiretic puternic și este implicat în dezvoltarea febrei. Prostaglandinele joacă un rol cheie în modularea procesului inflamator prin reglarea exsudației, emigrării și degranulării leucocitelor și fagocitozei. Deci, de exemplu, PGE potențează dezvoltarea edemului cauzat de histamină sau bradikinină, în timp ce PGF 1a, dimpotrivă, slăbește. În mod similar, PGE și PGF 1a acționează asupra emigrării leucocitelor.
leucotriene(sintetizat în toate celulele sanguine, cu excepția eritrocitelor, precum și în adventiția vasculară, mastocite, plămâni) contribuie la contracția mușchilor netezi ai tractului gastrointestinal, au un efect vasoconstrictiv (inclusiv artere coronare). LTC4, LTD4, LTE4 măresc permeabilitatea vasculară prin contracţia directă a celulelor endoteliale, iar LTB4 acţionează ca un mediator dependent de neutrofile. leucotriene la-
duce la spasm al mușchilor netezi ai bronhiilor (efectul bronhospasmului, spre deosebire de cel cauzat de histamină, se dezvoltă mai lent, dar este mai lung), dezvoltarea edemului, implicarea eozinofilelor, creșterea secreției de mucus și întreruperea transportului acestuia. . Organul țintă pentru leucotriene este inima. Fiind eliberate în exces, acestea inhibă (cu 60%) contractilitatea mușchiului inimii, reducând fluxul sanguin coronarian și sporind răspunsul inflamator. Leucotrienele interacționează intens cu alți mediatori inflamatori. Acestea sporesc actiunea bronhospastica a histaminei, acetilcolinei, prostaglandinelor si tromboxanilor, stimuleaza eliberarea de prostaglandine si tromboxani.
Tromboxani(formate în țesutul creierului, splinei, plămânilor și în trombocite, celulele granulomului inflamator) provoacă aderența și agregarea trombocitelor, contribuie la dezvoltarea trombozei în boala coronariană inima, au efect vasospastic.
Funcția modulatoare a eicosanoizilor se realizează prin modificări ale raportului dintre nucleotidele ciclice din celule.
Amine biogene - histamina si serotonina sunt considerați principalii mediatori ai tulburărilor microcirculatorii inițiale în focarul inflamației acute și faza imediată de creștere a permeabilității vasculare.
Cantitate mică de neurotransmițător serotonina se găsește în celulele mastocite și enterocromafine, dar principala sa sursă sunt trombocitele. Efectele serotoninei sunt ambigue și variază în funcție de cantitate. În condiții fiziologice normale, serotonina este un vasoconstrictor, provoacă vasospasm prelungit și le crește tonusul. Odată cu inflamația, cantitatea de serotonină crește dramatic. În concentrații mari, serotonina este un vasodilatator, dilată vasele de sânge, crește permeabilitatea și este de 100 de ori mai eficientă decât histamina. Serotonina este capabilă să provoace contracția directă a celulelor endoteliale venule și este, de asemenea, un mediator al durerii. În plus, serotonina stimulează monocitele la locul inflamației.
histamina acţionează în două moduri în raport cu vasele şi celulele. Prin receptorii H 1, extinde arteriolele și inhibă emigrarea și degranularea leucocitelor, iar prin receptorii H 1 îngustează venule, crescând astfel presiunea intracapilară, și stimulează
stimulează emigrarea și degranularea leucocitelor. In cursul normal al inflamatiei, histamina actioneaza in principal prin receptorii H 1 de pe neutrofile, limitandu-le activitatea functionala, si prin receptorii H 1 de pe monocite, stimuland-le. Astfel, alături de efectele vasculare proinflamatorii, are un efect antiinflamator. Deținând capacitatea de a regla proliferarea, diferențierea și activitatea funcțională a fibroblastelor, histamina este implicată în procesele de reparare. Efectele modulatoare ale histaminei sunt mediate și de nucleotidele ciclice.
În ceea ce privește interacțiunile aminelor biogene în focarul inflamației, se știe că histamina poate declanșa sau intensifica sinteza prostaglandinelor prin receptorii H 1 și o inhibă prin receptorii H 2. Interacționând atât între ele, cât și cu bradikinina, nucleotidele și nucleozidele, substanța P, aminele biogene cresc permeabilitatea vasculară. Efectul vasodilatator al histaminei este îmbunătățit în combinație cu acetilcolină, serotonină și bradikinină.
Enzime lizozomale sunt eliberate în focarul inflamației de la granulocite și monocite macrofage în timpul stimulării lor chemotactice, migrării, fagocitozei, deteriorarii, decesului. Granulele de neutrofile conțin proteinaze - elastază, catepsină G și colagenaze, care asigură protecție antimicrobiană prin lizarea microorganismelor moarte. Au efecte mediatoare și modulatoare asupra permeabilității vasculare, emigrării și fagocitozei.
O creștere a permeabilității vasculare sub influența enzimelor lizozomale apare din cauza lizei matricei subendoteliale, subțierea și fragmentarea celulelor endoteliale și este însoțită de hemoragie și tromboză. Formând sau scindând cele mai importante chemotaxine, enzimele lizozomale modulează infiltrarea leucocitară. În funcție de concentrație, ele înșiși pot îmbunătăți sau inhiba migrarea neutrofilelor. Proteinazele neutre sunt capabile să moduleze fagocitoza. De exemplu, elastaza formează opsonina C3b, care este necesară pentru aderența particulelor la suprafața neutrofilelor. În consecință, neutrofilul în sine oferă un mecanism de îmbunătățire a fagocitozei. Atât catepsina G, cât și elastaza cresc afinitatea receptorului Fc al membranei neutrofile pentru complexele de imunoglobuline și, în consecință, cresc eficiența captării particulelor.
Datorită capacității enzimelor lizozomale de a activa complementul, kalikreina-kinina, sistemele de coagulare și fibrinoliză, eliberează citokine și limfokine, inflamația se desfășoară și se autosusține pentru o lungă perioadă de timp.
proteine cationice neenzimatice, conținute în granule azurofile și specifice de neutrofile, au o proprietate atât de importantă precum microbiciditatea ridicată. În acest sens, ele sunt în interacțiune sinergică cu sistemul mieloperoxidază-peroxid de hidrogen. Proteinele cationice sunt absorbite pe membrana încărcată negativ a unei celule bacteriene prin interacțiune electrostatică, încălcând permeabilitatea și structura membranei acesteia. Apoi are loc moartea microorganismului, urmată de liza efectivă de către proteinazele sale lizozomale. În plus, proteinele cationice eliberate mediază permeabilitatea vasculară crescută (promovând degranularea mastocitelor și eliberarea histaminei), precum și aderența și emigrarea leucocitelor.
Citokineîn timpul inflamației, acestea sunt produse în principal de monocite și macrofage (monokine) stimulate, precum și de neutrofile, limfocite, celule endoteliale și alte celule. Citokinele cresc permeabilitatea vasculară (în mod dependent de neutrofile), aderența și emigrarea leucocitelor. Alături de proprietățile proinflamatorii, citokinele sunt, de asemenea, importante pentru apărarea directă a organismului, deoarece stimulează neutrofilele și monocitele să omoare, să absoarbă și să digere microorganismele invadatoare și, de asemenea, sporesc fagocitoza prin opsonizarea agentului patogen. Prin stimularea curățării rănilor, proliferării și diferențierii celulare, citokinele îmbunătățesc procesele reparatorii. Împreună cu aceasta, ele pot media distrugerea țesutului (degradarea matricei cartilajului și resorbția osoasă) și astfel joacă un rol în patogeneza bolilor țesutului conjunctiv, în special artrita reumatoida. Acțiunea citokinelor provoacă, de asemenea, o serie de efecte metabolice care stau la baza manifestărilor comune ale inflamației - febră, somnolență, anorexie, modificări metabolice, stimularea hepatocitelor la sinteza crescută a proteinelor de fază acută, activarea sistemului sanguin etc. Citokinele interacționează între ele, cu prostaglandine, neuropeptide și alți mediatori.
Mediatorii inflamatori (citokine) includ, de asemenea, o serie de limfokine- polipeptide produse de limfocitele stimulate. Limfokinele coordonează interacțiunea dintre neutrofile, macrofage și limfocite, reglând răspunsul inflamator în general.
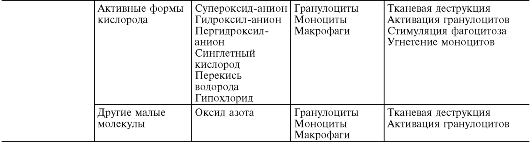
metaboliți activi ai oxigenului,în primul rând, radicalii liberi - radicalul anion superoxid (O * -), radicalul hidroxil (HO *), radicalul hidroperoxid (HO *,), datorită prezenței unuia sau mai multor electroni neperechi pe orbita lor exterioară, au reactivitate crescută cu alte molecule și, prin urmare, un potențial distructiv semnificativ, care este important în patogenia inflamației (Fig. 10-8).
Sursa speciilor reactive de oxigen - radicalii de oxigen, peroxidul de hidrogen (H 1 O 1), oxigenul singlet (1 O 1), hipoclorit (HOCl) etc. - sunt: izbucnirea respiratorie a fagocitelor în timpul stimulării lor, cascada acidului arahidonic în proces de formare a eicosanoizilor, procese enzimatice în reticulul endoplasmatic și peroxizomi, mitocondrii, citosol, precum și autooxidarea moleculelor mici precum hidrochinone, leucoflavine, catecolamine etc.
Radicalii de oxigen cresc capacitatea bactericidă a fagocitelor și au, de asemenea, funcții de mediator și modulator.
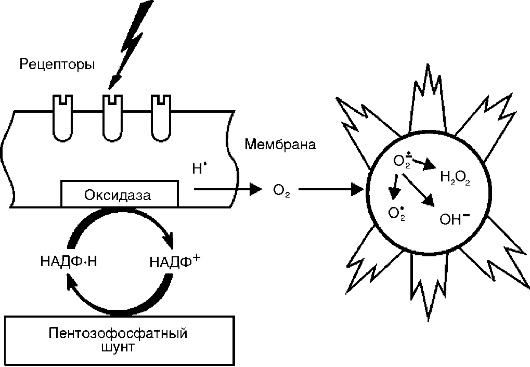 Orez. 10-8. Inducerea speciilor reactive de oxigen la activarea sistemului de oxidază al membranei celulare
Orez. 10-8. Inducerea speciilor reactive de oxigen la activarea sistemului de oxidază al membranei celulare
țiuni. Fiind mediatori ai inflamației, metaboliții activi de oxigen provoacă peroxidarea lipidelor, deteriorarea proteinelor, carbohidraților, acizilor nucleici, ceea ce crește permeabilitatea vasculară (datorită leziunii celulelor endoteliale) și favorizează stimularea fagocitelor. Ca modulatori, ei pot intensifica inflamația (prin eliberarea enzimelor și interacționând cu acestea atunci când țesutul este deteriorat) sau pot avea un efect antiinflamator (inactivarea hidrolazelor lizozomale și a altor mediatori inflamatori). Metaboliții activi de oxigen sunt de mare importanță în menținerea inflamației cronice.
Numiți și mediatori și modulatori ai inflamației neuropeptide- substanțe eliberate de fibrele C ca urmare a activării de către un agent inflamator a nociceptorilor polimodali, care joacă un rol important în apariția reflexelor axonale în ramurile terminale ale neuronilor aferenti primari (sensibili). Cele mai studiate sunt substanța P, peptida legată de gena calcitoninei, neurokinina A. Neuropeptidele cresc permeabilitatea vasculară, iar această capacitate este mediată în mare măsură de mediatorii derivați din mastocite. Există joncțiuni membranare între nervii nemieliniști și mastocite care asigură comunicarea între sistemul nervos central și focarul inflamației. Neuropeptidele interacționează sinergic în creșterea permeabilității vasculare atât între ele, cât și cu histamina, bradikinina, C5a, factorul de activare a trombocitelor, leucotriena B4; antagonic – cu ATP și adenozină. Ele au, de asemenea, un efect de potențare asupra atracției și funcției citotoxice a neutrofilelor, sporesc aderența neutrofilelor la endoteliul venulei. În plus, neuropeptidele cresc sensibilitatea nociceptorilor la acțiunea diverșilor mediatori, în special prostaglandina E 1 și prostaciclina, participând astfel la formarea durerii în timpul inflamației.
Pe lângă substanțele de mai sus, mediatorii inflamatori includ și acetilcolină și catecolamine, eliberat la excitarea colinei și a structurilor adrenergice. Acetilcolina determină vasodilatație și joacă un rol în mecanismul axon-reflex al hiperemiei arteriale în timpul inflamației. Noradrenalina și epinefrina inhibă creșterea permeabilității vasculare, acționând în principal ca modulatori ai inflamației.
10.4.3. Tulburări de circulație și microcirculație în țesutul inflamat
Tulburări de microcirculație. Fenomenele vasculare se dezvoltă în urma expunerii la un agent inflamator, deoarece cele inițiale sunt de natură reflexă. Ele sunt bine urmărite la microscop în experimentul clasic al lui Yu. Kongeym pe mezenterul unei broaște și includ o serie de etape:
1. spasm pe termen scurt arteriole, însoțite de albirea țesuturilor. Este rezultatul excitației reflexe a vasoconstrictoarelor din expunerea la un agent inflamator. Durează de la câteva zeci de secunde până la câteva minute, așa că nu este întotdeauna posibil să-l observi.
2. hiperemie arterială, datorită expansiunii arteriolelor, al căror mecanism, pe de o parte, este asociat cu excitația axon-reflex a vasodilatatoarelor și, pe de altă parte, cu efectele vasodilatatoare directe ale mediatorilor inflamatori: neuropeptide, acetilcolină, histamina, bradikinină, prostaglandine etc. Hiperemia arterială stă la baza două semne externe principale ale inflamației - roșeața și creșterea temperaturii țesuturilor. În plus, în recrearea căldurii, este importantă creșterea producției de căldură în focalizare datorită metabolismului crescut.
3. Hiperemia venoasă. Se poate dezvolta în câteva minute după expunerea la un flogogen și se caracterizează printr-o durată semnificativă - însoțește întregul curs al procesului inflamator. În același timp, deoarece cu participarea sa se desfășoară principalele fenomene inflamatorii, este luat în considerare adevărată hiperemie inflamatorie.
În mecanism congestie venoasă Există 3 grupe de factori: a) încălcări ale proprietăților reologice ale sângelui si circulatia acestuia. Acestea includ o creștere a vâscozității sângelui datorită îngroșării sale din cauza exsudației, pierderea albuminei, creșterea conținutului de globuline, modificări ale stării coloidale a proteinelor; rezistență crescută la fluxul sanguin ca urmare a stării marginale a leucocitelor, umflarea și agregarea eritrocitelor; formarea de trombi datorită activării sistemului de coagulare a sângelui; o încălcare a naturii fluxului sanguin - o încetinire a fluxului sanguin în zona axială, o scădere a zonei plasmatice marginale;
b) schimbări peretele vascular, care includ pierderea tonusului vascular din cauza paraliziei aparatului neuromuscular al vaselor; scăderea elasticității peretelui vascular; umflarea endoteliului și creșterea adezivității acestuia, în urma căreia lumenul vaselor se îngustează, se creează condiții pentru aderarea leucocitelor la endoteliu;
în) modificari ale tesuturilor, constând în compresia venulelor şi vase limfaticețesut edematos, infiltrat; scăderea elasticității țesutului conjunctiv. Mulți dintre acești factori sunt atât cauze, cât și, în același timp, consecințe ale dezvoltării hiperemiei venoase.
Hiperemia inflamatorie diferă de alte tipuri de hiperemie (cauzată, de exemplu, de un factor mecanic) printr-o slăbire semnificativă sau chiar perversiune a reacției vaselor țesutului inflamat la acțiunea agenților vasoconstrictori (adrenalină, cofeină) și la iritație. a nervilor simpatici. Acest fenomen poate fi asociat cu „desensibilizarea” vaselor, i.e. sensibilitatea lor redusă sau alterată calitativ la acţiunea stimulilor vasoconstrictori, care se datorează blocării receptorilor. Alte diferențe în hiperemia inflamatorie sunt asociate cu o aprovizionare mai pronunțată cu sânge în zona inflamată a unui organ sau țesut, extinderea și creșterea numărului de capilare funcționale, intensitatea microcirculației, întârzierea vitezei liniare a fluxului sanguin etc., ceea ce ne permite să considere hiperemia inflamatorie ca un tip special de tulburări de microcirculație.
4. Staza. Se poate dezvolta în unele ramificații ale vaselor țesutului inflamat. Staza larg răspândită este caracteristică inflamației acute, cu dezvoltare rapidă, de exemplu hiperergică. De regulă, perturbarea fluxului sanguin în staza inflamatorie este tranzitorie, cu toate acestea, dacă apar leziuni ale peretelui vascular și trombi în multe microvase, staza devine ireversibilă.
10.4.4. Exudații și exsudații
Tulburările de microcirculație în timpul inflamației sunt însoțite de fenomene de exudație și emigrare.
Exudația(exudatie, din lat. exudare- sudoare) - exudarea părții lichide din sânge care conține proteine prin peretele vascular
în țesutul inflamat.În consecință, lichidul care iese din vase în țesut în timpul inflamației se numește exudat. Termenii „exudat” și „exudat” sunt folosiți numai în legătură cu inflamația. Ele sunt concepute pentru a sublinia diferența dintre lichidul inflamator (și mecanismul de formare a acestuia) din lichidul intercelular și transudat - un revărsat neinflamator care iese cu un alt edem, neinflamator. Dacă transudatul conține până la 2% proteine, atunci exudatul conține mai mult de 3 (până la 8%).
Mecanismul de exudare include 3 factori principali:
1) permeabilitate vasculară crescută (venile și capilare) ca urmare a expunerii la mediatori inflamatori și, în unele cazuri, la agentul inflamator însuși;
2) o creștere a presiunii sanguine (filtrare) în vasele focarului de inflamație din cauza hiperemiei;
3) o creștere a presiunii osmotice și oncotice în țesutul inflamat ca urmare a modificării și exsudației care a început și, eventual, o scădere a presiunii oncotice din sânge ca urmare a pierderii de proteine în timpul exsudației abundente (Fig. 10-9, 10-10).
Factorul principal în exudare este permeabilitate vasculară crescută, care este de obicei Are două faze - imediată și întârziată.
 Orez. 10-9. Eliberarea albastrului Evans din vasul mezenterului broaștei în timpul inflamației, X 35 (conform lui A.M. Chernukh)
Orez. 10-9. Eliberarea albastrului Evans din vasul mezenterului broaștei în timpul inflamației, X 35 (conform lui A.M. Chernukh)
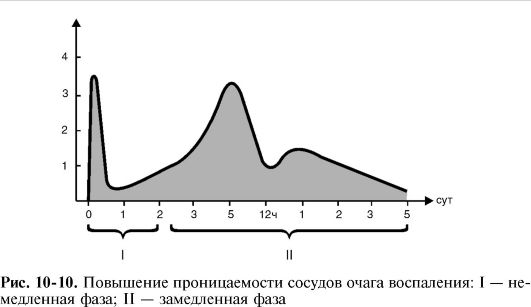 Faza Imediata apare după acțiunea unui agent inflamator, atinge un maxim în câteva minute și se termină în medie în 15-30 de minute, când permeabilitatea poate reveni la normal (dacă flogogenul în sine nu are un efect dăunător direct asupra vaselor). O creștere tranzitorie a permeabilității vasculare în faza imediată se datorează în principal fenomenelor contractile din endoteliul venulelor. Ca urmare a interacțiunii mediatorilor cu receptorii specifici de pe membranele celulelor endoteliale, microfilamentele de actină și miozină ale citoplasmei celulelor sunt reduse, iar celulele endoteliale sunt rotunjite; două celule adiacente se îndepărtează una de cealaltă, iar între ele apare un decalaj interendotelial prin care are loc exudația.
Faza Imediata apare după acțiunea unui agent inflamator, atinge un maxim în câteva minute și se termină în medie în 15-30 de minute, când permeabilitatea poate reveni la normal (dacă flogogenul în sine nu are un efect dăunător direct asupra vaselor). O creștere tranzitorie a permeabilității vasculare în faza imediată se datorează în principal fenomenelor contractile din endoteliul venulelor. Ca urmare a interacțiunii mediatorilor cu receptorii specifici de pe membranele celulelor endoteliale, microfilamentele de actină și miozină ale citoplasmei celulelor sunt reduse, iar celulele endoteliale sunt rotunjite; două celule adiacente se îndepărtează una de cealaltă, iar între ele apare un decalaj interendotelial prin care are loc exudația.
faza lenta se dezvolta treptat, atinge maxim dupa 4-6 ore si dureaza uneori pana la 100 de ore, in functie de tipul si intensitatea inflamatiei. În consecință, faza exudativă a inflamației începe imediat după expunerea la flogogen și durează mai mult de 4 zile.
O creștere persistentă a permeabilității vasculare în faza lentă este asociată cu deteriorarea peretelui vascular al venulelor și capilarelor de către factorii leucocitari - enzime lizozomale și metaboliți activi de oxigen.
În raport cu permeabilitatea vasculară mediatori inflamatori sunt impartite in:
1) actorie directa, afectând direct celulele endoteliale și provocând contracția acestora - histamina, serotonina, bradikinină, C5a, C3a, LTC4 și LTD4;
2) dependent de neutrofile, al cărui efect este mediat de factorii leucocitari. Astfel de mediatori nu sunt capabili să crească permeabilitatea vasculară la animalele leucopenice. Aceasta este o componentă a complementului C5a des Arg, LTB4, interleukine, în special IL-1, parțial un factor de activare a trombocitelor.
Ieșirea părții lichide a sângelui din vas și reținerea acesteia în țesut se explică prin: creșterea permeabilității vasculare, creșterea presiunii de filtrare a sângelui, presiunea osmotică și oncotică a țesutului, filtrarea și difuzia prin micropori în celulele endoteliale în sine (canale transcelulare). ) în mod pasiv; în mod activ - cu ajutorul așa-numitului transport microvezicular, care constă în micropinocitoză de către celulele endoteliale ale plasmei sanguine, transportul acestuia sub formă de microbule (microvezicule) către membrana bazală și eliberarea ulterioară (extrudarea) în țesut. .
Creșterea permeabilității vasculare în timpul inflamației Mai mult decât cu oricare dintre edemele neinflamatorii și, prin urmare, cantitatea de proteine din exsudat o depășește pe cea din transudat. Această diferență se datorează diferenței dintre cantitățile și setul de substanțe biologic active eliberate. De exemplu, factorii leucocitari care afectează peretele vascular joacă un rol important în patogenia exsudației și mai puțin semnificativ în edemul neinflamator.
Gradul de creștere a permeabilității vasculare este determinat și de compoziția proteică a exudatului. Cu o creștere relativ mică a permeabilității, pot ieși doar albumine fin dispersate, cu o creștere suplimentară - globuline și, în final, fibrinogen.
În funcție de compoziția calitativă, se disting următoarele tipuri de exsudate: seroase, fibrinoase, purulente, putrefactive, hemoragice, mixte (Fig. 10-11, vezi insertul color).
Exudat seros caracterizată printr-un conținut moderat de proteine (3-5%), în cea mai mare parte fin dispersate (albumină), și o cantitate mică de leucocite polimorfonucleare, drept urmare are o greutate specifică scăzută (1015-1020) și este
suficient de transparent. Compoziția este cea mai apropiată de transudat. Caracteristic pentru inflamația membranelor seroase (peritonită seroasă, pleurezie, pericardită, artrită etc.), mai puțin frecventă cu inflamația la nivelul organelor parenchimatoase. Exudatul cu inflamație seroasă a membranelor mucoase se caracterizează printr-un amestec mare de mucus. Această inflamație se numește catarală (din greacă. catarreo- curge în jos, curge în jos; rinită catarrală, gastrită, enterocolită etc.). Cel mai adesea, exudatul seros este observat cu arsuri, inflamații virale, alergice.
exudat fibrinos e diferit continut ridicat fibrinogen, care este rezultatul unei creșteri semnificative a permeabilității vasculare. La contactul cu țesuturile deteriorate, fibrinogenul se transformă în fibrină și cade sub formă de mase viloase (pe membranele seroase) sau o peliculă (pe membranele mucoase), în urma căreia exudatul se îngroașă. Dacă pelicula fibrinosă este situată lasat, superficial, ușor de separat, fără a încălca integritatea mucoasei, o astfel de inflamație se numește croupoasă. Se observă în stomac, intestine, trahee, bronhii. În cazul în care filmul este strâns lipit de țesutul de dedesubt și îndepărtarea lui expune suprafața ulceroasă, vorbim despre inflamația difterică. Este caracteristic amigdalelor, cavităţii bucale, esofagului. Această diferență se datorează naturii epiteliului mucoasei și adâncimii leziunii. Filmele fibrinoase pot fi respinse spontan din cauza autolizei, care se dezvoltă în jurul focarului, și inflamației de demarcație, și ies afară; suferă topire sau organizare enzimatică, adică germinarea prin țesut conjunctiv cu formarea de aderențe de țesut conjunctiv, sau aderențe. Exudatul fibrinos se poate forma cu difterie, dizenterie, tuberculoză.
Exudat purulent caracterizată prin prezența unui număr mare de leucocite polimorfonucleare, în principal moarte și distruse (corpi purulenți), enzime, produse ale autolizei tisulare, albumine, globuline, uneori fire de fibrină, în special acizi nucleici, care provoacă vâscozitatea ridicată a puroiului. Ca urmare, exudatul purulent este destul de tulbure, cu o nuanță verzuie. Este caracteristic proceselor inflamatorii cauzate de infecția cocică, ciuperci patogene sau flogogeni chimici precum terebentina, substanțe toxice.
Exudat putred (icor). Se distinge prin prezența produselor de descompunere putrefactivă a țesuturilor, în urma cărora are o culoare verde murdară și un miros urât. Se formează în cazul aderării anaerobilor patogeni.
Exudat hemoragic caracterizată printr-un conținut ridicat de globule roșii, ceea ce îi conferă o culoare roz sau roșie. Este caracteristică leziunilor tuberculoase (pleurezie tuberculoasă), ciumei, antrax, variolă, gripă toxică, inflamație alergică, i.e. pentru impactul agenților foarte virulenți, inflamație violentă, însoțită de o creștere semnificativă a permeabilității și chiar distrugerea vaselor de sânge. Caracterul hemoragic poate lua orice fel de inflamație - seroasă, fibrinoasă, purulentă.
Exsudate mixte sunt observate în timpul inflamației care apar pe fondul apărării organismului slăbite și ca urmare a atașării unei infecții secundare. Sunt exsudate sero-fibrinoase, seros-purulente, seros-hemoragice, purulent-fibrinoase.
Semnificația biologică a exsudației de două ori. Îndeplinește un rol protector important: asigură alimentarea țesutului cu mediatori plasmatici - componente active ale complementului, kinine, factori ai sistemului de coagulare, enzime plasmatice, substanțe biologic active eliberate de celulele sanguine activate. Împreună cu mediatorii de țesuturi, aceștia sunt implicați în uciderea și liza microorganismelor, recrutarea leucocitelor din sânge, opsonizarea unui agent patogen, stimularea fagocitozei, curățarea rănilor și fenomenele reparatorii. Cu exudat, produse metabolice, toxinele ies din fluxul sanguin în focar, adică. focarul de inflamație îndeplinește o funcție de eliminare a drenajului. Pe de altă parte, din cauza coagulării limfei în focar, a pierderii de fibrină, a agravării stazei venoase și a trombozei vaselor venoase și limfatice, exudatul este implicat în reținerea microbilor, a toxinelor și a produselor metabolice. în focalizare.
Fiind o componentă a procesului patologic, exsudația poate duce la complicații - fluxul de exudat în cavitatea corpului cu dezvoltarea pleureziei, pericarditei, peritonitei; compresia organelor din apropiere; formarea puroiului cu dezvoltarea unui abces, empiem, flegmon, pielie. Formarea de aderențe poate provoca deplasarea și disfuncția organelor. Localizarea procesului inflamator este de mare importanță. De exemplu,
formarea exsudatului fibrinos pe membrana mucoasă a laringelui în difterie poate duce la asfixie.
Acumularea de exudat în țesut provoacă un astfel de semn local extern de inflamație precum umflarea. În plus, împreună cu acțiunea bradikininei, histaminei, prostaglandinelor, neuropeptidelor, presiunea exudatului asupra terminațiilor nervilor senzoriali este de o anumită importanță în apariția durerii inflamatorii.
10.4.5. Eliberarea leucocitelor în țesutul inflamat (migrarea leucocitelor)
Emigrare(emigrare, din lat. emigra- mutați-vă, mutați-vă - eliberarea leucocitelor din vase în țesut. Se realizează prin diapedeză în principal prin peretele venulelor. Emigrarea leucocitelor în focar este un eveniment cheie în patogeneza inflamației. Leucocitele sunt principalii efectori ai inflamației. Efectele bactericide și litice extracelulare ale produselor leucocitare și fagocitoza joacă un rol decisiv în lupta împotriva flogogenului. În același timp, afectând celulele, vasele de sânge și sângele, componentele leucocitelor acționează ca mediatori și modulatori importanți ai inflamației, inclusiv leziuni ale propriilor țesuturi. Efectuând curățarea rănilor, fagocitele creează premisele fenomenelor reparatorii, unde stimulează proliferarea, diferențierea și activitatea funcțională a fibroblastelor și a altor celule. Mecanismul emigrării (după I.I. Mechnikov) constă în fenomenul de chemotaxie.
Punctul de plecare pentru activarea leucocitelor este impactul asupra receptorilor (adeseori specifici) membranelor celulare a diverșilor agenți chemotactici. (atractanți chimici), eliberate de microorganisme sau fagocite, precum și formate în țesut ca urmare a acțiunii unui agent inflamator sau sub influența fagocitelor înseși. Cele mai importante chemattractanți sunt: fragmente de complement, fibrinopeptide și produși de degradare a fibrinei, kalikreina, proactivator de plasminogen, fragmente de colagen, fibronectina, metaboliți ai acidului arahidonic, citokine, limfokine, peptide bacteriene, produși de degradare a granulocitelor.
Ca urmare a legării hemattractanților de receptori și a activării enzimelor membranei plasmatice, în fagocit se dezvoltă o explozie respiratorie - o creștere bruscă a consumului.
oxigen și formarea metaboliților săi activi. Acest proces nu are nimic de-a face cu furnizarea fagocitului cu energie. Se urmărește înarmarea suplimentară a fagocitei cu substanțe toxice foarte reactive pentru o distrugere mai eficientă a microorganismelor. Odată cu explozia respiratorie, în fagocit apar și alte modificări: creșterea producției de glicoproteine membranare speciale care determină adezivitatea fagocitei; o scădere a tensiunii superficiale a membranei și o schimbare a stării coloidale a regiunilor citoplasmatice (o tranziție reversibilă de la gel la sol), care este necesară pentru formarea pseudopodiilor; activarea microfilamentelor de actină și miozină, care este baza migrației; secreție crescută și eliberare de substanțe care facilitează atașarea leucocitelor la endoteliu (lactoferină, proteine cationice, fibronectină, interleukine).
Leucocitele ies din fluxul sanguin axial în plasmă. Acest lucru este facilitat de o încălcare a proprietăților reologice ale sângelui, o încetinire a fluxului sanguin, o schimbare a naturii sale, în special o scădere a zonei marginale a plasmei (Fig. 10-12).
Datorită creșterii proprietăților adezive ale leucocitelor și celulelor endoteliale, leucocitele aderă la
 Orez. 10-12. Schema fluxului sanguin in conditii normale si in inflamatie: 1 - circulatie normala: flux axial, zona plasmatica marginala cu leucocite individuale; 2 - încetinirea fluxului sanguin: eritrocitele sunt vizibile, poziționarea marginală a leucocitelor și trombocitelor; 3 - stază puternică a sângelui: poziție marginală a leucocitelor și trombocitelor, o scădere a zonei plasmatice marginale (conform D.E. Alpern)
Orez. 10-12. Schema fluxului sanguin in conditii normale si in inflamatie: 1 - circulatie normala: flux axial, zona plasmatica marginala cu leucocite individuale; 2 - încetinirea fluxului sanguin: eritrocitele sunt vizibile, poziționarea marginală a leucocitelor și trombocitelor; 3 - stază puternică a sângelui: poziție marginală a leucocitelor și trombocitelor, o scădere a zonei plasmatice marginale (conform D.E. Alpern)
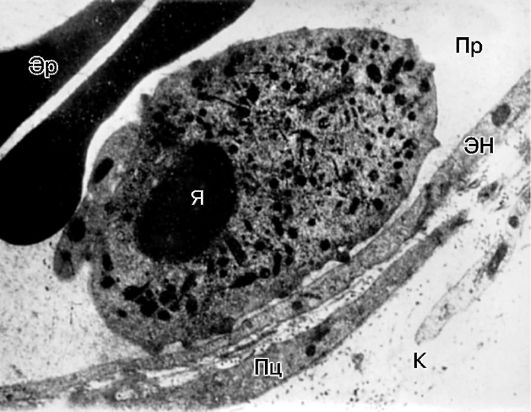 Orez. 10-13. Starea marginală a unui leucocite în venula mezenterului de șobolan în timpul inflamației: Pr - lumenul vasului; EN - celula endotelială; Pc - pericit; K - fibre de colagen; Eu sunt nucleul; Er - eritrocite. Microscopie electronică, x10.000 (conform A.M. Chernukh)
Orez. 10-13. Starea marginală a unui leucocite în venula mezenterului de șobolan în timpul inflamației: Pr - lumenul vasului; EN - celula endotelială; Pc - pericit; K - fibre de colagen; Eu sunt nucleul; Er - eritrocite. Microscopie electronică, x10.000 (conform A.M. Chernukh)
endoteliul - se dezvoltă fenomenul de poziţionare marginală a leucocitelor
(Fig. 10-13).
Creșterea adezivității endoteliului se poate datora: producției crescute de glicoproteine adezive (lectine) și alte substanțe care sunt incluse în compoziția peliculei de fibrină, care în mod normal acoperă endoteliul din lumenul vasului, fixarea de chemattractanți pe celulele endoteliale, interacționând ulterior cu anumite receptori pe leucocite, expresie crescută pe receptorii endoteliocitelor pentru imunoglobulina G și fragmentul de complement C3b, care contribuie la fixarea complexelor imune, iar prin intermediul acestora - leucocite purtătoare de receptori pentru imunoglobulină (Ig) G și C3b.
aderența leucocitelor la endoteliu mediată de următorii factori:
Leucocitele în faza de inițiere a inflamației sunt activate și formează agregate; ca urmare a activării leucocitelor, sarcina lui negativă scade, ceea ce reduce forțele de repulsie reciprocă dintre acesta și endoteliul încărcat negativ;
Între leucocite și endoteliu se formează punți de calciu (Ca 2 + și alți ioni divalenți joacă un rol cheie în aderența leucocitelor);
În timpul activării în leucocite, sinteza granulelor specifice este îmbunătățită, unele componente ale cărora, cum ar fi lactoferina, sporesc proprietățile adezive ale celulelor;
Pe membrana leucocitară, expresia glicoproteinelor adezive din clasele Mac-1 și LAF-1 crește.
Contactul inițial al leucocitelor cu endoteliul este foarte fragil și, sub influența fluxului sanguin, se pot rostogoli pe suprafața peliculei de fibrină, totuși, contactul se stabilizează rapid, deoarece leucocitele secretă proteaze în zona de adeziune, expunând lectinei. secțiuni ale membranei endoteliocitelor și dându-le adezivitate crescută. Fibronectina secretată de fagocite este direct legată de aderența fagocitelor la endoteliu. Leucocitele care au luat poziția marginală eliberează pseudopodii, care pătrund în golurile interendoteliale și astfel „deversează” prin stratul endotelial (Fig. 10-14). Emigrarea este facilitată de o creștere a permeabilității vasculare și o creștere a fluxului de lichid din vas în țesut, ceea ce facilitează foarte mult trecerea peretelui vascular pentru leucocite.
Odată ajuns între stratul endotelial și membrana bazală, leucocitul secretă proteinaze lizozomale care îl dizolvă, precum și proteine cationice care modifică starea coloidală a membranei bazale (tranziție reversibilă de la gel la sol), ceea ce asigură o permeabilitate crescută a acestuia pentru leucocit. . Leucocitele imigrate sunt separate de suprafața exterioară a peretelui vascular și sunt direcționate prin mișcări amiboide către centrul focarului de inflamație (Fig. 10-15), care este determinat de gradientul de concentrație al substanțelor chemotactice din focar. Un anumit rol poate fi jucat de fenomenele electrocinetice datorită diferenței de potențial dintre un leucocit încărcat negativ și o sarcină pozitivă a unui țesut caracterizat prin H + - hiperionie.
Inițial, printre leucocitele exsudatului aflate în focarul inflamației acute predomină granulocitele, în principal neutrofile, iar apoi monocite/macrofage. Mai târziu, limfocitele se acumulează în focar.
Deoarece încetinirea fluxului sanguin în ramurile individuale ale microvasculaturii și poziționarea marginală a leucocitelor poate
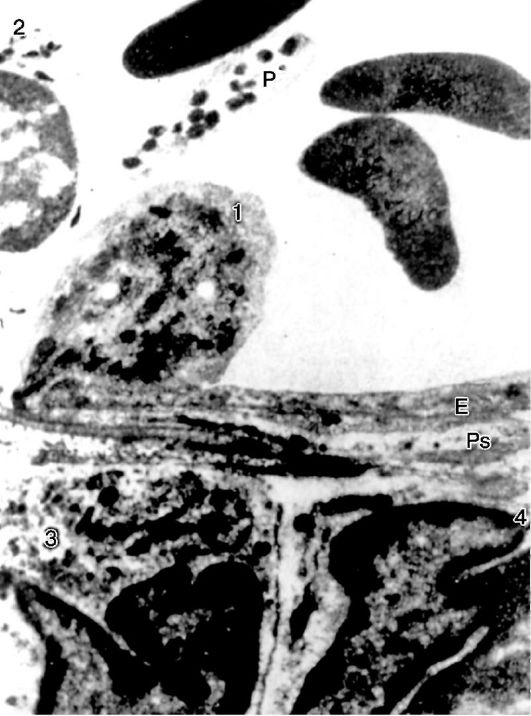 Orez. 10-14. Emigrarea neutrofilelor: 1 - neutrofile emigrătoare; E - celula endotelială; Ps - pseudopodi lungi, situati paralel cu endoteliul; 2 - neutrofile în lumenul vasului; 3, 4 - neutrofile emigrate; P - trombocite. x15 500 (după Marchesi)
Orez. 10-14. Emigrarea neutrofilelor: 1 - neutrofile emigrătoare; E - celula endotelială; Ps - pseudopodi lungi, situati paralel cu endoteliul; 2 - neutrofile în lumenul vasului; 3, 4 - neutrofile emigrate; P - trombocite. x15 500 (după Marchesi)
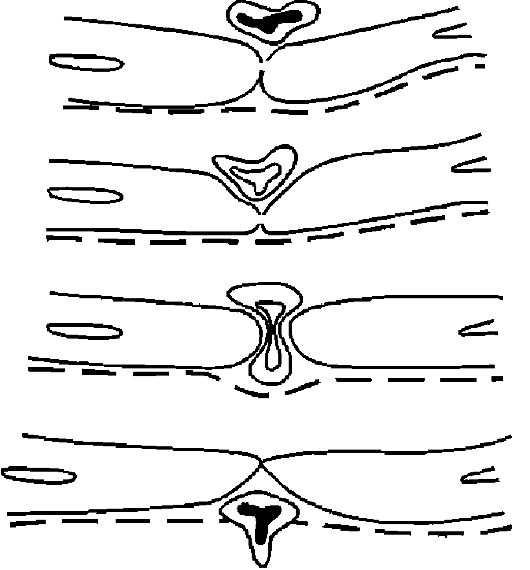 Orez. 10-15. Schema emigrării leucocitelor (după Marchesi)
Orez. 10-15. Schema emigrării leucocitelor (după Marchesi)
se dezvoltă foarte repede și durează 3-12 minute pentru ca un neutrofil în migrație să treacă prin endoteliu, apariția granulocitelor în focar poate fi observată deja în al 10-lea minut de la debutul inflamației. Rata de acumulare a neutrofilelor în focar este cea mai mare în primele 2 ore, scăzând treptat în următoarele. Numărul lor atinge maxim după 4-6 ore.În această perioadă, leucocitele focarului sunt reprezentate de neutrofile cu peste 90%. Granulocitele fagocită bacterii sau altele corpuri străineși particule de elemente celulare pe moarte, efectuând simultan furnizarea extracelulară de enzime, proteine cationice, metaboliți activi de oxigen. În același timp, are loc o distrugere masivă a neutrofilelor, ale căror rămășițe sunt un stimul important pentru extinderea infiltrației - atât neutrofile, cât și monocitare. În mod normal, majoritatea granulocitelor eliberate în țesut nu revin niciodată în fluxul sanguin.
Monocitele predomină de obicei în focarul inflamației acute după 16-24 de ore și ating un vârf, de regulă, în a treia zi. Totuși, migrarea monocitelor din sânge în țesut începe simultan cu migrarea neutrofilelor. Se presupune că, la început, rata de acumulare a monocitelor, care este mai mică decât cea a neutrofilelor, este asociată cu inhibarea chemotaxiei acestor celule sub influența deșeurilor neutrofilelor pentru un anumit timp, ceea ce este necesar. pentru exprimarea deplină a reacției neutrofile și prevenirea controlului monocitar al acesteia. În focarul inflamației, există o transformare treptată a monocitelor imigrate în macrofage și maturarea acestora din urmă, timp în care crește volumul citoplasmei și organelelor din acesta. În special, numărul de mitocondrii și lizozomi crește, ceea ce este esențial pentru performanța deplină de către macrofage a funcțiilor lor în focalizare. Activitatea pinocitozei crește, crește numărul de fagolizozomi din citoplasmă și crește numărul filopodiilor. Monocitele/macrofagele sunt, de asemenea, o sursă de mediatori inflamatori (enzime, metaboliți de oxigen, citokine), fagocită bacterii, dar au o importanță primordială în fagocitoza resturilor de celule moarte, în special neutrofile. Prin urmare, dependența acumulării de monocite de producția anterioară de neutrofile este de înțeles. Deci, la iepurii cu neutropenie, monocitele nu apar în focarul de inflamație în decurs de 16 ore, în timp ce în condiții naturale de inflamație sunt detectate deja după 4 ore și introducerea în focar.
inflamația neutrofilelor la animalele leucopenice restabilește acumularea obișnuită de celule mononucleare. Efectul chemotactic al lizatelor de neutrofile asupra monocitelor este cunoscut, în parte datorită proteinelor cationice din granulele lor lizozomale.
Pe de altă parte, acumularea de neutrofile depinde în mare măsură de monocite. Acest lucru este valabil mai ales pentru acea parte a infiltrației neutrofile care este asociată cu creșterea hematopoiezei, deoarece aceasta din urmă este inițiată de factori hematopoietici monocite-macrofagi, în special IL-1, diferite tipuri de așa-numiți factori de stimulare a coloniilor - substanțe ale unui natura proteică responsabilă de proliferare și diferențiere în măduvă osoasă celulele hematopoietice. În prezent, au fost izolate o serie de peptide chemotactice din monocite umane pentru neutrofile, care pot juca un rol în mecanismul de autoreglare a reacției leucocitare a focarului inflamator. Cu toate acestea, problema mecanismelor de schimbare a fazelor celulare în focarul inflamației, trecerea de la dezvoltarea unei reacții inflamatorii la rezolvarea acesteia este una dintre cele mai puțin studiate în problema inflamației.
Compoziția celulară a exsudatului depinde în mare măsură de natura și cursul procesului inflamator, care, la rândul lor, sunt determinate de agentul inflamator și de starea de reactivitate a organismului. Deci, exudatul este deosebit de bogat în neutrofile dacă inflamația este cauzată de microbi piogeni; în inflamația alergică, focarul conține multe eozinofile. Procesele inflamatorii cronice se caracterizează printr-un conținut scăzut de neutrofile, predominanța monocitelor și limfocitelor.
Leucocitele imigrante, împreună cu celulele proliferante de origine locală, formează un infiltrat inflamator. Totodată, exudatul cu celulele conținute în el impregnează țesutul, fiind distribuit între elementele zonei inflamatorii și făcându-l tensionat și dens. Infiltratul împreună cu exudatul provoacă umflături și este important în apariția durerii inflamatorii.
10.4.6. Procese de recuperareîn țesutul inflamat
sub proliferare inflamatorie(proliferate, din lat. prole- descendenți ferre- crea) înțelege înmulțirea celulelor locale
elemente exacte în focarul inflamației. Proliferarea se dezvoltă încă de la începutul inflamației odată cu fenomenele de alterare și exudare, dar devine predominantă într-o etapă ulterioară. perioada procesului, pe măsură ce fenomenele exudativ-infiltrative cedează. Inițial, este mai pronunțată la periferia focalizării. Cea mai importantă condiție pentru progresia proliferării este eficiența curățării focarului de inflamație de la microorganisme sau alți agenți nocivi, produse de alterare a țesuturilor, leucocite moarte (curățarea rănilor). Rolul principal în acest sens este atribuit macrofagelor - origine hematogenă (monocite) și tisulară (histocite).
curățarea rănilor apare în principal prin degradarea extracelulară a țesutului deteriorat și fagocitoză. Se efectuează sub influența reglatoare a citokinelor cu ajutorul enzimelor precum proteoglicanaza, colagenaza, gelatinaza. Activarea acestor enzime poate avea loc sub influența unui activator de plasminogen eliberat cu participarea citokinelor din celulele mezenchimale. Prostaglandinele, fiind eliberate împreună cu enzimele, pot, la rândul lor, induce proteinaze și contribuie la procesele de degradare.
Fagocitoză a fost descoperit și înțeles ca un element esențial al inflamației și al imunității naturale de către I.I. Mechnikov în 1882
I.I. a remarcat Mechnikov 4 faze ale fagocitozei:
1) faza de abordare: ieșirea leucocitelor din vas și apropierea de obiectul fagocitozei sub acțiunea hematractantelor;
2) faza de adeziune(a lua legatura);
3) faza de scufundare:învelirea și scufundarea obiectului în interiorul fagocitului; se formează o vacuolă specială unde se acumulează lizozomi;
4) faza de digestie, care poate avea ca rezultat 2 rezultate: a) eliberare dozată adecvată a enzimelor lizozomale, distrugând doar flogogenul (fagocitul în sine rămâne intact); b) eliberarea excesivă de enzime lizozomale, ceea ce duce la distrugerea obiectului fagocitozei și a fagocitului în sine.
Fagocitele, care interacționează cu bacteriile, sunt activate, membrana lor devine „lipicioasă”, deoarece numărul diferiților receptori de pe ea crește dramatic, la fel ca și mobilitatea „simțită” a citoplasmei acestor celule. În același timp, peroxizomii și granulele se acumulează în citoplasmă, umplute cu
nye proteaze puternice. Când o astfel de celulă întâlnește un microorganism, bacteria se „lipește” de suprafața fagocitei, se înfășoară în jurul pseudopodiilor sale și ajunge în interiorul celulei, unde este distrusă. Macrofagele încep să elibereze factorul de necroză tumorală (TNF), interferonul γ (IFN-γ) și IL-8 în mediu, care joacă un rol special în inflamație - provoacă apariția receptorilor în endoteliocite care reacţionează cu monocitele și neutrofilele cu un nivel ridicat. afinitate, astfel încât aceste celule se opresc în capilarele situate în zona de inflamație. IL-8 este cel mai eficient în crearea unui gradient pentru chemotaxia celulelor fagocitare. Fagocitele au receptori pentru IL-8, care „simt” diferența de concentrație a acesteia față de partea îndreptată spre sursa și din partea opusă și își direcționează mișcarea de-a lungul axei diferenței maxime. Astfel, celulele fagocitare se acumulează în focarul inflamației, absorb și distrug activ (intracelular) bacteriile și resturile celulare și secretă enzime care distrug substanța intercelulară a țesutului conjunctiv. Odată cu supurația, pielea care acoperă inflamația din jur (abcesul) devine mai subțire și se rupe: flogogenii, fragmentele de celule și fagocitele acumulate sunt ejectate din organism. Zona afectată a țesutului este restabilită treptat. Prin îndepărtarea resturilor de leucocite și a țesuturilor distruse, macrofagele elimină cea mai importantă sursă de stimulare chimiotactică proprie și suprimă dezvoltarea ulterioară a reacției leucocitelor locale. Pe măsură ce focarul inflamației este curățat, numărul de macrofage scade din cauza scăderii aportului lor din sânge. Din focalizare, ei sunt duși de fluxul limfatic în refacere către ganglionii limfatici regionali, unde mor. Limfocitele mor parțial, parțial se transformă în celule plasmatice care produc anticorpi și apoi sunt eliminate treptat.
Proliferarea se realizează în principal datorită elementelor mezenchimatoase ale stromei, precum și elementelor parenchimului organelor. Implica celule cambiale, adventice, endoteliale. Ca urmare a diferențierii celulelor stem ale țesutului conjunctiv - poliblaste - celule epitelioide, fibroblaste și fibrocite apar în centrul atenției. Principalele elemente celulare responsabile de procesele reparatorii în focarul inflamației sunt fibroblastele. Ei produc principala substanță intercelulară - glicozaminoglicanii și, de asemenea, sintetizează și secretă structuri fibroase - colagen,
elastina, reticulina. La rândul său, colagenul este componenta principală a țesutului cicatricial.
reglarea proliferării. Procesul de proliferare este sub control umoral complex. Crucial Aici avea din nou macrofage. Sunt sursa principală de factor de creștere a fibroblastelor, o proteină termolabilă care stimulează proliferarea fibroblastelor și sinteza colagenului. Macrofagele cresc, de asemenea, atracția fibroblastelor către locul inflamației, secretând IL-1 și fibronectină. Macrofagele stimulează proliferarea celulelor endoteliale și musculare netede ale peretelui vascular, membranei bazale și, astfel, formarea microvaselor. Inhibarea sau stimularea sistemului fagocite mononucleare respectiv slăbește sau intensifică dezvoltarea țesutului de granulație în focarul inflamației purulente.
La rândul lor, macrofagele mediază efectul reglator asupra fibroblastelor și proliferarea limfocitelor T. Acestea din urmă sunt activate de proteinazele formate în focarul inflamației ca urmare a defalcării țesuturilor. Proteinazele pot avea un efect direct atât asupra macrofagelor, cât și asupra fibroblastelor. Macrofagele și limfocitele pot elibera mono- și limfokine, care nu numai că stimulează, ci și inhibă fibroblastele, acționând ca adevărați regulatori ai funcțiilor lor.
Fibroblastele depind și de factorul de creștere a trombocitelor, care este o proteină termostabilă cu un conținut ridicat de cisteină și o greutate moleculară de 30.000 D. Alți factori de creștere pentru fibroblaste se numesc somatotropină, somatomedine, peptide asemănătoare insulinei, insulină, glucagon.
joacă un rol important în fenomenele proliferative. keylons- glicoproteine termolabile cu o greutate moleculară de 40.000 D, capabile să inhibe diviziunea celulară prin inactivarea enzimelor implicate în replicarea ADN-ului. Una dintre principalele surse de chaloni sunt neutrofilele segmentate. Pe măsură ce numărul de neutrofile scade în focarul inflamației, conținutul de chaloni scade, ceea ce duce la o accelerare a diviziunii celulare. Conform altor ipoteze, în timpul inflamației, neutrofilele segmentate practic nu produc chaylons și produc intens antikeylons(stimulatoare de diviziune); în consecință, diviziunea celulară este accelerată, proliferarea este îmbunătățită.
Alte celule și mediatori pot modula procesul reparator prin influențarea funcțiilor fibroblastelor, macrofagelor
gov și limfocite. Importanţă semnificativă în reglementarea fenomenelor reparatorii, conform D.N. Mayansky, au, de asemenea, relații reciproce în sistemul colagen-colagenază, interacțiuni stromal-parenchimatoase.
Proliferarea este înlocuită de regenerare. Acesta din urmă nu este inclus în complexul de fenomene inflamatorii propriu-zise, dar cu siguranță le urmează și este greu de separat de ele. Constă în proliferarea țesutului conjunctiv, neoplasm vase de sânge, într-o măsură mai mică - în reproducerea elementelor tisulare specifice. Cu leziuni minore ale țesuturilor, are loc o regenerare relativ completă a țesuturilor. Când se formează un defect, acesta este mai întâi umplut cu țesut de granulație - tânăr, bogat în vase de sânge, care este ulterior înlocuit cu țesut conjunctiv cu formarea unei cicatrici.
10.5. INFLAMAȚIE CRONICĂ
Sunt cazuri când, de la bun început, nu leucocitele polimorfonucleare se acumulează în infiltrate inflamatorii, ci monocite, limfocite și derivații acestora. Formarea unei astfel de acumulări de celule mononucleare, numită "granulom" este o condiție prealabilă pentru un curs lung de inflamație. inflamație cronică servește drept ilustrare a validității declarației lui I.I. Mechnikov: „Inflamația este o reacție de protecție în esența sa biologică, dar, din păcate, pentru organism nu ajunge întotdeauna la perfecțiune”.
Spre deosebire de inflamația acută începe inflamația cronică nu din tulburările de microcirculație și evenimentele descrise anterior în patul vascular, ci din acumularea unui număr critic iritat (activat) macrofage Intr-un loc.
Poate fi cauzată iritația persistentă a macrofagelor căi diferite.
O serie de microbi sunt absorbiți de macrofage, dar odată ajunși în fagozomi, ei nu mor și au posibilitatea de a persista și de a se înmulți în interiorul celulei pentru o lungă perioadă de timp (aceștia sunt agenții cauzatori ai tuberculozei, leprei, listeriozei, toxoplasmozei și multe altele). Macrofagele care conțin microbi devin active și încep să secrete mediatori inflamatori.
Macrofagele pot absorbi particule neinfecțioase pe care celula nu este capabilă să le descompună sau să le arunce în mediul înconjurător (complexe complexe de polizaharide - corragenan de alge marine, dextran, zimosan din drojdia de brutărie). După administrare intravenoasă la șoarecii cu granule de zimosan, ele sunt preluate de macrofagele rezidente (celule Kupffer) ale ficatului și macrofagele interstițiale ale plămânilor și le activează. După 2-3 zile, în jurul unor astfel de macrofage, ca în jurul epicentrelor, încep să se acumuleze monocitele care au intrat cu sânge și se formează ceea ce se numește în mod obișnuit granulom sau infiltrat mononuclear. Atragerea de noi monocite/macrofage către zona de localizare a macrofagelor activate este asociată cu substanțe care provoacă chemotaxia. Ele sunt secretate de macrofagele active în formă finită (LTC 4 , LTD 4 , PGE 2) sau sub formă de precursori: componentele complementului C2, C4, C5, C6, care sunt transformate în fracții C3, C5a, C567 cu activitate chemotactică ridicată. sub acţiunea proteazelor, secretate de aceleaşi macrofage.
Enzimele lizozomale secretate de macrofage, cum ar fi colagenaza, descompun colagenul. Produsele de degradare parțială a colagenului au o capacitate puternică de a atrage monocite proaspete la locul inflamației.
Macrofagele activate secretă bio-oxidanți care declanșează peroxidarea lipidelor în membranele altor celule din zona de infiltrare. Cu toate acestea, un simplu chemotaxine crescuteîntr-o anumită parte a țesutului nu ar însemna încă afluxul de noi celule efectoare a inflamației din sânge. Este necesar ca, împreună cu formarea unui gradient al acestor substanțe, creșterea permeabilității microvase, din care leucocitele mononucleare ar putea intra în zona de localizare a macrofagelor iritate. Macrofagele activate cresc permeabilitatea microvaselor, producând LTC4, LTD4, factor de agregare plachetar, O2*-, colagenază și activator de plasminogen, slăbind bariera de țesut conjunctiv capilar. Ele fie decomprimă membrana bazală capilară, fie contractă celulele endoteliale și expun fisurile interendoteliale, fie acționează în ambele moduri. Ca urmare, eliberarea leucocitelor din sânge și deplasarea lor în zonă este facilitată. concentrație mare chemotaxine, unde se atașează la alte celule din infiltrat. Monocitele, care au intrat în infiltrat, secretă
fibronectina. Datorită acestui fapt, ele sunt asociate ferm cu matricea țesutului conjunctiv, în primul rând cu fibrele de colagen. Ei par să „devină ancorați”. În literatura engleză, o astfel de imobilizare a celulelor a primit chiar numele "ancorare"(din engleza. ancoră- ancoră). Aceasta este foarte punct important, pentru că fagocitele „în mișcare” „nu au timp să rezolve problemele” care apar în fața lor în focarul inflamației.
Fagocitoza are loc cel mai eficient numai după ce monocitele sunt fixate și răspândite pe structurile țesutului conjunctiv. Astfel, macrofagele active nu numai că declanșează, ci și determină întregul proces de inflamație cronică. Cu toate acestea, în conditii reale macrofagele nu funcționează izolat, ci în combinație cu alte tipuri de celule care fac parte din infiltratul inflamator (granulomul) (Fig. 10-16, vezi insertul color).
cel mai bine studiat cooperarea funcțională între macrofageși limfocite:
1. În primul rând, aceste celule intră în interacțiune strânsă într-un răspuns imun specific care se dezvoltă în timpul inflamației infecțioase. Macrofagele înghit și distrug parțial antigenele microbiene din fagolizozomii lor. Într-o formă modificată, acești antigeni reapar pe membrana citoplasmatică a macrofagului, unde intră într-o relație complexă cu proteine specifice. Numai în această combinație, antigenul este recunoscut de limfocitele T. Această interacțiune a macrofagelor și a limfocitelor T în focarul inflamației cronice poate fi numită dependentă de antigen. Se manifestă cel mai vizibil în acele forme de inflamație cronică care apar în timpul infecției microbiene și care continuă cu fenomene de hipersensibilitate de tip întârziat (DTH).
2. Alături de aceasta, macrofagele sunt asociate cu limfocitele nu numai prin antigene, ci și prin secretele lor. Macrofagele secretă substanțe (de exemplu, IL-1) care sporesc creșterea limfocitelor și cresc activitatea acestora.
3. În același timp, limfocitele care proliferează activ secretă limfokine care activează macrofagele și își măresc brusc funcțiile efectoare în centrul inflamației cronice:
Factorul de inhibare a migrației macrofagelor crește adezivitatea membranelor macrofagelor și le permite să se fixeze ferm.
se agață de substrat. Același factor dezinhibează secreția de mediatori inflamatori de către macrofage;
Un factor care sporește agregarea macrofagelor, proliferarea lor, fuziunea macrofagelor între ele cu formarea de celule gigantice multinucleate, atât de caracteristice focarelor de inflamație cronică. În special, există în special multe astfel de celule în infiltratele tuberculoase din plămâni;
Modalități de declanșare și dezvoltare a inflamației acute și cronice fundamental diferite:
1. În inflamația acută, procesul începe „de la vase”, în timp ce în inflamația cronică - de pe teritoriul țesutului conjunctiv, unde sunt localizate macrofagele active.
2. Celula conducătoare a inflamației acute - efectorul - este un neutrofil, iar a inflamației cronice - un macrofag activ. Toate celelalte celule mezenchimale (catarg, limfocite, eozinofile) contribuie și ele la implementarea procesului prin modularea reactivității neutrofilelor și macrofagelor.
3. Inflamație acută se termină rapid, în câteva zile, dacă nu există complicații sub forma unei cavități purulente (abces).
4. Inflamația cronică nu se poate termina rapid din următoarele motive:
În primul rând, macrofagele în focarul inflamației au o lungă durată ciclu de viață, care se calculează în săptămâni, luni și chiar ani. Inițial, în stadiul de inițiere, monocite proaspete cu sânge, limfocite - cu sânge și limfa vin la granulom. Ele nu au încă o activitate microbicidă suficient de mare. Apoi granulomul se maturizează treptat, iar macrofagele diferențiate se acumulează în el, absorbind în mod activ microbii. În sfârșit, în stadiul final, într-un granulom vechi, numărul de celule activ fagocitare scade, dar procentul crește în raport cu
Inert în sensul fagocitozei celulelor epitelioide și gigant multinucleate; în al doilea rând, orice granulom nu este o formațiune „înghețată”. Este urmată în mod constant de un flux din ce în ce mai multe monocite cu sânge din măduva osoasă. Dacă există multe macrofage activate în granulom, influxul va depăși fluxul de celule din granulom. Faptul este că macrofagele iritate produc intens hematopoietine speciale. Ele stimulează formarea fagocitelor în măduva osoasă. Factorul de stimulare a coloniilor lui Metcalfe este unul dintre ele. Prin urmare, în timp ce macrofagele iritate „funcționează”, echilibrul va fi deplasat către afluxul de celule în infiltrat, iar resorbția acestuia este imposibilă. Dacă macrofagele eliberează o mulțime de bio-oxidanți în mediul lor, ele nu numai că pot igieniza focarul, ci și pot deteriora propriile celule ale corpului. Cu hiperproducție de H 2 O 2 și O 2 * - acești factori pot scăpa din fagozomi în citosolul macrofagului și pot duce la moartea acestuia. Pentru a preveni o astfel de situație, macrofagele au un sistem de neutralizare de urgență a biooxidanților în exces. Include enzime: catalaza, glutation peroxidaza si glutation reductaza. În special, sub acțiunea glutation reductazei, peroxidul de hidrogen este neutralizat în reacția 2 HH + H 2 O 2 - G-G + 2H 2 O, unde G este glutation. Enzima superoxid dismutaza neutralizează radicalul anion superoxid (O 2 *-) în reacția O 2 *- + O 2 *- + 2H + - H 2 O 2 + O 2. Atunci când sistemele de apărare antioxidante eșuează, inflamația persistă.
Inflamația cronică poate continua pe tot parcursul vieții. Periodic, se înrăutățește atunci când neutrofilele și macrofagele proaspete cu activitate proinflamatoare ridicată intră în centrul atenției. În centrul infiltrației mononucleare se află distrugerea țesutului conjunctiv. Ca răspuns la aceasta, are loc creșterea structurilor fibroase. În cele din urmă, scleroza se poate dezvolta cu oprirea parțială sau completă a funcțiilor specializate ale organului. Acest lucru este facilitat de acumularea în granulomul unei clase speciale de macrofage care secretă factori de stimulare a fibroblastelor. Medicii trebuie să facă față unei astfel de situații cu ciroza hepatică după hepatită virală, pneumonie cronică, glomerulonefrită cronică și alte boli inflamatorii cronice.
10.6. MANIFESTĂRI GENERALE ALE INFLAMAȚIEI
Manifestările generale ale inflamației se datorează influențelor din focalizarea procesului, în principal mediatori ai inflamației.
Febră este rezultatul acțiunii pirogenilor endogeni, în special IL-1, eliberați de leucocitele activate ale focarului de inflamație și a sângelui periferic, pe centrul termoreglării.
Metabolism accelerat este o consecință a secreției crescute de hormoni catabolici, în special sub influența monokinelor, și poate fi, de asemenea, secundar febrei. În același timp, în sânge se observă un conținut crescut de glucoză, globuline și azot rezidual.
Creșterea VSH reflectă predominanța absolută sau relativă a globulinelor asupra albuminei în plasmă, care apare din cauza producției crescute de „proteine de fază acută” de către hepatocite sub influența monokinelor sau unei pierderi avansate de albumină în timpul exudației. Predominanța proteinelor mari dispersate în plasmă reduce sarcina negativă a eritrocitelor și, în consecință, respingerea lor reciprocă. Aceasta crește aglutinarea eritrocitelor și, în consecință, sedimentarea acestora.
Modificări ale proprietăților imune organisme, manifestate, în special, prin rezistența crescută la expunerea repetată la un flogogen, în special unul infecțios, se datorează formării imunității celulare și umorale în timpul inflamației. În aceasta, celulele limfoide ale focarului de inflamație joacă un rol important, de exemplu, limfocitele B, care se transformă în celule plasmatice care produc anticorpi. Inflamația formează reactivitatea imunologică a organismului („imunitate prin boală”).
Reacții ale sistemului sanguin cu inflamație, acestea includ emigrarea leucocitelor către focar și o serie de modificări în țesutul hematopoietic și sângele periferic:
1) o scădere tranzitorie inițială a numărului de leucocite circulante în sânge (leucopenie tranzitorie), datorită marginalizării și emigrării acestora;
2) o scădere a numărului de granulocite și monocite mature și imature din măduva osoasă ca urmare a scurgerii crescute a acestora în sânge, care este asigurată de un reflex și, eventual, de accelerarea umorală a fluxului sanguin în măduva osoasă. Când numărul de leucocite din sânge care provine din măduva osoasă
depășește numărul celor care au emigrat în focarul inflamației, se dezvoltă leucocitoză;
3) restabilirea ulterioară a numărului de granulocite și monocite imature și mature din măduva osoasă, indicând activarea hematopoiezei;
4) o creștere (față de inițială) a numărului total de mielocariocite și celule ale liniilor hematopoietice individuale din măduva osoasă, ceea ce indică dezvoltarea hiperplaziei acesteia. Toate acestea asigură dezvoltarea și menținerea pe termen lung a infiltrației leucocitelor focarului de inflamație.
Activarea hematopoiezeiîn inflamație, se datorează producției crescute de substanțe hematopoietice de către leucocitele stimulate ale focarului de inflamație și sânge - factori de stimulare a coloniilor, interleukine etc., care sunt veriga inițială în mecanismul de auto-întreținere a infiltrației leucocitelor. focar de inflamație. În autoreglarea infiltrației, enzimele lizozomale, speciile reactive de oxigen și eicosanoizii sunt esențiale.
Inflamația acută se caracterizează prin leucocitoză neutrofilă. cu o deplasare la stânga (o creștere a numărului de neutrofile mai tinere, înjunghiate și tinere ca urmare a implicării rezervei de măduvă osoasă și a activării hematopoiezei), precum și a monocitozei, pentru inflamația cronică - leucocitoză monocitară și limfocitoză.
În apariția fenomenelor generale în inflamație sunt importante influențele umorale și reflexe din focalizare. Acest lucru este evidențiat, de exemplu, de o creștere a reflexului Goltz la o broască (scăderea ritmului cardiac cu atingeri ușoare pe abdomen) în timpul inflamației organelor abdominale.
10.7. ROLUL REACTIVITĂȚII ÎN INFLAMAȚIE
Apariția, dezvoltarea, evoluția și rezultatul inflamației depind de reactivitatea organismului, care, la rândul său, este determinată în primul rând de starea funcțională a sistemelor de reglare superioare - nervos, endocrin, imunitar.
Rolul sistemului nervos. Implicarea sistemului nervos în patogeneza inflamației a devenit evidentă datorită cercetărilor lui I.I. Mechnikov despre patologia comparativă a inflamației, care a arătat că, cu cât corpul este mai complex, cu atât este mai diferențiat nervos.
sistem, cu atât mai luminos și mai complet exprimat reacția inflamatorie. Ulterior, s-a stabilit rolul esențial al mecanismelor reflexe în declanșarea și dezvoltarea inflamației. Anestezia preliminară a țesutului la locul aplicării flogogenului întârzie și reduce răspunsul inflamator. Deteriorarea și întreruperea părții aferente a arcului reflex în timpul inflamației slăbesc dezvoltarea ulterioară a acestuia. După cum sa menționat, ischemia pe termen scurt și hiperemia arterială în focarul inflamației sunt de natură reflexă. Rolul reacțiilor reflexe este evidențiat și de datele din observațiile clinice conform cărora inflamația se poate dezvolta spontan în zonele simetrice ale corpului.
Importanța părților superioare ale sistemului nervos central este indicată de întârzierea dezvoltării și slăbirea inflamației pe fondul anesteziei sau în timpul hibernării. Există o posibilitate cunoscută de a reproduce inflamația și leucocitoza reflex condiționată la acțiunea doar a unui stimul condiționat (zgârierea sau încălzirea pielii abdomenului) după dezvoltarea unui reflex condiționat folosind flogogen (injecția intraperitoneală de stafilococi uciși) ca stimul necondiționat. .
Rolul părților subiacente ale sistemului nervos central este evidențiat de datele privind dezvoltarea proceselor inflamatorii extinse la nivelul pielii și mucoaselor în afectarea cronică a regiunii talamice. Se crede că acest lucru se datorează unei încălcări a trofismului nervos al țesuturilor și, astfel, unei scăderi a rezistenței acestora la agenții nocivi.
Sistemul nervos autonom are o influență semnificativă asupra dezvoltării inflamației. Pe urechea nesimpatică a iepurelui, inflamația decurge mai rapid, dar se termină și mai repede. Dimpotrivă, iritația nervilor simpatici inhibă dezvoltarea inflamației. Acetilcolina determină vasodilatație și favorizează dezvoltarea hiperemiei arteriale, sporește emigrația. Noradrenalina provoacă ischemie pe termen scurt, inhibă creșterea permeabilității vasculare și emigrarea. Deci parasimpaticul sistem nervos are efect proinflamator, iar simpatic - antiinflamator.
Rolul sistemului endocrin.În ceea ce privește inflamația, hormonii pot fi împărțiți în pro- și anti-inflamatorii. Primele includ somatotropină, mineralocorticoizi, hormoni tiroidieni, insulină, cei din urmă - corticotropină, glucocorticoizi, hormoni sexuali.
Rolul sistemului imunitar.Într-un organism imunizat, ca urmare a rezistenței crescute la un agent dăunător, inflamația se caracterizează printr-o intensitate redusă și se termină mai repede. Cu reactivitate imunologică redusă (deficiență imunologică - imunodeficiențe ereditare și dobândite), se observă o inflamație lentă, prelungită, adesea recurentă și repetată. Cu reactivitate imunologică crescută (alergie), inflamația decurge mai rapid, cu predominanța fenomenelor alterative, până la necroză.
Efectorii sistemului nervos, endocrin și imunitar - neurotransmițători, neuropeptide, hormoni și limfokine - au atât un efect direct de reglare asupra țesutului, vaselor de sânge și sângelui, hemo- și limfopoiezei, cât și mediați de alți mediatori inflamatori, a căror eliberare sunt modulează prin receptorii specifici ai membranelor celulare și modifică concentrațiile de nucleotide ciclice din celule.
În funcție de reactivitatea organismului, inflamația poate fi norrgică, hiperergică și hipergică.
Inflamație norrergică- de obicei curgătoare, inflamație într-un corp normal.
inflamație hiperergică- curgere rapidă, inflamație la un organism sensibilizat. Exemple clasice sunt fenomenul Arthus, reacția Pirquet etc. Se caracterizează prin predominanța fenomenelor de alterare.
hiperinflamație- Inflamatie usoara sau lenta. Primul se observă cu rezistență crescută la un stimul, de exemplu într-un organism imunizat, și se caracterizează prin intensitate redusă și finalizare mai rapidă. (hipergie pozitivă). Al doilea - cu o reactivitate generală și imunologică redusă (imunodeficiențe, foame, tumori, Diabet etc.) și se caracterizează prin dinamică slabă, curs prelungit, eliminarea întârziată a flogogenului și a țesutului deteriorat de acesta, rezoluția reacției (hipergie negativă).
Semnificația reactivității în patogeneza inflamației a făcut posibil să o considerăm ca reacție generală organism pentru daune locale.
10.8. TIPURI DE INFLAMAȚIE
După natura reacției țesutului vascular, se disting inflamația alterativă, exudativ-infiltrativă și proliferativă.
Tipul de inflamație depinde de reactivitatea organismului, de localizarea procesului, de tipul, puterea și durata acțiunii flogogenului.
Inflamație alterativă caracterizate printr-o severitate deosebită a fenomenelor de distrofie (până la necrobioză și necroză) și, astfel, predominarea lor asupra exudativ-infiltrative și proliferative. Cel mai adesea, inflamația alternativă se dezvoltă în organele și țesuturile parenchimatoase (miocard, ficat, rinichi, mușchi scheletici) în timpul infecțiilor și intoxicațiilor, de aceea este numită și parenchim. Cu modificări necrobiotice pronunțate, inflamația alterativă se numește necrotică, de exemplu, inflamație alergică imunocomplex (fenomenul Arthus experimental și reacții asemănătoare lui Arthus la om).
Inflamație exudativ-infiltrativă caracterizat printr-o predominanţă a tulburărilor circulatorii cu exsudaţie şi emigrare faţă de alterare şi proliferare. În funcție de natura exsudatului, acesta poate fi seros, fibrinos, purulent, putrefactiv, hemoragic și mixt.
10.9. CURS DE INFLAMAȚIE
Cursul inflamației este determinat de reactivitatea organismului, de tipul, puterea și durata acțiunii flogogenului. Există inflamații acute, subacute și cronice.
Inflamație acută caracterizat printr-o intensitate destul de pronunțată și o durată relativ scurtă
inflamație cronică caracterizat prin intensitate scăzută și durată lungă - de la câteva luni până la mulți ani și decenii. Prin natura reacției țesutului vascular, este cel mai adesea proliferativă. Rolul principal în patogeneza sa îl au monocite-macrofage și limfocite. Inflamația cronică poate fi primară și secundară (datorită trecerii inflamației acute la cronice). Dezvoltarea inflamației cronice primare este determinată în primul rând de proprietățile flogogenului (tuberculoză, sifilis etc.), inflamația cronică secundară este determinată de caracteristicile reactivității organismului.
inflamație subacută ocupa o pozitie intermediara. A lui durata clinică- Aproximativ 3-6 săptămâni.
Inflamația acută poate dobândi un curs prelungit, de ex. devin subacute sau cronice secundare. Poate un curs ondulat de inflamație cronică, când perioadele de subsidență ale procesului alternează cu exacerbări. Totodată, în perioada de exacerbare se intensifică şi devin predominante fenomenele exudative cu infiltrare de leucocite polimorfonucleare şi chiar alterative. În viitor, fenomenele proliferative ies din nou în prim-plan.
În general, nu există diferențe fundamentale în mecanismele generale ale inflamației acute și prelungite (inflamația este un proces tipic). Diferența constă în faptul că, în timpul unui proces prelungit, din cauza reactivității modificate a organismului, unitatea de deteriorare și protecție este încălcată, iar procesul inflamator capătă caracterul unuia negativ hipoergic, proliferativ.
10.10. REZULTATELE INFLAMĂRII
Rezultatul inflamației depinde de tipul și cursul acesteia, de localizare și prevalență. Următoarele rezultate ale inflamației sunt posibile:
1. Practic restaurarea completă a structurii și funcției(revenirea la normal - restitutio ad integrum). Se observă cu leziuni minore, când sunt restaurate elemente specifice de țesut.
2. Formarea cicatricilor(revenirea la normal cu recuperare incompletă). Se observă cu un defect semnificativ la locul inflamației și înlocuirea acestuia cu țesut conjunctiv. Cicatricea poate să nu afecteze funcțiile sau să ducă la disfuncții ca urmare a: a) deformării organului sau țesutului (de exemplu, modificări cicatriciale ale valvelor cardiace); b) deplasarea organelor (de exemplu, plămânii ca urmare a formării de aderențe în cavitatea toracică ca urmare a pleureziei).
3. Moartea organelorși întregul organism – cu inflamație necrotică.
4. Moartea unui organism cu o anumită localizare a inflamației - de exemplu, de la sufocare din cauza formării de filme de difterie pe membrana mucoasă a laringelui. Amenințătoare este localizarea inflamației în vital organe importante.
5. Dezvoltarea complicațiilor proces inflamator: a) fluxul de exudat în cavitatea corpului cu dezvoltarea, de exemplu, a peritonitei în procesele inflamatorii în organele abdominale; b) formarea puroiului cu dezvoltarea unui abces, flegmon, empiem, pielmie; c) scleroza sau ciroza organului ca urmare a proliferării difuze a țesutului conjunctiv în timpul inflamației proliferative.
6. Trecerea inflamației acute la cronice.
În rezultatul clinic al inflamației mare importanță are o boală de bază dacă apariția focarului (focurilor) de inflamație este asociată cu aceasta.
10.11. SEMNIFICAȚIA INFLAMAȚIEI PENTRU ORGANISM
În termeni biologici generali inflamația este important reacție de protecție și adaptare, format în procesul de evoluție ca o modalitate de a conserva întregul organism cu prețul deteriorării părții sale. Aceasta este o metodă de protecție de urgență a organismului, utilizată în cazul în care organismul nu a putut face față unui agent nociv prin eliminarea fiziologică a acestuia și a avut loc deteriorarea. Inflamația este un fel de barieră biologică și mecanică, cu ajutorul căreia se asigură localizarea și eliminarea flogogenului și (sau) țesutului lezat de acesta și refacerea acestuia sau compensarea defectului tisular. Proprietățile de barieră biologică sunt atinse
prin aderența, uciderea și liza bacteriilor, degradarea țesutului deteriorat. Funcția unei bariere mecanice se realizează din cauza pierderii fibrinei, coagulării limfei în focar, blocării vaselor de sânge și limfatice, reproducerii celulelor țesutului conjunctiv la granița țesutului deteriorat și normal (demarcație). Toate acestea împiedică absorbția și răspândirea microbilor, a toxinelor, a produselor metabolice afectate și a degradarii.
Focalizarea inflamatorie îndeplinește nu numai o barieră, ci și o funcție de drenaj: cu exudatul din sânge, produse ale metabolismului perturbat, toxinele ies în centrul atenției. După cum am menționat deja, inflamația afectează formarea imunității.
În același timp, oportunitatea inflamației ca reacție protectoare și adaptativă este necondiționată doar în sens evolutiv-biologic. Și ca proces local cu o anumită localizare și prevalență inflamația poate fi însoțită de manifestări patologice generale(intoxicație, modificări ale reactivității etc.) și chiar în cursul obișnuit să dăuneze organismului. În plus, în legătură cu reactivitatea alterată, în practică, sunt adesea întâlnite forme neobișnuite și complicații ale inflamației.
Conceptul de inflamație
Inflamația este o reacție complexă locală a organismului de natură protectoare și adaptativă la deteriorare, caracterizată prin fenomene strâns legate și simultan în curs de dezvoltare: alternanțe, tulburări de microcirculație (inclusiv exsudație și emigrare) și poliferare.
Această definiție prezintă componentele (componentele) procesului inflamator, primul dintre care este alternanța, adică. daune, inclusiv aspecte morfologice, biochimice și funcționale. Alternarea apare mai întâi sub influența așa-numiților factori flogogeni (etiologici) (alternanța primară) și în cursul dezvoltării inflamației este intensificată de deteriorarea suplimentară (alternanță secundară).
Modificările care apar în timpul alternanței țesuturilor formează factori care dezvăluie capacitatea de a asigura dezvoltarea altor componente ale inflamației, adesea chiar și cu un efect pe termen scurt. factor etiologic. Fenomenele de alternanță au fost mai întâi studiate în termeni morfologici și sistematizate de patologul german R. Vikhrov, iar biochimic de G. Schade.
Perturbarea circulației locale a sângelui (microcirculația) în țesuturi în cazul leziunii lor a fost dedicată lucrărilor lui Yu. Kongeym, care a descris cea mai caracteristică dinamică a tulburărilor, a stabilit rolul important al permeabilității vasculare crescute în patogeneza inflamației și a descris etapele emigrării (eliberarea leucocitelor) din pat vascularîn țesuturile deteriorate. Cu toate acestea, semnificația acestui din urmă factor a devenit clară numai după lucrările lui I. I. Mechnikov, care a descoperit fenomenul fagocitozei și a fundamentat semnificația acestuia în dinamica și esența biologică a inflamației ca reacție protectoare și adaptativă a corpului.
Astfel, o încălcare a microcirculației, pe fondul căreia există o creștere a permeabilității vasculare odată cu eliberarea părții din sânge care conține proteine (exudat) în țesuturi, precum și eliberarea de leucocite și mișcarea ulterioară a acestora către centrul de alternanță - aceasta este a doua componentă a inflamației. A treia componentă este poliferarea, adică procesul de reproducere celulară, care creează condiții pentru refacerea structurilor tisulare deteriorate anterior.
În funcție de proprietățile factorului patogen (natura, intensitatea și localizarea acțiunii) și de proprietățile organismului, reactivitatea acestuia și, mai ales, sistemele de reglare și starea mecanismelor de apărare imună, adaptabilitatea și adaptabilitatea determinată biologic și genetic. utilitatea inflamației la un individ poate varia într-o gamă largă - de la pozitivitate absolută la semnificație dublă și la un efect negativ care provoacă moartea organismului. În primul caz, corpul, cu ajutorul inflamației, este eliberat de un agent străin fără consecințe negative (golirea unui abces pe piele în mediu inconjurator). În cel de-al doilea caz, organismul, cu ajutorul inflamației, este, de asemenea, eliberat de agentul patogen, dar acest lucru are loc cu un defect greu de reparat al țesuturilor sau unui organ sau chiar pierderea unei părți a unui organ ( strictura esofagiană, boli de inimă, necroză tisulară în fenomenul Arthus-Saharov etc.). Și în al treilea caz, inflamația duce la moartea corpului (golire abces purulentîn ventriculii creierului, sepsis, DIC etc.). Valoarea negativă a inflamației poate fi asociată nu numai cu o încălcare a implementării programului specific de răspuns adaptiv, ci și cu o anomalie a programului în sine.
Cauzele și condițiile inflamației
Cauzele inflamației sunt bine cunoscute și pot fi împărțite în exogene și endogene. În practică, aceștia includ factori de natură fizică, chimică și biologică care pot provoca leziuni tisulare. Proprietățile flogogene sunt posedate de microorganisme (bacterii, viruși, ciuperci), organisme animale (protozoare, insecte), substanțe chimice(acizi, alcaline), mecanice (corpi străini, compresie, rupturi), efecte termice (frig, căldură), energia radiațiilor ( radiatii ionizante, Razele de soare).
De asemenea, se știe că stresul emoțional poate provoca boli ale pielii. Într-un experiment pe voluntari, posibilitatea de a dezvolta manifestări inflamatorii pe piele sub sugestie hipnotică.
La factori endogeni includ factori care apar în organismul însuși ca urmare a unei alte boli. De exemplu, inflamația poate apărea ca o reacție la formarea de calculi biliari și de litiază urinară; acumularea în țesuturi a produselor de metabolism afectat (artrita cu gută, alcaptonurie); formarea cheagurilor de sânge în vase, leziuni ischemice; proces tumoral. Cauza inflamației pot fi complexele imune (dacă au capacitatea de a fi fixate în vasele oricărui organ), precum și tulburările neurotrofice.
Se crede că inflamația este cel mai adesea asociată cu influența factorilor flogogeni exogeni. Mai mult, deoarece cea mai frecventă cauză a acestora sunt agenții infecțioși, din punct de vedere al etiologiei, inflamația este împărțită în infecțioase (bacteriene, septice) și neinfecțioase (aseptice).
De asemenea, trebuie remarcat faptul că nu este corect să se reducă etiologia inflamației doar la factorii flogogeni, deoarece apariția, evoluția și rezultatul acesteia depind de factori (condiționali) concomitenți, de caracteristicile funcționării. sisteme fiziologice(și în primul rând imun, endocrin, nervos), care este determinat de vârstă, sex, caracteristici constituționale care determină reactivitatea individuală a organismului.
Astfel, acest proces inflamator predominant local implică întregul organism și, în primul rând, sistemele sale precum nervos, endocrin și imunitar. De regulă, inflamația severă este însoțită de o creștere a temperaturii corpului, activarea are loc în organism. procese imunitare, activitatea multor organe și sisteme se modifică.
Cu toate acestea, în ciuda naturii generale a acestei reacții, focarul inflamației în sine se dezvoltă local într-un anumit organ și țesut. Mai mult, țesuturile au un anumit tip de celulă (histion sau element funcțional), pe teritoriul căreia se dezvoltă inflamația. Histia sau unitatea structurală funcțională a țesutului conține celule specifice și formațiuni fibroase ale țesutului conjunctiv, fibre nervoase și terminațiile acestora, vase de microcirculație. Toate aceste componente ale hisției de la bun început devin participanți la focarul inflamator.
Mecanisme de dezvoltare a inflamației
Alterare (lat.alteratio - schimbare, în terminologia medicală - deteriorare) - o încălcare a structurii și funcției celulelor, organelor și sistemelor, care duce la o tulburare a vieții. În inflamație, alterarea are loc sub influența acțiunii locale a unui factor patogen, dar în viitor se adaugă tulburări ulterioare în țesutul înconjurător și în organismul în ansamblu. diferite niveluri. În acest caz, trebuie avute în vedere două circumstanțe: în primul rând, în apariția și dezvoltarea alterării, atât agentul patogen, cât și/sau afectarea primară a țesuturilor sunt importante; al doilea - schimbările locale și generale reactive pot avea valoare atât pozitivă, adaptativă, cât și negativă, agravând daune. Destul de des în centrul inflamației alocă alterarea primară și secundară. Deși o astfel de diviziune este în mare măsură arbitrară, cu toate acestea este larg răspândită, deoarece ne permite să urmărim relațiile cauzale în dezvoltarea inflamației. Alterarea primară are loc sub influența factorului patogen în sine, este de obicei localizată în centrul focarului inflamației și se caracterizează prin încălcarea cea mai pronunțată a metabolismului, structurii și funcției celulelor. Alterarea secundară apare și sub influența factorului patogen însuși, dacă acesta continuă să acționeze și ca urmare a răspunsurilor țesutului din jur, precum și a organismului în ansamblu; este cel mai pronunțat de-a lungul periferiei focarului de inflamație și se caracterizează prin modificări deosebite în metabolismul, structura și funcția celulelor, inclusiv a vaselor de sânge. Alterarea se manifestă prin eliberarea de mediatori inflamatori, modificări ale metabolismului și anomalii fizico-chimice în țesut, care de obicei inițiază dezvoltarea ulterioară a procesului inflamator.
Leziunile tisulare primare sunt însoțite de moartea celulelor și eliberarea de enzime proteo-, glico-, lipolitice. Ele sunt capabile să distrugă membranele altor celule din zona afectată, precum și elementele țesutului conjunctiv (colagen, proteoglicani, glicozaminoglicani). Deteriorarea celulelor este însoțită de o încălcare a proceselor redox, astfel încât produsele acide se acumulează în zona de deteriorare. Lipoliza crescută duce la acumularea de acizi grași. Toate acestea determină dezvoltarea acidozei mai întâi compensate și apoi decompensate în țesuturile afectate. O creștere a defalcării structurilor proteinelor duce la o creștere a structurii moleculare, iar eliberarea electroliților din celulele moarte duce la o creștere a concentrației ionice a fluidului intercelular și, în consecință, la o creștere a presiunii osmotice (hiperosmie). în ea. Deoarece hidrofilicitatea coloizilor crește într-un mediu acid și se observă un randament crescut de proteine plasmatice, hiperonkia tisulară se dezvoltă simultan cu hiperosmia.
Se modifică și mulți alți parametri fiziologici, mulți dintre care acționează ca factori conducători (patogenetici) ai răspunsului inflamator, lucru observat de G. Schade, care la începutul secolului XX a studiat tiparele metabolismului în timpul inflamației. Atunci a apărut ideea inflamației ca un fel de foc de schimb, adică. un fenomen în care procesele catabolice sunt puternic îmbunătățite și există o acumulare de produse suboxidate.
G. Sade a numit acidoza principala forta motrice inflamație, deoarece ar putea sta la baza aproape tuturor componentelor acestui proces patologic tipic. S-a demonstrat că acidoza modifică tonusul vascular, crește permeabilitatea vasculară, ceea ce poate duce la tulburări circulatorii locale. Acumularea ionilor H+ și K+ pe fondul permeabilității crescute este legată de dezvoltarea exsudației și a edemului inflamator. Drenarea ionilor de hidrogen și potasiu încărcați pozitiv în secțiunile venoase ale microvasculaturii modifică sarcina (potențialul zeta) a trombocitelor și eritrocitelor, ceea ce corespunde agregării acestora cu dezvoltarea fenomenului de nămol și tromboză și hiperemie venoasă, care, cu progresie, se poate termina în stază.
Aceiași factori (acumularea de ioni H+ și K+ în țesuturi) pot asigura atracția electrocinetică a leucocitelor încărcate negativ, adică. stimulează emigrarea acestora în zona afectată. De asemenea, se știa că acidoza ușoară poate spori activitatea celulelor țesutului conjunctiv (fibroblaste) și astfel poate stimula procesul de proliferare. Acidoza severă are un efect bactericid asupra microorganismelor, furnizând reacții defensive cu inflamație bacteriană.
De idei moderne Cu toate acestea, acidoza, care joacă un rol semnificativ în dezvoltarea inflamației, încă nu poate fi considerată principalul (sau principalul) factor patogenetic al acesteia. S-a demonstrat că, chiar înainte de dezvoltarea acidozei în zona de alternanță, se găsesc substanțe care acționează ca mediatori, asigurând dezvoltarea unei reacții inflamatorii. Unele dintre ele sunt de origine celulară, altele se formează în timpul dezvoltării unei reacții inflamatorii din componentele plasmatice. După structura chimică, se disting trei grupuri de mediatori:
Amine biogene;
Natura proteinelor;
Altele, inclusiv prostaglandine.
Factorul inițial care le asigură aspectul este deteriorarea lizozomilor.
Semne de inflamație
Semne locale de inflamație
Principalele semne ale inflamației sunt cunoscute de mult timp. Chiar și omul de știință roman, enciclopedul A. Celsus, în tratatul său „Despre medicină”, a identificat următoarele principale simptome locale inflamații: roșeață (rubor), umflare (tumoare), căldură (culoare) și durere (dolor). Medicul și naturalistul roman C. Galen, pe lângă cele patru semne de inflamație identificate de A. Celsus, a adăugat al cincilea - disfuncție (functio laesa). Deși aceste simptome, caracteristice inflamației acute a tegumentului extern, sunt cunoscute de mai bine de 2000 de ani, ele nu și-au pierdut astăzi semnificația. De-a lungul timpului, doar explicația lor s-a schimbat. Aceste cinci semne au rezistat testului timpului și au primit caracteristici fiziopatologice și patomorfologice moderne.
Roșeața este un semn clinic clar de inflamație, asociat cu extinderea arteriolelor, dezvoltarea hiperemiei arteriale și „arterializarea” sânge venos la locul inflamației.
Umflarea în timpul inflamației se datorează creșterii alimentării cu sânge a țesutului, formării unui infiltrat, datorită dezvoltării exsudației și edemului, umflarii elementelor tisulare.
Căldura, o creștere a temperaturii zonei inflamate, se dezvoltă datorită unui aflux crescut de căldură sânge arterial, precum și ca urmare a activării metabolismului, a creșterii producției de căldură și a transferului de căldură în focarul inflamației.
Durerea - apare ca urmare a iritației terminațiilor nervilor senzoriali de către diferite substanțe biologic active (histamină, serotonină, bradikinină, unele prostaglandine etc.), modificarea pH-ului mediu internîn sens acid, comprimarea mecanică a receptorilor, fibrelor nervoase prin edem inflamator.
Încălcarea funcției pe baza inflamației are loc, de regulă, întotdeauna; uneori se poate limita la disfuncția țesutului afectat, dar mai des are de suferit întregul organism, mai ales când apare inflamația în organele vitale. Încălcarea funcției organului inflamat este asociată cu leziuni structurale, dezvoltarea durerii și o tulburare a reglării sale neuroendocrine.
Pentru inflamație cronică și inflamație organe interne Este posibil ca unele dintre aceste caracteristici să lipsească.
Semne comune de inflamație
Inflamația este un proces care se manifestă nu numai prin semne locale pronunțate, ci și prin modificări foarte caracteristice și adesea semnificative în întregul corp. Dintre factorii care determină relaţia dintre local şi modificari generaleîn inflamație, alături de autocoizii formați și care circulă în sânge (kinine, citokine, componente ale sistemului complement, prostaglandine, interferoni etc.), de mare importanță au așa-numiții reactanți de „fază acută”. Aceste substanțe nu sunt specifice pentru inflamație, ele apar după o varietate de leziuni tisulare, inclusiv după leziuni în timpul inflamației.
Următoarele modificări ale nivelului de inflamație pot indica dezvoltarea inflamației: întreg organismul, așa-numitele semne de natură generală:
Modificarea numărului de leucocite din sângele periferic. Marea majoritate a proceselor inflamatorii sunt însoțite de leucocitoză, mult mai rar, cu inflamație de origine virală - leucopenie. Prin natura sa, leucocitoza este, în principal, redistributivă, adică. datorită redistribuirii leucocitelor în organism, eliberarea lor în fluxul sanguin. O anumită contribuție la creșterea numărului de leucocite din sângele periferic se realizează și prin activarea leucopoiezei. Principalele motive pentru dezvoltarea leucocitozei includ stimularea sistemului simpatoadrenal, expunerea la anumite toxine bacteriene, produse de degradare a țesuturilor și o serie de mediatori inflamatori (interleukin-Iβ, factor de inducție a monocitopoiezei etc.).
Febra se dezvoltă sub influența factorilor pirogene proveniți din focarul inflamației: pirogeni primari de origine exogenă și endogenă (endotoxine - elemente structurale de natură lipopolizaharidă ale membranelor celulare ale diferitelor bacterii, antigeni diferiți de origine microbiană și nemicrobiană, aloantigeni, exotoxine diverse, etc.) și pirogenii secundari (interleukina -Ib, interleukina-6, factorul de necroză tumorală).
Modificări în cantitatea și compoziția calitativă a proteinelor plasmatice ale sângelui
Într-un proces inflamator acut, așa-numitele „proteine de fază acută” sintetizate de hepatocite, macrofage și alte celule se acumulează în sânge. Pentru curs cronic inflamația se caracterizează printr-o creștere a conținutului de a- și mai ales g-globuline din sânge, un dezechilibru al albuminelor și globulinelor.
O creștere a vitezei de sedimentare a eritrocitelor (VSH), care apare în special în procesele inflamatorii cronice, se datorează creșterii vâscozității sângelui, scăderii sarcinii negative și aglomerării eritrocitelor, modificărilor constantelor fizico-chimice, compoziției proteinelor (disproteinemie). ) a sângelui și o creștere a temperaturii.
Tipuri de inflamație
Clasificarea inflamației și alocarea diferitelor sale forme, pe baza experiență clinică, ia în considerare contribuția la dezvoltarea inflamației proprietăților și factorilor patogeni, precum și organismul însuși. Alocați inflamații infecțioase și neinfecțioase (aseptice); inflamația infecțioasă, la rândul său, este împărțită în banală și specifică. În funcție de severitatea componentelor principale, inflamația se împarte în alterativă, exsudativă și proliferativă (productivă).În funcție de tipul de exudat, inflamația exsudativă poate fi seroasă, fibrinoasă (croupoasă și difterică), purulentă, hemoragică și putrefactivă și productivă. inflamație - interstițială, granulomatoasă și polipoasă. În funcție de severitatea manifestărilor locale și generale, se pot distinge hiperergice, hipergice și norrergice, iar în funcție de rata de dezvoltare și durată - inflamație acută și cronică.
Trecerea inflamației acute la inflamația cronică este asociată cu incompletitudinea inflamației, atunci când scopul final al inflamației, care este distrugerea agentului patogen și îndepărtarea acestuia din organism, nu este atins. Natura procesului de inflamație cronică depinde și de proprietățile și tipul agentului patogen (leishmania, plasmodul malaric, echinococul, invazia amibiană etc.) și de proprietățile macroorganismului, de adaptarea reciprocă a micro- și macroorganismului cu stabilirea unui echilibru instabil. Acest echilibru poate fi perturbat, iar perioadele de exacerbare apar în cazul slăbirii protecției antiinfecțioase și activării infecției. Mecanismele specifice ale inflamației cronice în toate variantele sale nu au fost pe deplin studiate; alocă factori locali, regionali și generali care împiedică realizarea scopului final al inflamației. Potrivit lui I. V. Davydovsky (1964), cauzele locale ale inflamației cronice ar trebui să includă formațiuni care rănesc constant țesuturile (de exemplu, fragmente osoase într-o rană, sechestrați, corpuri străine, creșterea depunerilor de sare etc.). Dintre factorii regionali care susțin inflamația trebuie menționate tulburările de circulație sanguină și limfatică, inclusiv tulburările cauzate de ateroscleroză, arterită, varice vene, elefantiaza, tulburări de inervație de diverse origini. Acești factori de inflamație contribuie adesea la apariția unui proces ulcerativ și la nevindecarea prelungită a ulcerelor. Importanţăîn cronicitatea inflamației, au tulburări comune cauzate de perturbarea activității mecanismelor nespecifice și specifice ale imunității, de exemplu, insuficiența fagocitozei și unele așa-numitele forme selective de stări de imunodeficiență. Mai des, stările de imunodeficiență conduc la o încălcare a mecanismelor de izolare a focarului inflamator și la dezvoltarea sepsisului. Cu toate acestea, inflamația cronică este de obicei asociată cu două fenomene care interacționează - persistența factorului cauzal și dezvoltarea proceselor imunopatologice. Apariția proceselor imunopatologice și a inflamației cronice poate fi rezultatul apariției autoalergenilor în focarul inflamației și/sau al transformării proprietăților sistemului imunitar. Prelungirea inflamației este facilitată și de epuizarea generală a organismului, beriberi, anemie, insuficiență circulatorie, înfometare de proteine, diabet zaharat și multe alte fenomene. În aceste condiții, există adesea o lipsă a mecanismelor de imunitate, ceea ce contribuie la trecerea inflamației acute la cronice.
Rezultatul inflamației
Rezultatele inflamației pot fi foarte diferite.
Recuperarea (revenirea la normal) cu restaurarea completă sau incompletă a structurilor, metabolismului și funcțiilor deteriorate (de exemplu, formarea unei cicatrici de țesut conjunctiv în locul unui epiteliu deteriorat).
Trecerea inflamației acute la cronice.
Trecerea de la o boală inflamatorie la alta.
Moartea celulară reversibilă (unele tipuri de carbohidrați, grăsimi, distrofie proteică, paranecroză).
Moartea celulară ireversibilă (distrofie hidropică, necrobioză, necroză).
Moartea întregului organism.
Rezultatul inflamației depinde de tipul, puterea și durata acțiunii flogogenului, reactivitatea organismului, cursul, localizarea și prevalența acestuia. Cu afectare minoră a țesuturilor, cu vindecare a rănilor prin tensiune primară, procesul inflamator se încheie cu refacerea morților și refacerea elementelor deteriorate reversibil, adică. recuperare aproape completă. În cazul morții unor rețele mari de celule, defectul este înlocuit cu țesut conjunctiv, urmat de formarea unei cicatrici, adică. există o regenerare incompletă. Această inflamație se termină de obicei. Cu toate acestea, în unele cazuri, există o formare excesivă de țesut cicatricial, care poate deforma organul și poate afecta funcția acestuia. Un posibil rezultat al inflamației poate fi dezvoltarea complicațiilor procesului inflamator (formarea unui abces, flegmon, empiem, dezvoltarea peritonitei) și chiar moartea unui organ și, eventual, a întregului organism (cu inflamație necrotică a organelor vitale). ).
Importanța inflamației pentru organism
Inflamația ca proces complex dezvoltat în evoluție are o valoare adaptativă. Setul de reacții înrudite și în schimbare dinamică care alcătuiesc inflamația are ca scop în cele din urmă fixarea pe loc și distrugerea factorului patogen, izolarea locului de leziune de țesutul înconjurător și restaurarea țesutului. Aceasta este chiar servită de alterare, ischemie inițială și stază, care asigură legarea factorului patogen și prevenirea răspândirii acestuia împreună cu distrugerea enzimelor și a radicalilor de oxigen eliberați în timpul leziunii celulare. Factorul patogen poate fi eliminat deja în această etapă, iar „scopul” inflamației va fi curățarea focarului inflamator de țesutul deteriorat și regenerarea acestuia.
O regularitate importantă a inflamației este aceea că fiecare eveniment anterior asigură unul ulterior, care începe să se dezvolte nu după finalizarea primului, ci mult mai devreme, în urma căruia eficiența atingerii „obiectivului” inflamației poate crește și durata cursului său poate fi redusă semnificativ.
În același timp, atât inflamația în sine, cât și orice reacție care o alcătuiește la un individ, din cauza unei încălcări a programului genetic (forme ereditare de patologie) sau a implementării acestuia (forme dobândite de patologie), își pot pierde rolul adaptativ sau dobândi un sens dual – atât pozitiv cât și negativ – pentru organism. În acest caz, „obiectivul” biologic al inflamației este atins doar parțial cu consecințe adverse pentru organism sau nu este atins deloc, iar organismul moare. Acest lucru depinde în cele din urmă de proprietățile factorului patogen și de starea reactivității individuale a organismului.
Abaterile de reactivitate sub formă de hipergie, hiperergie sau disergie determină în mare măsură cursul inflamației și rezultatul acesteia.
Bibliografie
1. Sarkisov D.S., Paltsev M.A., Khitrov N.Kh. " Patologia generală persoană.
2. Patologie, ed. V.T. Dolgikh și V.V. Rusakov.
3. Chesnokova N.P., Morrison V.V. „Patologia generală”.
4. Vismont F.I. „Inflamație” (Aspecte fiziopatologice).
Fagocitoză.
Fagocitoza – constă în absorbția și digestia bacteriilor, produse ale deteriorării și degradarii celulare. Activitatea fagocitară este prezentată în primul rând de leucocitele neutrofile și macrofage. Există 4 etape de fagocitoză: prima etapă este apropierea fagocitei de un obiect străin, a doua etapă este aderența fagocitei la obiect. Este precedat de acoperirea fagocitei cu imunoglobuline M și J și fragmente de complement (opsonizare). Etapa a 3-a - absorbția obiectului prin invaginarea fagocitei și formarea unei vacuole - fagozom. Înainte de formarea unui fagozom, oxidaza este activată în fagocit, ceea ce asigură sinteza peroxidului de hidrogen. Peroxidul de hidrogen sub influența peroxidazelor formează molecule active de oxigen, care distrug membranele celulare prin peroxidare. Distrugerea membranelor este facilitată și de enzimele lizozomale și proteinele bactericide eliberate în timpul degranulării leucocitelor. Acest lucru se întâmplă în a 4-a etapă - clivaj intracelular și digestia microbilor fagocitați și a resturilor de celule deteriorate. În acest caz, fagocitele înseși mor. Produsele distrugerii lor stimulează procesele de proliferare.
Proliferare.
Elementele de proliferare au loc încă de la începutul inflamației, dar aceasta devine predominantă pe măsură ce exsudația scade. În stadiul de proliferare, procesele distructive se opresc treptat și sunt înlocuite cu altele creative. Există o rambursare activă a procesului inflamator. În acest sens, proteina α 2 -macroglobulina joacă un rol activ. Are un spectru larg de acțiune, în special, inhibă kininele. În inactivarea celulelor inflamatorii, pe lângă factorii locali, factorii generali, precum cei endocrini, sunt de mare importanță. Cortizolul inhibă sinteza substanțelor vasoactive, provoacă eozinofilopenie, limfopenie și bazofilopenie. Apoi defectul este înlocuit cu țesut sănătos. Acest lucru se realizează prin înmulțirea celulelor vii rămase (celule rezidente), precum și a celulelor noi din zonele învecinate (celule emigrante). Celulele stem ale țesutului vascular - se înmulțesc poliblastele și celulele limfoide, apar capilare noi. Se formează țesut de granulație. Stimulantii de crestere sunt: factorul de crestere a fibroblastelor trombocitare (trombocite); factori similari se formează în limfocite și monocite. În unele organe se formează substanțe care stimulează proliferarea. De exemplu, în glanda pituitară, factorul de creștere a fibroblastelor, în ficat, somatomedina, care stimulează și proliferarea. Există și inhibitori de proliferare - kalonii, hormonul cortizon.
La sfârșitul inflamației, când aceasta este finalizată, două celule, fibroblast și endoteliocitul, joacă un rol decisiv. Există o așezare a zonei de inflamație cu fibroblaste și neoangiogeneză. Fibroblastele sintetizează colagenul. Endoteliocitele contribuie la formarea vaselor de sânge.
Cu o ușoară afectare tisulară, cu răni care se vindecă prin intenție primară, procesul inflamator se încheie cu o recuperare completă. Când un număr mare de celule mor, defectul este înlocuit cu țesut conjunctiv cu formarea unei cicatrici. Poate exista formare în exces de țesut cicatricial.
Patogeneza semne clinice inflamaţie.
Roșeața se datorează dezvoltării hiperemiei arteriale, o creștere a fluxului sanguin cu continut ridicat oxigen, o creștere a numărului de capilare funcționale.
„Umflarea” se explică prin hiperemie arterială și venoasă, exudație și migrarea leucocitelor.
Căldura se datorează metabolismului crescut în stadiile incipiente ale inflamației, fluxului sanguin cu mai mult temperatura ridicata, disocierea proceselor de oxidare biologică și fosforilare.
Febra se dezvoltă sub influența factorilor pirogeni care provin din focarul inflamației, precum lipopolizaharidele, proteinele cationice, interleukina-1 etc.
Durerea este cauzată de iritarea receptorilor în focarul inflamației de către mediatori, în special serotonina, kininele, prostaglandinele, o schimbare a reacției mediului față de partea acidă, apariția disioniei, creșterea presiunii osmotice și întinderea mecanică sau compresia tesuturilor.
Încălcarea funcției organului inflamat este asociată cu o tulburare a reglării sale neuroendocrine, dezvoltarea durerii și tulburări structurale.
Leucocitoza se datorează activării leucopoiezei și redistribuirii leucocitelor în fluxul sanguin. Printre principalele motive ale dezvoltării sale se numără: stimularea sistemului simpatico-suprarenal, expunerea la anumite toxine bacteriene, produse de degradare a țesuturilor, precum și o serie de mediatori inflamatori (interleukina-1).
Modificarea „profilului” proteic al sângelui se exprimă în faptul că atunci când proces acut așa-numitele „proteine de fază acută” ale inflamației - proteina C-reactivă etc. se acumulează în sânge. Pentru cursul cronic al inflamației este caracteristică o creștere a conținutului de globuline alfa și în special gama în sânge.
O creștere a VSH apare din cauza scăderii sarcinii negative a eritrocitelor, a aglomerării eritrocitelor, modificărilor spectrului proteic al sângelui, în special, creșterii conținutului de fibrinogen și creșterii temperaturii.
Imunitatea și inflamația.
Schimbari in sistem imunitarîn inflamație, ele se exprimă printr-o creștere a titrului de anticorpi, apariția limfocitelor sensibilizate în sânge. În dezvoltarea imunității în timpul inflamației, trebuie remarcați factori nespecifici precum fagocitoza și complementul. Locul fagocitozei efectuate de PNL și fagocitul monocitar (macrofag) în sistemul imunitar este determinat de faptul că, în ciuda nespecificității actului de fagocitoză în sine, macrofagele participă la procesarea lor într-o formă imunogenă. Sistemul complement este implicat în reacții specifice, atașându-și componentele de moleculele de anticorpi, ceea ce asigură liza substanțelor antigenice împotriva cărora s-au dezvoltat anticorpi, activează complexele imune. Astfel, activarea răspunsului imun în timpul inflamației este asigurată de două sisteme celulare de apărare nespecifică - sistemul PMN și macrofage, precum și plasme. sistem - sistemul de complement.
Relația dintre modificările locale și generale ale inflamației.
În focarul inflamației, apar procese complexe care nu pot decurge autonom. Sunt un semnal care trebuie inclus în răspunsul inflamator. diverse sisteme organism. Substratul material al acestor semnale este acumularea și circulația în sânge a substanțelor biologic active, componentelor complementului, interferonului etc.. Dintre factorii care determină relația dintre modificările locale și cele generale în timpul inflamației, așa-numiții reactanți de fază acută sunt de mare importanta. Aceste substanțe nu sunt specifice pentru inflamație. Ele apar la 4-6 ore după diferite leziuni, inclusiv după leziuni în timpul inflamației. Cele mai importante dintre ele sunt: proteina C-reactivă, interleukina-1, T-kininogenul, transferrina, apoferitina etc. Majoritatea reactanților de fază acută sunt sintetizați de macrofage, hepatocite. Interleukina-1 afectează funcția celulelor focarului inflamator, inclusiv limfocitelor, activează PNL, stimulează sinteza de prostaglandine și prostacicline în endoteliocite și promovează o reacție hemostatică în leziune. Concentrația de proteină C reactivă crește în timpul inflamației de 100-1000 de ori. Această proteină activează activitatea citolitică a limfocitelor T ucigașe și inhibă agregarea trombocitelor.
T-kininogenul este un precursor al kininelor și un inhibitor al proteinazei. Inflamația induce sinteza apoferitinei în ficat, care stimulează producerea de PNL. Reactanții de fază acută determină răspunsul nespecific al organismului, creând condiții pentru dezvoltarea unei reacții inflamatorii locale. În același timp, ele stimulează includerea altor sisteme ale corpului în proces, contribuind la interacțiunea locală și generală în timpul inflamației.
Dimensiunea, prevalența focarului inflamației, precum și caracteristicile agentului dăunător au un efect pronunțat asupra relației dintre modificările locale și generale ale inflamației. Pornind de la o anumită dimensiune critică a acestui focus, dezvoltarea inflamației este combinată cu o serie de tulburări de homeostazie cauzate atât de produse ale leziunilor tisulare și de mediatori, cât și de stres (durere, emoțional).
Inflamația și reactivitatea organismului.
Apariția, dezvoltarea, evoluția și rezultatul inflamației depind de reactivitatea organismului. Reactivitatea depinde în primul rând de starea sistemelor de reglare superioare: nervos, endocrin, imunitar.
Utilizarea substanțelor anestezice care pot opri formațiunile receptorilor slăbește semnificativ cursul procesului inflamator. Crearea unui focus stabil de excitare în sistemul nervos central slăbește brusc cursul și intensitatea inflamației. Anestezia profundă slăbește semnificativ formarea de infiltrate. Efect semnificativ asupra dezvoltării inflamației are Sistemul endocrin. În ceea ce privește inflamația, hormonii pot fi împărțiți în pro- și anti-inflamatorii. Primele includ somatotropina, mineralocorticoizii, hormonii tiroidieni, insulina, cei din urmă - corticotropina, glucocorticoizii. Hormoni antiinflamatori: 1. Reduce permeabilitatea vasculară. 2. Stabilizați membranele lizozomale. 3. Potrivirea actiunii catecolaminelor. 4. Slăbiți sinteza și
acțiunea substanțelor biologic active (histamină, serotonina). 5. Reduceți emigrația
leucocite, slăbesc fagocitoza.
Dezvoltarea inflamației depinde în mod semnificativ de vârstă. La copiii nou-născuți, componenta exudativă a inflamației nu este aproape exprimată, deoarece reacțiile vasculare sunt imperfecte. Sunt imperfecte deoarece atât terminațiile nervoase periferice ale nervilor simpatic și vag, cât și centrii lor nu sunt suficient formate. Sistemul nervos simpatic își păstrează influența dominantă asupra tonusului vascular după naștere, ducând la vasospasm. Inflamația în perioada neonatală capătă un caracter alternativ. Componenta proliferativă a inflamației este întârziată. Cel mai adesea, la această vârstă, apare inflamația pielii, deoarece stratul epidermic este foarte slab dezvoltat.
Pielea și mucoasele copiilor pruncie nu poate oferi protecție antimicrobiană. Activitatea fagocitară a leucocitelor este foarte scăzută. Mai mult decât atât, fagocitele sunt capabile să absoarbă microbii, dar nu îi pot lize, deoarece. activitatea enzimelor hidrolitice este scăzută (fagocitoză nefinalizată). Fagozomii unor astfel de leucocite se transformă în „depozite” de microbi viabile, determinând generalizarea infecției.
La copii, începând de la vârsta de 5 luni, apare adesea inflamația intestinului subțire și gros (enterite, colită).
La bătrânețe, procesele inflamatorii ale tractului gastrointestinal apar mai des, deoarece. aciditatea scade suc gastric, care este un factor de protecție atunci când bacteriile intră în stomac. Ca urmare a inhibării activității cililor epiteliului tractului respirator, apare adesea pneumonia.
Tipuri de inflamație.
În funcție de natura procesului local dominant (alterare, exudare, proliferare), se disting 3 tipuri de inflamații. În alternativă, predomină inflamația, afectarea, distrofia și necroza. Se observă cel mai adesea în organele parenchimatoase în bolile infecțioase care apar cu intoxicație severă (degradare brânză a plămânilor în tuberculoză).
Inflamația exudativă se caracterizează prin tulburări circulatorii severe cu simptome de exudare și emigrare a leucocitelor.
camarad După natura exudatului, se disting inflamația seroasă, purulentă, hemoragică, fibrinoasă, putrefactivă, mixtă.
Inflamația proliferativă sau productivă se caracterizează prin faptul că este dominată de reproducerea celulelor de origine hematogenă și histiogenă. În zona inflamată apar infiltrate celulare. În timpul inflamației, celulele suferă transformare și diferențiere, ducând la formarea de țesut conjunctiv tânăr. Trece prin toate stadiile de maturare, în urma cărora organul sau o parte a acestuia este pătrunsă de fire de țesut conjunctiv.
În funcție de natura cursului, inflamația poate fi acută, subacută și cronică. Inflamația acută durează de la câteva zile la câteva săptămâni. Se caracterizează prin: o intensitate pronunțată a reacției inflamatorii și predominanța fenomenelor fie alternative, fie vascular-exudative. Rolul principalilor efectori în patogeneza sa este jucat de PNL. Inflamația cronică este un proces lent, pe termen lung. Este dominată de fenomene distrofice și proliferative. Rolul principal în inflamația cronică revine macrofagelor și limfocitelor. Inflamația subacută ocupă o poziție intermediară.
rezultate ale inflamației.
1. Restaurarea completă a organului deteriorat. Aceasta are loc dacă nici acțiunea factorului flogogen și nici dezvoltarea procesului inflamator nu duc la moartea unei cantități semnificative de țesut. 2. Dacă, ca urmare a acțiunii unui factor flogogen sau ca urmare a alterării secundare, se pierde o cantitate semnificativă de țesut, atunci defectul de țesut este eliminat prin formarea unei cicatrici sau germinarea difuză a țesutului conjunctiv. Prezența unei cicatrici uneori nu provoacă o încălcare semnificativă a funcției organului, dar în unele cazuri poate duce la consecințe grave. De exemplu, cicatricile în peretele esofagului (după arderea acestuia) pot provoca îngustarea esofagului, ceea ce va face dificilă hrănirea corpului. 3. Inflamația poate fi dăunătoare organismului. Acest lucru se datorează faptului că, în cazul unei modificări extinse, țesutul unui organ vital poate muri sau, ca urmare a exsudației, organe precum
creierul, inima, plămânii, care le pot perturba atât de mult funcția,
că va deveni incompatibil cu viața.
Inflamație cronică (Ado 1994, pp. 171-173).
Inflamația cronică începe cu acumularea unui număr mare de
la macrofage iritate (activate) într-un singur loc. Iritația persistentă a macrofagelor este cauzată în diferite moduri: 1. Defectul macrofagelor. În acest caz, macrofagele absorb factorul străin, dar nu îl pot distruge. Există o fagocitoză incompletă. Prin urmare, macrofagele sunt în mod constant într-o stare activă. 2. O serie de microorganisme sunt absorbite de macrofage, dar datorită caracteristicilor lor, ele nu mor în fagozomi și au posibilitatea de a trăi și de a se înmulți o perioadă lungă de timp. Aceste forme includ agenți patogeni de tuberculoză, lepră, toxoplasmoză și multe altele. boli infecțioase. 3. Macrofagele nu pot absorbi un agent străin. Îl înconjoară, devin emoționați și încep să atragă noi macrofage, formând țesut de granulație.
Atragerea noilor macrofage, monocite, limfocite către zona de localizare a macrofagelor activate este asociată cu substanțe care provoacă chemotaxie pozitivă. Aceste substanțe sunt secretate chiar de macrofagele iritate. Acestea includ leucotrienele C și D, prostaglandinele grupului E2. Afluxul de macrofage în focarul inflamației este facilitat de o creștere a permeabilității vasculare. Leucotrienele, FAT, colagenaza cresc permeabilitatea microvaselor. Aceste substanțe fie slăbesc membrana bazală a capilarelor, fie contractă celulele endoteliale și măresc golurile interendoteliale. Astfel, în focarul de inflamație cronică se acumulează celule mononucleare- monocite, macrofage, limfocite. Acumularea unor astfel de celule se numește „granulom”.
Macrofagele activate secretă biooxidanți care declanșează peroxidarea lipidelor în membranele celulare din zona de infiltrare. Macrofagele secretă, de asemenea, enzime lizozomale. Monocitele își secretă substanțele biologic active, în special fibronectina. Datorită fibronectinei, monocitele sunt ferm legate de granulom și imobilizate.
Limfocitele secretă diverse limfokine, inclusiv cele care activează macrofagele și le măresc puternic efectorul
funcţionează în centrul inflamaţiei cronice. Macrofagele, la rândul lor, secretă interleukina-1, care mărește creșterea limfocitelor și crește activitatea acestora.
Astfel, inflamația cronică diferă semnificativ de inflamația acută. Inflamația acută începe cu alterarea și microcirculația afectată, cronică cu activarea macrofagelor. Celula principală a inflamației acute este neutrofilul, cronic - un macrofag activ. Inflamația acută se termină rapid, inflamația cronică curge mult timp, uneori pe tot parcursul vieții. Inflamația cronică curge mult timp deoarece macrofagele aflate în focarul inflamației au un ciclu de viață lung. Au nevoie de mult timp pentru a intra într-o stare iritată, în plus, celule noi intră în mod constant în granulom, care se transformă, de asemenea, încet într-o stare activă. Exacerbarea inflamației cronice este asociată cu afluxul de macrofage proaspete cu activitate proinflamatoare ridicată în focarul de inflamație. Inflamația cronică se termină adesea cu scleroză cu oprirea parțială sau completă a funcțiilor organelor.
Semnificația biologică a inflamației.
Ca orice proces patologic, inflamația este în mod inerent un proces contradictoriu. Combină atât mobilizarea apărării organismului, cât și fenomenele de deteriorare. Organismul este protejat de efectele factorilor străini și nocivi prin delimitarea focarului inflamator de întregul organism. Această acțiune previne răspândirea și generalizarea procesului inflamator, concentrând lupta împotriva unui agent dăunător într-un singur loc. Focalizarea inflamatorie captează tot ce se află în el, absoarbe substanțele toxice care circulă în sânge. Acest lucru se explică prin faptul că în jurul focarului se formează un fel de barieră cu permeabilitate unilaterală. Inițial, este creată din cauza blocării vaselor de ieșire și din cauza blocării transportului de țesut extravascular. Mai mult, această barieră se formează în cele din urmă datorită dimensiunii. celulele țesutului conjunctiv dintre țesutul normal și cel bolnav. În centrul inflamației, se creează condiții nefavorabile pentru viața microorganismelor. În acest sens, rolul principal îl au fagocitele și anticorpii specifici, enzimele. Partea pozitivă inflamația se manifestă mai ales în stadiul de proliferare și regenerare. Inflamația este una dintre modalitățile prin care se formează imunitatea. A doua parte opusă a inflamației poartă întotdeauna elemente de distrugere. Lupta împotriva agentului dăunător din zona de inflamație este inevitabil combinată cu moartea propriilor celule. În unele cazuri, începe să predomine alterarea, ceea ce duce la moartea unui țesut sau organ. Exudația poate duce la malnutriție a țesutului, topirea lui enzimatică, hipoxie și intoxicație generală. Resorbția din focarul inflamator al diferitelor toxine. substanțele provoacă intoxicație. Transferul bacteriilor fagocitate de către leucocite în timpul fagocitozei incomplete poate determina dezvoltarea focarelor de inflamație în alte părți ale corpului.
Principiile terapiei patogenetice pentru inflamație:
I. Impact asupra factorului dăunător pentru a preveni sau opri alterarea primară (antibiotice, răspunsuri imune)
gulere etc.)
II Terapie proinflamatoare.
1. Efect de stimulare locală asupra focarului de inflamație (băi fierbinți, perne de încălzire etc.)
2. Efect general asupra organismului (terapie cu vaccin, lactoterapie, autohemoterapie).
III. Terapie antiinflamatoare:
1. Utilizarea medicamentelor care previn formarea și eliberarea mediatorilor de permeabilitate:
a) blocarea eliberării enzimelor lizozomale, stabilizarea membranelor lizozomale.
b) Suprimarea glicolizei ca sursă de energie pentru eliberarea factorilor de permeabilitate.
2. Utilizarea antagoniştilor şi inhibitorilor substanţelor biologic active.
a) inhibitori de kinină.
b) Inhibitori de prostaglandine.
c) Medicamente antiproteaze.
3. Aplicarea locală a medicamentelor vasoconstrictoare.
4. Influențe locale pe multe verigi ale procesului inflamator (rece).
5. Impact general asupra organismului (nutriție rațională, stil de viata sanatos viaţă).


